UPLC-MS/MS检测果蔬饮料中痕量吡虫啉
2017-07-01王新梅
王新梅
(琼台师范学院,海南海口571127)
UPLC-MS/MS检测果蔬饮料中痕量吡虫啉
王新梅
(琼台师范学院,海南海口571127)
建立一种快速、有效的超高效液相色谱-串联质谱法测定果蔬饮料中痕量吡虫啉农药残留的方法。样品经0.1%醋酸-乙腈提取后,采用氨基固相萃取小柱进行净化和富集。采用Waters Atalantis T3色谱柱(2.1 mm×150 mm,3 μm)分离,以0.1%甲酸-乙腈为流动相的梯度洗脱模式下,吡虫啉标准在0.5 ng/mL~50.0 ng/mL浓度范围内线性良好,相关系数r2为0.999,检出限为0.15 μg/kg,定量限为0.50 μg/kg,加标回收率达到93.2%~96.9%。
超高效液相色谱-串联质谱;吡虫啉;农药残留
吡虫啉是新一代氯代尼古丁杀虫剂,目前世界范围内的使用量已居所有杀虫剂的首位[1-3]。该物质会对人类和哺乳动物产生慢性毒理效应,0.05 mg/kg的吡虫啉就会损害人体淋巴细胞的遗传物质DNA[4],近年来,随着吡虫啉在果蔬产品中的使用量的逐年增加,其残留量受到广泛关注。然而由果蔬产品制成的果蔬饮品却研究不多,而且果蔬变成果蔬饮品后原有成分会被稀释,加之对检测方法灵敏度不够等原因,果蔬饮料中微量的农药残留很难被检测到。
对于吡虫啉检测方法主要有GC-MS、HPLC等方法[5-13],本试验利用超高效液相色谱-串联质谱法检测果蔬饮料中的吡虫啉农药残留,能够在原有的高效液相色谱法上使得检出限和灵敏度提高一个等级,可用于检测果蔬饮料中痕量吡虫啉的农药残留。本研究对果蔬饮料的前处理过程采用固相萃取技术,可以对样品中的目标物起到净化和富集的作用,操作简便,净化效果好,可以为吡虫啉在果蔬饮料中的痕量残留研究提供数据参考。
1 材料与方法
1.1 材料仪器与试剂
材料:样品均随机购于超市。
Agilent 1290超高效液相色谱仪:美国安捷伦公司;API4000四极杆串联质谱仪:美国AB公司。
吡虫啉标准品:国家标准物质中心;甲醇、乙腈为色谱纯:美国Fisher Scientific公司。
氨基固相萃取小柱:Waters公司,规格3cc,250mg。
1.2 超高效液相色谱条件
色谱柱:WatersAtalantisT3(2.1mm×150mm,3μm);流速:0.3 mL/min;进样量:10 μL;柱温:30 ℃;流动相 A为0.1%甲酸水溶液,B为乙腈;流动相梯度洗脱程序:0~5.0 min 70%A;5.0 min~8.0 min 70%A →20%A;8.0 min~14.0 min 20%A →70%A;15.0 min 70%A。
1.3 方法
1.3.1 流动相体系的选择
本试验主要比较流动相A:纯水、0.1%甲酸水溶液,以及流动相B:甲醇、乙腈的不同组合对吡虫啉色谱行为的影响。
1.3.2 质谱条件的优化
采用针泵连续进样的方式,在正离子模式(ESI+)下,先对目标物进行母离子全扫描,然后对其子离子进行全扫描,分别选定定性离子和定量离子,并对喷雾电压、离子源温度、碰撞气、扫描停滞时间、去簇电压及碰撞电压等参数进行优化。
1.3.3 标准曲线的制作
称取相应质量的吡虫啉标准品,配制成浓度为0.5、1.0、5.0、10.0、50.0 ng/mL 的标准溶液,进行液相-质谱分析,绘制标准曲线。
1.3.4 样品前处理条件的优化
果蔬饮料中除了固有的一些食品基质外,还含有很多人为添加的营养元素,成分复杂,对前处理要求高,所以本试验样品比较几种常用的溶剂提取效果;再利用氨基固相萃取小柱,对吡虫啉农药残留起到一个净化和富集的作用,并对4种固相萃取小柱进行比较,选择较合适的固相萃取小柱。
1.3.5 加标回收试验及样品测定
以市售未检测出吡虫啉残留的果蔬饮料为空白基质,加入标准溶液,选择优化后的前处理条件操作,过固相萃取柱,上机检测,计算回收率。
2 结果与讨论
2.1 流动相的选择
参考相关标准和文献[14-20],发现不同标准文献检测吡虫啉农药残留的流动相体系不同,本试验主要比较几种不同体系的流动相:纯水、0.1%甲酸水溶液为流动相A,以及甲醇、乙腈为流动相B的流动相体系效果。
结果发现,在流动相体系A中添加甲酸后,既有利于目标物的离子化,提高目标物的响应值,又有利于改善其峰形;流动相体系B中乙腈相比甲醇,洗脱能力强,可减少样品中的杂质在色谱柱中的残留,延长色谱柱的寿命。因此本试验的流动相体系选择0.1%甲酸水为流动相A,乙腈为流动相B,采用优化后的色谱条件,吡虫啉出峰时间为4.71 min,灵敏度高,峰形尖锐,如图1所示。
图1 吡虫啉总离子流图及子离子的提取离子色谱图Fig.1 Total ion current chromatogram and extracted ion chromatogram of imidacloprid
2.2 质谱条件的优化
采用针泵连续进样的方式,在正离子模式(ESI+)下,对浓度为10 ng/mL的吡虫啉的标准溶液进行母离子全扫描,确定其分子离子,优化各母离子的锥孔电压。再在上述母离子的基础上,对其子离子进行全扫描,选择两组丰度最高的离子,较高的作为定量离子,次之的为定性离子,并对喷雾电压、离子源温度、碰撞气、扫描停滞时间、去簇电压及碰撞电压等参数进行优化。
优化后的质谱参数为:喷雾电压5 500 V、离子源温度500℃、氮气流量30 L/min、扫描停滞时间100 ms,其他质谱参数见表1。
2.3 标准曲线的制作
为了验证吡虫啉标准品在2.2优化后超高效液相-质谱条件下的线性关系,配制了浓度为0.5、1.0、5.0、10.0、50.0 ng/mL的系列标准溶液。试验结果表明,吡虫啉在0.5 ng/mL~50.0 ng/mL内均具有良好的线性关系,其线性回归方程及相关系数见表2,并计算得到吡虫啉组分的检出限为 0.15 μg/kg,定量限为 0.50 μg/kg。
2.4 提取溶剂的选择
根据对吡虫啉的化学结构的分析[21-22],可以得知其属于极性物质,不溶或难溶于水,易溶于甲醇、乙腈、丙酮等有机溶剂。但由于市售不同种类的果蔬饮料中都存在一定量的固形物,直接用有机溶剂萃取时容易发生乳化现象。所以在提取溶剂中一般都会加入少量的酸,吡虫啉与酸结合成盐时,加强了极性,不易产生乳化现象,还有利于提高吡虫啉的提取效率。所以本试验比较了甲醇、乙腈以及0.1%甲酸-乙腈和0.1%醋酸-乙腈等4种提取溶剂对吡虫啉提取效果的影响。

表2 吡虫啉的保留时间、标准曲线、相关系数、检出限与定量限Table 2 Retention time,standard curve,correlation coefficient,detection limit and quantitative limit of imidaeloprid

表3 不同提取溶剂对吡虫啉回收率的影响Table 3 The effect of different extract solution on the recovery rate of imidaeloprid
结果如表3所示,在添加相同量的目标物时,0.1%醋酸-乙腈作为提取溶剂时,目标物的检出量最高。当以甲醇提取时,样品易产生浑浊现象,吡虫啉的回收率最低;当乙腈作为提取溶剂,并添加少量酸以后,目标物的回收率较理想;当0.1%甲酸-乙腈为提取溶剂时,回收率达到90.2%,但RSD较大;当0.1%醋酸-乙腈为提取溶剂时,得到目标物的回收率最高,其回收率达到92.8%,且RSD较小,所以选择1%醋酸-乙腈为样品中吡虫啉农药残留的提取溶剂。
2.5 固相萃取小柱的选择
固相萃取法以其集样品提取、浓缩、净化于一体,简化了操作步骤,减少了溶剂用量,提高了样品前处理效率而受到重视。固相萃取法中,针对样品吡虫啉残留的检测大部分是利用氨基小柱进行净化[23-25]。本试验中为验证氨基小柱在果蔬饮料样品净化中的应用优势,与其他常用的弗罗里硅柱、氧化铝柱以及C18固相萃取小柱的净化效果进行比较。结果如图2所示。
发现氨基小柱前处理效果最好,平均回收率可以达到92.5%~95.8%。氨基小柱前处理果蔬饮料样品,可以去除试样中的天然色素、糖类等大分子组分,净化后杂质干扰较少,颜色比较浅,回收率能满足分析测定的需求。
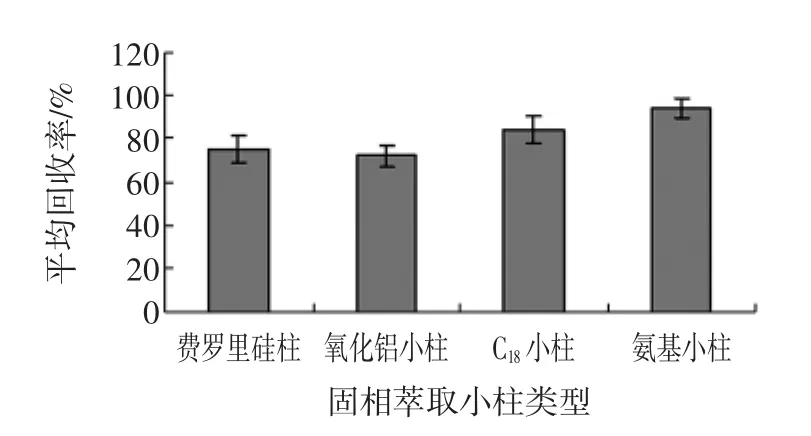
图2 不同固相萃取小柱对吡虫啉回收率的影响Fig.2 The effect of different solid phase extraction column on the recovery rate of imidaeloprid
2.6 加标回收率与相对标准偏差
在以上试验的优化条件下,利用空白基质的果蔬饮料样品进行加标回收率试验,在分别添加30、60、90 μg/kg共3个梯度浓度的标准混合溶液,每个浓度平行测定5次,测定结果见表4。

表4 方法的加标回收率及相对标准偏差(n=5)Table 4 Recoveries and relative standard deviations(RSD)of the method(n=5)
由表4可见,吡虫啉的加标回收率为93.2%~96.9%,相对标准偏差(RSD)为2.2%~3.1%,表明本试验所建立的方法具有可靠的准确度和精密度。
2.7 实际样品的测定
应用本试验所建立的方法,对市售不同类型果蔬饮料共20个批次进行测定,19个批次未发现上述吡虫啉农药残留,1个批次果蔬饮料中吡虫啉的浓度为12.6 μg/kg,但是未超出 GB 2763-2014《食品安全国家标准食品中农药最大残留限量》中规定的残留限量(≤0.05 mg/kg)[26]。并对20批次的果蔬饮料按照GB/T 23379-2009《水果、蔬菜及茶叶中吡虫啉残留的测定高效液相色谱法》复测(此方法检出限0.02 mg/kg)[14],结果未检测出阳性样品,表明本研究在用于实际样品中痕量吡虫啉残留的测定中有一定的优势。
3 结论
本文建立了一种固相萃取-超高效液相色谱-串联质谱法测定果蔬饮料中痕量吡虫啉农药残留的分析方法。结果表明,在0.1%甲酸-乙腈流动相体系中,吡虫啉能得到良好的基线分离,其峰型良好,出峰时间合适。在优化后的质谱条件下,样品经过1%醋酸-乙腈提取后,再处理采用氨基固相萃取柱法可有效去除样品中的复杂基质,可实现对目标物的净化与富集,样品中吡虫啉的加标回收率为93.2%~96.9%,相对标准偏差(RSD)为2.2%~3.1%,能准确快速有效地检测果蔬饮料中痕量的吡虫啉农药残留。
[1] 朱永和,王振荣,李布青.农药大典[M].北京:中国三峡出版社,2006:52-53
[2] 张一宾,张择.世界农药新进展[M].北京:化学工业出版社,2007:74-75
[3] 刘长令.世界农药大全:杀虫剂卷[M].北京:化学工业出版社,2012:178-179
[4] 封少龙,孔志明,王五香.吡虫啉和抑食肼对人体周围淋巴细胞遗传物质的影响[J].癌变·畸变·突变,2002,14(4):210-213
[5] 张雪辉,杜雨倩,徐芳,等.高效液相色谱法检测蔬菜中的吡虫啉残留[J].现代食品科技,2012,28(4):466-468
[6] 房超,董雷玲,宋阳威.高效液相色谱法同步检测橙汁饮料中多菌灵、吡虫啉残留量[J].江苏农业科学,2012,40(9):295-297
[7] 王凤池,高文惠,吕红英.固相萃取净化高效液相色谱法测定玉米中吡虫啉[J].食品科技,2006(8):259-262
[8] 陈迎丽,林绍霞,何钰.HPLC-MS/MS法分析18%吡虫啉·氟酰脲悬浮剂含量[J].农药,2016(12):898-900
[9] 苗雪雪,杨愿愿,刘登彪,等.分散液液微萃取-气质联用法测定牛奶中酰胺类除草剂[J].华南农业大学学报,2015(2):43-48
[10]张亮,孙剑宁,熊先贵,等.QuEChERS-高效液相色谱检测土壤中的吡虫啉[J].色谱,2015,33(3):228-234
[11]DiMuccioA,FidenteP,AttardBarbiniD,et al.Application of solidphase extraction and liquid chromatography-mass spectrometry to the determination of neonicotinoid pesticide residuesin fruit and vegetables[J].J Chromatogr A,2006,1108(1):1-6
[12]WatanabeE,BabaK,EunH,et al.Simultaneous determination of neonicotinoid insecticides in agricultural samples bysolid-phase extraction cleanup and liquid chromatography equipped with diodearraydetection[J].JAgric Food Chem,2007,55(10):3798-3804
[13]Pourreza N,Rastegarzadeh S,Larki A.Determination of fungicide carbendazim in water and soil samples using dispersive liquid-liquid microextraction and microvolume UV-vis spectrophotometry[J].Talanta,2015,134(1):24-29
[14]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23379-2009水果、蔬菜及茶叶中吡虫啉残留的测定高效液相色谱法[S].北京:中国标准出版社,2009
[15]中华人民共和国农业部.NY/T 1275-2007蔬菜、水果中吡虫啉残留量的测定[S].北京:中国标准出版社,2007
[16]中华人民共和国农业部.NY/T 1724-2009茶叶中吡虫啉残留量的测定高效液相色谱法[S].北京:中国标准出版社,2009
[17]中华人民共和国农业部.NY/T 1727-2009稻米中吡虫啉残留量的测定高效液相色谱法[S].北京:中国标准出版社,2009
[19]中华人民共和国国家质量监督检验检疫总局.SN/T 1902-2007水果蔬菜中吡虫啉、吡虫清残留量的测定高效液相色谱法[S].北京:中国标准出版社,2007
[20]中华人民共和国国家质量监督检验检疫总局.SN/T 2073-2008进出口植物性产品中吡冲啉残留量的检测方法液相色谱串联质谱法[S].北京:中国标准出版社,2008
[21]黄超群,谢文,于卓然,等.液相色谱-串联质谱法测定果蔬中10种酰胺类农药的残留量[J].食品安全质量检测学报,2015(3):886-892
[22]赵风年,石梦琪,李辉.分散固相萃取-液质联用法检测玉米中4种农药[J].食品研究与开发,2016(4):128-132
[23]黄优生,熊华亮,万偲,等.液相色谱串联质谱法同时检测茶叶中23种农药残留[J].食品研究与开发,2014,35(21):81-85
[24]张璇,姜敏,何锦惠.高效液相色谱-质谱联用仪测定韭菜中多菌灵、吡虫啉等7种农药残留量[J].农业科学与管理,2016(3):41-47
[25]Zeying He,Lu Wang,Yi Peng,et al.Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatography-tandem mass spectrometry-based method[J].Food Chemistry,2015,169(15):372-380
[26]中华人民共和国国家卫生和计划生育委员会,中华人民共和国农业部.GB 2763-2014食品安全国家标准食品中农药最大残留限量[S].北京:中国标准出版社,2014
Determination of Trace Imidaeloprid in Fruit and Vegetable Drink by UPLC-MS/MS
WANG Xin-mei
(Qiongtai Normal University,Haikou 571127,Hainan,China)
A rapid and effective method was established for the determination of trace imidaeloprid pesticide residue in fruit and vegetable drink by ultra performance liquid chromatography tandem mass spectrometry(UHPLC-MS/MS).After the sample was extracted by 0.1%acetic acid-acetonitrile,it concentrated and purified by amino solid phase extraction column.The separation of targeted compound was performed on a Waters Atalantis T3 chromatographic column(2.1 mm×150 mm,3 μm)using 0.1%formic acid-acetonitrile as mobile phase under gradient elution mode.The linear range of imidaeloprid was in the range of 0.5 ng/mL-50.0 ng/mL with a correlation coefficient of 0.999.The detection limit was 0.15 μg/kg and the quantitative limit was 0.5 μg/kg.The recovery rate was 93.2%-96.9%.
ultra performance liquid chromatography tandem massspectrometry;imidaeloprid;pesticide residue
2017-03-02
王新梅(1979—),女(汉),讲师,本科,研究方向:化学教育。
10.3969/j.issn.1005-6521.2017.13.036
