基于亚细胞定位的大豆和鹰嘴豆原生质体分离体系的建立与优化
2017-07-01舒英杰黄丽燕陈明陶源王占奎麻浩
舒英杰,黄丽燕,陈明,陶源,王占奎,麻浩
基于亚细胞定位的大豆和鹰嘴豆原生质体分离体系的建立与优化
舒英杰1,2,黄丽燕2,陈明2,陶源2,王占奎2,麻浩2
1 安徽科技学院农学院,安徽凤阳 233100 2 南京农业大学作物遗传与种质创新国家重点实验室,江苏南京 210095

舒英杰, 黄丽燕, 陈明, 等. 基于亚细胞定位的大豆和鹰嘴豆原生质体分离体系的建立与优化. 生物工程学报, 2017, 33(6): 976–985.Shu YJ, Huang LY, Chen M, et al. Establishment and optimization of systems for protoplasts isolation of soybean and chickpea that used in subcellular location. Chin J Biotech, 2017, 33(6): 976–985.
以湘豆3号大豆和型鹰嘴豆幼嫩叶片为材料,研究了酶解种类及配比、酶解液中甘露醇浓度、酶解液pH和酶解时间对两种豆科植物幼嫩叶片原生质体产量和存活率的影响。结果表明,湘豆3号大豆叶片在含有0.5%纤维素酶Onozuka R-10、0.8%半纤维素酶Hemicellulase、0.8%离析酶Macerozyme R-10、0.4%果胶酶Pectolyase Y-23、0.1% 2-(N-吗啡啉)乙磺酸 (MES) 和10%甘露醇的酶解液中 (pH 6.0),27 ℃黑暗条件下恒温水浴振荡 (45 r/min) 酶解6 h,分离得到的原生质体产量和存活率最高;型鹰嘴豆叶片在含有0.5%纤维素酶Onozuka R-10、0.8%半纤维素酶Hemicellulase、0.8%离析酶Macerozyme R-10、0.1% MES和10%甘露醇酶解液中 (pH 4.8),27 ℃黑暗条件下恒温振荡水浴 (45 r/min) 7–8 h,分离得到的原生质体产量和存活率最高。通过上述件分离到的湘豆3号大豆和型鹰嘴豆幼嫩叶片原生质体用于亚细胞定位的效果最好。
大豆,鹰嘴豆,原生质体,分离体系,亚细胞定位
植物“原生质体”一词最早由Hanstein提出,指通过质壁分离,能与细胞壁分离开的那部分植物细胞,包括细胞膜、细胞质和细胞核[1]。植物原生质体不仅与细胞一样含有完整的遗传物质,具有全能性,还能通过相互融合进而分化产生新的植株,能高效摄取外界DNA、细胞器、病毒等物质,并且可以用来分离和纯化突变体,进行种质资源的超低温保存等。目前原生质体技术已被用于包括原生质体培养及植株再生[2]、研究激素等因子对细胞的影响[3]、研究基因瞬时转化[4]、分析蛋白互作[5]、研究细胞壁再生[6]以及研究标记蛋白的亚细胞定位[7]等各个方面,因此筛选出不同植物最适宜的原生质体分离条件具有十分重要的意义。
大豆([L.] Merrill) 是我国主要的粮油兼用作物,在我国农业生产中发挥重要作用,尤其是随着玉米临储价的取消,大豆在我国种植业结构调整中发挥越来越大的作用,全国种植业结构调整规划[8](2016–2020) 显示,到2020年,我国大豆种植面积达到9.3×106hm2。鹰嘴豆L.具有很强的耐旱、耐寒、耐贫瘠及生物固氮等特性,在解决土壤干旱、退化等问题中作用独特,对于保持水土和生态环境治理有积极作用[9]。大豆和鹰嘴豆是本实验室近几年来主要的研究材料,对大豆α亚基缺失[10]、种子田间劣变的蛋白质组学[11]、转录组学和基因组学[12],鹰嘴豆抗旱种质筛选、抗旱相关基因的克隆与功能分析[13]等方面进行了较为系统的研究。
之前在分析基因功能时均以基因枪轰击洋葱表皮的方法进行相关基因的蛋白亚细胞定位研究,主要是由于洋葱表皮细胞较大,有典型的植物细胞结构,便于基因枪操作。但由于洋葱表皮细胞虽然含有细胞膜、细胞核、细胞壁、液泡等细胞器,但不含叶绿体,因此,利用洋葱表皮细胞进行亚细胞定位研究存在一定的局限性。为此,本实验以湘豆3号大豆和型鹰嘴豆幼嫩叶片为材料,研究了酶解液的种类及配比、酶解液中甘露醇浓度、pH值和酶解时间对两种豆科植物原生质体产量和存活率的影响,以期为开展大豆和鹰嘴豆相关基因功能研究提供理论与技术支撑。
1 材料与方法
1.1 实验材料及处理
以1–2叶期 (1对真叶展开,幼苗已具有两个节并形成第一个节间) 湘豆3号大豆叶片和15–30 d苗龄 (具有5–6个叶序)型鹰嘴豆幼嫩叶片为材料,将叶片切成0.5–1.0 mm的细条置于酶解液中进行酶解,酶解条件为27 ℃、45 r/min、黑暗条件。
1.2 实验方法
1.2.1 不同酶解液组合、酶解液中甘露醇浓度、酶解液pH和酶解时间的筛选
前期预备实验结果表明,型鹰嘴豆叶片在含有纤维素酶Onozuka R-10、半纤维素酶Hemicellulase和离析酶Macerozyme R-10的酶解液中酶解效果较好,而湘豆3号大豆叶片原生质体只有在添加果胶酶Pectolyase Y-23的条件下才能被酶解出来。不同酶解液组合采用正交实验设计L9(34),其中纤维素酶Onozuka R-10的浓度分别为0.5%、1.0%和1.5%,半纤维素酶Hemicellulase的浓度分别为0、0.4%和0.8%,离析酶Macerozyme R-10的浓度分别为0、0.4%和0.8%,果胶酶Pectolyase Y-23的浓度分别为0、0.2%和0.4%。酶解液中甘露醇浓度梯度设为8%、9%、10%、11%和12%;酶解液pH梯度设为4.8、5.2、5.6、6.0、6.4、6.8、7.2、7.6、8.0、8.4、8.8和9.2;酶解时间梯度设为4 h、5 h、6 h、7 h、8 h、9 h、10 h、11 h和12 h;每处理3次重复,分别统计不同处理湘豆3号大豆和型鹰嘴豆原生质体的产量和存活率。
1.2.2 原生质体产量和存活率的统计
湘豆3号大豆和型鹰嘴豆叶片原生质体分别用0.4%台盼蓝染液和0.1% FDA染液进行染色。染色后的湘豆3号叶片原生质体于电子显微镜下观察计数,未被染色的为有活力的原生质体,被染成蓝色的为死细胞;染色后的型鹰嘴豆叶片原生质体于荧光显微镜先在白光下统计总的原生质体数量,再切换到紫外激发光下记录发绿色荧光的原生质体数量,发荧光的为有活力的原生质体。原生质体计数采用血球计数板计数法。
原生质体产量 (个/(g·FW)) =25个方格内原生质体总数/0.1×1 000×10
原生质体存活率 (%) =未被染色的原生质体数量/原生质体总数量×100
式中,0.1为中间25个方格的体积,单位为mm3;每1 mL酶解液中植物材料的鲜重为0.1 g。
1.2.3 亚细胞定位验证
按上述方法分离出湘豆3号大豆和型鹰嘴豆幼嫩叶片的原生质体,将pA7空载体通过PEG诱导转入原生质体中,培养12–16 h后,激光共聚焦显微镜下观察标签的表达,并采集照片。
2 结果与分析
2.1 不同酶解液组合对大豆和鹰嘴豆叶片原生质体分离的影响
不同酶液组合对湘豆3号大豆和型鹰嘴豆幼嫩叶片原生质体产量和存活率的影响见表1和表2。表1可知,不同酶液组合对湘豆3号大豆叶片原生质体产量和存活率有明显影响,其中处理3、6和7的原生质体产量较高,分别为2.16×107个/(g·FW)、1.94×107个/(g·FW)和1.99×107个/(g·FW);处理2、3、4和7的原生质体存活率较高,分别为83.97%、75.93%、72.09%和71.86%。综合原生质体产量和存活率,湘豆3号叶片原生质体分离最适宜的酶解液组合为处理3,即酶组成为0.5%纤维素酶Onozuka R-10+0.8%半纤维素酶Hemicellulase+0.8%离析酶Macerozyme R-10+0.4%果胶酶Pectolyase Y-23。从原生质体产量来看,处理3最高(1.10×107个/(g·FW)),处理2次之 (1.04×107个/ (g·FW)),从原生质体存活率来看,处理2最高 (86.81%),处理3次之 (83.71%),但是处理3所用的半纤维素酶和离析酶浓度是处理2的2倍。因此,综合考虑,认为型鹰嘴豆叶片原生质体分离最适宜的酶解液组合为处理2,即酶组成为0.5%纤维素酶Onozuka R-10+0.4%半纤维素酶Hemicellulase+0.4%离析酶Macerozyme R-10 (表2)。
2.2 酶解液中甘露醇浓度对大豆和鹰嘴豆叶片原生质体分离的影响
将大豆和鹰嘴豆幼嫩叶片分别置于2.1中的最优酶解液组合中进行酶解,酶解过程中其他条件均保持一致,发现不同甘露醇浓度对大豆和鹰嘴豆原生质体分离效果影响显著 (图1)。随着酶解液中甘露醇浓度的升高,湘豆3号大豆与型鹰嘴豆叶片原生质体的产量和存活率均呈现先升高后下降的趋势,当酶解液中甘露醇浓度为10%时,原生质体的产量和存活率达最高,即湘豆3号大豆与型鹰嘴豆叶片原生质体分离最适宜的酶解液甘露醇浓度均为10%。

表1 不同酶解液组合对大豆叶片原生质体产量与存活率的影响

表2 不同酶解液组合对鹰嘴豆叶片原生质体产量与存活率的影响

图1 甘露醇浓度对大豆和鹰嘴豆叶片原生质体分离的影响(图中不同小写字母表示处理间差异显著,P<0.05)
2.3 酶解液pH对大豆和鹰嘴豆叶片原生质体分离的影响
将切好的大豆和鹰嘴豆叶片分别置于pH不同的酶解液中进行酶解,其他条件均为2.1和2.2筛选得到的最优条件,结果见图2。由图2可知,湘豆3号大豆叶片原生质体的产量和存活率均随着酶解液pH的增大呈先小幅度升高随后降低的趋势,当酶解液pH为6时,原生质体产量和存活率均达到最大值;型鹰嘴豆叶片原生质体的产量和存活率总体随着酶解液pH的增大呈逐渐下降趋势,即型鹰嘴豆叶片原生质体分离最适宜的酶解液pH 为4.8。
2.4 酶解时间对大豆和鹰嘴豆叶片原生质体分离的影响
在最佳酶解液组合、酶解液中甘露醇最佳浓度及酶解液最佳pH确定的情况下,将切好的大豆和鹰嘴豆叶片分别置于最优条件下进行酶解,观察酶解时间对原生质体产量和存活率的影响,结果见图3。随着酶解时间的延长,湘豆3号叶片原生质体的产量呈先增后降趋势,原生质体存活率总体呈逐渐降低趋势;型鹰嘴豆叶片原生质体产量随酶解时间的延长呈现先增加后降低的趋势,而存活率则呈现缓慢降低的趋势。综合考虑原生质体产量与存活率,认为湘豆3号叶片原生质体分离最适宜的酶解时间为6 h,型鹰嘴豆叶片原生质体分离最适宜的酶解时间为7–8 h。
2.5 大豆和鹰嘴豆叶片原生质体分离及其在亚细胞定位中的应用效果
通过上述条件的优化,将湘豆3号大豆幼嫩叶片在含有0.5%纤维素酶Onozuka R-10、0.8%半纤维素酶Hemicellulase、0.8%离析酶Macerozyme R-10和0.4%果胶酶Pectolyase Y-23的酶液中加10%甘露醇,pH为6.0时酶解6 h,在电子显微镜下观察分离到的原生质体如图4B、C所示;型鹰嘴豆幼嫩在含有0.5%纤维素酶Onozuka R-10、0.4%半纤维素酶Hemicellulase和0.4%离析酶Macerozyme R-10的酶液中加10%甘露醇,pH为4.8时酶解7–8 h,在荧光显微镜下观察分离到的原生质体见 图4E、F。由图4可知,通过上述筛选方法分别从湘豆3号大豆和型鹰嘴豆叶片中分离出的原生质体数量较多,视野中破碎的原生质体较少,且活力较高。
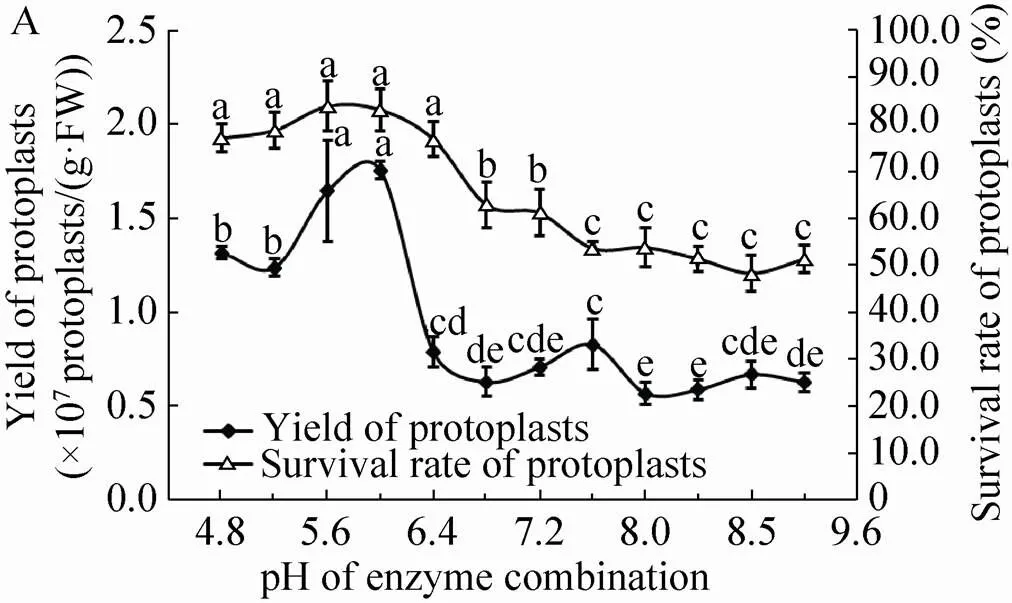
图2 酶解液pH对大豆和鹰嘴豆叶片原生质体分离的影响(图中不同小写字母表示处理间差异显著,P<0.05)

图3 酶解时间对大豆和鹰嘴豆叶片原生质体分离的影响(图中不同小写字母表示处理间差异显著,P<0.05)

图4 大豆和鹰嘴豆叶片原生质体分离效果
将上述方法分离得到的原生质体参照 Yoo等[14]的方法进行蛋白的亚细胞定位验证,结果见图5。图5 A、B分别为连有绿色荧光蛋白GFP的空载体pA7转入湘豆3号及型鹰嘴豆叶片原生质体的效果图,可以明显观察到载体pA7在原生质体中的表达位置,效果较好,即通过本实验分离到的大豆和鹰嘴豆叶片的原生质体可以应用于相关基因蛋白的亚细胞定位研究。
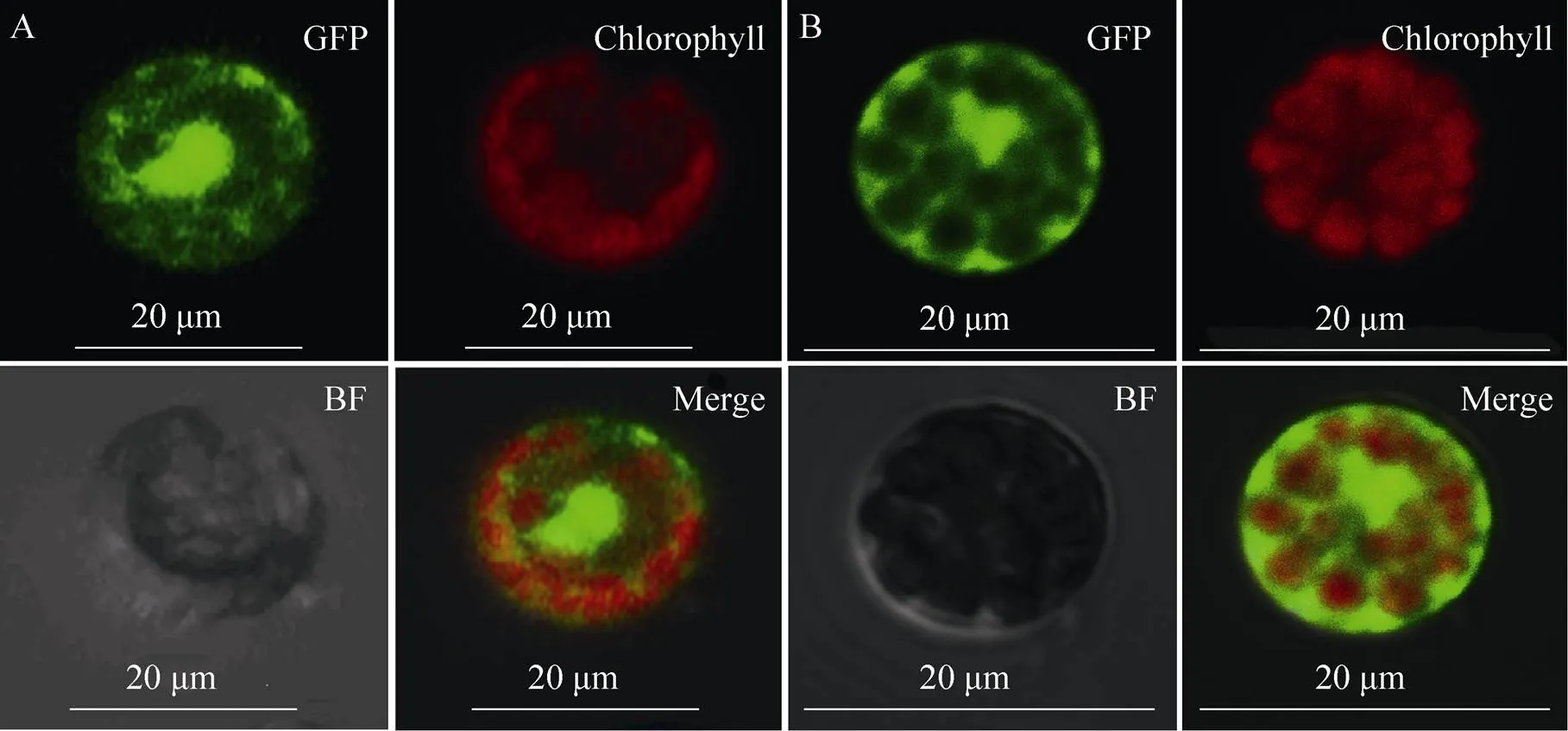
图5 GFP载体在大豆和鹰嘴豆叶片原生质体中的亚细胞定位效果
3 讨论
植物原生质体的分离方法主要有机械分离法和酶解分离法两种,机械分离法是将细胞置于高渗溶液中使其发生质壁分离,再用利刃割破细胞壁使原生质体游离出来,利用此种方法获得的原生质体数量较少,且受植物种类的限制;酶解分离法即将分离材料置于不同酶的混合液中酶解掉细胞壁从而游离出原生质体,这种方法获得的原生质体数量大、完整性好,因此酶解法目前被广泛应用于植物原生质体的分离。之前关于百脉根[15]和苜蓿[16]等豆科植物原生质体分离的研究均有报道,但尚未见关于鹰嘴豆原生质体分离研究的相关报道;大豆原生质体分离培养的报道主要有悬浮细胞[17]、幼荚[18]、未成熟种子的子叶[19-20]、幼苗子叶[21-22]、叶肉细胞[23]等,但是这些方法均不适用于湘豆3号大豆幼嫩叶片原生质体的分离。因此,本实验在参考前人研究的基础上,通过对最佳酶液组合、酶解液中甘露醇浓度、酶解液pH及酶解时间的筛选,建立并优化了湘豆3号大豆和型鹰嘴豆幼嫩叶片原生质体分离体系。
由于细胞壁的主要组成成分是纤维素、半纤维素和果胶,因此本实验选用了纤维素酶Onozuka R-10、半纤维素酶Hemicellulase和离析酶Macerozyme R-10用来分离原生质体,而研究过程中发现,在仅有这3种酶存在的情况下,湘豆3号大豆叶片原生质体几乎不能被分离出来,因此向酶解液组合中添加了果胶酶Pectolyase Y-23,实验结果表明分离效果较好。前人研究发现酶解液组合、酶解液中甘露醇浓度、酶解液pH及酶解时间都会对原生质体的分离效果有较大影响,本研究通过正交实验和单因素比较实验研究了这些因素对湘豆3号大豆和型鹰嘴豆幼嫩叶片原生质体分离的影响,并筛选出了适合湘豆3号大豆和型鹰嘴豆幼嫩叶片原生质体分离的最佳酶液组合、酶解液中甘露醇浓度、酶解液pH及酶解时间。研究发现,两种豆科植物材料原生质体分离的最适宜条件存在一定差异,这可能是由于不同植物以及不同取材部位细胞的细胞壁结构及组成不同导致的。
植物原生质体活力检测方法主要有形态识别法、荧光显微镜识别 (FDA法)、酚藏花红染色法、伊凡蓝 (Evan’s blue) 染色法、台盼蓝染色法、噻唑蓝 (Thiazolyl blue,MTT) 染色法等[24-25]。本实验过程中将分离后的型鹰嘴豆叶片原生质体用FDA染色,效果很好,视野清晰,能清楚地区分有无活力的原生质体;将此种染色方法应用于湘豆3号大豆上,效果则不明显,原生质体不能被很好地染色,荧光较淡,有活力的原生质体与无活力的原生质体界线不明晰,改用台盼蓝染液染色后效果较好。由于使用FDA对湘豆3号大豆和型鹰嘴豆叶片原生质体进行染色时操作方法完全相同,因此推测造成这种差异的原因可能跟物种差异 有关。
植物原生质体一个重要作用就是应用于蛋白的亚细胞定位研究,关于蛋白亚细胞定位的方法目前主要有利用基因枪轰击洋葱表皮细胞、利用根癌农杆菌侵染烟草叶片以及PEG转化原生质体法等。应用不同体系研究蛋白的亚细胞定位可能会出现不同的结果[22],本实验室之前也一直利用基因枪轰击洋葱表皮细胞的方法进行蛋白的亚细胞定位研究,但是实验结果经常不理想。因此,希望建立一套实用性更强、效果更好的大豆和鹰嘴豆相关蛋白的亚细胞定位研究体系。本研究建立的湘豆3号大豆和型鹰嘴豆幼嫩叶片原生质体分离体系分离出的原生质体数量多、存活率高,可以明显观察到空载体pA7在原生质体中的表达位置,效果较好,适合于相关蛋白的亚细胞定位研究。
[1] Qiang S. Botany. Beijing: Higher Education Press, 2006: 13 (in Chinese). 强胜. 植物学. 北京: 高等教育出版社, 2006: 13.
[2] Shu WH, Geng HZ, Sun YR. Protoplast culture and plant regeneration from mesophyll of alfalfa (L.). J Grassl, 1994, 2(1): 40–44 (in Chinese). 舒文华, 耿华珠, 孙勇如. 紫花苜蓿原生质体培养与植株再生. 草地学报, 1994, 2(1): 40–44.
[3] Pasternak TP, Prinsen E, Ayaydin F, et al. The role of auxin, pH, and stress in the activation of embryogenic cell division in leaf protoplast-derived cells of alfalfa. Plant Physiol, 2002, 129(4): 1807–1819.
[4] Abel S, Theologis A. Transient transformation ofleaf protoplasts: a versatile experimental system to study gene expression. Plant J, 1994, 5(3): 421–427.
[5] Walter M, Chaban C, Schütze K, et al. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant J, 2004, 40(3): 428–438.
[6] Leucci MR, Di Sansebastiano GP, Gigante M, et al. Secretion marker proteins and cell-wall polysaccharides move through different secretory pathways. Planta, 2007, 225(4): 1001–1017.
[7] Ohlrogge JB, Kuhn DN, Stumpf PK. Subcellular localization of acyl carrier protein in leaf protoplasts of. Proc Natl Acad Sci USA, 1979, 76(3): 1194–1198.
[8] 农业部关于印发《全国种植业结构调整规划(2016-2020年)》的通知. [2016-04-28]. http://www. moa.gov.cn/zwllm/tzgg/tz/201604/t20160428_5110638.htm
[9] Zhang JB, Miao HC, Wang W, et al. Research and utilization of chickpea. Crops, 2011, (1): 10–12 (in Chinese). 张金波, 苗昊翠, 王威, 等. 鹰嘴豆的应用价值及其研究与利用. 作物杂志, 2011, (1): 10–12.
[10] Zhang GM, Zhang YQ, Shu YJ, et al. Screening and identification of three types of soybean lines lacking different seed storage protein subunits. Soyb Sci, 2015, 34(1): 1–8, 31 (in Chinese). 张国敏, 张亚琴, 舒英杰, 等. 三种大豆种子贮藏蛋白亚基缺失种质的筛选与鉴定. 大豆科学, 2015, 34(1): 1–8, 31.
[11] Song LY, Wang S, Niu J, et al. Differentially proteomics analysis of pre-harvest seed deterioration and deterioration resistance in spring soybean. Sci Agric Sin, 2015, 48(1): 23–32 (in Chinese). 宋利茹, 王爽, 牛娟, 等. 春大豆种子田间劣变性和劣变抗性的差异蛋白质组学研究. 中国农业科学, 2015, 48(1): 23–32.
[12] Yang Y, Wang S, Huang LY, et al. Characterization and subcellular location of twogenes and their response to abiotic stress in soybean ((L.) Merr.). Chin J Biotech, 2014, 30(11): 1709–1719 (in Chinese). 杨艳, 王爽, 黄丽燕, 等. 两个大豆基因的特征、亚细胞定位及对非生物胁迫的响应. 生物工程学报, 2014, 30(11): 1709–1719.
[13] Gao WR. Screening of drought-tolerant chickpea germplasm, construction of cDNA libraries, analysis of EST sequences and clonging of water-stress responsed genes[D]. Nanjing: Nanjing Agricultural University, 2008 (in Chinese). 高文瑞. 鹰嘴豆耐旱种质的筛选、cDNA文库构建、EST数据分析及耐旱相关基因克隆[D]. 南京: 南京农业大学, 2008.
[14] Yoo SD, Cho YH, Sheen J. Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis. Nat Protoc, 2007, 2(7): 1565–1572.
[15] Li YZ, Tao R, Wang J, et al. Enzymolysis and isolation conditions of protoplasts from cotyledons and calli in. J Grassl, 2010, 18(6): 798–804 (in Chinese). 李玉珠, 陶茸, 王娟, 等. 百脉根原生质体的分离和酶解条件的研究. 草地学报, 2010, 18(6): 798–804.
[16] Wang HB. The impact of different physical conditions on protoplast dissociation of alfalfa for southern China. J Qujing Norm Univ, 2008, 27(6): 36–39 (in Chinese). 王海波. 不同物理条件对南方紫花苜蓿原生质体游离的影响. 曲靖师范学院学报, 2008, 27(6): 36–39.
[17] Kao KN, Keller WA, Miller RA. Cell division in newly formed cells from protoplasts of soybean. Exp Cell Res, 1970, 62(2/3): 338–340.
[18] Jian YY. Isolation, culture and callus formation of soybean protoplast. Soyb Sci, 1983, 2(2): 101–103 (in Chinese). 简玉瑜. 大豆原生质体的游离、培养和愈伤组织的生成. 大豆科学, 1983, 2(2): 101–103.
[19] Luo XM, Zhao GL, Jian YY. Plant regeneration from protoplasts of soybean (L.). Acta Bot Sin, 1990, 32(8): 616–621(in Chinese). 罗希明, 赵桂兰, 简玉瑜. 大豆原生质体的植株再生. 植物学报, 1990, 32(8): 616–621.
[20] Franklin G, Carpenter L, DavisE, et al. Factors influencing regeneration of soybean from mature and immature cotyledons. Plant Growth Regul, 2004, 43:73-79.
[21] Lu DY, Cooper-Bland S, Pental D, et al. Isolation and sustained division of protoplasts from cotyledons of seedlings and immature seeds ofL. Z Pjlanzenphysiol, 1983, 111(5): 389–394.
[22] Ma XH, Wu TL. Rapid and efficient regeneration in soybean [(L.) Merrill] from whole cotyledonary node explants. Acta Physiol Plant, 2008, 30: 209–216.
[23] Luo XM, Jian YY. Isolated and culture of mesophyll cells protoplast of soybean. J Jilin Agric Sci, 1984, (2): 20–23 (in Chinese). 罗希明, 简玉瑜. 大豆叶肉细胞原生质体的游离和培养. 吉林农业科学, 1984, (2): 20–23.
[24] Huang LY. Establishment and optimization of systems for protoplasts isolation of three plants that used in subcellular location[D]. Nanjing: Nanjing Agricultural University, 2015 (in Chinese). 黄丽燕. 用于亚细胞定位的三种植物原生质体分离体系的建立与优化[D]. 南京: 南京农业大学, 2015.
[25] Zhao WT, Wei JH, Meng D, et al. Subcellular localization of a sesquiterpene synthase from Aquilaria sinensis utilizing three transient expression systems. Chin Tradit Herb Drugs, 2013, 44(23): 3379–3385(in Chinese). 赵文婷, 魏建和, 孟冬, 等. 3种瞬时表达体系研究1个白木香倍半萜合酶的亚细胞定位. 中草药, 2013, 44(23): 3379–3385.
(本文责编 郝丽芳)
Establishment and optimization of systems for protoplasts isolation of soybean and chickpea that used in subcellular location
Yingjie Shu1,2, Liyan Huang2, Ming Chen2, Yuan Tao2, Zhankui Wang2, and Hao Ma2
1 College of Agronomy, Anhui Science and Technology University, Fengyang 233100, Anhui, China 2 State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
Young leaves ofchickpea as well as soybean., which are the current plants that studied in our laboratory were selected as materials. Effects on protoplasts yield and survival rate of different enzyme combination, concentration of D-Mannitol in enzyme combinations, pH of enzyme combinations and enzymolysis time are detected. The results showed that, the best condition for.leaf protoplasts isolation is to rotate the cut materials for 6 hours in enyzme solution under temperature of 27 ℃ and rotate speed of 45 r/min for 6 h. Onozuka R-10 (0.5%), Hemicellulase (0.8%), Macerozyme R-10 (0.8%) in combination with Pectolyase Y-23 (0.4%) dissolving in CPW solution with MES (0.1%) and Mannitol (10%), pH 6.0 was found best for protoplasts isolation of.leaves.The best condition for protoplasts isolation ofchickpea is to put the cut materials into enzymatic hydrolysate enzymolyse for 7 to 8 hours under temperature of 27 ℃ and rotate speed of 45 r/min on water bath shaker, the optimum combination of enzyme consists of Onozuka R-10 (0.5%), Hemicellulase (0.8%), Macerozyme R-10 (0.8%), MES (0.1%) and Mannitol (10%) dissolved in CPW solution with pH 4.8. The protoplasts prepared with the methods above are used in subcellular location and the effects show well.
soybean, chickpea, protoplasts, isolation system, subcellular location
10.13345/j.cjb.170086
March 4, 2017; Accepted:April 19, 2017
Yingjie Shu. Tel/Fax: +86-550-6732029; E-mail: shuyj@ahstu.edu.cn Hao Ma. Tel/Fax: +86-25-84395324; E-mail: Lq-ncsi@njau.edu.cn
Supported by: National Natural Science Foundation of China (Nos. 31101212, 31171572, 31371711), Natural Science Foundation of Anhui Province (No. 1608085MC69), the Youth Talent Major Project of College and University of Anhui (No. gxyqZD2016216).
国家自然科学基金 (Nos. 31101212, 31171572, 31371711),安徽省自然科学基金 (No. 1608085MC69),安徽省高校优秀青年人才支持计划重点项目 (No. gxyqZD2016216) 资助。
网络出版时间:2017-05-03
http://kns.cnki.net/kcms/detail/11.1998.Q.20170503.1700.007.html
