一种猪溶菌酶来源的抗菌六肽的分离鉴定及其性质
2017-07-01朱德伟蔡国林陆健
朱德伟,蔡国林,陆健
一种猪溶菌酶来源的抗菌六肽的分离鉴定及其性质
朱德伟1,2,3,蔡国林1,2,3,陆健1,2,3
1江南大学工业生物技术教育部重点实验室,江苏无锡 214122 2江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡 214122 3江南大学生物工程学院,江苏无锡 214122

朱德伟, 蔡国林, 陆健. 一种猪溶菌酶来源的抗菌六肽的分离鉴定及其性质. 生物工程学报, 2017, 33(6): 1046–1056.Zhu DW, Cai GL, Lu J. Purification, identification and characterization of an anti-microbial hexapeptide from Sus scrofa lysozyme. Chin J Biotech, 2017, 33(6): 1046–1056.
为提高猪溶菌酶 (lysozyme,SSL) 的抗革兰氏阴性菌活性,将其进行了不同蛋白酶的水解,选择抗革兰氏阴性菌效果最好的水解产物,利用凝胶过滤色谱和反相制备色谱进行分离,对其功能成分进行液质联用鉴定。对分离得到的物质进行抗菌活性验证和生物信息学的分析,并在此基础上对抗菌物质的杀菌机理进行了探讨。结果表明,胰蛋白酶的水解产物具有较高的杀灭革兰氏阴性菌的活性,进一步分离纯化得到了具有抗革兰氏阴性菌活性的六肽A-W-V-A-W-K。经化学合成验证,该六肽既保留了SSL的部分抗菌活性,也具备杀灭多种革兰氏阴性菌的能力。进一步分析发现其位于SSL分子C端的一个螺旋-回环-螺旋的结构中,并由此推测其杀菌机理是通过改变细胞膜的渗透性,进而使细胞内溶物流出而造成细胞死亡,而抗菌实验也验证了这一推测。该抗菌肽的发现为后续提高SSL的抗菌活性提供了理论依据。
猪溶菌酶,大肠杆菌,抗菌肽,抗生素,膜渗透性
由于近年来食品安全事件的频发以及饲用抗生素滥用问题的日益凸显,寻求安全高效的饲用抗生素替代品已经刻不容缓。溶菌酶是一种天然的盐基碱性蛋白质,已经被广泛应用于食品、医药、生物工程以及饲料等领域[1]。而作为C型溶菌酶的一种,猪溶菌酶 (lysozyme,SSL) 是猪体内抵抗外源性疾病的一道重要屏障[2-3]。鉴于猪在畜牧行业中的重要地位,它的发酵生产为解决饲用抗生素的滥用问题提供了选择[4]。然而,SSL对革兰氏阴性菌的杀菌效果并不明显,这也限制了其应用的范围。因此,提高SSL的抗菌活性,尤其是对革兰氏阴性菌的杀灭作用,对其进一步的生产应用有着重要意义。
目前,提高溶菌酶抗革兰氏阴性菌活性的方法主要包括:热变性[5-6]、化学修饰[7-8]、抗菌肽的分离[9-10]以及融合表达[11-12]。其中,热变性的方法可以提高溶菌酶抗革兰氏阴性菌的活性,但是会失去其原有的抗革兰氏阳性菌能力;化学修饰的方法获得的产品其稳定性不能保证,而且生产过程较为繁琐;目前融合表达的方法虽然可获得多功能的产物,但是与SSL分子进行融合的都是外源蛋白,可能会成为动物体内免疫系统或消化酶的作用对象进而影响其在动物体内的作用;抗菌肽的分离虽然暂时将溶菌酶的分子破坏,但是它对进一步提高SSL的抗菌活性具有重要指导价值。比如从SSL分子中分离出对革兰氏阴性菌有抗菌功能的肽段,利用其他分子生物学手段 (如融合表达) 强化SSL中该抗菌肽的杀菌能力,既可以保持SSL原有的抗菌能力,又能得到性能稳定的发酵产品,是提高SSL抗菌性能的理想途径。
本研究采用多种蛋白酶对SSL进行酶解。在分析其水解产物的抗革兰氏阴性菌活性的基础上,利用凝胶过滤色谱、反相制备色谱的分离手段,从水解产物中分离得到SSL中对革兰氏阴性菌具有杀菌作用的肽段。对此肽段进行生物信息学的分析以及抗菌特性的研究,为进一步强化该肽段在SSL中的作用、增强其抗菌能力提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
SSL的原核表达菌株BL21(DE3)-pET28a(+)- SSL,由本实验室构建。SSL抗菌活性测试菌种大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 25923、克雷伯氏肺炎菌CMCC(B)46117、铜绿短杆菌ATCC 15442以及沙门氏杆菌CMCC(B) 50335,购自无锡赛维贸易有限公司;溶壁微球菌ATCC 4698,购自南京建成生物科技有限公司;枯草芽孢杆菌(Wild Strain,WS)和解淀粉芽孢杆菌(WS) 由本实验室保藏。
1.1.2 试剂与培养基
胃蛋白酶 (Pepsin)、胰蛋白酶 (Trypsin)、梭菌蛋白酶 (Clostripain)、色谱纯甲醇、乙腈,购自Sigma-Aldrich公司;凝胶色谱柱Superdex peptide 10/300GL购自美国GE公司;反相制备色谱柱XBridge Prep C18购自美国Waters公司。酵母提取物与胰蛋白胨,购自Oxiod公司;其他试剂均为分析纯,购自国药集团有限公司。LB培养基 (g/L):酵母提取物5,胰蛋白胨10,NaCl 10,琼脂20 (固体培养基),自然pH,121 ℃灭菌20 min。TSB培养基(g/L):胰蛋白胨15,大豆蛋白胨5,NaCl 5,pH为7.2±0.2,121 ℃灭菌20 min。
1.1.3 仪器与设备
Dimension®IconTM原子力显微镜,美国Bruker公司;Spectra Max Plus 384光吸收酶标仪,美国Molecular Devices公司;AKTATMavant 25蛋白纯化系统,美国GE公司;IKARV10旋转蒸发仪,德国IKA公司;Partec PAS IIIi流式细胞仪,法国PARTEC公司;Scientz-10N冷冻干燥机,宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 SSL的发酵及其复性
SSL的发酵及其复性参照文献[4]进行。SSL表达宿主在IPTG浓度为0.1 mmol/L、25 ℃、200 r/min条件下诱导表达8 h后,离心弃上清。超声波破碎细胞后,采用氧化还原体系的方法进行复性。复性后经过一步的超滤纯化可得到纯度为90%以上的SSL产品。纯化后的产品经冷冻干燥后于–20 ℃保存备用。
1.2.2 SSL的蛋白酶水解
分别称取4份1.2.1中得到的SSL产品70 mg,用1 mL 0.03 mol/L NaCl溶液 (pH 7.0) 溶解,前3组分别加入4 mL的蛋白酶溶液 (50 mg/mL胃蛋白酶,pH 2.0;50 mg/mL胰蛋白酶,pH 10.0;或10 U/mL梭菌蛋白酶,pH 7.5),于37 ℃条件下过夜酶解。第4组试验中,先加入4 mL的胃蛋白酶溶液,37 ℃反应过夜之后,调节溶液pH至10.0,加入200 mg的胰蛋白酶继续反应12 h。80 ℃保温30 min将酶灭活之后,10 000 ×离心5 min,取上清液过0.22 μm滤膜之后进行抗菌活性测定,选择抗菌活性最高的水解液进行下一步的分离纯化。其中,每个实验组中的空白为不加SSL的蛋白酶溶液。
1.2.3 抗菌活性测试以及抗菌肽的最低抑菌浓度 (Minimal inhibitory concentration,MIC)
水解液的抗菌活性测试参照文献[9]的方法进行。在前期的分离过程中,以大肠杆菌ATCC 25922为测试菌进行抗菌活性分析。合成抗菌肽的抗菌谱测定时,对1.1.1中涉及的所有测试菌都进行分析。测定时设3组平行,结果以±的形式表示。对实验组与对照组的结果进行检验,分析实验结果的差异显著性。
抗菌肽的MIC测定参照文献[13]进行。测试抗菌肽的浓度梯度从1到100 μmol/L (250 μL TSB培养基溶解)。其中不加抗菌肽的测试菌为阳性对照,不加测试菌的抗菌肽溶液为阴性对照,MIC定义为相对于阳性对照组600无明显变化的测试组所对应的抗菌肽浓度。测定时设3组平行,结果以±的形式表示。
1.2.4 凝胶过滤色谱分离
抗菌活性分析后选择的水解液,经过0.22 μm的滤膜过滤,然后上样至凝胶过滤色谱Superdex peptide 10/300GL。流速为0.5 mL/min,流动相为20 mmol/L的PBS缓冲液 (pH 7.0),每1 mL的洗脱液收集到一个采样管。用酶标仪对收集的样品进行蛋白浓度225测定,同时进行抗菌活性分析 (用大肠杆菌进行)。
1.2.5 反相制备色谱分离
选择凝胶过滤分离后的样品,用反相制备色谱Agilent 1100 series结合色谱柱Phenomenex luna C18 column (7.8 mm×150 mm,5 μm)。流动相为含0.1% TFA的无菌Milli-Q水 (A) 和含0.1% TFA的乙腈 (B),系统流速为10 mL/min。梯度洗脱程序为0−5 min,5% B;5−30 min,5%−50% B;30−35 min,50%−80% B。紫外检测器,检测波长为225 nm。收集HPLC洗脱峰对应的采样管,旋转蒸发之后用0.03 mol/L NaCl溶液 (pH 7.0) 补充至采样管中的原体积,并测定其抗菌活性 (用进行)。
1.2.6 液质联用 (liquid chromatography-mass spectrometry,LC-MS) 鉴定
对反相制备色谱得到的具有抗菌活性的洗脱峰进行LC-MS的分析[14]。LC条件为色谱柱Phonomenex luna C18 (4.6 mm×250 mm),乙腈(3)∶水(97)∶甲酸(0.1) 作为流动相A;乙腈(70)∶水(30)∶甲酸(0.1) 作为流动相B。洗脱程序为:0–10 min,100% A,0% B;20 min,70% A,30% B;30 min,0% A,100% B;35 min 100% A,0% B;流速,1 mL/min;柱温,30 ℃。质谱分析条件为:毛细管电压,3.88 kV;圆锥体电压,20 V;离子源温度,120 ℃;去溶温度,300 ℃;流速,1 mL/min;分流比,50∶1。用MassLynx软件(version 4.1) 对质谱结果进行分析。将软件分析得到的氨基酸序列按照可能性从高到低排序;同时根据胰蛋白酶的作用位点[15]列出其水解SSL后可能产生的肽段序列。两组序列一一比对,最终确定抗菌肽的氨基酸序列。
1.2.7 生物信息学分析与Swiss-modelling建模
经LC-MS鉴定后的抗菌肽,提交至抗菌肽数据库 (http://aps.unmc.edu/AP/main.html) 进行比对分析,根据同源或类似序列的分析推测该抗菌肽的生物学特性。抗菌肽的三维结构模拟是借助Swiss-Model (http://swissmodel.expasy.org)在线模拟分析软件进行,选择蛋清溶菌酶作为模板。由于抗菌肽的序列较短,因此选择了包含抗菌肽序列及其上下游共30个氨基酸残基进行模拟。
1.2.8 抗菌肽作用后细胞形态的扫描
将LC-MS鉴定得到的抗菌肽进行化学合成,并作用于靶细胞。将抗菌肽处理(0.2 mg/107细胞,37 ℃处理20 min,0.1 mol/L、pH 7.2的PBS缓冲液作对照) 过后的微生物 (ATCC 25922进行,下同) 离心 (5 000×,5 min) 收集并洗涤,按参考文献[16]的方法用玻璃板固定,然后用原子力显微镜进行观察。
1.2.9 抗菌肽作用后细胞荧光强度的检测
将抗菌肽 (终浓度1 mg/L) 与靶细胞大肠杆菌(约108CFU/mL) 混合后,于37 ℃条件下培养30 min,10 000 ×离心10 min,用0.22 μm滤膜过滤后的0.1 mol/L PBS缓冲液 (pH 7.2) 重悬至原体积,用超声仪对细胞进行分散。参照Budde[17]的方法进行染色,每毫升的细胞悬浮液中加入10 mL的染色液 (10 mmol/L cFDA染料溶于丙酮中),37 ℃温浴30 min,置于避光的冰上保存至流式细胞仪分析。
2 结果与分析
2.1 SSL的蛋白酶水解物的抗菌活性
图1中显示了不同的蛋白酶作用于SSL后的水解液的抗菌活性,其中胃蛋白酶的水解液对革兰氏阴性菌大肠杆菌ATCC 25922基本没有杀菌效果,主要是因为SSL对胃蛋白酶的降解作用具有抗性[18](SDS-PAGE结果未显示),而自然状态下的SSL对大肠杆菌并没有明显的杀菌作用。梭菌蛋白酶的水解产物具有一定的抗革兰氏阴性菌能力,但是效果有限 (抗菌系数为0.25,即杀菌率约为56%);而胰蛋白酶对SSL的水解物具有最强的抗革兰氏阴性菌活性,其抗菌系数可达2.81 (可杀死99%以上的靶细胞);胃蛋白酶结合胰蛋白酶对SSL的水解产物杀菌效果 (抗菌系数为1.02,杀菌率90%)要弱于单独使用胰蛋白酶的水解液。一方面胃蛋白酶的存在可能会作为底物竞争性影响胰蛋白酶对SSL的降解活性;另一方面,胃蛋白酶会使SSL水解产物中抗菌活性成分的纯度有所降低,进而可能影响其杀菌效果。在后续的试验中,采用胰蛋白酶单独对SSL进行水解。然后对其水解产物中的具体抗菌物质进行分离纯化和鉴定。
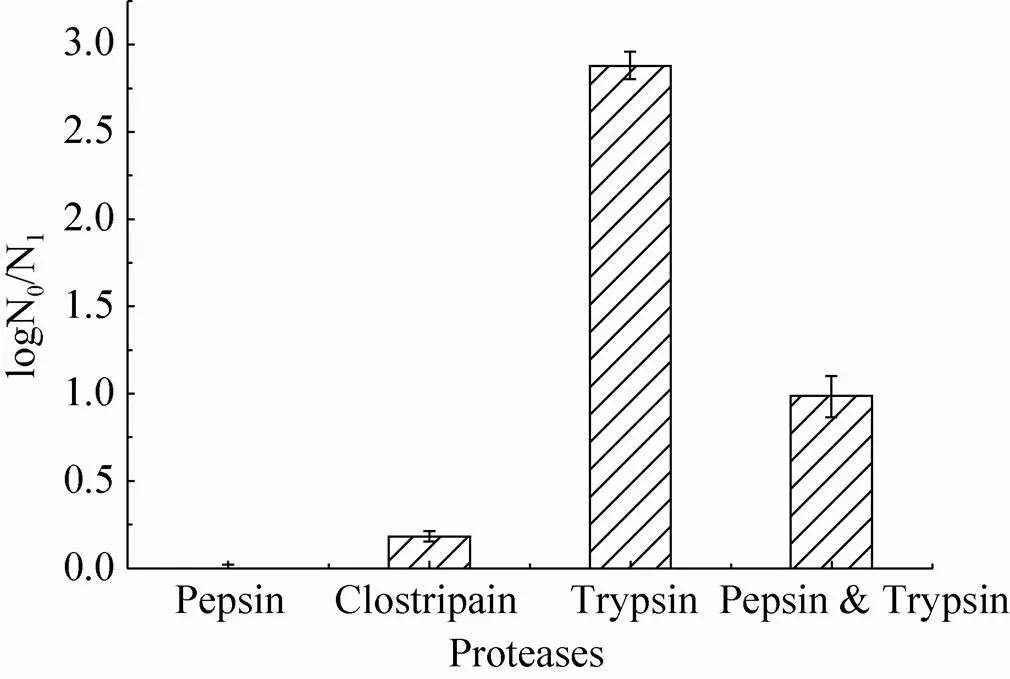
图1 不同蛋白酶对SSL水解产物的抗菌活性
2.2 SSL水解物中抗菌肽的分离纯化
2.2.1 凝胶过滤色谱分离
用凝胶过滤色谱Superdex peptide 10/300GL对SSL的胰蛋白酶水解液进行分离纯化,洗脱峰如图2所示。水解液经过凝胶过滤分离,得到了6个明显的洗脱峰 (编号Ⅰ–Ⅵ)。分别对其进行抗菌活性分析,其结果如图中的虚线部分所示。结果表明,对测试菌大肠杆菌具有抗菌活性的水解片段集中在分子量较小的区间,其中洗脱峰Ⅴ和Ⅵ的抗菌活性较高;而洗脱峰Ⅴ的抗菌系数可达0.85,约是洗脱峰Ⅵ抗菌活性的2倍。因此,在后续的试验中,选择洗脱峰Ⅴ的收集管作为研究对象,进行下一步的反相制备色谱的分离纯化。
2.2.2 反相制备色谱的分离纯化
用反相制备色谱HPLC对上一步凝胶过滤色谱中的洗脱峰Ⅴ进行分离纯化,结果如图3所示。结果显示,经过反相制备色谱的分离,可得到7个明显的洗脱峰 (编号Ⅰ–Ⅶ),对其洗脱峰收集液旋转蒸发后冷冻干燥。用同体积的PBS溶液(0.02 mol/L,pH 7.0) 溶解,并进行抗菌活性分析,其结果如图中的虚线部分所示。结果表明,洗脱峰Ⅱ和Ⅲ的抗菌活性较高,其抗菌系数分别为0.48和1.25。在后续的试验中,选择抗菌效果较高的洗脱峰Ⅲ的收集管作为研究对象,进行LC-MS鉴定。

图2 胰蛋白酶对SSL水解产物的凝胶过滤分离

图3 抗菌物质的反相制备色谱分离
2.3 抗菌物质的鉴定及其生物信息学分析
2.3.1 抗菌物质的LC-MS鉴定
对2.2.2中反相制备色谱得到的洗脱峰Ⅲ的收集液进行旋转蒸发和冷冻干燥,用无菌水溶解后进行LC-MS分析。其LC图谱如图4A所示,而其质谱鉴定的结果如图4B所示,这与文献[14]的部分结果一致。经软件MassLynx (version 4.1) 分析,结合SSL的一级结构以及胰蛋白酶的酶切位点,得到了该抗菌肽的氨基酸序列A-W-V-A-W-K,命名为SP。此抗菌肽的氨基酸序列分别对应于SSL一级结构中的第108–113位的氨基酸残基,其分子量为(759.91±0.5) Da。
2.3.2 抗菌肽的生物信息学分析
将抗菌肽SP的氨基酸序列导入抗菌肽数据库进行比对分析,发现其分子的疏水性比率为83% (疏水性对抗菌肽的抗菌活性有着重要作用),同时其Boman系数 (此性质表征抗菌肽与蛋白结合的能力) 为–1.12 kcal/mol。此外,该抗菌肽属于碱性肽,其等电点pI为9.70。序列比对结果显示,抗菌肽SP与来源于的抗菌肽PGLa-H (AP01814)[19]有着40%的相似性,后者既能够杀灭革兰氏阳性菌,也能够抗革兰氏阴性菌。为了验证SP的抗菌功能与活性,化学合成了此抗菌肽进行后续实验。
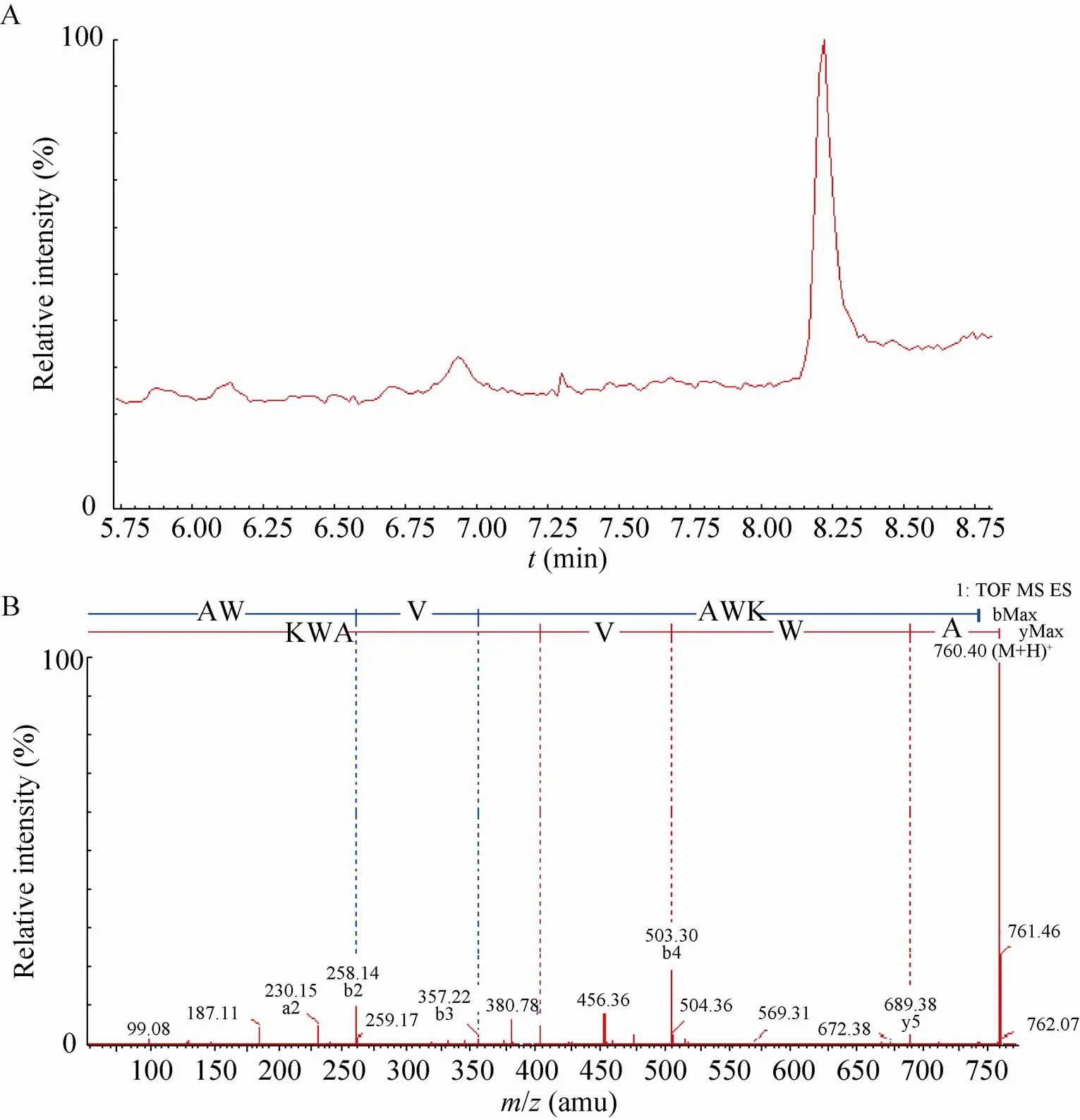
图4 抗菌肽的LC-MS鉴定
2.4 抗菌肽SP的抗菌活性验证
表1中列出了纯化得到的抗菌肽SP以及合成的SP对多种革兰氏阳性菌和革兰氏阴性测试菌的抗菌活性及其MIC。本实验中纯化得到的抗菌肽与化学合成的SP抗菌活性类似,基本可以确认为同一物质。SSL的抗菌能力主要是针对革兰氏阳性菌;而抗菌肽SP不仅具有抗革兰氏阴性菌的能力,同时也部分保留了SSL的抗革兰氏阳性菌的效果。SP的抗菌效果与其同源性最高的PGLa-H (AP01814)[19]的抗菌效果较一致,推测此类抗菌肽的框架 (++A+VA+K++) 可能是一种对革兰氏阳性菌和阴性菌都有杀菌效果的功能结构域。SSL与抗菌肽SP的抗菌效果的差异主要是由它们的作用机理决定的。SSL的杀菌机理是由其分子中E35的参与下与细胞壁中肽聚糖的糖苷键形成碳正离子中间体,然后在D53的参与下对该中间体进行分离,进而完成对肽聚糖的水解[20]。抗菌肽SP属于阳离子肽,而阳离子肽按其二级结构可分为α螺旋、拓展结构、Loop结构以及β折叠4大类[21]。为进一步了解SP的性质,有必要对其作用方式进行研究。
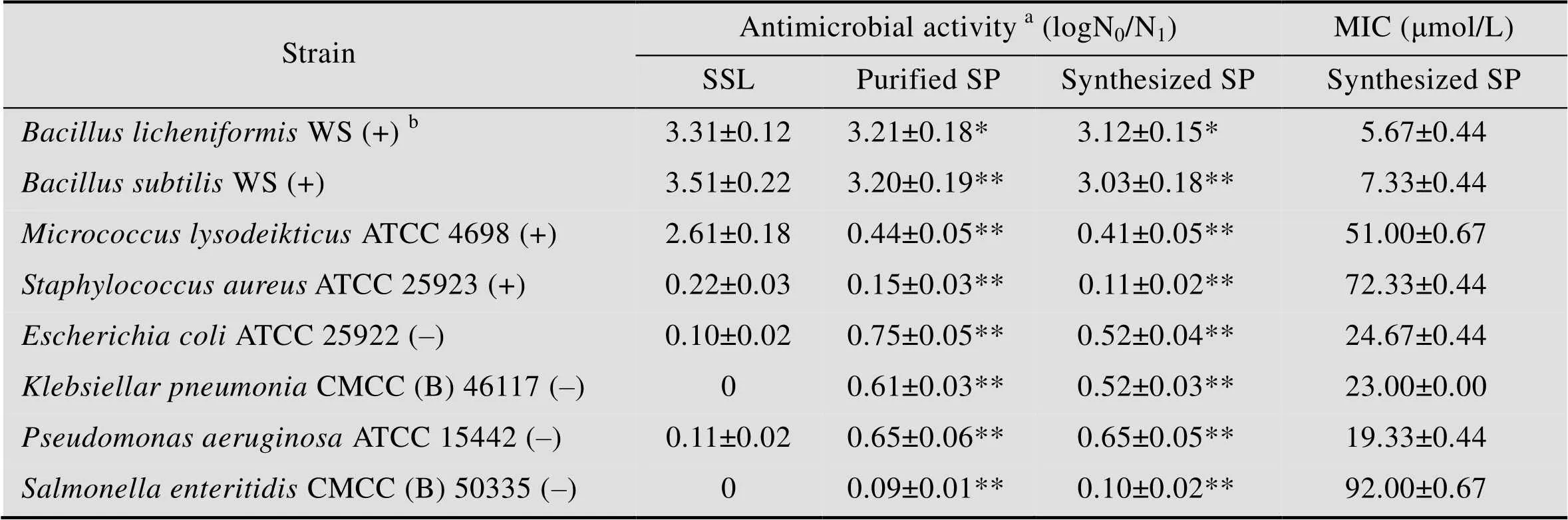
表1 抗菌肽SP的抗菌谱检测
aThe peptide or SSL concentrations were 2.5×10–7mol per assay. The assays were performed in triplicate, and-tests were used to compare the differences of peptide to natural SSL;bGram-positive bacteria (+) and gram-negative bacteria (–); *<0.05; **<0.01.
2.5 抗菌肽SP的作用机理
2.5.1 抗菌肽SP在SSL中的结构模拟
SP及其在SSL中两端部分序列 (共30个氨基酸残基,对应于SSL一级结构的86−115位的氨基酸残基的肽段的3D结构模拟如图5所示。从模拟图可以看出,该抗菌肽处在一超二级结构模体Helix-Loop-Helix (HLH) 中的一段螺旋之中 (SP的位置在Helix 2中)。而结构HLH存在于多种抗菌肽中[22-23],被证明是与抗菌肽对靶细胞膜的渗透性破坏有关,其作用方式可以是形成孔洞或者地毯式模型[24]等。因此,我们推测,此种抗菌肽的作用机理也是通过破坏靶细胞膜的渗透性,从而导致细胞死亡。

图5 抗菌肽在SSL中的结构模拟
2.5.2 抗菌肽SP对靶细胞细胞形态的影响
为了进一步验证抗菌肽SP的作用方式,采用原子力显微镜扫描的手段对其作用后的细胞进行检测,其结果如图6所示。从图中可以明显看出,经过抗菌肽SP作用后的靶细胞的细胞完整性遭到了破坏,细胞大小没有明显变化,但是部分细胞膜已经破落,细胞内溶物也有流出。经初步判断,靶细胞遭到抗菌肽SP作用后,其细胞膜的完整性被破坏,细胞膜的渗透性也有所改变,其作用方式与具备HLH结构的抗菌肽类似。SP可通过破坏靶细胞的细胞膜渗透性 (或结构完整性) 进而杀死革兰氏阴性菌,但是在天然的SSL中它们并没有发挥出这种功能。这可能是因为它们都被SSL的表面结构所包裹,并没有足够的机会去接触靶细胞的细胞膜。因此,除了通过改变SSL的表面结构,使其疏水性提高,SSL的作用位点更能够接触其作用底物-肽聚糖层之外;我们提出,利用相应的技术手段,将抗菌肽SP暴露在其结构表面,从而直接利用抗菌肽的杀菌作用进行杀菌,是SSL增效研究的另一新的途径。

图6 抗菌肽SP作用后的大肠杆菌原子力显微镜扫描图
2.5.3 抗菌肽SP对靶细胞细胞膜渗透性的影响
图7表示了抗菌肽SP处理过后的靶细胞细胞表面的荧光强度 (FI) 的变化,FI降低主要是由于细胞外膜的破裂而导致荧光染料外流所致,可用于表征膜电势的变化情况[25]。结果显示,抗菌肽SP作用后的细胞膜表面的平均荧光强度由253减少到了125,降低幅度达50.6%。说明被SP处理过后的细胞膜的结构受到了破坏,导致其通透性得到提高,细胞内溶物流出而导致细胞死亡。Budde等[17]在利用细菌素Bacteriocin作用于NCFB 2714细胞时,得到了类似的结果,其平均荧光强度由1.55降至0.40,降低幅度可达74%。
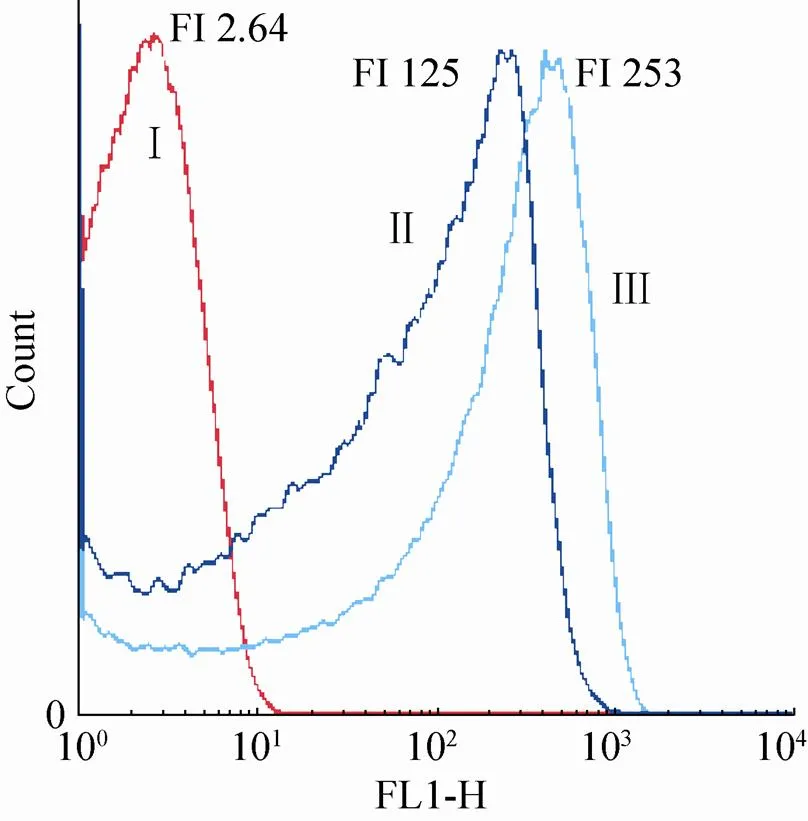
图7 抗菌肽处理对大肠杆菌细胞膜荧光强度的影响
3 结论
通过对SSL进行蛋白酶水解以及抗菌活性分析,发现SSL对胃蛋白酶的水解具有抗性,同时胰蛋白酶的水解物具有最强的抗革兰氏阴性菌活性,本实验条件下的抗菌系数为2.81,可杀灭99%以上的测试菌。通过凝胶过滤色谱和反相分离色谱的分离纯化,结合LC-MS的分离与鉴定,得到了一种对革兰氏阴性菌具有抗菌活性的小肽,其氨基酸序列为A-W-V-A-W-K (SP)。
经化学合成以后进行抗菌谱的测定,发现SP既可以杀灭革兰氏阴性菌,也部分保留了SSL的抗革兰氏阳性菌的能力。通过Swiss-modeling结构模拟、原子力显微镜检测以及细胞膜渗透性实验,发现SP具有α螺旋结构,在SSL中位于N端的一段HLH的超二级结构模体中。
抗菌肽SP的发现,表明SSL中存在对革兰氏阴性菌有杀菌作用的片段或结构,但是由于其分子表面的空间位阻等作用,导致这些结构的功能没有在自然状态下得以展现。后续研究中,可以通过改善SP等结构周围的环境或者通过基因融合的手段提高SP在SSL中的比重等方法强化SP的杀菌作用,对提高SSL的抗菌谱具有理论指导价值。
[1] Zhu D, Cai G, Wu D, et al. Comparison of two codon optimization strategies enhancing recombinantlysozyme production in. Cell Mol Biol, 2015, 61(2): 43–49.
[2] Yu M, Irwin DM. Evolution of stomach lysozyme: the pig lysozyme gene. Mol Phylogenet Evol, 1996, 5(2): 298–308.
[3] Palmieri C, Brunetti M, Salda LD. Immunohistochemical characterization of Kisselev nodules (ectopic lymphoid follicles) in wild boar (L.). Res Vet Sci, 2007, 83(1): 109–115.
[4] Zhu DW, Cai GL, Lu J. The expression oflysozyme in.and its refolding. Food Ferment Ind, 2016, 42(10): 23–28 (in Chinese). 朱德伟, 蔡国林, 陆健. 猪溶菌酶在大肠杆菌中的表达及其复性. 食品与发酵工业, 2016, 42(10): 23–28.
[5] Derde M, Guérin-Dubiard C, Lechevalier V, et al. Dry-heating of lysozyme increases its activity againstmembranes. J Agric Food Chem, 2014, 62(7): 1692–1700.
[6] Cong L, Yang X, Wang X, et al. Characterization of an i-type lysozyme gene from the sea cucumber, and enzymatic and nonenzymatic antimicrobial activities of its recombinant protein. J Biosci Bioeng, 2009, 107(6): 583–588.
[7] Liu ST, Sugimoto T, Azakami H, et al. Lipophilization of lysozyme by short and middle chain fatty acids. J Agric Food Chem, 2000, 48(2): 265–269.
[8] Ibrahim HR, Taniyama N, Aoki T. Distinct dimerization between α-lactalbumin and lysozyme exhibiting novel antimicrobial activity against gram-positive and gram-negative bacteria. Lett Drug Des Discov, 2004, 1(2): 101–109.
[9] Pellegrini A, Thomas U, Bramaz N, et al. Identification and isolation of a bactericidal domain in chicken egg white lysozyme. J Appl Microbiol, 1997, 82(3): 372–378.
[10] Mine Y, Ma FP, Lauriau S. Antimicrobial peptides released by enzymatic hydrolysis of hen egg white lysozyme. J Agric Food Chem, 2004, 52(5): 1088–1094.
[11] Lu XM, Jin XB, Zhu JY, et al. Expression of the antimicrobial peptide cecropin fused with human lysozyme in. Appl Microbiol Biotechnol, 2010, 87(6): 2169–2176.
[12] Zhao H, Tang J, Cao L, et al. Characterization of bioactive recombinant antimicrobial peptide parasin I fused with human lysozyme expressed in the yeastsystem. Enzyme Microb Technol, 2015, 77(3): 61-67.
[13] Wang AP, Su YP, Wang S, et al. Antibacterial activity and mechanism of recombinant human α-defensin 5 against clinical antibiotic-resistant strains. Afr J Microbiol Res, 2010, 4(8): 626–633.
[14] Zhu D, Cai G, Li X, et al. Enhancing the antimicrobial activity oflysozyme by N-terminal fusion of a sextuple unique homologous peptide. J Biotechnol, 2017, 243: 61–68.
[15] Rawling ND, Barrett AJ. Families of serine peptidases. Methods Enzymol, 1994, 244: 19–61.
[16] Soon RL, Nation RL, Harper M, et al. Effect of colistin exposure and growth phase on the surface properties of livecells examined by atomic force microscopy. Int J Antimicrob Agents, 2011, 38(6): 493–501.
[17] Budde BB, Rasch M. A comparative study on the use of flow cytometry and colony forming units for assessment of the antibacterial effect of bacteriocins. Int J Food Microbiol, 2000, 63(1/2): 65–72.
[18] Nonaka Y, Akieda D, Aizawa T, et al. X-ray crystallography and structural stability of digestive lysozyme from cow stomach. FEBS J, 2009, 276(8): 2192–2200.
[19] Hou F, Li J, Pan P, et al. Isolation and characterisation of a new antimicrobial peptide from the skin of. Int J Antimicrob Agents, 2011, 38(6): 510–515.
[20] Vocadlo DJ, Davies GJ, Laine R, et al. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate. Nature, 2001, 412(6849): 835–838.
[21] Wu M, Maier E, Benz R, et al. Mechanism of interaction of different classes of cationic antimicrobial peptides with planar bilayers and with the cytoplasmic membrane of. Biochemistry, 1999, 38(22): 7235–7242.
[22] Engelman DM, Steitz TA. The spontaneous insertion of proteins into and across membranes: the helical hairpin hypothesis. Cell, 1981, 23(2): 411–422.
[23] Ibrahim HR, Thomas U, Pellegrini A. A helix-loop-helix peptide at the upper lip of the active site cleft of lysozyme confers potent antimicrobial activity with membrane permeabilization action. J Biol Chem, 2001, 276(47): 43767–43774.
[24] Strömstedt AA, Ringstad L, Schmidtchen A, et al. Interaction between amphiphilic peptides and phospholipid membranes. Curr Opin Colloid Interface Sci, 2010, 15(6): 467–478.
[25] Chikindas ML, Garcia-Garcerá MJ, Driessen AJ, et al. Pediocin PA-1, a bacteriocin fromPAC1.0, forms hydrophilic pores in the cytoplasmic membrane of target cells. Appl Environ Microbiol, 1993, 59(11): 3577–3584.
(本文责编 陈宏宇)
Purification, identification and characterization of an anti-microbial hexapeptide fromlysozyme
Dewei Zhu1,2,3, Guolin Cai1,2,3, and Jian Lu1,2,3
1 The Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China 2 National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China 3 School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
lysozyme (SSL) was digested by different proteases to find peptides with enhanced antibacterial activity against gram-negative bacteria. Hydrolysate with the highest anti-bacterial activity was loaded onto a gel filtration chromatography column followed by a reversed-phase one. The obtained substance was identified by liquid chromatography-mass spectrometry, synthesized to test its antibacterial spectrum and analyzed for bioinformatics. The hydrolysate of trypsin showed the highest antibacterial activity. By purification and identification, the functional peptide with sequence of A-W-V-A-W-K was obtained. The peptide was synthesized and proved to retain partial function of SSL and had activity against gram-negative bacteria. By bioinformatics analysis, the peptide was found to locate in a helix-loop-helix structure, suggesting that the peptide may kill cells by penetrating cell membrane and cause the outflow of cell contents. The discovery of the peptide could lay the foundation for improving the antibacterial activity of SSL.
lysozyme,, antibacterial peptide, antibiotics, membrane penetrating
10.13345/j.cjb.160475
December 12, 2016; Accepted:February 21, 2017
Jian Lu. Tel/Fax: +86-510-85918191; E-mail: jlu@jiangnan.edu.cn
Supported by:National Basic Research Program of China (973 Program) (No. 2013CB733602), Fundamental Research Funds for the Central Universities (No. JUSRP51302A), the Priority Academic Program Development of Jiangsu Higher Education Institutions.
国家重点基础研究发展计划 (973计划) (No. 2013CB733602),中央高校基本科研业务费专项资金资助 (No. JUSRP51302A),江苏高校优势学科建设工程项目资助。
网络出版时间:2017-03-31
http://kns.cnki.net/kcms/detail/11.1998.Q.20170331.1001.001.html
