卵巢肿块中超声造影参数图像处理软件的DVP表现及与VEGF和HIF-1a同步相关研究
2017-07-01仲跻凤孟庆欣
仲跻凤,孟庆欣
(1.南京中医药大学附属海安县中医院 超声科,江苏 南通226600;2.南京军区总医院 超声科)
卵巢肿块中超声造影参数图像处理软件的DVP表现及与VEGF和HIF-1a同步相关研究
仲跻凤1,孟庆欣2
(1.南京中医药大学附属海安县中医院 超声科,江苏 南通226600;2.南京军区总医院 超声科)
对于实质性的肿瘤微环境来说,缺氧状态属于一种非常常见的基本特征[1]。因为恶性肿瘤增殖生长的速度过于迅速,和肿瘤细胞中的血管不成比例,造成局部组织严重缺氧[2]。肿瘤可通过多种方式适应缺氧微环境,其中最重要的代偿机制和肿瘤血管的诱导形成密切关联[3,4]。血管内皮生长因子(Vascular endothelial growth factor,VEGF)属于一种非常重要的生长因子,主要作用是对恶性肿瘤血管的形成产生刺激作用,与肿瘤的发生发展密切相关。在缺氧情况下,机体组织的许多因子都会做出应激反应,在这个过程中起中心调节作用的因子就是缺氧诱导因子(Hypoxia Inducibie Factor,HIF-1a)。HIF-1a可促进肿瘤生长、侵袭及转移[5,6]。
1 材料与方法
1.1 材料
研究对象:2010年2月至2016年2月在本院及在南京军区总医院学习期间常规超声发现卵巢包块的患者50例,年龄24-70(44±12)岁。所有患者于术前1周内行盆腔超声造影检查,初步判定卵巢肿块的性质,再结合手术病理结果分析卵巢良恶性肿块不同的超声造影特征。所有患者在检查前签署知情同意书,对无临床指征者不以研究为理由进行组织标本采集。排除孕期或哺乳期妇女、术前行介入治疗或化疗、有心脏病史、近期血栓史及对造影剂中任何成分过敏者。50例病例分别为:良性肿块28例,其中浆液性囊腺瘤8例,粘液型囊腺瘤6例,子宫内膜异位囊肿2例,成熟畸胎瘤3例,炎性包裹性积液2例,卵泡膜细胞瘤1例,卵巢结核1例,出血性黄体囊肿2例,卵巢纤维瘤3例;恶性22例,其中浆液性囊性瘤9例,粘液性囊腺瘤5例,未成熟畸胎瘤2例,大网膜炎性纤维肉瘤2例,转移性瘤3例,恶化卵泡膜瘤1例。
超声诊断仪:VolusuanE8 ,探头C1-5,频率3.5-5.0 MHz。
超声造影采用1.0造影分析软件。造影剂Sonovue。试剂:鼠抗人VEGF、HIF-Ia单克隆抗体由美国Abcom公司提供。
1.2 方法
超声造影检查:患者取仰卧位,检查过程中保持体位不变并匀速呼吸。每个病例由同一超声医师在相同条件下、同一台超声诊断仪完成。造影前所有患者均签署知情同意书。根据上升时间、达峰时间及平均跨越时间等时间相关性指标的参数成像图特征,提出参数成像诊断法:以颜色边界不清晰、颜色过渡紊乱,“点状”分布者计1分;颜色边界清晰,颜色过度均匀,“片状”分布者计0分。对每个病例的这3个参数成像图分别进行计分,相加得出总分,以总分≦1分归为良性组,总分≧2分归为恶性组,将病理诊断作为金标准得出配对计数资料,计算两种诊断方法的结果一致性。利用参数成像法计算卵巢肿块的敏感性、特异性等。
免疫组织化学染色检测卵巢良恶性肿块中VEGF、HIF-1a的表达:手术中的使用的标本注意使用10%的甲醛液进行固定,时间为1天,将该标本送南京军区总院病理科检测。
1.3 统计学方法
2 结果
2.1 造影前后卵巢良恶性肿瘤声像图特征
良性肿块大多表现为囊性为主,边界清楚,少数为实性或实性为主,常规超声测量肿块直径结果为良性组3.9-13.2 cm,平均(7.2±3.4)cm;恶性肿块多表现为混合性包块或实性包块,边界不规则,直径4.0-12.9 cm,平均(8.5±2.9)cm,造影后良性4.2-15.2 cm,平均(7.4±3.6)cm,造影后肿块直径较造影前无明显增大,差异无统计学差异(P=0.398);对于恶性组来说,大约是4.5-13.2 cm,平均直径是(9.7±3.0)cm。由此可知造影之前的直径要远小于造影后的直径,两者之间的差异具有统计学意义(P=0.006)。
2.2 卵巢良恶性肿块造影前后病灶内血流显像情况
造影前后卵巢良恶性肿块的血管数目、形态及分布明显不同。卵巢良性肿块显示瘤内无灌注或均匀性增强,多数从周边向内部灌注,血管多分布于肿块的周边,形态规则,偶见稀疏分支,但光滑,走行较直,血管之间无分流;而恶性肿块在造影后显示瘤体不均匀性增强,多数从中央向周边灌注,血管数目较良性肿块明显增多,分布于肿块内外,外围血管粗大、扭曲、走向不规则,呈树枝状、蟹足状伸入瘤内,瘤内血管呈繁星点状、团簇状。
对50例卵巢肿块用SonoLiver超声造影参数图像处理分析软件进行脱机分析,良性肿块中24例(86%)显示内部以蓝色为主的低增强(图1),其中包括4例内部无增强(2例炎性包裹性积液显示内部无增多,2例子宫内膜异位囊肿显示内部无增强,但囊壁和分隔见造影增强显像);4例显示内部以红色为主的高增强(14%),分别是畸胎瘤2例,卵巢纤维瘤2例;恶性肿块中15例(68%)显示内部以红色为主的高增强(图1),7例显示内部以蓝色为主的低增强(32%)。两组比较差异有统计学意义(χ2=15.190,P<0.01)。
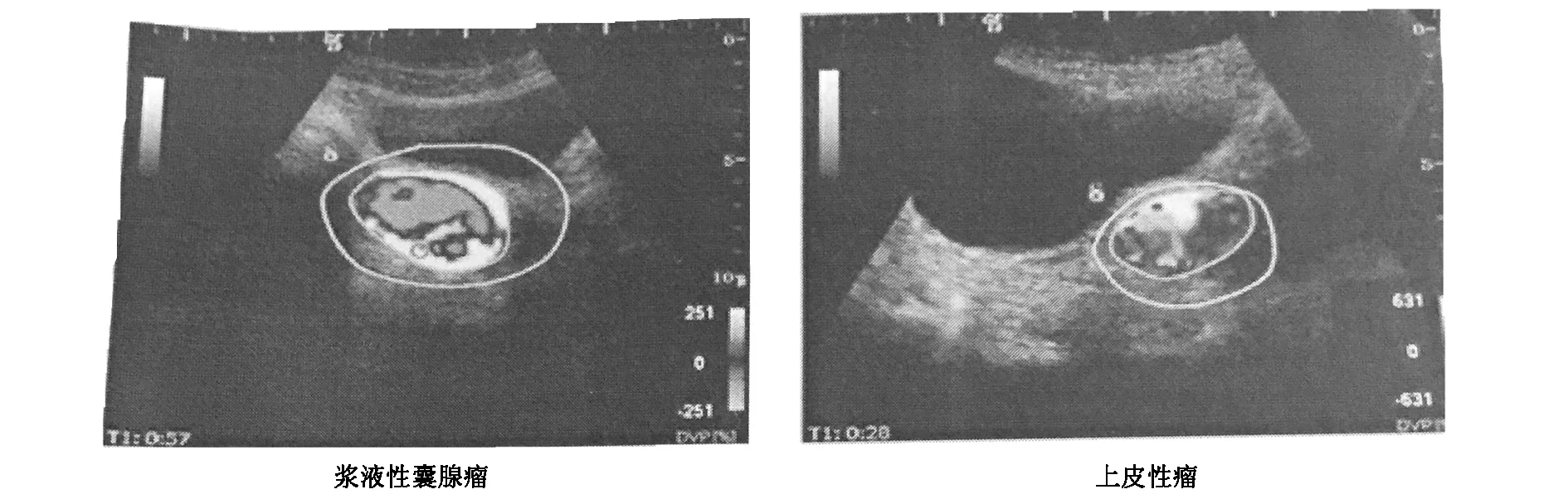
图1 卵巢浆液性囊腺瘤、上皮性癌超声造影图像
2.3 TIC、DVP曲线分析
卵巢良性肿块时间-强度曲线(TIC)多表现为“缓升缓降”,波峰圆钝,上升支与下降支较平滑,廓清时间较长;恶性肿块的TIC多表现为“速升速降”,波峰尖锐,上升支下降支均陡直,较周围正常组织提前达峰。动态血管模式(DVP)曲线的特征:良性组中的23例(79%)DVP曲线在造影全过程全部时段保持在基线之下(图2),5例在基线之上(18%),这5例分别是畸胎瘤2例,纤维瘤1例,卵巢黄体囊肿出血2例;恶性组中有15例(68%)DVP曲线在造影全过程全部时段保持在基线之上(图2),6例(27%)在灌注其和廓清早期位于基线之上,廓清中晚期降至基线之下,1例(5%)在造影全过程全部时段保持在基线之下。
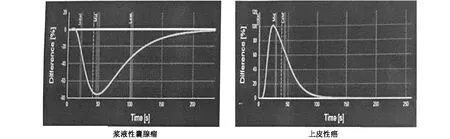
图2 卵巢浆液性囊腺瘤、上皮性癌动态血管模式曲线
2.4 卵巢良恶性肿块超声造影TIC定量参数比较
卵巢肿块经超声造影图像呈随时间变化而出现灌注强弱、消退的变化规律。造影剂达峰强度恶性肿瘤显著高于良性肿瘤(P=0.000),达峰时间及平均跨越时间恶性组短于良性组(P<0.05),上升时间虽恶性短于良性,但无显著性差异(P>0.05),见表1。

表1 卵巢良恶性肿块的TIC各参数比较
2.5 卵巢良恶性肿块中VEGF和HIF-1a的变动情况及相关性
VEGF主要表达于卵巢癌细胞的胞质或胞膜、肿瘤间质血管内皮细胞及少量炎性细胞,胞质中的表达最强。VEGF在良性卵巢肿块组织阳性表达率为22%(4/18),其中中表达(++),低表达(+);但是恶性卵巢肿块组织中的阳性表达率是72.7%(16/22),并且多为中表达(++),高表达(+++),低表达(+)。两组比较差异有统计学意义(P<0.05),见表2。

表2 卵巢良恶性肿块中VEGF的表达情况
HIF-1a主要表达于卵巢癌细胞的胞质,胞核及间质的血管内皮细胞,胞质最多见,见图3。HIF-1a在良性卵巢肿块组织的阳性表达率为10.7%(3/28),均表示低表达(+);在恶性卵巢肿块组织的阳性表达率为69.2%(15/22),多为高表达(+++),中表达(++)。两组比较差异有统计学意义(P<0.05),见表3。

表3 卵巢良恶性肿块中HIF-1a的表达情况
对于22例卵巢恶性肿块组织来说,大约有21例表现为HIF-1a和VEGF具有一致性,并且同时表现为阳性的有15例;两者同时表现为阴性的有6例;VEGF阳性表达但是HIF-1a阴性表达的只有1例。经Spearman相关分析,卵巢恶性肿块组织仲HIF-1a表达与VEGF表达之间呈明显正相关(r=0.791,P<0.05),见表4。

表4 卵巢恶性肿块中VEGF/HIF-1a表达的相关性
超声造影定量参数达峰强度与卵巢良恶性肿块中VEGF、HIF-1a的表达呈明显的正相关,P均小于0.05。上升时间、达峰时间、平均跨越时间和卵巢良恶性肿块中VEGF、HIF-1a的表达呈明显的负相关,P均小于0.05,见表5。
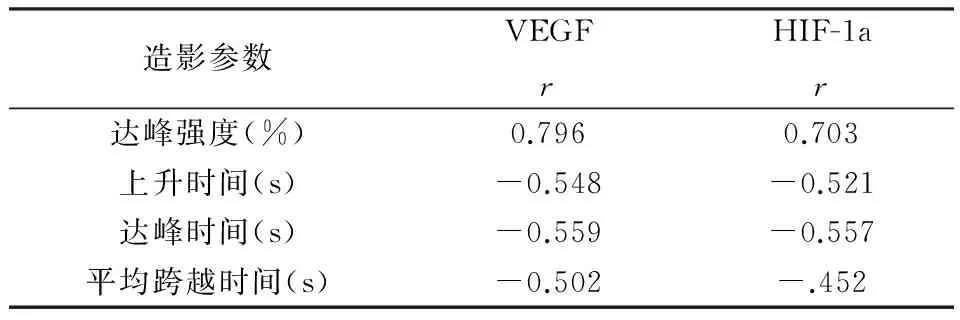
表5 卵巢良恶性肿块中VEGF、HIF-1a的表达与超声造影定量参数的相关性(r值)
3 讨论
常规的超声检查不能快速检测低速的肿瘤血管,但超声造影则可以。超声造影的作用主要是通过超声造影剂微泡在血管组织中利用相关的轨迹及造影增强达峰后肿瘤内微血管的分布图像,可观察到70 μm左右小血管,获得关于毛细血管的相关信息,也就是说组织内部的血供问题[7-10],这样可以更清楚地获得肿瘤血管的形态、走行、分布位置以及所有肿瘤内部的血管情况等。
SonoLiver超声造影定量分析软件用颜色深浅反应目标组织内的造影剂灌注情况。本研究的良性肿瘤中有86%显示为以蓝色为主的低增强,恶性肿瘤中68%显示为以红色为主的高增强,直观的反映了良恶性肿块中的血管分布和血流灌注情况。而良性肿瘤中2例成熟畸胎瘤病检结果含有伴甲状腺成分和神经胶质成分,血流丰富,因此显示为红色为主的高增强;2例卵巢纤维瘤,超声造影显示病灶内造影剂呈絮状慢慢充盈,较稀疏,也显示为红色为主的高增强。而恶性肿瘤以蓝色为主的低增强可能与肿瘤的大片坏死有关。
本研究使用动态血管模式曲线是标准化时间-强度曲线,是TIC的进一步升华,研究病灶区与参考区的强度差随时间变化的过程,反映强度差值的变化过程。卵巢恶性肿瘤TIC表现为“速升速降”、卵巢良性肿瘤TIC表现为“缓升缓降”。本次研究的22例恶性病灶中,有6例DVP曲线表现为灌注期以及廓清早期等都位于基线以上,但是廓清中晚期下降到基线之下,这样的结果表明廓清中期和晚期的病灶内部的造影剂强度要远远低于周围的正常组织的造影剂强度,进而可以间接地反映出恶性病灶内部的造影剂消失的速度要远远大于正常组织。造影剂达峰强度恶性肿瘤显著高于良性肿瘤(P=0.000),反映了恶性肿瘤血管丰富,进入肿瘤血管床的微泡总数量明显多于良性肿瘤;达峰时间及平均跨越时间恶性肿块短于良性肿块(P<0.05),说明恶性肿瘤新生血管数目增多,血管壁不完整,存在大量的动静脉短路和血管环。而上升时间恶性短于良性,但二者无显著性差异,可能与本研究样本量小有关。
这里所说的肿瘤血管生成属于一个非常复杂的过程,在一系列影响肿瘤血管生成的因子中,VEGF、HIF-1a是刺激肿瘤血管形成的重要因子、与肿瘤的发生发展密切相关。VEGF的主要作用是能够增强血管的通透性,然后直接对血管内皮细胞的转移和增殖分化产生刺激,进而对血管的构建和生长产生促进作用。HIF-1a属于一种氨特异性感受器,主要来源于哺乳动物体内,并且在缺氧的状态下对信号的转导具有非常重要的作用。本次研究主要采用的是免疫化的方法,然后对卵巢良恶性肿瘤中的VEGF、HIF-1a因子的表达情况进行及时的检测,结果显示VEGF在卵巢良性肿块组织阳性表达率分别为14.3%(4/28),均为中低表达;在卵巢恶性肿块组织的阳性表达率为72.7%(16/22),多为中高表达;HIF-1a在良性良性肿块组织的阳性表达率为10.7%(3/28),且均为低表达;在恶性卵巢肿块组织的阳性表达率为68.2%(15/22),多为中高表达。HIF-1a蛋白表达与VEGF水平呈显著性相关。这与前人的研究结果一致,提示VEGF、HIF-1a在肿瘤的发生发展中有重要的作用,HIF-1a能够在基因水平上对VEGF的表达产生调控作用,这样可以加快肿瘤的生长速度。肿瘤细胞不断增生,但是血管生长相对不足引起新生肿瘤细胞局部出现缺氧的情况,缺氧又可以反馈性的对VEGF表达产生影响,进而促进血管增生,最终为肿瘤的进一步生长提供必要条件[11]。
本研究通过对卵巢肿块的超声造影动态血管模式表现、定量参数与血管生成因子VEGF、HIF-1a表达的相关性研究发展,达峰强度与卵巢良恶性肿块中VEGF、HIF-1a的表达呈明显的正相关;肿瘤血管内的血流灌注及血流量明显增加,这表示卵巢肿块的VEGF、HIF-1a表达越强,卵巢肿块内新生血管数目越多,造影时进入血管床的微泡流量越大,而达峰强度反映了某一时间进入肿瘤血管床的最大微泡数量,说明了超声造影达峰强度可间接反映肿瘤的血管生成情况。上升时间、达峰时间、平均跨越时间和卵巢良恶性肿块中VEGF、HIF-1a的表达呈明显的负相关,这表示卵巢肿块的VEGF、HIF-1a表达越强,血液与组织液之间的交换面积越大,造影时血流灌注量越大,微泡流速越大,故超声造影时间相关性指标就越短。
综上所述,本研究术前利用SonoLiver超声造影定量分析,从影像学宏观评价肿瘤血管灌注状态,术后从免疫组化的分子学微观评价肿瘤血管生成状态。虽然免疫组化检测肿瘤是目前评价肿瘤血管生成最常用的方法,但它通过活检或术后取得标本,是有创检查,而且术后的检查并不能达到早期诊断的目的。而造影技术作为一种新型的影像学检查技术,以肿瘤内部血管特征为病理基础,实时观察病变区造影剂灌注的全过程,在肿块的定性诊断中颇有发展[12,13]。具有无创、安全、快捷、重复性好,因此超声造影弥补了免疫组化有创、术后评价的缺点,为卵巢癌的早期诊断提供依据。
[1]Osinsky S,Bubnovskaya L,Ganusevich I,et al.Hypoxia,tumour-associated macrophages,microvessel density,VEGF and matrix metalloproteinases in human gastric cancer:interaction and impact on survival[J].Clin Transl Oncol,2011,13(2):133.
[2]Oliver L,Olivier C,Marhuenda FB,et al.Hypoxia and the malignant glioma microenvironment:regulation and implications for therapy[J].Curr Mol Pharmacol,2009,2(3):263.
[3]Chen L,Endler A,Shibasaki F.Hypoxia and angiogenesis:regulation of hypoxia-inducible factors via novel binding factors[J].Exp Mol Med,2009,41(12):849.
[4]Semenza GL.Regulation of vascularization by hypoxia-inducible factor 1[J].Ann N Y Acad Sci,2009,1177:2.
[5]Batmunkh E,Shimada M,Morine Y,et al.Expression of hypoxia-inducible factoe-1 alpha(HIF-1alpha) in patients with the gallbladder carcinoma[J].Int J Clin Oncol,2010,15(1):59.
[6]Rekwirowicz H,Marszatek A.Hypoxia-inducible factor-1,a new possible important factor in neoplasia[J].Pol J Pathol,2009,60(2):61.
[7]Lim K,Patel N,Eckersley RJ,et al.Hepatic vein ransit time of SonoVue:a comparative study with Levovist[J].Radiology,2006,240:130.
[8]Huang Wei C,Bleuzen A,Bourlier P,et al.Differential diagnosis of focal nodular hyperplasia with quantitative parametric analysis in contrast enhanced sonography[J].Invest Radiol,2006,41:363.
[9]Kabakic N,Igci E,Secil M,et al.Echo contrast-enhanced power Doppler ultrasonography for assessment of angiogenesis in renal cell carcinoma [J].J Ultrasound Med,2005,24(6):747.
[10]Wang Z,Tang J,An L,et al.Contrast-enhanced ul trasonography for assessment of tumor vascularity in hepatocel lalar carcinoma[J].J Utrasound Med,2007,26(6):757.
[11]Fraga A,Ribeiro R,Medeiros R Hypoxia-inducible factor-1,a new possible important factor in neoplasia[J].Pol J Pathol,2009,60(2):61.
[12]Bernardini I,Mucciarini C,Razzini G,et al.The role of contrast-enhanced ultrasound in detection of liver metastastases from colorectal cancer:2 years update update results[J].Annals of Oncology,2010,21(Supp1.8):215.
[13]Shiozawa K,Watanabe M,Sumino Y,et al.Evaluation of Hemodynamic Status of Focal Hepatic Lesions 20 mm or Less in Diameter by Contrast-Enhanced Ultrasonography Using Sonazoid[J].Intervirollogy,2009,52(4):213.
1007-4287(2017)06-1046-05
仲跻风,女,副主任医师,超声科主任,研究方向:妇科疾病的超声诊断,各种介入性治疗。
2016-10-12)
