全自动免疫亲和在线净化/高效液相色谱法快速高通量测定饲料中黄曲霉毒素
2017-06-29王松雪
李 丽,黎 睿,谢 刚,叶 金,王松雪
(国家粮食局科学研究院,北京 100037)
全自动免疫亲和在线净化/高效液相色谱法快速高通量测定饲料中黄曲霉毒素
李 丽,黎 睿,谢 刚*,叶 金,王松雪
(国家粮食局科学研究院,北京 100037)
建立了全自动免疫亲和在线净化/高效液相色谱快速高通量测定饲料中黄曲霉毒素(Aflatoxins,AFT)的分析方法。饲料样品经乙腈-水(80∶20,体积比)提取,3 g/L Triton X-100水溶液10倍稀释后,用自动进样器注入RIDA®CREST在线固相萃取系统并流经黄曲霉毒素免疫亲和小柱,以甲醇-水(45∶55,体积比)为流动相,流速为1.0 mL/min,C18色谱柱(150 mm×3.5 mm,5 μm)分离,光化学衍生,荧光检测器测定。根据3倍信噪比的峰响应值,确定黄曲霉毒素B1,B2,G1,G2的检出限分别为0.08,0.05,0.18,0.08 μg/kg,分别在1~100,0.24~24,0.56~56,0.24~24 μg/kg 范围内呈线性相关,相关系数(r2)分别为0.999 4,0.999 7,0.999 8 和0.999 8;AFT在猪饲料、鸡饲料、宠物饲料和饲料原料4类样品中的加标回收率为72.6%~103%,相对标准偏差为2.5%~4.9%。该方法一次装柱可检测60个样品,液相色谱分析一个样品总的运行时间为15 min,所以1 d可检测70~80个样品,满足饲料中黄曲霉毒素快速高通量准确定量检测的需要。
饲料;黄曲霉毒素;在线免疫亲和柱净化;高效液相色谱
黄曲霉毒素(Aflatoxins,AFT)是黄曲霉(Aspergillus flavus)、寄生曲霉(A.parasiticus)和模式曲霉(A.nomius)等在合适的温度和湿度条件下产生的真菌毒素,对人畜有强烈的致病性、致癌性,是危害最严重的真菌毒素之一,在自然界中广泛存在[1-3]。污染饲料的黄曲霉毒素主要有B1,B2,G1和G2。国内外非常重视黄曲霉毒素的防控,为减少黄曲霉毒素的危害,我国在2001年颁布了《饲料卫生标准》,规定了各类饲料中黄曲霉毒素B1的限量值[4]。
目前AFT的检测方法主要有薄层色谱法[5]、胶体金试纸条法[6]、酶联免疫法或免疫传感器[7]、液相色谱法或液质联用[8-12]等方法。胶体金和酶联免疫方法主要用于快速筛查,液质联用法主要用于多种真菌毒素的同时监测。免疫亲和柱/液相色谱法是目前国际上普遍采用的黄曲霉毒素准确定量和确认方法,针对此方法净化过程操作繁琐、费时费力的问题,已有相关研究提出了离线或在线自动固相萃取的解决方案。1991年Sharman等建立了基于离线免疫亲和柱自动固相萃取装置进行样品净化的食品和饲料中黄曲霉毒素[13]和赭曲霉毒素A[14]的高效液相色谱检测方法,Eskola等[15]建立了离线自动固相萃取高效液相色谱测定谷物中黄曲霉毒素和赭曲霉毒素A的分析方法,Niedwetzki等[16]建立了基于离线自动前处理工作站的谷物和花生酱中黄曲霉毒素的高效液相色谱检测方法。这些离线自动净化方法,提高了检测结果的可比性,节省了时间和人力成本,但样品前处理步骤较为繁琐,免疫亲和柱只能使用一次,离线净化检测耗材成本较高,检测效率仍然较低[17]。2012年,Jinap等尝试通过特殊处理的免疫亲和预柱(2.1 mm I.D.×50 mm)在线净化-柱后溴衍生/高效液相色谱法进行了花生、无花果干、红辣椒粉等样品中4种黄曲霉毒素检测方法验证[18-19],发现在线自动化净化样品显著提高了方法的分析效率和重现性,降低了检测成本。本研究采用全自动在线净化技术,将抗体偶合到耐压聚合物的免疫亲和柱(1 mm I.D.×10 mm),结合RIDA®CREST ICE在线固相萃取装置,建立了在线净化-光化学衍生液相色谱检测饲料中黄曲霉毒素的方法,增加了免疫亲和柱的使用次数,提高了检测的自动化水平,降低了检测成本,并提高了检测效率,可满足大规模样品准确定量的需求。
1 实验部分
1.1 仪器与试剂
Spark通用全自动高效液相色谱(荷兰Spark Holland公司),配RIDA®CREST 在线固相萃取系统、荧光检测器;AflaTest在线固相萃取柱(Immunoprep®Online Aflatoxin,德国拜发公司);光化学衍生器;PL403IC型电子分析天平(梅特勒上海有限公司);Pulverisette14 高速旋转粉碎机(德国Fritsch 公司);离心机;振荡器。
黄曲霉毒素标准品(纯度≥99%,以色列Fermentek 公司),甲醇、乙腈(色谱纯,美国Fisher公司),实验用水为Milli-Q超纯水(美国Millipore公司),乙酸铵、曲拉通X-100(Triton X-100)、氢氧化钠、氯化钠、浓硝酸(分析纯,国药集团化学试剂有限公司)。
1.2 黄曲霉毒素标准溶液的配制
分别准确称取1 mg(精确至0.01 mg)黄曲霉毒素B1,B2,G1和G2标准品于10 mL棕色容量瓶中,用甲醇溶解并定容,配制成100 mg/L的黄曲霉毒素B1,B2,G1和G2标准储备液,于-20 ℃保存。临用前,用储备液稀释成1,5,10,50,100 μg/kg(以B1计,其余3种毒素浓度按B1∶B2∶G1∶G2为25∶6∶14∶6混配)的工作液,备用。考虑到黄曲霉毒素的毒性,建议购买标准母液来稀释配制标准工作溶液。
1.3 样品制备
将猪饲料、鸡饲料、宠物饲料和鱼饲料样品及过夜后的加标样品加5.0 g氯化钠、100 mL提取液,高速振荡提取30 min,静置3~5 min 后,取适量提取液于8 000 r/min离心5 min,上清液转移至试管,用3 g/L Tritox-100稀释10倍后,将稀释液置于进样瓶中以备进样。
1.4 在线固相萃取/高效液相色谱测定条件
色谱条件:Agilent ZORBAX Eclipse Plus C18色谱柱(4.6 mm×150 mm,5 μm);进样量1 000 μL ;流速1.0 mL/min;柱温35 ℃;荧光检测器:激发波长360 nm,发射波长440 nm;流动相为甲醇-水(45∶55)。
在线固相萃取条件:活化液:20 mmol/L 乙酸铵,调至pH 6.8~7.0;淋洗液:含20 mmol/L乙酸铵和25 mmol/L氨基丁三醇的水-甲醇-乙腈溶液(90∶6∶4,体积比),调节pH值至8.3~8.5;洗脱液:含50 mmol/L乙酸铵的水-甲醇-乙腈(62∶26∶12,体积比);黄曲霉毒素免疫亲和柱的活化和平衡体积均为1 000 μL;上样体积为1 000 μL;淋洗体积为6 000 μL;洗脱体积为1 000 μL;在线免疫亲和柱采用活化液进行再生,体积为2 000 μL。
2 结果与讨论
2.1 样品提取液的优化
由于饲料成分较为复杂,考察了甲醇-水(70∶30)、甲醇-水(80∶20)、乙腈-水(80∶20) 3种提取液对饲料中黄曲霉毒素提取效果的影响。采用加标回收方式进行验证,添加20 ng/g标准溶液(以AFB1的量计,其余3种毒素浓度按B1∶B2∶G1∶G2为25∶6∶14∶6混配)于猪饲料、鸡饲料、宠物饲料阳性样品中,分别用3种提取试剂提取,每种提取试剂做6个平行,检测结果见表1。从外观看,乙腈-水混合提取液的颜色较深,经稀释液稀释后颜色变浅;而甲醇-水混合提取液虽然颜色较浅,但在使用0.22 μm PTFE滤膜过滤时有较大的阻力,这可能是由于甲醇-水提取液中含有较多大分子蛋白。从回收率结果来看,4种黄曲霉毒素的回收率均在73.3%~106%之间,且以乙腈-水(80∶20)的提取效果最稳定,回收率最高。因此,选择乙腈-水(80∶20)作为饲料中黄曲霉毒素的提取试剂。
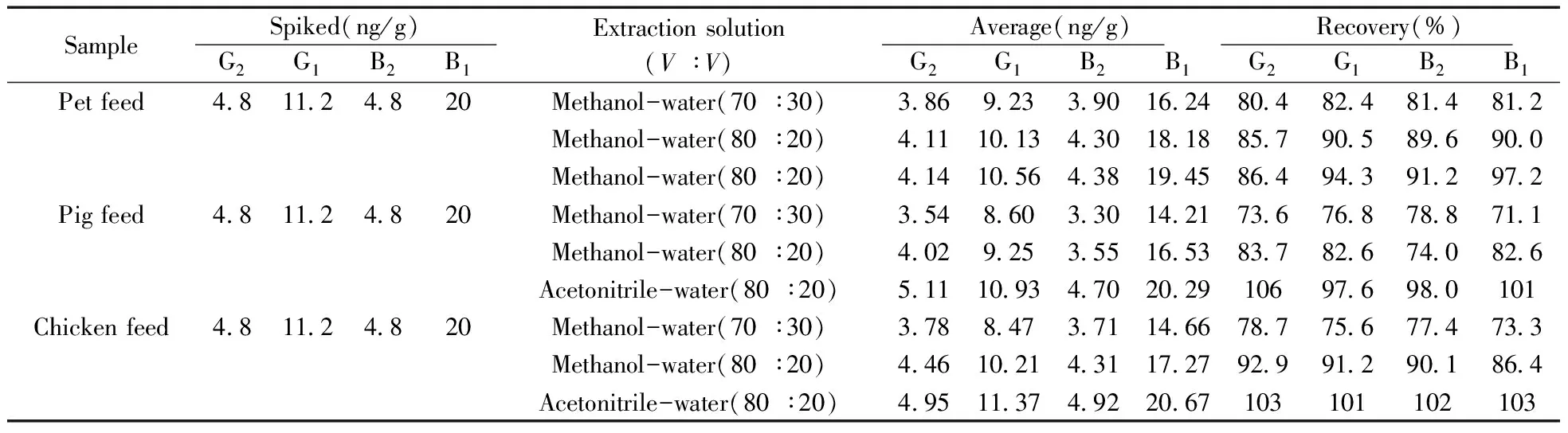
表1 不同提取溶剂的回收率结果(n=6)
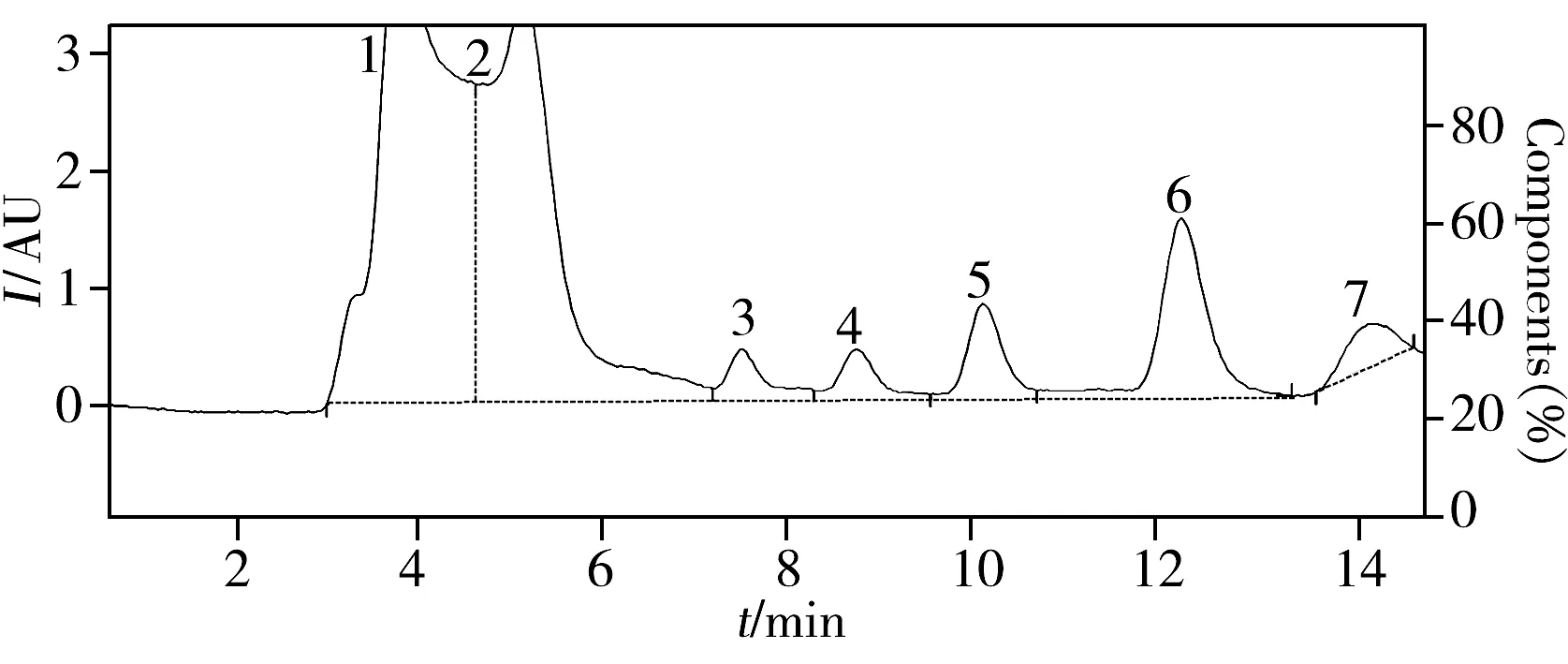
图1 含3 g/L Triton X-100的常用淋洗液条件下饲料样品色谱图Fig.1 Chromatogram of common feed using wash buffer of 3 g/L Triton X-1001,2,7:impurity;3:AFG2;4:AFG1;5:AFB2;6:AFB1
2.2 在线固相萃取系统中淋洗液的优化
RIDA®CREST 在线固相萃取系统常用的淋洗液为20 mmol/L 乙酸铵-甲醇-乙腈溶液(90∶6∶4)。考虑到饲料成分较为复杂,比较了20 mmol/L 乙酸铵-甲醇-乙腈溶液(90∶6∶4)和含3 g/L Triton X-100的20 mmol/L 乙酸铵-甲醇-乙腈溶液(90∶6∶4)两种淋洗液的效果。结果表明,采用不添加Triton X-100的淋洗液,在黄曲霉毒素B1出峰附近有杂质干扰,分离度差,影响定量。而添加表面活化剂Triton X-100后可消除干扰,获得的基线平稳,峰形较好(图1),且添加Triton X-100后不影响对黄曲霉毒素的回收率。因此,本实验选用含3 g/L Triton X-100的20 mmol/L 乙酸铵-甲醇-乙腈溶液(90∶6∶4)作为淋洗液。
2.3 免疫亲和柱重复使用次数的确定
通过阴性饲料样品的加标回收率检测免疫亲和柱的重复使用次数,黄曲霉毒素总加标量为40.8 μg/kg,其浓度比为AFB1∶AFB2∶AFG1∶AFG2=25∶6∶14∶6,经在线黄曲霉毒素免疫亲和柱净化,光化学衍生器衍生后,荧光法检测。进样次数60次。结果显示,4种黄曲霉毒素的回收率均在90%以上,且柱子使用60次后重复性依然满足要求,RSD值均不大于12.1%。同时,该柱在无保护液的情况下,可以连续使用24 h,简化了操作步骤,节省了时间和人力成本。此外,RIDA®CREST在线固相萃取仪可以同步进行两根柱子净化和分析,与常规离线净化每人1 d处理20~30个样品相比,本方法1 d可净化并检测70~80个样品,显著提高了检测效率。
2.4 线性范围与检出限
在上述色谱条件下,分别测定AFB1,AFG1,AFB2和AFG2的系列标准溶液,经在线黄曲霉毒素免疫亲和柱处理,以HPLC测得的峰面积(Y)为纵坐标,相应的质量浓度(X,μg/L)为横坐标绘制标准曲线,根据3倍信噪比的峰响应值计算方法检出限;根据10倍信噪比的峰响应值计算方法定量下限。结果表明,黄曲霉毒素B1,B2,G1,G2分别在1~100,0.24~24,0.56~56,0.24~24 μg/kg范围内呈线性相关,相关系数(r2)分别为0.999 4,0.999 7,0.999 8 和0.999 8,检出限分别为0.08,0.05,0.18,0.08 μg/kg,定量下限分别为0.24,0.15,0.54,0.24 μg/kg。
2.5 精密度与回收率
采用本方法对添加了黄曲霉毒素的猪饲料、鸡饲料和宠物饲料样品进行检测。加标量为20 ng/g(以B1计,其余3种毒素浓度按B1∶B2∶G1∶G2为25∶6∶14∶6混配)的同一批样品重复测7 d,每天测7次,每个浓度做5 个平行样。黄曲霉毒素B1,B2,G1,G2的日内相对标准偏差(RSD)为2.5%~4.9%,日间RSD为3.4%~7.5%,加标回收率为72.6%~103%(表2)。
2.6 在线净化液相色谱法与稳定同位素稀释LC-MS/MS法比较
样品选用FAPAS能力验证的玉米粉,经振荡提取后,一部分滤液用同位素稀释LC-MS/MS法检测;一部分滤液稀释10倍,用在线净化/液相色谱法进行分析,平行测定2次。同位素稀释LC-MS/MS的测定平均值为3 μg/kg,在线净化/液相色谱法的测定平均值为3.03 μg/kg,2种方法的测定结果一致。同时,通过黄曲霉毒素B1定性离子可以判断提取液中目标毒素为黄曲霉毒素B1,说明使用的在线免疫亲和柱专一性符合要求。
2.7 在线净化液相色谱法与离线净化液相色谱法的比较
2.7.1 实际样品检测的比较 为了比较在线IAC净化液相色谱法的准确性,通过在线净化和离线净化两种方法对国家有证标准物质进行提取研究,标准物质的证书编号为GBW(E)100386,AFB1量值为(27±3) μg/kg。3次测定结果取平均值,在线净化法为26.5 μg/kg,离线净化法为27.2 μg/kg,相对标准偏差(RSD)分别为4.7%和3.1%。两种方法测定结果均在量值范围内,且在中值附近,通过t检验,发现两组结果无显著性差异。说明在线净化/液相色谱法准确可靠,可用于饲料样品的检测。
2.7.2 加标回收结果的比较 样品经振荡提取后,一部分滤液采用离线净化/液相色谱法检测;一部分滤液稀释10倍后,采用在线净化/液相色谱法进行分析。采用添加AFT的空白猪饲料样品进行检测,加标量为20 ng/g(以B1计,其余3种毒素浓度按B1∶B2∶G1∶G2为25∶6∶14∶6混配)。重复测定3次,结果见表3。
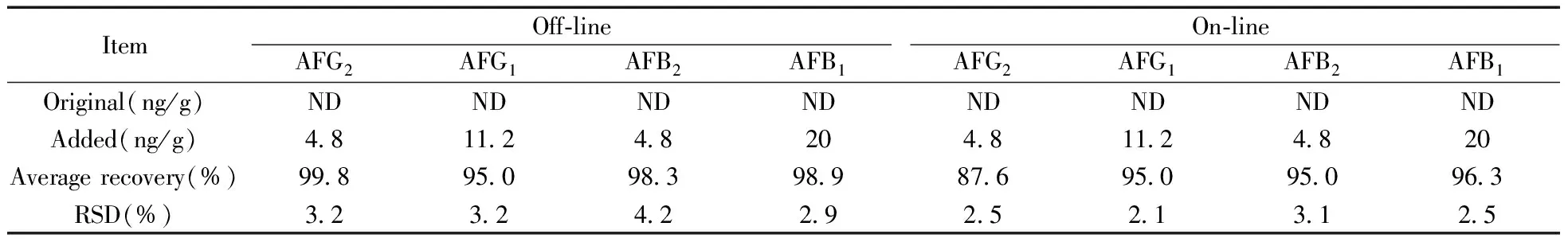
表3 在线净化与离线净化结果比较
从表3可知,黄曲霉毒素免疫亲和在线净化法除了AFG2的回收率低于离线净化的回收率外,其他3种黄曲霉毒素的回收率结果相当,满足GB/T 27404-2008[20]的检测要求。
3 结 论
本文建立了快速测定饲料中黄曲霉毒素B1,B2,G1,G2的在线免疫亲和净化/液相色谱法。黄曲霉毒素B1,B2,G1,G2的检出限分别为0.08,0.05,0.18,0.08 μg/kg,在猪饲料、鸡饲料、宠物饲料和饲料原料4类样品中的加标回收率为72.6%~103%,RSD为2.5%~4.9%。本方法操作简单,灵敏度、准确度、精密度和回收率等均符合检测需要,一次装柱可以检测60个样品,一天可以净化并检测70~80个样品,优于常规离线净化检测方法,检测效率高,适于大批量样品的处理。
[1] Zain M E.J.SaudiChem.Soc.,2011,15(2):129-144.
[2] Lewis L,Onsongo M,Njapau H,Schurz-Rogers H,Luber G,Kieszak S,Nyamongo J,Backer L,Dahiye A M,Misore A,DeCock K,Rubin C.Environ.HealthPerspect.,2005,113(12):1763-1767.
[3] Liu L X,Zhang L,Xiang Y E,Huang Z W,Li H B,Cui J.AnimalHusbandryandFeedScience(刘利晓,张亮,向艳娥,黄志伟,李洪波,崔佳.畜牧与饲料科学),2016,37(3):33-35.
[4] GB 13078-2001.Hygienical Standard for Feed.National Standards of the People's Republic of China(饲料卫生标准.中华人民共和国国家标准).
[5] GB/T 8381-2008.Determination of Aflatoxin B1in Animal Feeding Stuffs-Semi-Quantitative Thin Layer Chromatographic Methods.National Standards of the People's Republic of China(饲料中黄曲霉毒素B1的测定 半定量薄层色谱法.中华人民共和国国家标准).
[6] Wang D,Zhang W,Li P W.Chin.J.OilCropSci.(王督,张文,李培武.中国粮油学报),2014,36(4):529-532.
[7] GB/T 17480-2008.Determination of Aflatoxin B1in Animal Feeding Stuffs-Enzyme-Linked Immunosorbent Assay.National Standards of the People's Republic of China(饲料中黄曲霉毒素B1的测定 酶联免疫吸附法.中华人民共和国国家标准).
[8] GB/T 30955-2014.Determination of Aflatoxin B1,B2,G1,G2Content in Feeds-High Performance Liquid Chromatography with Immunoaffinity Column Clean-up.National Standards of the People's Republic of China(饲料中黄曲霉毒素B1、B2、G1、G2的测定 免疫亲和柱净化/高效液相色谱法.中华人民共和国国家标准).
[9] Wang H,Yang H M,Guo Q L,Zhao L,Shi H L,Pan H M.J.Instrum.Anal.(王浩,杨红梅,郭启雷,赵丽,史海良,潘红梅.分析测试学报),2014,33(8):911-916.
[10] NY/T 2071-2011.Determination of Aflatoxins Zearalenone and T-2 in Feeds-Liquid Chromatography-Tandem Mass Spectrometry.National Standards of the People's Republic of China(饲料中黄曲霉毒素、玉米赤霉烯酮和T-2 毒素的测定 液相色谱-串联质谱法.中华人民共和国国家标准).
[11] Li J,Tian M,Yu Y M,Wang H W,Wei F,Wang X.J.Instrum.Anal.(李军,田苗,于一芒,王宏伟,卫锋,王雄.分析测试学报),2007,26(1):93-96.
[12] Zheng C M,Zhang Y,Wang S X,Xie G,Zhang G M.J.Instrum.Anal.(郑翠梅,张艳,王松雪,谢刚,张广民.分析测试学报),2012,31(4):383-389.
[13] Sharman M,Gilbert J.J.Chromatogr.A,1991,543(1):220-225.
[14] Sharman M,MacDonald S,Gilbert J.J.Chromatogr.A,1992,603(1/2):285-289.
[15] Eskola M,Kokkonen M,Rizzo A.J.Agric.FoodChem.,2002,50(1):41-47.
[16] Niedwetzki G,Lach G.J.Chromatogr.A,1994,661(1/2):175-180.
[18] Jinap S,De Rijk T C,Arzandeh S,Kleijnen H C H,Zomer P,Van der Weg G,Mol J G J.FoodControl,2012,26(1):42-48.
[19] Rhemrev R,Pazdanska M,Marley E.J.AOACInt.,2015,98(6):1585-1590.
[20] GB/T 27404-2008.Criterion on Quality Control of Laboratories-Chemical Testing of Food.National Standards of the People's Republic of China(实验室质量控制规范.中华人民共和国国家标准).
Rapid and High Throughput Analysis of Aflatoxins in Feed Matrix Using On-line Immunoaffinity Column Clean-up and High Performance Liquid Chromatography
LI Li,LI Rui,XIE Gang*,YE Jin,WANG Song-xue
(Academy of State Administration of Grain,Beijing 100037,China)
A rapid analytical method using on-line immunoaffinity column clean-up and high performance liquid chromatography(HPLC) was developed for the determination of aflatoxins(B1,B2,G1,G2) in feed samples.The samples were extracted with acetonitrile-water solution(80∶20,by volumn).The extraction solution was diluted by 10 times using 3 g/L triton X-100 water solution,then injected into the RIDA®CREST on-line immunoaffinity column clean-up system,and washed out with methanol-water(45∶55,by volume) as mobile phase at a flow rate of 1.0 mL/min.Aflatoxins were analyzed by HPLC/FLD with post-column photochemical derivatizaton.The detection limits of AFB1,AFB2,AFG1and AFG2were 0.08,0.05,0.18,0.08 μg/kg,respectively.The linear ranges for AFB1,AFB2,AFG1and AFG2were 1-100,0.24-24,0.56-56,0.24-24 μg/kg,with their correlation coefficients(r2) of 0.999 4,0.999 7,0.999 8 and 0.999 8,respectively.The recoveries for four kinds of feed samples spiked with aflatoxins were in the range of 72.6%-103%,with relative standard deviations of 2.5%-4.9%.Each immunoaffinity colomn could be used for 60 samples cleanup,and the total running time for each HPLC analysis is 15 min,thus 70-80 samples could be detected per day.This method could satisfy the demands for rapid and accurate analysis of aflatoxin in feed.
feed;aflatoxins;on-line immunoaffinity column clean-up;high performance liquid chromatography(HPLC)
2016-12-07;
2017-02-22
粮食公益性行业科研专项(201313005)
10.3969/j.issn.1004-4957.2017.06.017
O657.72;S852.44
A
1004-4957(2017)06-0800-05
*通讯作者:谢 刚,硕士,副研究员,研究方向:粮油质量安全检测与控制,Tel:010-58523613,E-mail:xg@chinagrain.org
