基于碳量子点光活性模拟酶性能灵敏检测焦磷酸根离子
2017-06-29李小琴曹根霞王光丽
李小琴,袁 芳,曹根霞,王光丽
(江南大学 化学与材料工程学院,江苏 无锡 214122)
基于碳量子点光活性模拟酶性能灵敏检测焦磷酸根离子
李小琴,袁 芳,曹根霞,王光丽*
(江南大学 化学与材料工程学院,江苏 无锡 214122)
利用简单的水热法合成了具有良好水溶性、优良光活性模拟酶性质的碳量子点(CDs),该量子点在可见光照(λ≥400 nm)下可以催化氧化辣根过氧化物酶(HRP)的特征底物 3,3',5,5'-四甲基联苯(TMB),生成与HRP催化氧化相同的产物。铜离子可与CDs发生配位作用,使CDs聚集光诱导模拟酶的活性降低;焦磷酸根(ppi)存在时,铜离子与ppi配位生成Cu2+-ppi复合物,从而使CDs分散模拟酶活性恢复。利用这一现象建立了一种比色检测ppi的方法,在最佳条件下,检测信号与ppi的浓度之间存在良好的线性关系,其线性范围为1.0×10-6~5.0×10-3mol/L,检出限为2.5×10-7mol/L。将该方法应用于健康人血浆中ppi的检测,ppi的回收率为97.4%~104.8%,研究表明该比色传感器可用于人血浆中ppi的检测。
碳量子点;模拟酶;比色法;焦磷酸根离子
焦磷酸根(ppi)在许多生命活动过程如细胞新陈代谢、DNA聚合和一些酶促反应中扮演关键角色[1]。研究表明,ppi在关节炎的病理过程中起着很重要的作用,可以作为一个潜在的生物标记物用于关节炎疾病的临床诊断和治疗[2]。此外,ppi还用于食品添加剂中[3]。因此,建立快速、简便、选择性好的ppi测定方法具有十分重要的意义。目前,检测ppi的方法有荧光光度法[4]、电化学方法[5]、比色法[6]等。其中电化学方法准确度高、选择性好,但重现性较差;而荧光光度法需使用较复杂的仪器。与其他方法相比,比色分析法因简单易行、重复性好而在化学分析中得到广泛应用[6]。但当前的比色法存在灵敏度低以及干扰严重等现象。所以,发展简便、灵敏地检测ppi的方法仍具有重要意义。
天然酶具有底物特异性好、催化活性高等显著优点,但其提取成本较高,易变性失活,价格昂贵,这些因素极大地限制了其应用。因此,以纳米材料为模拟酶的研究引起了越来越多的关注。与天然酶相比,基于纳米结构的模拟酶成本低、催化活性高且耐受更苛刻的环境,具有很好的应用前景[7]。但是大部分基于纳米材料的过氧化物模拟酶均需使用大量具有破坏性的过氧化氢(H2O2),这使其在生物分析领域受到较大限制。本课题组研究发现通过光照可使纳米材料表现模拟酶活性,从而为模拟酶的应用提供了一种新的方法[8-9]。
碳量子点(CDs)是一种新型的纳米材料,具有较高的光稳定性、低毒性、良好的生物相容性,在生物成像、传感器及等方面具有潜在的应用前景[10-11]。本文采用简单的水热法合成了粒径为2~3 nm的CDs,发现其在可见光(λ≥400 nm)下有较强的模拟酶活性,可以催化氧化典型底物 3,3',5,5'-四甲基联苯(TMB)显色;铜离子与CDs发生配位作用[12]使其光催化模拟酶活性减弱;在ppi存在下,铜离子与ppi发生配位作用形成Cu2+-ppi复合物[13-14]使得CDs的模拟酶活性恢复。基于此,建立了一种ppi的检测方法。该方法具有灵敏度高、选择性好、操作简便、检测快速、成本低等优点。
1 实验部分
1.1 仪器与试剂
荧光分光光度计(美国瓦里安有限公司),TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),JEOL JEM-2100型透射电子显微镜(日本Hitachi公司),D8型X射线衍射仪(德国布鲁克AXS有限公司),FTLA 2000-104型红外光谱仪(加拿大ABB Bomem有限公司),CEL-S5001350氙灯光源(北京中教金源科技有限公司),CHI 800C型电化学工作站(上海辰华仪器有限公司)。
3,3',5,5'-四甲基联苯(TMB)、碘化钾、乙二胺四乙酸(EDTA)、 抗坏血酸(AA)、异丙醇(IPA)、叔丁醇(TBA)、乙醇、色氨酸(L-Try)、半胱氨酸(L-Cys)、醋酸钠、醋酸、焦磷酸钠(Na4P2O7·10H2O)、硫酸铜、二氯甲烷、溴化钠、氟化钠、硫酸钠、亚硫酸钠等均购于国药化学试剂有限公司。人血浆(江南大学医务室)。超氧化物歧化酶(SOD)、辣根过氧化物酶(HRP)购自Aladdin公司。氧化铟锡(ITO)导电玻璃购自深圳南玻显示器件有限公司。所有试剂均为分析纯。实验所用缓冲液为0.2 mol/L的醋酸缓冲溶液,实验用水为超纯水。
1.2 碳点的制备
参照文献[15]采用水热法合成CDs,在100 mL烧杯中,加入25 mL水、1.1 g AA以及25 mL乙醇,在不断搅拌下形成均匀溶液。取25 mL混合物加至反应釜中,在180 ℃下加热4 h,自然冷却至室温,得深褐色溶液,用二氯甲烷(CH2Cl2)萃取后,透析袋透析2 d,得到黄色水溶性的CDs。
1.3 光诱导CDs模拟酶性质研究及其比色法检测ppi离子
可见光诱导CDs 模拟酶活性的研究:在离心管中加入200 μL pH 3.0 的HAc-NaAc缓冲、50 μL CDs,然后加入100 μL 0.5 mmol/L TMB溶液,并加水稀释至 1.0 mL,溶液混合均匀后置于氙灯(λ≥400 nm)下照射15 min,在紫外可见分光光度计上测定 652 nm处的吸光度。
可见光诱导CDs模拟酶动力学的研究:在离心管内加入 200 μL的HAc-NaAc缓冲(pH 3.0)、50 μL CDs和不同浓度的TMB(20~500 μmol/L),加水稀释至 1.0 mL。溶液混合均匀后置于氙灯(λ≥400 nm)下照射,于 652 nm 处每隔 1 min 测定反应体系的吸光度值。通过米氏方程计算反应动力学参数。
ppi的检测:在离心管中加入200 μL的HAc-NaAc(pH 3.0)缓冲溶液,50 μL CDs,1.0×10-5mol/L的铜离子,反应10 min后加入不同浓度的ppi以及100 μL 0.5 mmol/L 的TMB,并加水稀释至1.0 mL,在40 ℃下氙灯(λ≥400 nm)照射15 min后,于紫外可见分光光度计上测定 652 nm 处的吸光度。
2 结果与讨论
2.1 CDs的表征


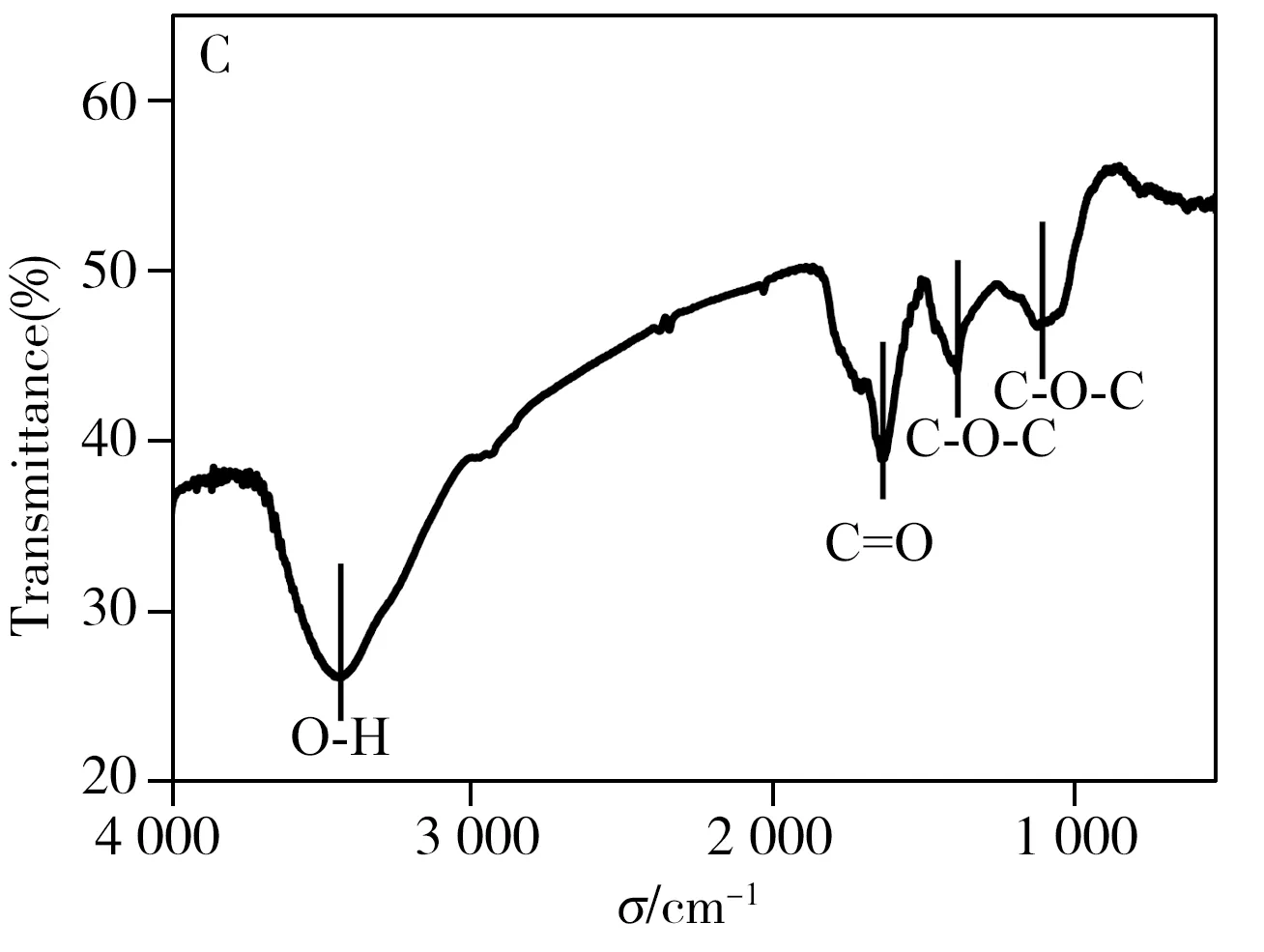
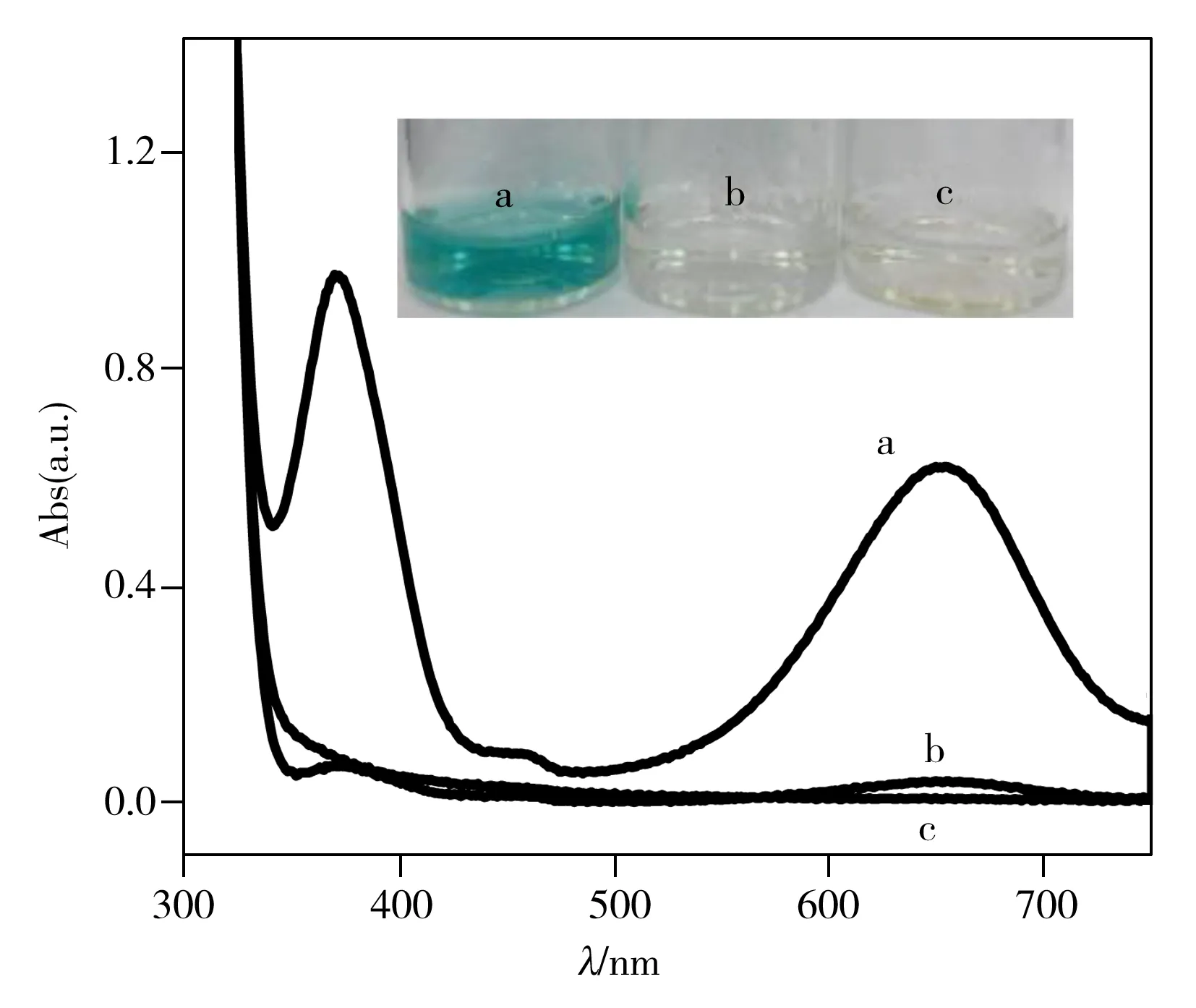
图2 不同溶液的紫外可见吸收图Fig.2 UV-Vis spectra of different solutionsa.CDs+TMB+visible light,b.TMB+visible light,c.CDs+TMB;inset image is the corresponding color of the above solutions
2.2 光诱导CDs的模拟酶活性
为了探究 CDs的模拟酶活性,选择TMB 为显色底物,这种底物通常作为研究模拟酶活性的特征底物。为了避免紫外光直接光氧化TMB,选择可见光研究CDs的催化活性。如图2曲线b所示,单独可见光(λ≥400 nm)的光照不会引起TMB 的氧化,而在无光照的条件下,CDs也不会催化氧化TMB(如图2曲线c),但在光照条件下,CDs氧化TMB 的效果大大提升(图2曲线a)。CDs加入TMB 溶液,用可见光光照 15 min后溶液变为蓝色,氧化的TMB在652 nm处和370 nm处有特征吸收峰出现。证明了CDs具有类似天然辣根过氧化物酶(HRP)的活性。HRP可以催化 H2O2氧化TMB的反应。光诱导CDs模拟酶不需要 H2O2,表明光诱导CDs比天然酶和其他纳米材料模拟酶更加环保和更具生物兼容性。
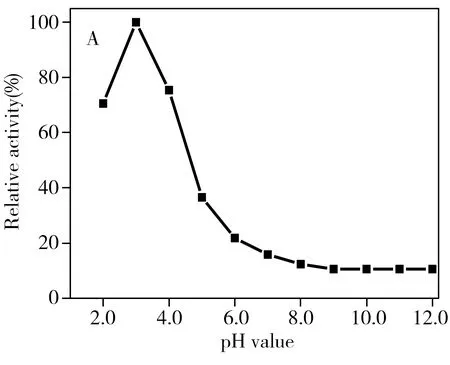
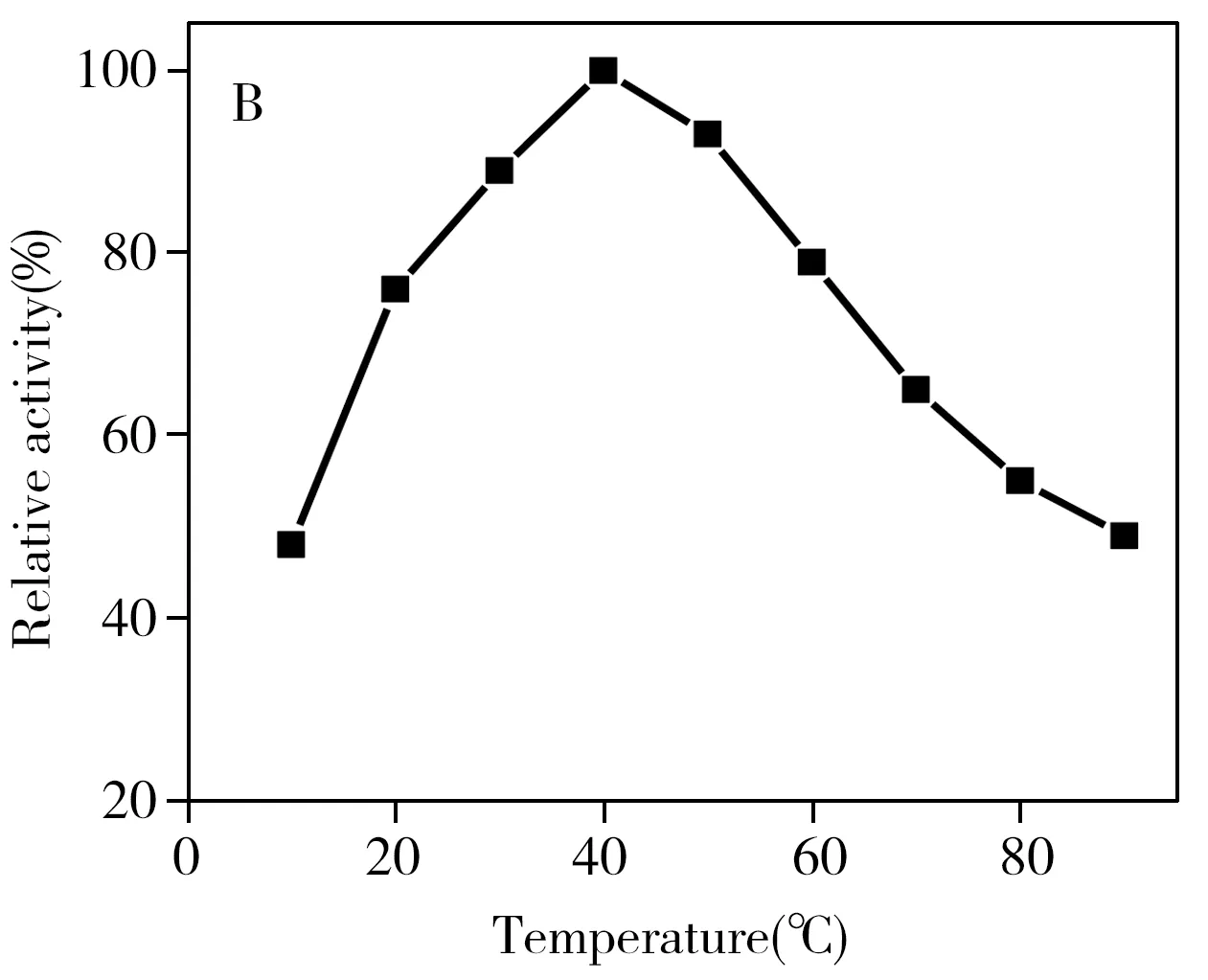
图3 pH值(A)和温度(B)对CDs 光活性模拟酶的影响Fig.3 Relative catalytic activity of CDs under visible light irradiation with pH value(A) and temperature(B)
2.3 实验条件的优化
与天然酶HRP类似,光诱导 CDs的模拟酶催化活性受溶液 pH值和温度的影响。因此,本实验分别在温度 10~90 ℃和 pH 2.0~12.0范围内测量其相对催化活性。由图3可看出,CDs在较宽的温度和pH值范围内均具有较高的催化活性,其中以在pH 3.0、温度为 40 ℃时的催化活性效果最佳。此最优条件和其它纳米材料和天然酶催化的最优条件类似[8]。而CDs模拟酶在低pH值和高温度时的活性较好,也表明该CDs的模拟酶性质比较稳定。
2.4 光诱导CDs模拟酶活性的动力学研究
为进一步了解CDs光催化模拟酶的活性,探究了CDs模拟酶的动力学参数。米氏动力学常数(Km)表示酶对于底物的亲和能力,Km值越小,说明酶和底物的结合能力越强。Km可以通过 Lineweaver-Burk 曲线:1/υ=Km/υmax×1/[S]+1/υmax获得,其中,υ,υmax,[S]和Km分别代表反应速率、最大反应速率、底物浓度和米氏常数。以TMB为底物,研究了CDs对其的亲和能力。通过CDs在不同浓度TMB下的吸光度变化得到 Michaelis-Menten曲线。在最优条件下,得到CDs对底物TMB的υmax=137.7 nmol/L·s-1,Km=76.1 μmol/L。与天然酶HRP相比,CDs的Km值比HRP(Km=434 μmol/L)[19]的低很多,表明光诱导CDs与TMB的亲和力比HRP强。CDs 的υmax值较 HRP(10 nmol/L·s-1)的值更大,说明 CDs 的催化反应速度比天然酶更快,催化所需的时间更短、效率更高,CDs模拟酶在反应速度及亲和性上比天然酶有更大的优势。
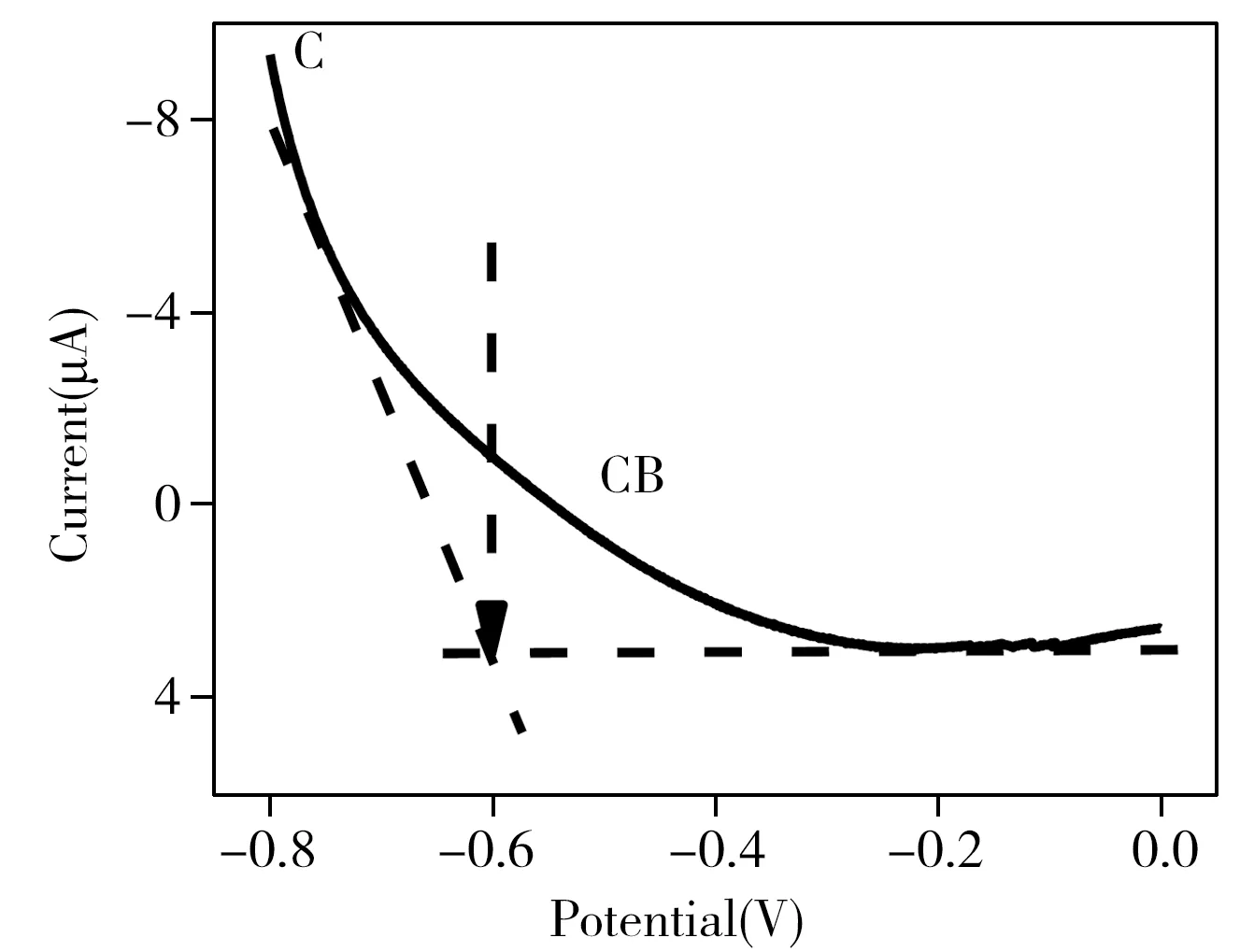
2.5 光诱导CDs模拟酶的产生机理
2.6 比色法检测焦磷酸根(ppi)
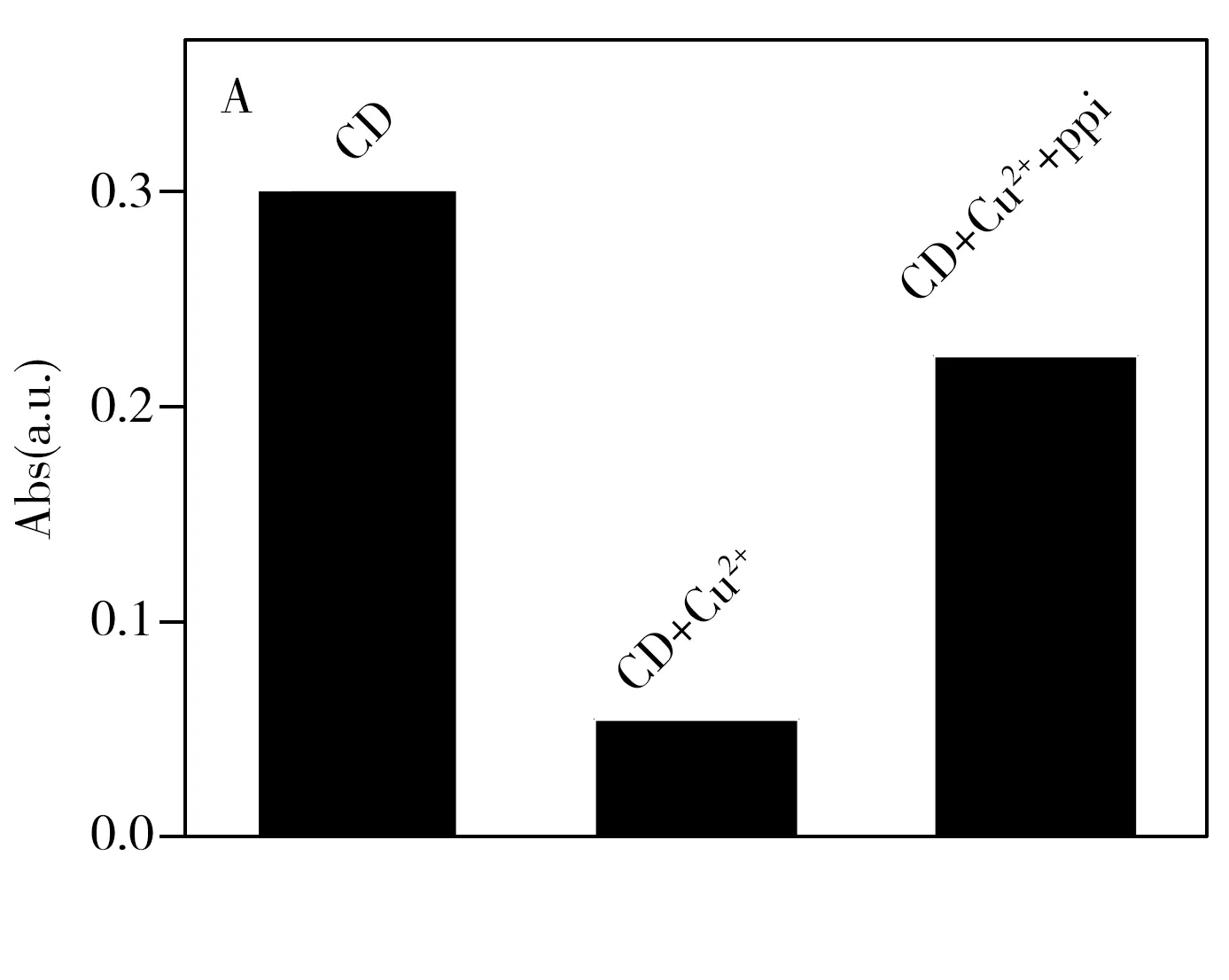
实验发现,铜离子可以抑制CDs光催化模拟酶的活性,加入ppi后模拟酶的活性恢复如图5A所示。因为铜离子与CDs发生配位作用,使得CDs聚集模拟酶的活性降低,ppi存在时,铜离子与ppi发生配位作用生成Cu2+-ppi复合物,CDs分散模拟酶的活性恢复。在最优条件下,对不同浓度的ppi进行了测定。由图5B可知,随着ppi浓度的增加,吸光度增强。吸光度A0为加入铜离子后CDs光照射下催化氧化TMB的吸光度,吸光度A为加入ppi后CDs光催化模拟酶活性恢复后催化氧化TMB后的吸光度。吸光度差值与ppi浓度在1.0×10-6~5.0×10-3mol/L范围内存在良好的线性关系,其检出限(S/N=3)为 2.5×10-7mol/L。本文建立的比色方法简便快捷,无需复杂仪器,耗时短,碳材料无毒,且具有良好的生物相容性,所需要的催化条件比HRP和其他过氧化物模拟酶更加温和(即不需要破坏性的过氧化氢)[25]。由于目前检测ppi 的方法中,电化学法重现性较差[5],荧光光度法需复杂的仪器[4],指示剂置换比色法的检出限高[26],拉曼光谱法需复杂仪器且检出限高[27]。因此,本方法具有较好的优势。

2.7 方法的选择性
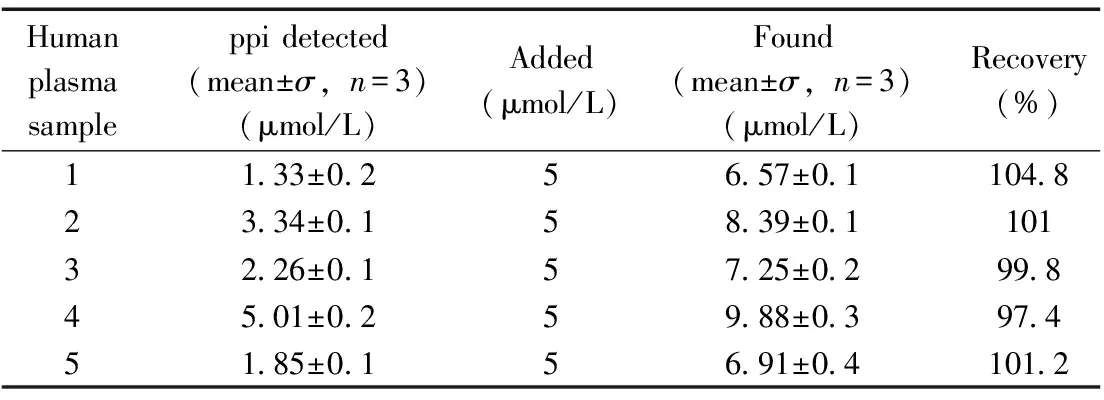
表1 人血浆样品中ppi的分析结果
2.8 人血浆中焦磷酸根离子的测定
采用本方法测定健康人血浆中ppi含量。通过离心(10 000 r/min,20 min)血浆样品除去血浆中可能存在的蛋白质对焦磷酸根测定的影响。测定结果如表1所示,健康人血浆中的ppi浓度为1.33~5.01 μmol/L,ppi的回收率为97.4%~104.8%,检测结果与文献报道的血浆中ppi含量结果(1.4~4.7 μmol/L)一致[28],表明方法具有可行性,可用于检测人血浆中的ppi。
3 结 论
本文采用一种简单的水热法合成了在可见光照下具有模拟酶催化活性的CDs,利用铜离子与ppi的配位作用比铜离子与CDs的作用强,使得CDs的光催化模拟酶活性先抑制后恢复,实现了ppi的快速、灵敏、选择性检测。该比色法具有检出限低、线性范围宽、操作简便、成本低等优点。
[1] Steinberg K M,Okbu D T,Zwick M E.Anal.Chem.,2008,80(3):520-528.
[2] Terkeltaub R A.Am.J.Physiol.CellPhysiol.,2001,281(1):C1-C11.
[3] Li C P,Ibrahim H R,Sugimoto Y,Hatta H,Aoki T.J.Agric.FoodChem.,2004,52(18):5752-5758.
[4] Su X,Zhang C,Xiao X J,Xu A Q,Xu Z D,Zhao M P.Chem.Commun.,2013,49(8):798-800.
[5] Anzenbacher P,Palacios M A,Jursikova K,Marquez M.Org.Lett.,2005,7(22):5027-5030.
[6] Quinlan E,Matthews S E,Gunnlaugsson T.J.Org.Chem.,2007,72(20):7497-7503.
[7] Fu X M,Liu Z J,Cai S X,Li P,Li Y T,Chen J H.J.Instrum.Anal.(傅贤明,刘智晶,蔡淑贤,李萍,李云腾,陈敬华.分析测试学报),2016,35(4):426-431.
[8] Jin L Y,Dong Y M,Wu X M,Cao G X,Wang G L.Anal.Chem.,2015,87(20):10429-10436.
[9] Cao G X,Wu X M,Dong Y M,Li A J,Wang G L.Microchim.Acta,2016,183(1):441-448.
[10] Wang L P,Ma Y J,Zhou X H,Liu Y,Wu R D.J.Mater.Eng.(王林鹏,马玉洁,周学华,刘云,武瑞东.材料工程),2015,43(5):101-112.
[11] Tao H L,Sun C,Liao X F,Xu M Z,Wang H Y,Yi Z S,Qin H W.J.Instrum.Anal.(陶慧林,孙超,廖秀芬,徐铭泽,王海洋,易忠胜,覃宏伟.分析测试学报),2015,34(2):177-182.
[12] Zhou Q,Lin Y X,Xu M D,Gao Z Q,Yang H H,Tang D P.Anal.Chem.,2016,88(17):8886-8892.
[13] Sun J,Wang B,Zhao X,Li Z J,Yang X R.Anal.Chem.,2016,88(2):1355-1361.
[14] Sun J,Yang F,Zhao D,Yang X R.Anal.Chem.,2014,86(15):7883-7889.
[15] Zhang B,Liu C Y,Liu Y.Eur.J.Inorg.Chem.,2010,2010(28):4411-4414.
[16] Qian Z S,Chai L J,Zhou Q,Huang Y Y,Tang C,Chen J R,Feng H.Anal.Chem.,2015,87(14):7332-7339.[17] Deng J H,Lu Q J,Hou Y X,Liu M L,Li H T,Zhang Y Y,Yao S Z.Anal.Chem.,2015,87(4):2195-2203.
[18] Gao X,Ding C Q,Zhu A W,Tian Y.Anal.Chem.,2014,86(14):7071-7078.
[19] Song Y J,Qu K G,Zhao C,Ren J S,Qu X G.Adv.Mater.,2010,22(19):2206-2210.
[20] An C H,Wang J Z,Qin C,Jiang W,Wang S T,Li Y,Zhang Q H.J.Mater.Chem.,2012,22(26):13153-13158.[21] Wang W,Jiang X P,Chen K Z.Chem.Commun.,2012,48(58):7289-7291.
[22] Feng S,Xu H,Liu L,Song Y H,Li H M,Xu Y G,Xia J X,Yin S,Yan J.ColloidsSurf.A,2012,410(20):23-30.[23] Wang X,Mao W W,Zhang J,Han Y M,Quan C Y,Zhang Q X,Yang T,Yang J P,Li X,Huang W.J.ColloidInterfaceSci.,2015,448:17-23.
[24] Marquez L A,Dunford H B.Biochemistry,1997,36(31):9349-9355.
[25] Zhang L N,Deng H H,Lin F L,Weng S H,Liu A L,Lin X H,Xia X H,Chen W.Anal.Chem.,2014,86(5):2711-2718.
[26] Yue P,Fu X H.Chem.Bioeng.(岳攀,扶雄辉.化学与生物工程),2016,33(4):59-61.
[27] Wu H D,Zhao L,Yin Y,Wang L Z,Sun K.Chin.J.Anal.Lab.(吴洪达,赵略,殷宇,王令兆,孙阔.分析试验室),2013,4(32):70-75.
[28] Li F,Liu Y T,Zhuang M,Zhang H L,Liu X Y,Cui H.ACSAppl.Mater.Interfaces,2014,6(20):18104-18111.
Sensitive Detection of Pyrophosphate Using a Novel Colorimetric Sensor Based on Carbon Quantum Dots Photocatalytic Mimic Enzyme Activity
LI Xiao-qin,YUAN Fang,CAO Gen-xia,WANG Guang-li*
(College of Chemistry and Material Engineering,Jiangnan University,Wuxi 214122,China)
The highly solubile and photocatalytic carbon quantum dots(CDs) were prepared by a one-pot hydrothermal method.The CDs could oxidize the typical substrate of 3,3',5,5'-tetramethylbenzidine(TMB) of the horseradish peroxidase(HRP) under visible light(λ≥400 nm) irradiation causing the color signal.In this assay,the interaction between copper ion and CDs will suppress the oxidase mimicking activity of CDs.Upon introduction of target pyrophosphate ions(ppi) into the detection system,the Cu2+-ppi complexes were forming on the basis of the coordination reaction between copper ion and inorganic pyrophosphate ions,thus the oxidase mimicking activity of released CDs was recovered.Based on this characteristic,a colorimetric sensor for the ppi detection was designed.Under the optimal conditions,the obtained colorimetric signal showed a linear response to ppi within a dynamic range of 1.0×10-6-5.0×10-3mol/L with a detection limit(LOD) of 2.5×10-7mol/L.The method was applied in the determination of ppi in human plasma samples,with recoveries of 97.4%-104.8%.The results showed that the colorimetric sensor could be used to detect ppi in human plasma samples.
carbon quantum dots;enzyme mimetics;colorimetry;pyrophosphate ion
2016-12-04;
2017-02-23
国家自然科学基金项目(21275065,21575052)
10.3969/j.issn.1004-4957.2017.06.016
O657.3;P578.92
A
1004-4957(2017)06-0794-06
*通讯作者:王光丽,博士,副教授,研究方向:纳米分析化学,Tel:0510-85917090,E-mail:glwang@jiangnan.edu.cn
