葡萄球菌核酸酶样结构蛋白1在应激刺激下与T细胞胞内抗原1共同参与应激颗粒聚集
2017-06-29邵洁张兵兵赵猛周云丽任丽
邵洁,张兵兵,赵猛,周云丽,任丽
葡萄球菌核酸酶样结构蛋白1在应激刺激下与T细胞胞内抗原1共同参与应激颗粒聚集
邵洁,张兵兵,赵猛,周云丽,任丽△
目的探讨葡萄球菌核酸酶样结构蛋白1(SND1)在应激刺激下如何与T细胞胞内抗原1(TIA-1)共同参与应激颗粒(SG)的聚集以及如何调节应激反应。方法利用免疫荧光实验和激光共聚焦显微镜观察HeLa细胞中的SND1蛋白与TIA-1蛋白在应激刺激下是否形成共定位颗粒,并利用绿色荧光蛋白载体过表达质粒转染HeLa细胞进行外源蛋白表达,从而确定在应激刺激下SND1蛋白与TIA-1结合的结构域。利用RNA干扰技术敲除HeLa细胞中SND1蛋白表达并利用Western Blotting检测蛋白表达水平,从而观察SND1低表达是否对TIA-1聚集形成SG产生影响。利用不同热休克刺激时间观察SND1与TIA-1的聚集过程是否存在动态变化。结果SND1蛋白在应激刺激下与TIA-1蛋白结合共同参与SG聚集,其主要作用结构域为葡萄球菌核酸酶结构域(SN domain)。SND1低表达不会抑制TIA-1聚集到SG,但会减少SG的数量。在不同热休克刺激时间下,SND1聚集到SG的运输过程滞后于TIA-1。结论SND1蛋白在应激刺激下与TIA-1蛋白共同参与SG的聚集,从而调节细胞应激反应。
应激;RNA干扰;葡萄球菌核酸酶样结构蛋白1;T细胞胞内抗原1;应激颗粒
真核细胞在受到应激刺激时会启动细胞的保护机制,聚集可调节细胞功能的蛋白形成应激颗粒(SG)。SG的成分包括未被翻译的mRNA、翻译起始因子、核糖体、RNA结合蛋白等[1]。SG的主要功能
被认为是抑制mRNA的翻译,同时选择性地合成生存急需蛋白,从而保护细胞免受应激侵害[2]。本课题组前期研究发现葡萄球菌核酸酶样结构蛋白1(SND1)可与Ras-GAP SH3结构域结合蛋白(G3BP)结合从而参与SG形成,并调节细胞应激反应[3]。另有研究表明SND1作为含有多聚A尾mRNA的结合蛋白参与mRNAs的代谢与穿梭[4],而SND1在参与应激反应时其103位的苏氨酸会被磷酸化修饰[5],但其对抗应激刺激的具体机制尚未阐明。T细胞胞内抗原1(TIA-1)是参与SG聚集、结合多聚A尾mRNA的RNA结合蛋白[6-7]。TIA-1是RNA识别模序类家族成员,在稳定状态下会富集于细胞核内,同时也会在某些生理状态下穿梭于胞核与胞质之间[7],并且TIA-1是SG的标志蛋白,其朊病毒样结构域(PRD)具有自我聚集功能,可促进SG中的RNA结合蛋白聚集[6]。本研究旨在探讨SND1蛋白如何通过与TIA-1结合参与应激反应,从而为今后研究细胞应激反应等保护机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系与过表达质粒 HeLa细胞由芬兰坦佩雷大学医学技术研究所分子免疫学实验室惠赠。绿色荧光蛋白载体过表达质粒包括pEGFP-SND1全长蛋白、pEGFP-SN片段、pEGFP-TSN片段,均为天津医科大学基础医学院免疫学教研室构建。
1.1.2 主要试剂及仪器 抗SND1抗体(鼠源,多克隆抗体)、抗α-Tubulin抗体(兔源,多克隆抗体)、Texas Red-596标记的抗羊荧光二抗(兔源,多克隆抗体)、Alexa Flour-488标记的抗鼠荧光二抗(兔源,多克隆抗体)购自Abcam公司。抗SND1抗体(羊源,多克隆抗体)、抗TIA-1抗体(羊源,多克隆抗体)购自Santa Cruz公司。辣根过氧化物酶标记的抗鼠源、抗羊源、抗兔源的IgG二抗购自晶美公司。Lipofectamine 2000转染试剂盒购自美国Invitrogen公司。亚砷酸钠(Arsenite Sodium)购自美国Sigma公司。小干扰RNA序列,包括乱序siRNA(Scramble siRNA)和siRNA-SND1由美国Invitrogen公司设计并合成。激光共聚焦显微镜(FV1000,日本Olympus公司)。
1.2 方法
1.2.1 应激刺激实验 培养HeLa细胞,在细胞处于对数生长期时将HeLa细胞分别接种到3个90 mm培养皿中,分为A、B、C组,A组即正常对照组,37℃培养;B组以45℃-45 min刺激;C组为亚砷酸钠0.5 mmol/L-1 h刺激,即培养基中加入亚砷酸钠至终浓度为0.5 mmol/L。按以上刺激条件对细胞进行应激刺激,由于TIA-1是SG的标志蛋白,所以SG形成标准为:HeLa细胞经过抗TIA-1抗体染色后,在显微镜下能观察到TIA-1呈阳性表达的红色荧光颗粒即为SG。
1.2.2 免疫荧光和激光共聚焦实验 对经过以上刺激条件
的HeLa细胞进行免疫荧光抗体染色。首先用4%多聚甲醛-PBS溶液对细胞进行固定,再加0.2%TritonX-100-PBS溶液对细胞透化处理,并用0.2%BSA-PBS溶液封闭细胞之后进行抗体孵育:加一抗anti-TIA-1羊源(1∶200)在水平摇床上4℃摇16 h,之后加德克萨斯红(Texas Red)抗羊二抗荧光抗体(1∶500)在水平摇床上室温摇1 h。再加一抗anti-SND1鼠源(1∶50)和阿莱克斯荧光(Alexa Flour)488抗鼠二抗荧光抗体(1∶500),方法同前。最后用DAPI溶液进行核染色,标本用激光共聚焦显微镜观察并收集图片,100×放大物镜。结果图片用Image J 1.48u图像处理软件编辑和整理。红色图片是细胞中的TIA-1的表达与定位,绿色图片是SND1的表达与定位,处理后可观察两蛋白细胞内共定位(即绿色与红色重叠的黄色图片)。
1.2.3 免疫共沉淀(Co-Immunoprecipitation,Co-IP)实验 培养HeLa细胞,设置A、B、C 3组,3组细胞的处理条件同方法1.2.1,进行应激刺激后裂解HeLa细胞,每个培养皿加细胞裂解液,冰上作用30 min,之后采用超声破碎法裂解细胞,离心,收集上清获全细胞裂解液;BCA法测定总蛋白浓度,并取出3组各自的全细胞裂解液样本的10%作为Input(阳性对照)。再将每组全细胞裂解液混匀后按体积均分3份,每份样本分别加入抗 SND1抗体(1∶500)、抗 TIA-1抗体(1∶200)和IgG抗体(作为阴性对照)以及琼脂糖4B磁珠,在4℃水平摇床作用16 h后离心,收集磁珠后得到蛋白复合物样本,进行蛋白免疫印迹实验。
1.2.4 蛋白免疫印迹实验(Western Blotting) 将Co-IP方法得到的蛋白复合物在4%SDS-PAGE浓缩凝胶和10%SDSPAGE分离凝胶进行凝胶分离蛋白。电泳结束后将凝胶在250 mA、90 min条件下电转到PVDF膜上,牛奶常温封闭1 h,TBST冲洗,裁剪目的条带SND1和TIA-1,分别置于抗SND1抗体(1∶2 000)和抗 TIA-1抗体(1∶1 000)以及抗 α-Tubulin(1∶5 000)抗体中4℃孵育过夜。而后将PVDF膜置于二抗(1∶5 000)孵育液中1 h,最后用ECL发光底物显色阳性蛋白条带。
1.2.5 pEGFP过表达质粒和小干扰RNA转染实验 培养HeLa细胞,对数生长期时将细胞接种于6 cm培养皿中,饥饿过夜。取3份同样的10 μL Lipofectamine 2000分别加入3份200 μL无血清培养基中孵育10 min。再将过表达质粒pEGFP-SND1全长蛋白、pEGFP-SN和pEGFP-TSN片段各取10 μL,分别加入3份200 μL无血清培养基中孵育10 min。之后将1份Lipofectamine 2000混合物与pEGFP-SND1全长蛋白质粒混合物再孵育20 min,另2个质粒混合物依此同法。最后将3种质粒混合物缓慢滴加于3组细胞中,边滴加边混匀,培养24~48 h后观察转染效率。小干扰RNA转染的方法同质粒转染。Scramble siRNA序列为5′-GACTTCATAAGGCGCATGC-3′(作为阴性对照,不敲除SND1的表达),SND1-siRNA 序列为 5′-AAGGCATGAGAGCTAATAATC-3′,并利用Western Blotting检测SND1是否被敲除。
2 结果
2.1 SND1与TIA-1在应激刺激下可以形成细胞内共定位颗粒 激光共聚焦显微镜下可见,SND1在应激刺激下与TIA-1可形成细胞内共定位颗粒。A组显示SND1与TIA-1弥散、均匀地分布于细胞内,无共定位颗粒出现。B组和C组可见SND1与TIA-1聚集于同一颗粒中,这些颗粒即为SG,见图1。

Fig.1 SND1 co-localized with TIA-1 on stress granules under stress condition(scale bar 10 μm)图1 SND1在应激刺激下与TIA-1形成共定位颗粒(比例尺 10 μm)

Fig.2 SND1 interacted with TIA-1 weakly under stress stimuli图2 SND1在应激刺激下与TIA-1有微弱的蛋白结合作用
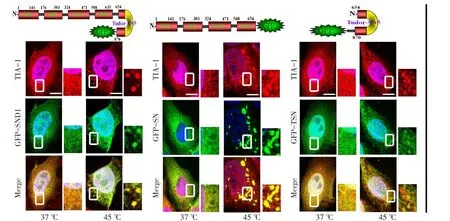
Fig.3 SN domain of SND1 associated with TIA-1 under stress stimuli(scale bar 10 μm)图3 SN结构域是SND1在应激刺激下与TIA-1相互作用结构域(比例尺10 μm)
2.2 SND1蛋白与TIA-1在应激刺激下可形成微弱的Co-IP结合 Co-IP结果显示,A组培养条件下得到的蛋白复合物中几乎检测不到SND1和TIA-1的结合作用。而在B组和C组培养条件刺激下,Co-IP所得到的蛋白复合物中能检测到两者微弱的结合作用,见图2。
2.3 SND1在应激刺激下通过其SN结构域与TIA-1产生细胞内共定位 不同蛋白片段与TIA-1的蛋白定位情况有所不同,pEGFP-SND1、pEGFP-SN过表达蛋白均可与TIA-1形成共定位颗粒,但pEGFP-TSN过表达蛋白不能与TIA-1形成共定位颗粒,见图3。
2.4 敲除HeLa细胞内源性SND1蛋白的表达 转染了SND1-siRNA的HeLa细胞被敲除了SND1表达。转染了SND1-siRNA的HeLa细胞,SND1表达降低,而转染了Scramble siRNA的HeLa细胞并没有影响SND1表达量,同时以TIA-1以及α-tubulin的表达作为参照蛋白,见图4。
2.5 敲除SND1表达未抑制TIA-1的聚集但会影响SG的大小和数量 敲除HeLa细胞的SND1蛋白表达后,免疫荧光结果显示SND1低表达,未影响TIA-1的聚集,但减少了SG的数量。转染了ScramblesiRNA的HeLa细胞在应激刺激下,SND1与TIA-1的聚集未受任何影响,而转染了SND1-siRNA的HeLa细胞经过45℃-45 min刺激后,虽然TIA-1仍能聚集形成SG,但SG的数量明显减少,见图5。
2.6 SND1在应激刺激下聚集到SG的过程滞后于TIA-1 在不同的热休克刺激时间下,随着刺激时间的延长,SND1与TIA-1逐渐聚集形成SG,在刺激5 min时已经可见明显的TIA-1阳性颗粒,但SND1的聚集还不明显,刺激30 min时SND1阳性颗粒才基本形成,两者共同聚集于SG。在不同的刺激时间,分别计数100个HeLa细胞,其中含有SND1阳性颗粒的细胞数明显少于含有TIA-1阳性颗粒的细胞数,SND1聚集到SG的运输过程滞后于TIA-1,见图 6、7。

Fig.4 The expression of SND1 interfered by RNAi and measured by Western Blotting assay图4 SND1蛋白表达水平通过RNAi被敲除并利用Western Blotting检测蛋白表达

Fig.5 Knockdown of SND1 did not inhibit the recruitment of TIA-1 onstress granules(scale bar 10 μm)图5 敲除SND1不会抑制TIA-1聚集到SG(比例尺10 μm)

Fig.6 Aggregation of SND1 laged behind TIA-1 on stress granules(scale bar 10 μm)图6 SND1聚集到SG的过程滞后于TIA-1(比例尺10 μm)
3 讨论
SG是细胞在应对应激刺激时形成的胞内动态颗粒结构[3]。当真核细胞受到氧化应激、热休克、紫外线照射及病毒感染等应激刺激时,首先会终止蛋白质翻译的起始过程,然后重新改编mRNAs代谢程序,调节具有修复损伤功能的蛋白质基因转录及表达[3,8-9]。由此,细胞胞质中就形成了这种无胞膜的细胞亚结构[4],它的出现是细胞保护性机制启动的表现。近来研究报道了TIA-1、G3BP、多聚A尾mRNA结合蛋白(PABP)等许多分子都参与SG的聚集[7,10]。TIA-1 作为 SG 的重要标志蛋白,可以通过其PRD结构调节SG中蛋白的相互聚集过程,因而被称为 SG 的启动因子[2,11]。TIA-1 可调节血管紧张素Ⅱ受体 1(AT1R)的 mRNA 的聚集[12],这些研究显示TIA-1是调节SG功能的重要分子。
SND1是近来发现参与SG聚集的组分之一,其不仅可以与G3BP结合参与SG的形成[3],还可与AT1R共定位于SG,调节其聚集和穿梭过程,并可调节多聚A尾mRNAs向SG的聚集过程[4,13]。而本研究显示SND1在应激刺激时通过其SN结构域与TIA-1结合并共定位于SG,证实SND1实现其功能的结构基础是N端4个相似的葡萄球菌核酸酶样结构域[3,14]。由此结果推测SN结构域很可能起到蛋白与蛋白之间的桥联作用,从而促进蛋白复合物的形成。另外,RNAi敲除SND1表达不会影响TIA-1聚集形成SG,提示SND1不是启动SG聚集的蛋白组分,SG的形成也不是单一某个蛋白就能决定的。其具体机制,一方面可能与蛋白自身结构特点有关,另一方面可能与其调节不同的RNA代谢有关,SND1的缺失可能只影响某一类mRNA的代谢而不会影响其他mRNA及RNA结合蛋白的聚集,由此就表现为聚集颗粒数量的减少而不是完全被抑制。而在不同热休克刺激时间下,TIA-1是先于SND1聚集到SG的蛋白,这也佐证了SG中的蛋白聚集是有时序性和阶段性的,应激刺激所影响的mRNA及对应的RNA结合蛋白很可能在某些具有引导作用的分子的“指挥”下或依赖不同的信号通路按照一定的时间顺序聚集成SG,由此可以推测SG结构具有动态可变性,这可能与不同的刺激因素和刺激时间有关[8]。
综上所述,SND1在应激刺激下与TIA-1共同参与SG聚集,从而参与细胞的应激反应。SG从本质上说就是被终止翻译的那些“受伤”的mRNAs的分类急救中心[9,15],它不仅掌管着那些 mRNAs的最终命运,而且也作为细胞的信号通路上的“集线器”直接参与应激状态下的不同信号通路之间的“沟通与对话”[9,16]。而 SND1作为具有结合多聚A尾mRNAs的一种RNA结合蛋白,其参与真核细胞对抗应激刺激的生物学机制势必成为SG及应激相关理论的关键点之一[17]。尽管SND1究竟参与哪种mRNA的代谢以及遵循哪几条信号通路起作用仍有待进一步验证,但其作为SG的重要组分已经逐渐成为SG理论研究和治疗相关疾病的潜在新靶点。

Fig.7 The number of cells per 100 with SND1+and TIA-1+granules under different stress time points图7 在不同刺激时间下每100个HeLa细胞中的含有SND1+颗粒和TIA-1+颗粒的细胞数
[1]Panas MD,Ivanov P,Anderson P.Mechanistic insights into mammalian stress granule dynamics[J].J Cell Biol,2016,215(3):313-323.doi:10.1083/201609081.
[2]Waris S,Charles M,Wilce J,et al.RNA recognition and stress granule formation by TIA proteins[J].J Mol Sci,2014,15(12):23377-23388.doi:10.3390/ijms151223377.
[3]Gao XJ,Ge L,Shao J,et al.Tudor-SN interacts with and colocalizes with G3BP in stress granules under stress conditions[J].FEBS Lett,2010,584(16) :3525-3532.doi:10.1016/j.febslet.2010.07.022.
[4]Gao X,FU X,Song J,et al.Poly(A)+mRNA-binding protein Tudor-SN regulates stress granules aggregation dynamics[J].FEBS J,2015,282(5):874-890.doi:10.1111/febs.13186.
[5]Su C,Gao XJ,Yang W,et al.Phosphorylation of Tudor-SN,a novel substrate of JNK,is involved in the efficient recruitment of Tudor-SN into stress granules[J].J Biochim Biophys Acta,2017,1864(3):562-571.doi:10.1016/j.bbamcr.2016.12.018.
[6]Gilks N,Kedersha N,Ayodele M,et al.Stress granule assembly is mediated by prion-like aggregation of TIA-1[J].Mol Biol Cell,2004,15(12):5383-5398.doi:10.1091/mbc.E04-08-0715.
[7]Moutaoufik TM,Fatimy RE,Nassour H,et al.UVC-induced stress granules in mammalian cells[J].PLoS One,2014,9(11):e112742.doi:10.1371/journal.pone.0112742.
[8]Wheeler JR,Matheny T,Jain S,et al.Distinct stages in stress granule assembly and disassembly[J].Elife,2016,5.pii:e18413.doi:10.7554/eLife.18413.
[9]Kedersha N,Ivanov P,Anderson P.Stress granules and cell signaling:more than just a passing phase?[J].Trends Biochem Sci,2013,38(10):494-506.doi:10.1016/j.tibs.2013.07.004.
[10]Brunello CA,Yan X,Huttunen HJ,et al.Internalized Tau sensitizes cells to stress by promoting formation and stability of stress granules[J].Sci Rep,2016,6:30498.doi:10.1038/srep30498.
[11]Cruz GI,Aroca Á,Gunzburg MJ,et al.The binding of TIA-1 to RNA C-rich sequences is driven by its C-terminal RRM domain[J].RNA Biol,2014,11(6):766-776.doi:10.4161/rna.28801.
[12]Backlund M,Paukku K,Kontula KK,et al.Endoplasmic reticulum stress increases AT1R mRNA expression via TIA-1-dependent mechanism[J].Nucleic Acids Res,2016,44(7):3095-3104.doi:10.1093/nar/gkv1368.
[13]Gao X,Shi X,Fu X,et al.Human Tudor staphylococcal nuclease(Tudor-SN)protein modulates the kinetics of AGTR1-3′UTR granule formation[J].FEBS Lett,2014,588(13):2154-2161.doi:10.1016/j.febslet.2014.04.045.
[14]Gutierrez-Beltran E,Denisenko TV,Zhivotovsky B,et al.Tudor staphylococcal nuclease:biochemistry and functions[J].Cell Death Diffe,2016,23(11):1739-1748.doi:10.1038/cdd.2016.93.
[15]Dimasi P,Quintiero A,Shelkovnikova TA,et al.Modulation of peIF2α cellular levels and stress granule assembly/disassembly by trehalose[J].Sci Rep,2017,7:44088.doi:10.1038/srep44088.
[16]Buchan JR.mRNP granules.Assembly,function,and connections with disease[J].RNA Biol,2014,11(8):1019-1030.doi:10.4161/15476286.2014.972208.
[17]Gutiérrez-Beltran E, Bozhkov PV, Moschou PN.Tudor Staphylococcal Nuclease plays two antagonistic roles in RNA metabolism under stress[J].Plant Signal Behav,2015,10(10):e1071005.doi:10.1080/15592324.2015.1071005.
(2017-03-06收稿 2017-04-27修回)
(本文编辑 李国琪)
SND1 protein co-localization with TIA-1 on stress granules under stress stimuli
SHAO Jie,ZHANG Bing-bing,ZHAO Meng,ZHOU Yun-li,REN Li△
Department of Clinical Laboratory,Cancer Institute and Hospital,Tianjin Medical University,National Clinical Research Center of Cancer,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China△
E-mail:roland-li@163.com
ObjectiveTo analyze the association of staphylococcal nuclease domain-containing protein 1(SND1)and T-cell intracellular antigen 1(TIA-1)on stress granules,and the regulation of SND1 on stress granules under stress stimuli.MethodsThe immunofluorescence assay and laser scanning confocal microscopy were used to observe the co-localization of SND1 protein and TIA-1 protein under stress stimuli,and the over-expression plasmids of pEGFP vector were transfected into HeLa cells and to verify which domain of SND1 co-localized with TIA-1 under stress stimuli.RNA interferencemediated knockdown of the expression of SND1 protein in HeLa cells was measured by Western Blotting assay.Then whether the knockdown of SND1 affected the recruitment of TIA-1 on stress granules was observed.Heat shocks under different times were used to identify whether there were dynamic changes in transportation of SND1 and TIA-1 on stress granules.ResultsSND1 co-localized with TIA-1 on stress granules under stress stimuli,and the associated domain of SND1 were SN domain.TIA-1 still can be recruited on stress granules but a large amount of stress granules were reduced even though the expression of SND1 protein was decreased.And the transportation of SND1 on stress granules was laged behind TIA-1 under different-times of heat shocks.ConclusionSND1 protein co-localizes with TIA-1 on stress granules,and which co-regulates the cellular stress response under stress stimuli.
stress;RNA interference;Staphylococcal nuclease domain-containing protein 1;T-cell intracellular antigen 1;stress granule
R349.5
:A
10.11958/20170286
国家自然科学基金青年项目(31501091)
天津医科大学肿瘤医院检验科,国家肿瘤临床医学研究中心,天津市恶性肿瘤临床医学研究中心,天津市“肿瘤防治”重点实验室(邮编300060)
邵洁(1980),女,博士研究生,讲师,主要从事免疫学及临床肿瘤标志物研究
△通讯作者 E-mail:roland-li@163.com
