大强度运动导致肝脏线粒功能紊乱及姜黄素的拮抗效应
2017-06-29王宇飞张雪松徐维盛杨月欣
高 超,刘 阳,王宇飞,张雪松,徐维盛,杨月欣
(中国疾病预防控制中心营养与健康所,北京 100050)
大强度运动导致肝脏线粒功能紊乱及姜黄素的拮抗效应
高 超,刘 阳,王宇飞,张雪松,徐维盛,杨月欣
(中国疾病预防控制中心营养与健康所,北京 100050)
目的:探讨姜黄素对大强度游泳运动小鼠肝脏线粒体功能紊乱的拮抗作用。方法:成年雄性BALB/C小鼠随机分为安静对照组、运动对照组、运动+姜黄素组[100 mg/(kg·d)]和安静+姜黄素组[100 mg/(kg·d)]。干预期为4w,干预期最后1w同时进行游泳运动训练,每天训练90 min,每天采用上述方式游泳运动7d,动物末次运动完成后处死。观察肝脏超微病理形态改变,测定血清谷丙转氨酶、谷草转氨酶水平,以及肝脏线粒体膜电位、呼吸控制率等线粒体功能学指标。结果:与安静对照组相比,姜黄素干预明显抑制了大强度运动导致的小鼠血清谷丙转氨酶(P<0.05)和谷草转氨酶(P<0.05)水平的上升,减轻了运动导致的肝细胞线粒体超微病理结构异常。姜黄素干预显著抑制了运动导致的小鼠肝脏线粒体膜电位(P<0.05)和呼吸控制率水平(P<0.05)的下降。结论:姜黄素对大强度运动小鼠肝细胞线粒体超微结构损伤和功能紊乱具有良好的拮抗作用,为天然植物化学物应用于抗运动疲劳提供新的前景方向。
姜黄素;大强度运动;线粒体;超微病理
肝脏是体内以代谢功能为主的重要器官,发挥着去氧化、分泌性蛋白质的合成、储存肝糖等关键作用,与机体运动应激密切相关,同时也可能成为运动过劳性损伤的重要靶点[1]。研究表明,细胞线粒体的氧化呼吸链是机体活性氧(ROS)的最主要来源,正常情况下超过90%的ROS由呼吸链的“电子漏”产生,在细胞有氧呼吸过程中,大多数电子沿呼吸链传递至末端,最终与氧分子反应生成H2O,但存在约2%~5%的电子可从呼吸链酶复合物Ⅰ和Ⅱ处漏出,生成自由基[2-3]。线粒体系统的功能一直是运动性损伤的重要研究内容,肝脏组织中线粒体含量丰富,耗氧量高,尤其在大强度运动过程中,肝细胞能量代谢和氧耗骤增的情况下,生成的大量ROS直接攻击线粒体,可能导致其超微病理结构的改变以及膜电位和呼吸控制率的下降等功能紊乱[4-5],因此,线粒体可能成为大强度运动引发肝细胞损伤的关键靶点[6]。
从而,寻找天然、安全、合理的外源性抗劳损的营养补充剂,减轻肝脏线粒体功能紊乱,在预防大强度运动导致的肝脏损伤中至关重要[7,8]。姜黄素是从姜科、天南星科等植物中提取的一种植物多酚,很早就作为一种天然色素被广泛用到食品工业中。研究表明,姜黄素具有很好的抗氧化、抗炎、降血脂、抗肿瘤以及免疫调节等功效[9-10],并且可能对运动过劳损伤及线粒体功能紊乱具有良好的拮抗作用[11-13]。本实验建立动物大强度游泳训练损伤模型,研究姜黄素对大强度运动导致肝脏线粒体结构及功能障碍的保护作用,为姜黄素应用于创制抗过劳性损伤的膳食营养补充剂提供支持。
1 材料与方法
1.1 实验动物
40只健康雄性BALB/C清洁级小鼠,购自上海西普尔-必凯实验动物有限公司,5w龄,体重18~20 g,饲养于实验室清洁级动物房,动物房温度20±2 ℃,相对湿度50%±5%。
1.2 主要实验仪器和试剂
1.2.1 主要仪器 BS-200全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;Tecnai G2 12透射电子显微镜,荷兰FEI公司;Spectra Max M2 全能酶标仪,美国Molecular Devices公司;氧电极,英国汉莎科学仪器公司。
1.2.2 主要试剂 姜黄素,购自美国Sigma公司;谷草转氨酶(AST)、谷丙转氨酶(ALT)检测试剂盒,购自深圳迈瑞生物医疗电子股份有限公司;组织线粒体分离试剂盒,购自碧云天生物技术有限公司;罗丹明123荧光探针(Rhodamine 123,Rh123),购自美国Sigama公司;线粒体呼吸控制率(Respiratory control ratio,RCR)试剂盒,购自上海杰美基因医药科技有限公司。
1.3 实验方法
1.3.1 动物模型的建立 经适应性饲养1w后,40只成年雄性BALB/c小鼠,随机分为安静对照组(Ct)、运动对照组(Ex)、运动+姜黄素100 mg/(kg·d)组(Ex+Cur)和安静+姜黄素100 mg/(kg·d)组(Cur),每组10只。姜黄素以灌胃方式进行干预,而安静对照组和运动对照组则灌胃以等量的生理盐水,干预期为4w,干预期最后1w同时进行游泳运动训练,水温控制在30±1℃,水深45 cm,进行连续7d无负重游泳训练,每天持续90min。
1.3.2 取材及样品制备 小鼠最后一次游泳结束后摘眼球取血,分离血清并检测AST和ALT水平。迅速切取各组肝脏1 mm3左右放在2.5%戊二醛中4℃固定,进行电镜样品制备。按照线粒体分离试剂盒要求,取约100 mg新鲜肝脏组织于冰浴中制备匀浆液,4℃离心(600 g),取上清液再次4 °C离心(11 000 g),将沉淀制备线粒体重悬液,待测。
1.3.3 指标测定 ALT、AST由BS-200全自动生化分析仪检测;线粒体膜电位(Mitochondrial membrane potential,MMP)采用Rhodamine123荧光探针检测;线粒体呼吸控制率(RCR)采用氧电极法检测。
1.4 统计分析
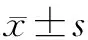
2 结果与分析
2.1 姜黄素对大强度运动小鼠血清ALT和AST水平的影响
结果如图1所示,与安静对照组相比,大强度游泳运动显著提高了小鼠血清ALT(P<0.01)和AST(P<0.01)水平,表明大强度游泳导致了小鼠明显的肝细胞损伤;而姜黄素干预显著减轻了游泳小鼠血清ALT(P<0.05)和AST(P<0.05)水平。
2.2 姜黄素对大强度运动小鼠肝脏超微病理的影响
由图2可见,安静对照组小鼠肝细胞线粒体基质密度正常,脊清晰,结构基本完整。游泳运动小鼠肝细胞线粒体超微形态变异明显,可见不同程度肿胀与变形,基质电子密度下降,其嵴减少甚至消失而变空。与运动对照组相比,姜黄素处理小鼠肝细胞线粒体的肿胀和脊减少的程度相对较轻,提示姜黄素对游泳引发的小鼠肝细胞超微病理结构紊乱具有良好的拮抗效应。
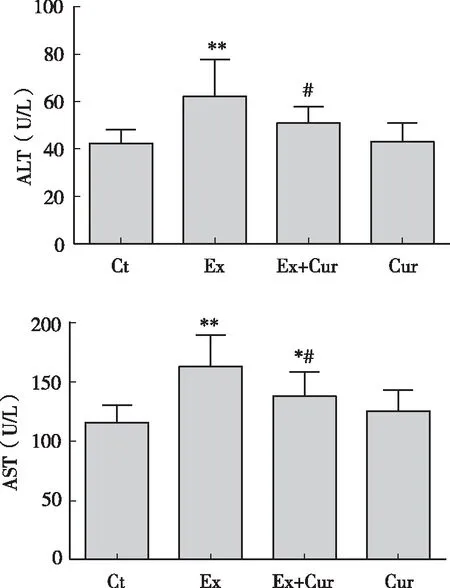
图1 姜黄素对大强度运动小鼠血清ALT、AST水平的影响注:*、** P<0.05、 P<0.01 vs 安静对照组;#P<0.05 vs 运动对照组
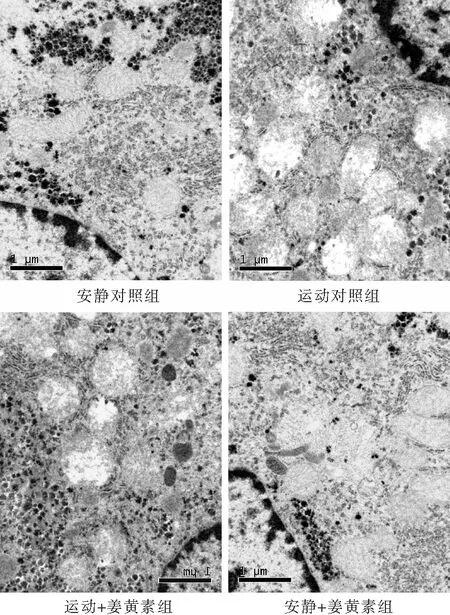
图2 电镜下观察姜黄素对大强度运动小鼠肝脏超微病理改变的影响
2.3 姜黄素对大强度运动小鼠肝脏线粒体膜电位的影响
从图3可知,大强度游泳运动导致小鼠肝脏线粒体膜电位下降35.9 %(P<0.01),姜黄素干预显著抑制了游泳导致的小鼠肝脏线粒体膜电位的下降(P<0.05)。姜黄素本身对肝脏线粒体膜电位没有明显影响(P>0.05)。
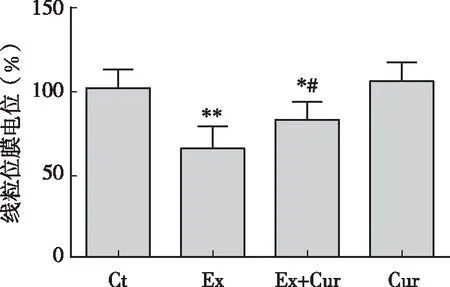
图3 姜黄素对大强度运动小鼠肝脏线粒体膜电位的影响注:*、 ** P<0.05、 P<0.01 vs 安静对照组; #P<0.05 vs 运动对照组
2.4 姜黄素对大强度运动小鼠肝脏线粒体呼吸控制率的影响
如图4所示,与安静对照组相比,游泳运动及姜黄素干预对肝细胞线粒体的3态呼吸未见显著影响(P>0.05),但游泳运动组4态呼吸上调40.1 %(P<0.01),而姜黄素处理抑制了游泳小鼠4态呼吸的上调(P<0.05)。与安静对照组相比,游泳运动小鼠肝脏线粒体RCR降低了31.1%(P<0.01),同时,姜黄素处理显著缓解了游泳小鼠RCR水平的降低(P<0.05)。
3 讨论
不同运动方式会对肝脏的形态、功能造成影响,而大强度运动导致的肝脏损伤却往往在运动实践中被忽视。研究表明,急性的剧烈运动能够导致血清转氨酶含量增加[14],而力竭性的运动甚至可诱发较重的肝脏组织结构改变以及炎性细胞浸润等损伤表现[15]。肝脏富含线粒体,线粒体系统在机体运动机制中发挥着关键的生理作用,而以往研究中也发现,线粒体可能成为运动过劳性伤害的重要靶部位[6]。本试验显示,大强度运动导致了小鼠肝脏尤其是线粒体的结构和功能损伤,而姜黄素干预明显地抑制了游泳导致的肝脏ALT和AST的释放,显著减轻了游泳引发的肝脏线粒体超微结构改变和功能紊乱。
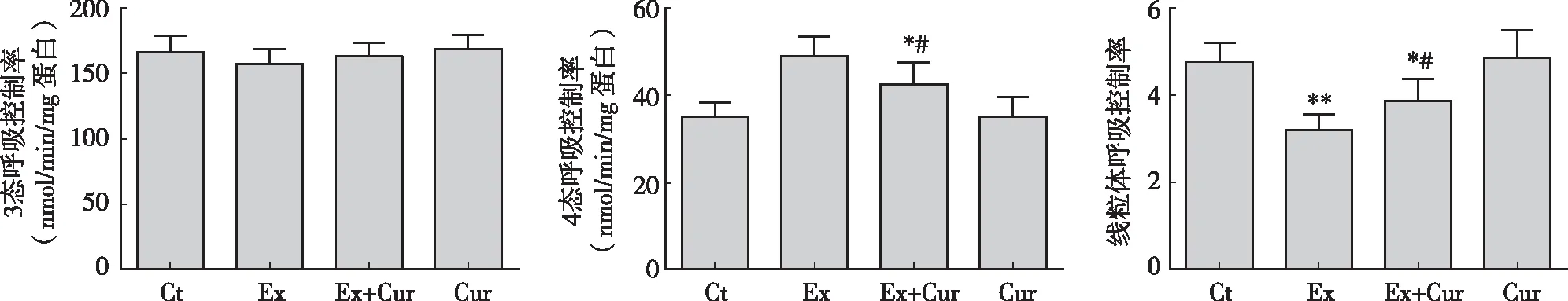
图4 姜黄素对大强度运动小鼠肝脏线粒体呼吸控制率的影响注:*、 ** P<0.05、 P<0.01 vs 安静对照组; #P<0.05 vs 运动对照组
正常的线粒体膜电位(MMP)是维持细胞线粒体进行氧化磷酸化、生成ATP的重要前提,而MMP的改变与线粒体膜损伤及功能紊乱紧密相关[16]。本研究显示,大强度游泳运动明显降低了小鼠肝细胞线粒体MMP,揭示了线粒体膜损伤和病理结构改变。相关证据表明,高强度运动能够引发线粒体膜通透性和流动性的异常,可部分归因于活性氧的猝发[17-18]。研究表明,细胞的能量主要来源于线粒体呼吸链的氧化磷酸化,大约2%~5%的氧耗生成自由基,而大强度运动引发肝细胞氧化代谢加速,可能导致线粒体持续的ROS生成,同时,也使线粒体成为ROS攻击的关键靶点[4,19]。有证据显示,线粒体内膜的脂质结构易受到ROS直接攻击和细胞氧化-抗氧化平衡状态的影响,引起线粒体通透性转换孔PTP开放,线粒体MMP下降,细胞色素c及凋亡诱导因子(AIF)等物质不断释放,线粒体过多摄入胞浆Ca2+,导致线粒体肿胀、变形等超微结构改变及相关功能障碍,最终引起细胞凋亡[6,20-21]。本研究中,姜黄素干预明显减轻了运动小鼠肝脏线粒体膜电位的异常改变,可能与其良好的清除自由基作用有关。相关文献显示,姜黄素分子中含有酚羟基结构,能够直接猝灭自由基,还可通过活化抗氧化酶系和抑制氧化酶系等途径,发挥抗氧化活性,对线粒体膜的结构损伤以及功能紊乱发挥抗氧化保护效应[11,22]。
线粒体RCR可较好衡量呼吸链氧化磷酸化水平以及ATP的生产能力,是反映线粒体呼吸功能的重要标准[23],尤其4态呼吸的上调,可作为其内膜损伤的关键证据[24]。本试验表明,大强度游泳运动导致肝细胞线粒体4态呼吸明显上升,但并未使3态呼吸发生显著改变,从而综合表现为线粒体RCR的显著降低。姜黄素干预则抑制了大强度游泳小鼠肝细胞线粒体4态呼吸,同时也缓解了RCR的降低,拮抗了线粒体呼吸功能障碍[6]。综上所述,本研究结果表明姜黄素对大强度运动小鼠肝细胞线粒体结构损伤以及功能障碍表现出较好的拮抗作用,为姜黄素应用于预防大强度运动引发的肝细胞损伤、创制营养补剂提供证据支持。◇
[1]Pillon B R,et al.Oxidative stress and inflammation:liver responses and adaptations to acute and regular exercise[J]. Free Radic Res,2017,51(2):222-236.
[2]Powers S K,Radak Z,Ji L L.Exercise-induced oxidative stress:past,present and future[J]. J Physiol,2016,594(18):5081-5092.
[3]He F,et al.Redox Mechanism of Reactive Oxygen Species in Exercise[J]. Front Physiol,2016,7:486.
[4]Jackson M J,Vasilaki A,Mcardle A.Cellular mechanisms underlying oxidative stress in human exercise[J]. Free Radic Biol Med,2016(98):13-17.
[5]Yavari A,et al.Exercise-induced oxidative stress and dietary antioxidants[J]. Asian J Sports Med,2015,6(1):e24898.
[6]高超.槲皮素对剧烈运动小鼠心肌、肝脏损伤的保护作用及其机制研究[D]. 华中科技大学,2014.
[7]Myburgh K H.Polyphenol supplementation:benefits for exercise performance or oxidative stress[J]. Sports Med,2014,44 Suppl 1:S57-S70.
[8]Pingitore A,Lima G P,Mastorci F,et al.Exercise and oxidative stress:potential effects of antioxidant dietary strategies in sports[J]. Nutrition,2015,31(7-8):916-922.
[9]Prasad S,Gupta S C,Tyagi A K,et al.Curcumin,a component of golden spice:from bedside to bench and back[J]. Biotechnol Adv,2014,32(6):1053-1064.
[10]Takahashi M,Suzuki K,Kim H K,et al.Effects of curcumin supplementation on exercise-induced oxidative stress in humans[J]. Int J Sports Med,2014,35(6):469-475.
[11]Gupta S C,Patchva S,Aggarwal B B.Therapeutic roles of curcumin:lessons learned from clinical trials[J]. AAPS J,2013,15(1):195-218.
[12]Kawanishi N,et al.Curcumin attenuates oxidative stress following downhill running-induced muscle damage[J]. Biochem Biophys Res Commun,2013,441(3):573-578.
[13]刘丽霞.姜黄素结合递增负荷有氧运动对中老年大鼠骨骼肌线粒体功能的影响[D]. 湖南师范大学,2016.
[14]Kayashima S,et al.Leucocytosis as a marker of organ damage induced by chronic strenuous physical exercise[J]. Eur J Appl Physiol Occup Physiol,1995,70(5):413-420.
[15]Huang C C,Lin W T,Hsu F L,et al.Metabolomics investigation of exercise-modulated changes in metabolism in rat liver after exhaustive and endurance exercises[J]. Eur J Appl Physiol,2010,108(3):557-566.
[16]Schlagowski A I,et al.Mitochondrial function following downhill and/or uphill exercise training in rats[J]. Muscle Nerve,2016,54(5):925-935.
[17]Perez A C,et al.Mitochondrial,sarcoplasmic membrane integrity and protein degradation in heart and skeletal muscle in exercised rats[J]. Comp Biochem Physiol C Toxicol Pharmacol,2003,134(2):199-206.
[18]Lundby C,Jacobs R A.Adaptations of skeletal muscle mitochondria to exercise training[J]. Exp Physiol,2016,101(1):17-22.
[19]Radak Z,Zhao Z,Koltai E,et al.Oxygen consumption and usage during physical exercise:the balance between oxidative stress and ROS-dependent adaptive signaling[J]. Antioxid Redox Signal,2013,18(10):1208-1246.
[20]Ascensao A A,et al.Cardiac mitochondrial respiratory function and oxidative stress:the role of exercise[J]. Int J Sports Med,2005,26(4):258-267.
[21]Conley K E.Mitochondria to motion:optimizing oxidative phosphorylation to improve exercise performance[J]. J Exp Biol,2016,219(Pt 2):243-249.
[22]de Oliveira M R,et al.Curcumin,mitochondrial biogenesis,and mitophagy:Exploring recent data and indicating future needs[J]. Biotechnol Adv,2016,34(5):813-826.
[23]Greggio C,et al.Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle[J]. Cell Metab,2017,25(2):301-311.
[24]Ascensao A,Ferreira R,Magalhaes J.Exercise-induced cardioprotection--biochemical,morphological and functional evidence in whole tissue and isolated mitochondria[J]. Int J Cardiol,2007,117(1):16-30.
(责任编辑 李婷婷)
High-Intensity Excercise Induced Hepatic Mitochondrial Dysfunction in Mice and Protective Effects of Curcumin
GAO Chao,LIU Yang,WANG Yu-fei,ZHANG Xue-song,XU Wei-sheng,YANG Yue-xin
(National Institute for Nutrition and Health,Chinese Center for Disease Control and Prevention,Beijing 100050,China)

curcumin;intense exercise;mitochondria;ultrastructural pathology
国家科技支撑计划(项目编号:2012BAD33B01);中国疾病预防控制中心营养与健康所青年科学基金(项目编号:NINH201606)。
高 超(1986— ),男,博士,助理研究员,研究方向:食物营养评价。
杨月欣(1955— ),女,研究员,研究方向:食物营养评价。
