生物炭对紫色土中氟喹诺酮吸附-解吸的影响
2017-06-28轩盼盼唐翔宇鲜青松黄月华海南大学环境与植物保护学院海南海口5708中国科学院水利部成都山地灾害与环境研究所四川成都6004
轩盼盼,唐翔宇,鲜青松,刘 琛*,杨 飞,黄月华(.海南大学环境与植物保护学院,海南 海口5708;.中国科学院水利部成都山地灾害与环境研究所,四川 成都 6004)
生物炭对紫色土中氟喹诺酮吸附-解吸的影响
轩盼盼1,2,唐翔宇2,鲜青松2,刘 琛2*,杨 飞1,黄月华1(1.海南大学环境与植物保护学院,海南 海口570228;2.中国科学院水利部成都山地灾害与环境研究所,四川 成都 610041)
以长江中上游典型坡耕地石灰性紫色土为对象,研究生物炭施用(质量比1%和5%)及田间老化(经5~11月份干湿交替)对氟喹诺酮类抗生素(环丙沙星、氧氟沙星和恩诺沙星)吸附-解吸行为的影响.研究表明,3种抗生素在紫色土中的吸附较强,Freundlich方程能较好地拟合其等温吸附-解吸过程,相关系数均达到极显著水平.新鲜施用生物炭不利于环丙沙星和氧氟沙星的吸附,但能促进恩诺沙星的吸附且与生物炭施用量正相关.施炭后土壤中的溶解性有机物明显增加,可能是降低吸附的重要因素,这种影响在老化后明显减弱.3种抗生素在经老化后的1%施炭土中的吸附量均大于对照处理(P>0.05),而老化5%施炭土与对照相当.相对于吸附,各处理土壤并未表现出明显的解吸迟滞,施炭促进了环丙沙星和氧氟沙星的解吸,但老化施炭土抑制了恩诺沙星的解吸.
生物炭;氟喹诺酮;紫色土;吸附-解吸;老化
氟喹诺酮类抗生素是一类由人工合成的人畜共用抗菌药,因其含有较多的离子型官能团,故而能与土壤中矿物离子结合而表现出较强的吸附能力.氟喹诺酮类抗生素在土壤中的吸附系数Kd值(260~5012L/kg)明显高于其他几类抗生素(如磺胺类、大环内酯类),一旦随污水排放进入土壤后,易为有机质和矿物质吸附[1-2].有研究表明,在珠江三角洲和山东省中北部的部分土壤中环丙沙星的最高检测浓度分别为119.2和651.6μg/ kg,诺氟沙星的最高检出浓度达到 150.2和288.3μg/kg[3-4],养殖场周边土壤中环丙沙星、氧氟沙星、恩诺沙星的检出浓度分别达到 58.9、29.2和49.4μg/kg[5].吸附到土壤颗粒上的氟喹诺酮类抗生素难以释放,不断积累并长期存在,致使残留浓度达到μg/kg~mg/kg水平[6-7],因此,被称为具有“假持久性”的一种新型环境污染物.
生物炭是指在无氧或限氧条件下,将农作物秸秆、木材、家禽粪便和其他材料等含碳量丰富的生物质经过高温热解并加工得到的一种细粒度、多孔性的碳质材料[8].近年来,生物炭越来越多地被用于土壤改良和污染控制与修复.国内外已有不少关于生物炭施用对抗生素在土壤中吸附-解吸行为的影响研究,例如,一些研究发现土壤中添加生物炭可提高磺胺甲恶唑、泰乐菌素的吸附[9-12],其作用机理与土壤、生物炭及污染物三者的性质密切相关,但较为复杂,尚未研究透彻[13].同时,这些研究所采用的施炭方式多以室内添加为主,很少采用经田间老化的施炭土进行,也相对较少涉及解吸过程.然而,最新的研究表明,老化后生物炭自身的性质及其与土壤颗粒、污染物之间的相互作用会发生变化[14],因而对于土壤中污染物是不可忽视的因素之一.
紫色土是长江上游尤其是四川盆地广泛分布的重要耕地资源[15],其中石灰性紫色土的面积约424万hm2,占四川紫色土面积的46.5%[16],并具有土层浅薄、土壤大孔隙和下伏泥岩裂隙丰富的特点,这些特点导致农化物质和污染物等易通过优先流发生大量快速的淋失迁移.有研究指出,2013年西南地区氟喹诺酮类抗生素的使用量高达到 3850t,占全国使用总量的 14.1%[17],然而目前,有关氟喹诺酮类抗生素在紫色土中的迁移规律及施用生物炭的控制效果研究尚未见报道.因此,本研究以川中丘陵区坡耕地石灰性紫色土为对象,探究生物炭及田间老化对环丙沙星、氧氟沙星、恩诺沙星3种氟喹诺酮类抗生素在土壤中吸附-解吸行为的影响,从而为该类污染物在紫色土地区的迁移防控及风险评估提供机理认识和基础数据.
1 材料与方法
1.1 供试材料
1.1.1 药品与试剂 环丙沙星(纯度94%)、氧氟沙星(纯度99%)和恩诺沙星(纯度99%)的标准品均购自德国 Dr.Ehrenstorfer公司,其基本理化性质见表1.乙腈为色谱纯,其他试剂,如甲酸、氯化钙、叠氮化钠,均为分析纯;实验用水为超纯水.
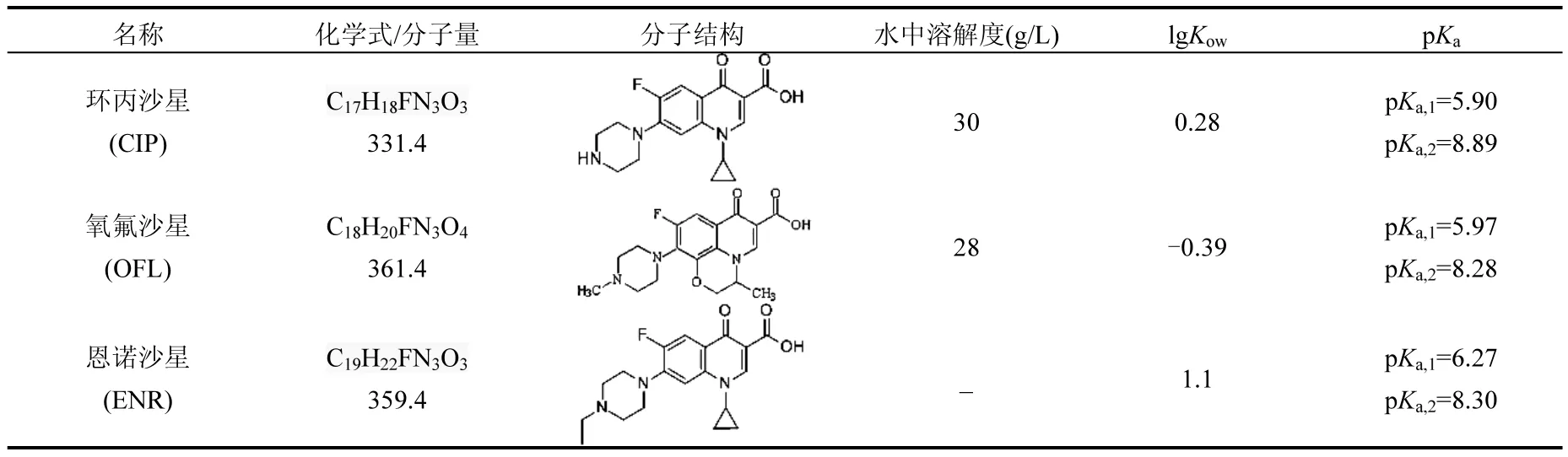
表1 3种氟喹诺酮类抗生素的基本性质Table 1 Basic properties of three fluoroquinolone antibiotics
1.1.2 实验仪器 高效液相色谱仪配荧光检测器(1200,美国Aglient公司),Eclipse plus C18色谱柱(4.6mm×150mm);DOC分析仪(Auto Analyzer 3,德国SEAL Analytical公司),紫外吸收-三维激发-发射荧光光谱仪(Aqualog,日本 Horiba JY公司),BET 比表面分析仪(ASAP 2460,美国Micromeritics公司)、X射线光电子能谱分析仪(XSAM800,英国 Kratos公司)、恒温振荡床(ZWF-200,上海智城分析仪器制造有限公司)、冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司)、pH计(Senslon+MM150,美国)等.
1.1.3 供试土壤 供试土壤为石灰性紫色土,采自中国科学院盐亭紫色土农业生态试验站(四川省盐亭县林山乡,105°27′E、31°16'N)坡耕地小区,种植方式为小麦-玉米轮作,小区0~15cm耕层土壤分别在1%和5%(质量比)2个投加量下施用生物炭,并经过2015年5~11月份干湿交替自然老化.采集土样置于阴凉处风干,研磨过 60目筛待用.供试土壤包括了对照土、田间老化的 1%和5%施炭土壤(以下称为老化施炭土)以及实验室内向对照土中新鲜添加生物炭的 1%和 5%施炭土壤(以下称为新鲜施炭土,生物炭与田间老化炭为同一批次,风干后密封、避光、干燥保存)共5种处理.土样置于阴凉处自然风干,研磨过60目筛,待用.实验前,供试土壤在120℃、0.115MPa条件下连续湿热灭菌2h.
对照土壤的基本理化性质:pH值为8.6,有机碳含量为3.9g/kg,机械组成为36%砂粒、40%粉粒和 24%粘粒.生物炭购于河南商丘三利新能源有限公司,是由农作物秸秆在500℃、无氧条件下烧制而成,采用BET比表面分析仪、X射线光电子能谱(XPS)对生物炭老化前后的孔隙结构和表面元素进行表征,结果见表 2.供试土壤和生物炭样品中均未检测出目标抗生素.

表2 生物炭老化前后BET比表面积和X射线光电子能谱分析Table 2 Analyses of BET surface area and X-ray photoelectron spectroscopy of the biochar prior to and after ageing
1.2 实验方法
1.2.1 土壤溶解性有机物(DOM)浸提实验 分别称取2g已过2mm筛的土壤样品,均置于30mL玻璃离心管中(每个样品 3个平行),加入 20mL 0.01mol/L CaCl2溶液,25℃、180r/min条件下振荡4h后,在25℃ 3000r/min条件下离心5min,取上清液用0.45μm滤膜过滤获得土壤中可水提的溶解性有机物.采用DOC流动分析仪和三维荧光光谱仪分别测定DOM的浓度及组 成.
1.2.2 吸附动力学实验 为确定 3种抗生素在土壤中的吸附平衡时间,进行吸附动力学实验.称取 1.0g土壤样品,加入 10mL初始浓度均为10mg/L的3种抗生素混合溶液(含0.01mol/LCaCl2和0.1g/LNaN3灭菌剂).置于恒温振荡器中,25℃、180r/min条件下振荡,分别于2min、4min、6min、8min、10min、15min、30min、1h、2h、4h、8h、12h、24h取样,以 4000r/min离心10min,取上清液过0.22μm聚醚砜滤膜,将滤液转移至小样品瓶,采用高效液相色谱仪—荧光检测器(HPLC-UV;Agilent1200,Eclipse plus C18色谱柱),测定水相中3种抗生素的浓度.
以上不同的时间处理均做 2个重复,用吸附前后溶液中抗生素浓度之差计算得到土壤中抗生素的吸附量,当吸附量趋于稳定时,将该时间视为达到吸附平衡所需的最短时间.

式中:qt为经一定振荡时间t后,土壤对抗生素的吸持量,mg/kg;C0为溶液中抗生素的初始浓度,mg/L;Ct为经过一定振荡时间t后,溶液中抗生素浓度,mg/L.
为避免抗生素的光解损失,批量法实验在铝箔遮光的条件下进行.以不加土壤的抗生素溶液为空白,计算实验过程中抗生素的非生物降解及器壁吸附等可能的损失率.预实验结果表明,这部分损失可忽略不计.
1.2.3 吸附-解吸热力学实验 基于吸附动力学实验结果,并考虑实验时间上的便利,将批量法等温吸附平衡实验的时间设定为 24h,分别称取1.0g风干后土样于 30mL离心管中,称重得 W0,添加10mL浓度梯度均为2、5、10、15、20、30mg/L的3种抗生素混合溶液,设3个重复,在避光、25℃、180r/min条件下恒温振荡使吸附达到平衡,以 4000r/min离心 10min,移取绝大部分的上清液,经 0.22μm聚醚砜滤膜过滤待测,离心管称重得W1,避光冷冻干燥2h后,向管内加入等体积(10mL)不含抗生素的 0.01mol/L CaCl2(含0.1g/LNaN3)溶液,继续在相同条件下振荡24h,至解吸平衡.离心分离,测定水相中的抗生素浓度.
以吸附前后溶液中抗生素的浓度差分别计算土壤中 3种喹诺酮类抗生素的吸附量.以解吸前土壤中的抗生素吸附量以及解吸平衡后溶液中的抗生素浓度计算解吸后土壤中抗生素残留量,解吸实验前离心管残留液中的抗生素用(W1W0)重量差及吸附平衡浓度(qe)予以扣除.所得等温吸附和解吸实验结果分别采用Freundlich方程和线性方程进行拟合.
1.2.4 抗生素检测方法 3种抗生素采用高效液相色谱仪同时检测,仪器参数为:流动相-乙腈/0.2%甲酸溶液=13:87(v/v),进样量 10μL,流速1mL/min,柱温 30℃,荧光检测器:激发波长290nm、发射波长 450nm;保留时间:氧氟沙星7.5min,环丙沙星8.5min,恩诺沙星12.8min.
1.3 数据处理方法
本文采用4种经典动力学模型(Elovich方程(qt=a+blnt)、双常数方程(qt=atb)、W-M 方程(qt=a+bt0.5)及准二级方程(t/qt=1/(ab2)+t/b))对抗生素在各反应时间t的吸附量qt进行拟合,通过模型拟合的优劣判断主要吸附动力学机制.
对于吸附热力学,本文采用线性方程及Freundlich非线性方程(lgQ=lgK+))描述目标ef物在土壤中的吸附量(Qe, mg/kg)与平衡溶液中浓度(Ce, mg/L)之间的关系,并获得吸附容量常数Kf及吸附亲和力n值.
本文还以Freundlich解吸等温线(1/ndes)与吸附等温线(1/nads)的比值表示迟滞系数(HI),用于描述解吸迟滞现象.
采用Origin9.0对实验数据进行统计分析.
2 结果与分析
2.1 施炭及老化对土壤化学性质的影响
在施用生物炭及经田间老化后,供试土壤的化学性质发生了一些变化.如表3中所示,在2种生物炭施用量下,经老化处理的施炭土壤有机碳含量都显著高于对照,即表明生物炭向土壤中引入了外来碳源.另一方面,与对照相比,施炭后土壤的阳离子交换量明显增加(P<0.01),而与新鲜施炭土相比,田间老化后土壤的阳离子交换量(CEC)值没有显著性变化(P>0.05),虽然生物炭在老化过程中会发生氧化作用引起一些极性含氧官能团的增加从而导致CEC发生变化[18-19],但这种氧化作用是一个缓慢的过程[20].实验所用生物炭的田间老化只有半年,时间相对较短,同时由表2中新鲜生物炭和老化生物炭的XPS数据可知,生物炭在老化过程中O/C值由0.20变化到0.27,表明生物炭发生了轻微的氧化作用,但不足以导致CEC发生明显变化.

表3 生物炭与各处理土壤及其溶解性有机物的化学性质Table 3 Chemicalproperties of biochar and soils of different treatmentsand their corresponding dissolved organic matter
溶解性有机物(DOM)被认为是土壤有机质中最活跃、最重要的组分,其含量一般不超过总有机质的百分之几,却能作为环境中有机污染物迁移的载体,对污染物在土壤中的吸附产生很大的影响.图1为在一定水土比下从各处理土壤中提取的DOM的三维激发-发射荧光光谱图,显而易见,施炭不仅改变了土壤颗粒的表面化学性质,也影响了土壤中DOM的成分及含量.与图1a中对照相比,添加新鲜的生物炭后,土壤DOM的荧光强度显著增加且与投加量呈正相关(图 1e,图1f),对照土、老化炭土及新鲜1%施炭土的DOC浓度没有显著差异(P>0.05),而当土壤中新鲜添加5%生物炭时土壤的DOC浓度从6.34增加到10.34mg/L,pH 值和电导率也相应增加(P<0.05,表3).从生物炭自身DOM的荧光强度(图1b)和化学指标上看,土壤DOM的这种变化应该是由生物炭所引入的DOM而产生的.另一方面,老化后,施炭土壤的DOM与对照土没有显著性变化(图 1c,图 1d).这是因为,新鲜的生物炭由于制备过程中未完全炭化,表面含有较丰富的活性有机组分、化学官能团及离子等,当施加到田间后在雨水的淋洗下可逐渐释放,经过一段时间的干湿交替老化到达稳定状态,从而表现出与新鲜炭不同的性状.土壤经施炭、老化而发生的这些变化,可能对目标抗生素的吸附-解吸过程产生一定的影响.

图1 生物炭与各处理土壤中溶解性有机物的三维激发-发射荧光光谱Fig.1 EEM fluorescence spectra of dissolved organic matter in biochar and soils of different treatments
2.2 抗生素在紫色土中的吸附动力学及模型
3种抗生素在施用不同比例的生物炭及经过老化作用后的紫色土中的吸附动力学有所差异.表4为不同动力学方程拟合得到的模型参数及相关系数(R2).Elovich方程和双常数方程拟合效果较好,相关系数均达到极显著水平(P<0.01),优于W-M方程及准二级方程.W-M颗粒内扩散模型方程拟合截距不为零,即没有经过原点,表明颗粒内扩散不是环丙沙星、氧氟沙星、恩诺沙星在 5种不同处理土壤上吸附速率的控制步骤,液膜扩散、孔道扩散等也可影响三者在土壤上的吸附过程[21].
动力学拟合结果表明,抗生素在土壤中的吸附是一个先快后慢的过程.在吸附的初始阶段,水相中抗生素浓度快速下降,土壤中抗生素吸附量相应的迅速增加,吸附速率最快,吸附强度最大;而后,水相中抗生素浓度随时间变化缓慢,土壤对抗生素的吸附速率变小,强度也减弱,吸附量增加缓慢;经一段时间后,吸附量趋于稳定并最终达到平衡,这与吸附动力学特征一致.3种抗生素均在2min内就达到平衡吸附量的96%左右,之后吸附量缓慢增加,在 10h左右达到吸附平衡.在对照土、老化1%施炭土和5%施炭土、新鲜的1%施炭土和5%施炭土5种不同处理中,环丙沙星、氧氟沙星和恩诺沙量达到吸附平衡时的吸附量占各自投加量的95%左右.

表4 抗生素在各处理土壤中的等温吸附动力学拟合参数Table 4 Fitting parameters of adsorption kinetics of antibiotics in soils of different treatments
2.3 生物炭施用及老化作用对抗生素吸附-解吸的影响
抗生素在五种处理紫色土中的吸附-解吸等温线如图2所示,相应的热力学方程拟合参数列入表5~6中.结果表明,线性方程与Freundlich方程都能较好地拟合 3种抗生素的吸附过程,比较之下 Freundlich方程的拟合效果更好,相关系数均达到极显著水平(P<0.01).如表 4所示,环丙沙星、氧氟沙星和恩诺沙星在不同处理中的土壤-水分配系数分别在 209~412、172~377和 161~268L/kg之间,Kd值的范围较为接近,这与报道中关于这几种含羧基喹诺酮类抗生素在同一土壤中具有相近的分配系数的结论一致[22].
对于lgKow较低的环丙沙星和氧氟沙星而言,新鲜施炭土的Kf值小于对照土,且生物炭施用量越高,Kf值越低.这表明,土壤中施用新鲜的生物炭降低了环丙沙星和氧氟沙星的吸附量,这与普遍报道生物炭能增强抗生素吸附的结论不一致[9-12,23-24],尤为值得注意.结论的差异除了污染物自身性质的不同,必然与生物炭原料及制备条件以及土壤理化性质(如CEC、pH值和有机质含量等)的差异相关[25].当吸附达到平衡时,水土悬浊液的pH值在7.3~7.6之间,新鲜加炭与老化两种处理之间平衡土壤溶液的pH值并无显著性差异(P>0.05),氟喹诺酮类抗生素在该pH值条件下以中性分子形态存在,易通过阳离子交换、疏水分配作用、表面络合、阳离子桥以及π-π键等作用力吸附到土壤颗粒上[26-27].另一方面,与其他类型土壤相比,紫色土是紫色岩上发育的一种岩性土,其粘粒和矿物质含量丰富,含有大量的Ca2+、Mg2+、Al3+等金属离子,由于研究表明氟喹诺酮类抗生素易与二价、三价的金属离子(Ca2+、Mg2+、Al3+)结合形成稳定的复合物吸附到土壤粘粒上[28],故石灰性紫色土的吸附性较强,施炭后土壤理化性质的差异也可能导致对该类抗生素的吸附影响效果各异.

图2 不同施炭处理土壤中抗生素的吸附-解吸等温线Fig.2 Adsorption-desorption isotherms of antibiotics in soils of different treatments

表5 各处理土壤中抗生素等温吸附过程的线性拟合参数Table 5 Linear fitting parameters of adsorption isotherms of antibiotics in soils of different treatments
从表5可以看出,新鲜施炭土中的Kf值均小于老化后的施炭土.前文中提到,新鲜施炭土中能释放大量的溶解性有机物(DOM)(在水土比10mL:1g条件DOC浓度可高达(34.8±0.2) mg/L),因此,在水土界面上 DOM对目标抗生素的吸附可能产生以下影响:一方面,土壤颗粒表面的有效吸附位点可被 DOM占据从而与抗生素形成竞争;另一方面,水相中的DOM可与抗生素结合从而增加后者的可溶性,这两方面的作用都将导致抗生素的吸附量降低,此外在老化过程中由于生物炭中大部分可溶活性成分经田间干湿交替作用后已淋失[29],从而使得生物炭颗粒表面吸附点位的作用得以体现出来,另外,根据表2中BET数据表征的生物炭老化前后孔隙结构的变化,生物炭在老化过程中和土壤以及水分的接触、挤压造成破裂及孔道破碎导致孔道连通性增强比表面积增加、平均孔径变大,因而也是老化施炭土吸附能力增加的原因.
一般而言,阳离子交换量的增加有利于氟喹诺酮类抗生素在土壤中的吸附[30-31],因而对于logKow转高的恩诺沙星,在不同处理土壤中的吸附强度表现为老化施炭土>新鲜施炭土>对照土.由于抗生素分子之间理化性质的不同,导致生物炭和DOM对其吸附作用影响的强弱也会有所差异.由于新鲜施炭土 DOM含量较高,部分未溶出的DOM在土壤中颗粒表面吸附,因此对于lgKow较低的环丙沙星和氧氟沙星而言,一方面,新鲜施炭土溶解出的DOM通过增加两者溶解性和吸附竞争降低了它们在土壤中的吸附量;另一方面,土壤颗粒上附着的DOM,在水、固两相之间的平衡过程中会阻碍抗生素在土壤颗粒上的吸附.在上述作用的综合影响下,不同处理土壤对环丙沙星和氧氟沙星的吸附强度最终表现为老化施炭土>对照土>新鲜施炭土.
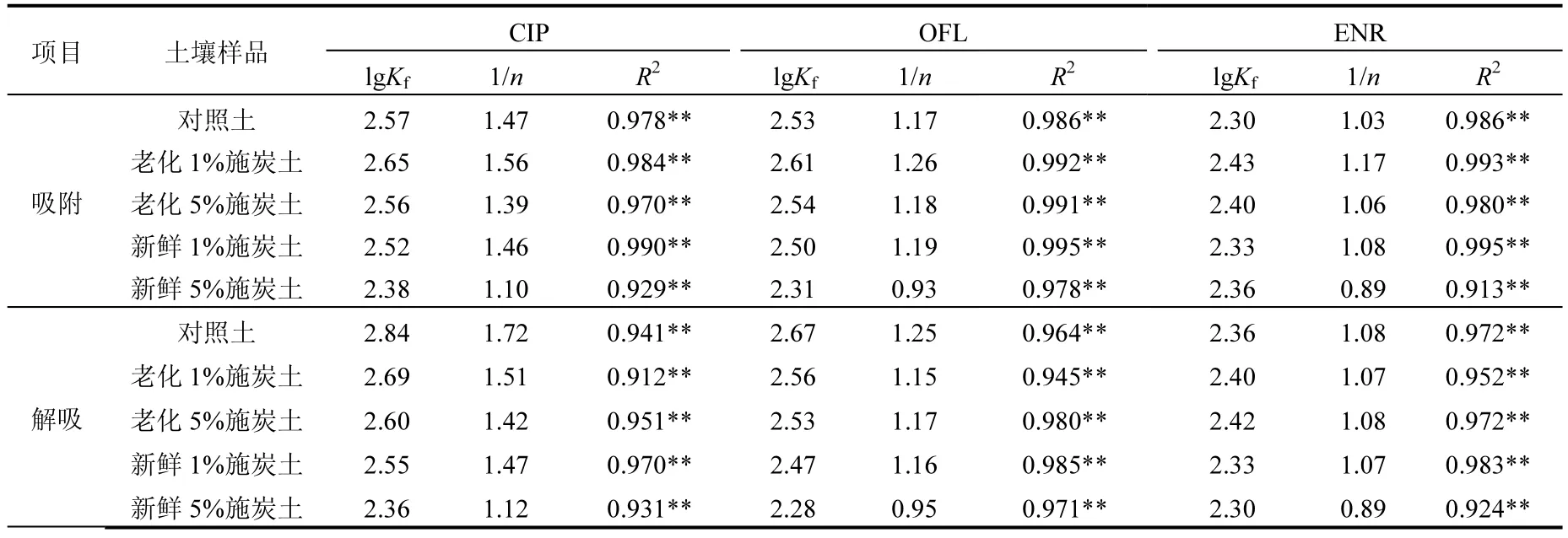
表6 不同处理土壤中抗生素吸附-解吸等温数据的Freundlich方程拟合结果Table 6 Freundlich model fitting parameters ofadsorption-desorption isotherms of antibiotics insoils of different treatments
如表6所示,采用Freundlich方程对等温解吸过程进行拟合,拟合得到的 Kf值越大,表明解吸能力越弱.对于环丙沙星和氧氟沙星,Kf值的大小顺序为:对照>老化施炭土>新鲜施炭土,且新鲜和老化施炭土中的 Kf值均随施炭量增加而减小.这表明,施炭促进了环丙沙星和氧氟沙星在土壤中的解吸,且解吸程度与施炭量正相关,老化处理的解吸程度小于新鲜施炭土.恩诺沙星的情况与另2种抗生素有差异,施炭对恩诺沙星解吸的影响相对较弱.在对照、新鲜1%和5%施炭土、老化1%施炭土中的Kf值大小顺序均为:环丙沙星>氧氟沙星>恩诺沙星,即3种抗生素解吸能力表现为恩诺沙星最强,环丙沙星最弱.通常对于吸附能力强的污染物,在解吸过程中由于与吸附介质之间存在较强的作用力,故在相同条件下,会比弱吸附的物质更难解吸.另一方面,新鲜添加生物炭的处理,增加了土壤的不均质并且提高了土壤水中溶解性有机物的含量,因而可能会与抗生素竞争有效吸附点位,从而导致抗生素的解吸能力较对照土和老化土都显著增强.此外,虽然老化施炭土的吸附能力较空白土增强(尤其是老化 1%施炭土),但由于部分抗生素通过表面作用或分配作用吸附在生物炭表面,故可能比吸附在土壤颗粒上的抗生素更容易解吸到水溶液中[24],从而表现出比对照土中的解吸能力更强.
为了准确描述 3种氟喹诺酮类抗生素施炭土壤中吸附与解吸过程的可逆性,本文计算了解吸迟滞系数(HI),如表 7中所示.通常认为,当HI<0.7为正迟滞现象,表示吸附质不易从吸附剂上解吸;当 0.7<HI<1,表示无解吸迟滞现象;当HI>1时为负迟滞效应,即吸附质易从吸附剂上解吸[32].3种抗生素在所有处理土壤中的HI值均接近 1,表示氟喹诺酮类抗生素在不同处理土壤中无解吸迟滞现象,即通过多次解吸,吸持在土壤中的氟喹诺酮类抗生素能够缓慢释放进入环境当中.这与在预实验过程中, 3种氟喹诺酮类抗生素在多次重复解吸下均基本等量释放(即每次解吸后溶液中的平衡浓度基本相同)的结果相符合,这也与报道中的研究结果一致[33],表明该类抗生素在固相基质的吸附位点积累,然后再慢慢释放到环境中.
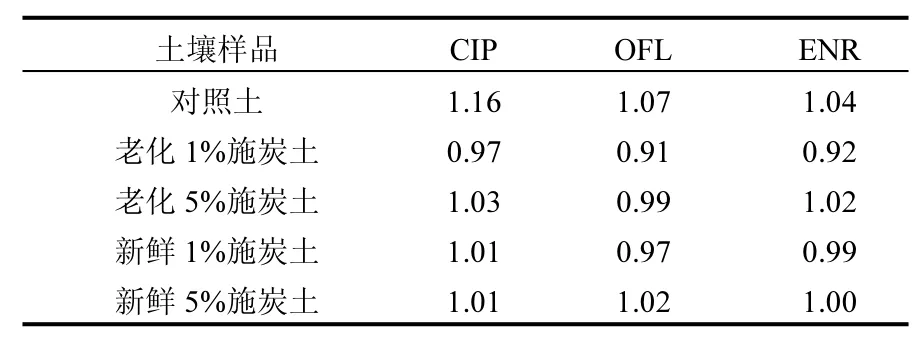
表7 各处理土壤中抗生素的解吸迟滞系数Table 7 Hysteresis coefficient (HI) of desorption of antibiotics from soils of different treatments
综上,生物炭对抗生素在紫色土中吸附-解吸过程的影响并不简单表现为促进或抑制作用,田间老化是一个不可忽略的影响因素,它会导致与采用新鲜生物炭进行室内模拟实验结果的差异性.生物炭的类型及田间施用后的长期效应还需更深入的探讨.
3 结论
3.1 土壤施炭后,有机碳、pH值及阳离子交换量都有不同程度的增加;新鲜施炭后,土壤中的溶解性有机物显著增加.
3.2 氟喹诺酮类抗生素在紫色土中的吸附很强,均能达到初始投加量的95%左右,并表现为:环丙沙星>氧氟沙星>恩诺沙星;新鲜施用生物炭不利于环丙沙星和氧氟沙星的吸附,但有利于恩诺沙星的吸附,而经田间老化后,抗生素的吸附容量均有明显的提高.
3.3 抗生素在紫色土中基本无解吸迟滞现象,在老化施炭土的解吸程度均小于新鲜施炭土;施炭促进了环丙沙星和氧氟沙星的解吸,而对恩诺沙星解吸的影响不显著.
[1]Tolls J. Sorption of Veterinary Pharmaceuticals in Soils: AReview [J]. Environmental Science & Technology, 2001,35(17):3397-3406.
[2]Wang S L, Wang H. Adsorption behavior of antibiotic in soil environment: a critical review [J]. Frontoiers of Environmental Science & Engineering, 2015,9(4):565-574.
[3]Xie Y, Li X W, Wang J F, et al. Spatial estimation of antibiotic residues in surface soils in a typical intensive vegetable cultivation area in China [J]. Science of the Total Environment, 2012,430(14):126-131.
[4]Li Y W, Wu X L, Mo C H, et al. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River Delta Area, Southern China [J]. Journal of Agricultural and Food Chemistry, 2011,59(13):7268-7276.
[5]刘 锋,廖德润,李 可,等.畜禽养殖基地磺胺类喹诺酮类和大环内酯类抗生素污染特征 [J]. 农业环境科学学报, 2013, 32(4):847-853.
[6]HouJ, Wan W, Mao D, et al. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China [J]. Environmental Science and Pollution Research, 2015,22(6):4545-4554.
[7]邰义萍,莫测辉,李彦文,等.长期施用粪肥土壤中喹诺酮类抗生素的含量与分布特征 [J]. 中国环境科学, 2010,30(6):816-821.
[8]Antal M J, Gronli M. The art, science and technology of charcoal production [J]. Industrial and Engineering Chemistry Research, 2003,42(8):1619-1640.
[9]Cao X, Ma L, Gao B, et al. Dairy-manure derived biochar effectively sorbs lead and atrazine [J]. Environmental Science & Technology, 2009,43(9):3285-3291.
[10]Yao Y, Gao B, Chen H, et al. Adsorption of sulfamethoxazole on biochar and its impact on reclaimed water irrigation [J]. Journal of Hazardous Materials, 2012,209:408—413.
[11]Cornelissen G, Gustafsson O, Bucheli T D, et al. Extensive sorption of organic compounds to black carbon, coal, and kerogen in sediments and soils: mechanisms and consequences for distribution, bioaccumulation, and biodegradation [J]. Environmental Science & Technology, 2005,39(18):6881—6895.
[12]Chang Y J, Jim J W, Syam K D, et al. Effect of Biochar Amendment on Tylosin Adsorption—Desorption and Transport in Two Different Soils [J]. Journal of Environmental Quality, 2012, 41(4):1185-1192.
[13]王 宁,侯艳伟,彭静静,等.生物炭吸附有机污染物的研究进展[J]. 环境化学, 2012,3(3):287-296.
[14]Sorrenti G, Masiello C A, Dugan B, et al. Biochar physicochemical properties as affected by environmental exposure [J].Science of the Total Environment, 2016,563:237-246.
[15]李仲明,张先婉,何毓蓉,等.中国紫色土(上) [M]. 北京:科学出版社, 1991:1-10.
[16]徐开未,张小平,陈远学,等.石灰性紫色土上花生的平衡施肥探讨 [J]. 西南农业学报, 2003(s1).16:108-112.
[17]张芊芊.中国流域典型新型有机污染物排放量估算、多介质归趋模拟及生态风险评估 [D]. 广州:中国科学院广州地球化学研究所, 2015:98-103.
[18]唐 伟,郭 悦,吴景贵,等.老化的生物质炭性质变化及对菲吸持的影响 [J]. 环境科学, 2014,35(7):2604-2611.
[19]Sorrenti G, Masiello C A, Dugan B, et al. Biochar physicochemical properties as affected by environmental exposure [J]. Science of the Total Environment, 2016,563-564:237-246.
[20]Kuzyakov Y, Bogomolova I, Glaser B. Biochar stability in soil:Decomposition during eight years and transformation as assessed by compound-specific 14C analysis [J]. Soil Biology & Biochemistry, 2014,70(6):229-236.
[21]Li J R, Wang Y X, Wang X, et al. Intercalation and adsorption of ciprofloxacin by layered chalcogenides and kinetics study [J]. Journal of Colloid and Interface Science, 2015,453:69-78.
[22]Nowara A, Burhenne J, Spiteller M. Binding of fluoroquinolone carboxylic acid derivatives to clay minerals [J]. Journal of Agricultural and Food Chemistry, 1997,45(4):1459-1463.
[23]陈 淼,唐文浩,葛成军,等.生物炭对环丙沙星在热带土壤中吸附行为的影响 [J]. 热带作物学报, 2015,36(12):2260-2268.
[24]陈 淼,唐文浩,葛成军,等.蔗渣生物炭对砖红壤吸附氧氟沙星的影响 [J]. 环境工程学报, 2015,10(9):5083-5090.
[25]Chen G L, Li M, Liu X. Fluoroquinolone Antibacterial Agent Contaminants in Soil/Groundwater: A Literature Review of Sources, Fate, and Occurrence [J]. Water Air & Soil Pollution, 2015,226(12):418.
[26]Liu X, Zhang J, Zhang C L, et al. Sorption of norfloxacin by lotus stalk-based activated carbon and iron-doped activated alumina:Mechanisms, isotherms and kinetics [J]. Chemical Engineering Journal, 2011,171(2):431-438.
[27]Yang W B, Lu Y P, Zheng F F, et al. Adsorption behavior and mechanisms of norfloxacin onto porous resins and carbon nanotube [J]. Chemical Engineering Journal, 2012,179(1):112-118.
[28]Turiel E, Martin-Esteban A, Tadeo J L. Multiresidue analysis of quinolones and fluoroquinolones in soil by ultrasonic-assisted extraction in small columns and HPLC-UV [J]. Analytica Chimica Acta, 2006,562(1):30—35.
[29]Mukherjee A, Zimmerman A R. Organic carbon and nutrient release from a range of laboratory-produced biochars and biochar—soil mixtures [J]. Geoderma, 2013,s193—194(2):122-130.
[30]Vasudevan D, Bruland G L, Torrance B S. pH dependent ciprofloxacin sorption to soils: interactions mechanisms and soilfactors influencing sorption [J]. Geoderma, 2009,151(3/4):68-76.
[31]Conkle J L, Lattao C, White J R, et al. Competitive sorption and desorption behavior for three fluoroquinolone antibiotics in a wastewater treatment wetland soil [J]. Chemosphere, 2010,80(11):1353-1359.
[32]Doretto K M, Peruchi L M, Rath S. Sorption and desorption of sulfadimethoxine, sulfaquinoxaline and sulfamethazine antimicrobials in Brazilian soils [J]. Science of The Total Environment, 2014,476-477:406-414.
[33]Sassman S A, Lee L S. Sorption of three tetracyclines by several soils: assessing the role of pH and cation exchange [J]. Environmental Science & Technology, 2005,39(19):7452-7459.
Effects of biochar on adsorption-desorption of fluoroquinolones in purple soil
XUAN Pan-pan1,2, TANG Xiang-yu2,XIAN Qing-song2, LIU Chen2*, YANG Fei1, HUANG Yue-hua1(1.College of Environment and Plant Protection, Hainan University, Haikou 570228, China;2.Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu 610041, China). China Environmental Science, 2017,37(6):2222~2231
Effects of biochar application (at rates of 1 wt.% and 5 wt.%) and alternative dry-wet process of ageing (from May to November in field) on the sorption-desorption of three fluoroquinolones (ciprofloxacin, ofloxacin and enrofloxacin) were studied using a sloping cropland calcareous purple soil. The soil is abundantly distributed in the upper reaches of the Yangtze River. The absorption-desorption isotherms were fitted well by Freudlich equation, with all of the relevant coefficients being highly significant. The freshly-applied biochar decreased the adsorption of ciprofloxacin and ofloxacin to the soil, but enhanced that of enrofloxacin and such effect was positively correlated with the biochar application rate. Obvious increase in the content of dissolved organic matter in soil solutions was observed after addition of fresh biochar, which may play an important role in decreasing the adsorption of the antibiotics, but such increase was weakened after ageing. After ageing process, increased absorption of three antibiotics was observed in the soil amended with 1 wt.%biochar (P>0.05), while no difference was observed between the 5 wt.% biochar treatment and the control. Biochar addition also enhancedthe extent of desorption of ciprofloxacin and ofloxacin, but the aged biochar decreased the desorption of enrofloxacin. No apparent adsorption-desorption hysteresis was observed for all tested soils with different biochar treatments.
biochar;fluoroquinolones;purple soil;adsorption-desorption;ageing
X505,X53
A
1000-6923(2017)06-2222-10
轩盼盼(1991-),女,河南商丘人,海南大学硕士研究生,研究方向土壤有机污染物的迁移行为.
2016-11-08
国家自然科学基金资助项目(41471268,41301549);中西部高校项目资助项目(MWECSP-RT08, ZXBJH-XK004, ZXBJHXK005)
* 责任作者, 助理研究员, chen1017@imde.ac.cn
