早期肠内营养联合锦红汤对重症急性胰腺炎患者肠黏膜屏障的影响
2017-06-28许文捷朱培庭钮宏文
许文捷,朱培庭,高 炬,钮宏文
论著
早期肠内营养联合锦红汤对重症急性胰腺炎患者肠黏膜屏障的影响
许文捷1,朱培庭2,高 炬1,钮宏文1
目的:探讨早期肠内营养联合锦红汤对重症急性胰腺炎(SAP)患者血浆中炎性介质的影响。方法:选取66例SAP患者,随机分为肠外营养(PN)组、肠内营养(EN)组、锦红汤合EN组各22例。分别测定治疗前及治疗后3 d和8 d的血浆炎症介质TNF-α、IL-6、降钙素原、C-反应蛋白、D-乳酸和血浆淀粉酶与脂肪酶的水平。结果:3组治疗后血浆各炎症介质及淀粉酶、脂肪酶均较治疗前明显改善(P<0.05);D乳酸水平较治疗前明显升高(P<0.05)。EN组治疗后3 d及8 d血浆IL-6、TNF-α、降钙素原、C-反应蛋白、淀粉酶、脂肪酶分别为(68.85±15.99)ng/L、(29.11±9.15)ng/L、(2.88±2.27)ng/mL、(279.23± 87.43)mg/L、(817±264)U/L、(1399±288)U/L和(41.97±11.11)ng/L、(12.37±8.01)ng/L、(1.86±1.05)ng/mL、(120.78±34.45)mg/L、(250±78)U/L、(305±91)U/L,均较PN组显著降低(P<0.05)。锦红汤合EN组治疗后3 d、8 d血浆IL-6、TNF-a、降钙素原、C-反应蛋白、淀粉酶、脂肪酶分别为(59.42±12.62)ng/L、(26.21±9.74)ng/L、(2.01±1.87)ng/mL、(246.32±70.74)mg/L、(621±204)U/L、(1266±223)U/L和(29.11±9.11)ng/L、(10.91±6.91)ng/L、(0.98±0.75)ng/mL、(109.34±27.58)mg/L、(196±59)U/L、(216±74)U/L,亦均较PN组和EN组显著降低(P<0.05);D-乳酸治疗后3 d 3组水平无明显差异(P>0.05),治疗后8 d,EN组为(12.20± 2.47)mg/L较PN组明显降低,锦红汤合EN组为(10.01±2.36)mg/L较EN组明显降低(P<0.05)。结论:早期肠内营养联合锦红汤能降低SAP患者血浆中炎性介质的水平,改善肠黏膜屏障,促进患者康复。
重症急性胰腺炎;肠内营养;炎性介质;肠黏膜屏障;锦红汤
重症急性胰腺炎(severe acute pancreatitis,SAP)迄今仍是一种并发症多、病死率高、治疗棘手的外科急症,主要恶化因素为全身性炎性反应综合征,肠道的屏障功能障碍被认为是其始动因素。当今学术界普遍认为,对SAP患者采用早期肠内营养,可有效保护肠黏膜屏障,防止细菌移位,改善患者预后。中医联合治疗可进一步调整肠道菌群,减少细菌移位、减轻内毒素血症。本研究按照随机分组方法,选择2013年1月—2016年6月本院收治的22例SAP患者,在早期肠内营养中加入中药锦红汤,观察中医联合治疗对肠黏膜屏障的影响。
1 资料与方法
1.1 研究对象 本组共66例,男36例,女30例;年龄26~81岁,平均(45.6±15.1)岁。胆源性胰腺炎36例,高脂血症16例,饮酒暴食12例,病因不明2例。诊断符合《急性胰腺炎诊治指南》。排除机械性肠梗阻、肠道占位、免疫力低下者。采用前瞻性随机单盲设计原则分为肠外营养(parenteral nutrition,PN)组、肠内营养(enteral nutrition,EN)组、锦红汤合EN组,3组年龄、性别、病程、病情、影像学及实验室检查等比较差异均无统计学意义(P>0.05),有可比性,见表1。
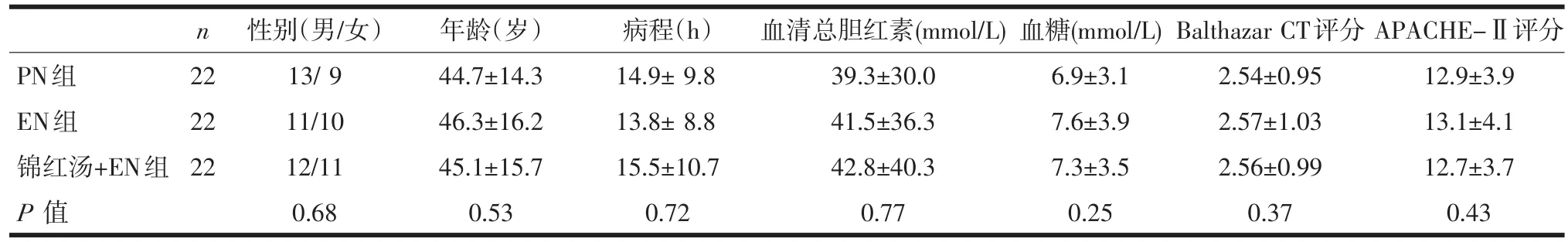
表1 3组患者的一般资料比较
1.2 治疗方法 PN组给予深静脉置管营养支持,按照每日104~146 kJ/kg热量和氮0.15~0.20 g/kg标准,根据患者的耐受情况稍作调整。肠外营养素选用20%力能和乐凡命(华瑞公司)。EN组于入院24 h内置入鼻饲管至Treitz韧带下30~40 cm,连续24 h泵入纤维素型肠内制剂选用百普素(荷兰纽迪希亚公司)。锦红汤合EN组在EN组治疗基础上,从鼻饲管内注入锦红汤(大黄,蒲公英,红藤),2次/d,每次150 mL。3组均给予抑制胰腺分泌、抑酸、补液、补充电解质和血容量、对症支持、预防感染等综合治疗。
1.3 观察指标 分别于治疗前及治疗后3 d和8 d早7:00取静脉血8 mL,分离血浆贮于-80℃冰箱中。降钙素原(PCT)采用电化学发光法,血浆白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),D-乳酸采用双抗体夹心ABC-ELISA法测定,C-反应蛋白(CRP)采用比浊法检测。同时检测3组患者血淀粉酶(AMY)、脂肪酶(LPS)。
1.4 统计学方法 采用SPSS 15.0软件进行数据统计。符合正态分布的计量资料采用均数±标准差(±s)描述,不符合正态分布的计量资料采用中位数描述,计量资料采用t检验,计数资料采用χ2检验,Fisher’s精确检验,以P<0.05为显著性差异标准。
2 结果
2.1 血浆TNF-α、IL-6的变化 3组治疗后血浆TNF-α、IL-6均较治疗前明显改善(P<0.05)。EN组治疗后3 d、8 d血浆IL-6、TNF-α水平均较PN组显著降低(P<0.05),锦红汤合EN组治疗后3 d、8 d血浆IL-6、TNF-α水平亦均较PN组显著降低(P<0.05)。锦红汤合EN组在治疗后3 d、8 d血浆IL-6、TNF-a水平均较EN组显著降低(P<0.05),见表2。
2.2 血浆PCT、CRP的变化 3组治疗后血浆PCT、CRP均较治疗前明显改善(P<0.05)。EN组治疗后3 d、8 d血浆PCT、CRP均较PN组显著降低(P<0.05),EN组和锦红汤合EN组治疗后3 d、8 d血浆PCT、CRP均较PN组显著降低(P<0.05)。锦红汤合EN组在治疗后3 d、8 d血浆PCT、CRP较EN组显著降低(P<0.05)。见表3。
表2 3组血浆TNF-a,IL-6比较(n=22,±s,ng/L)

表2 3组血浆TNF-a,IL-6比较(n=22,±s,ng/L)
注:与同组治疗前比较,aP<0.05;与PN组同期比较,bP<0.05;与EN组同期比较,cP<0.05
TNF-a IL-6 PN组治疗前48.12±9.98 91.86±20.34治疗3 d 36.75±9.41a 76.34±17.53a治疗8 d 15.73±9.33a 47.65±9.71a EN组治疗前47.51±10.12 92.01±21.01治疗3 d 29.11±9.15a、b 68.85±15.99a、b治疗8 d 12.37±8.01a、b 41.97±11.11a、b锦红汤+EN组治疗前48.58±10.35 90.75±19.46治疗3 d 26.21±9.74a、b 59.42±12.62a、b治疗8 d 10.91±6.91a、b、c 29.11±9.11a、b、c
表3 3组血浆PCT、CRP比较(n=22,±s)

表3 3组血浆PCT、CRP比较(n=22,±s)
注:与同组治疗前比较,aP<0.05;与PN组同期比较,bP<0.05;与EN组同期比较,cP<0.05
PCT CRP PN组治疗前5.73± 2.89 330.98±122.32治疗3 d 4.36±1.77a 299.64±95.32a治疗8 d 2.11±1.12a 165.85±37.76a EN组治疗前6.11± 3.05 321.11±113.21治疗3 d 2.88±2.27a、b 279.23±87.43a、b治疗8 d 1.86±1.05a、b 120.78±34.45a、b锦红汤+EN组治疗前6.13± 2.81 336.49±130.99治疗3 d 2.01±1.87a、b、c 246.32±70.74a、b、c治疗8 d 0.98±0.75a、b、c 109.34±27.58a、b、c
2.3 AMY、LPS的变化 3组治疗后血AMY、LPS均较治疗前明显改善(P<0.05)。EN组治疗后3 d、8 d的AMY、LPS较PN组显著降低(P<0.05),EN组和锦红汤合EN组治疗后3 d、8 d的AMY、LPS较PN组显著降低(P<0.05)。锦红汤合EN组在治疗后3 d、8 d的AMY、LPS较EN组显著降低(P<0.05)。见表4。
表4 3组血AMY、LPS比较(n=22,±s,U/L)
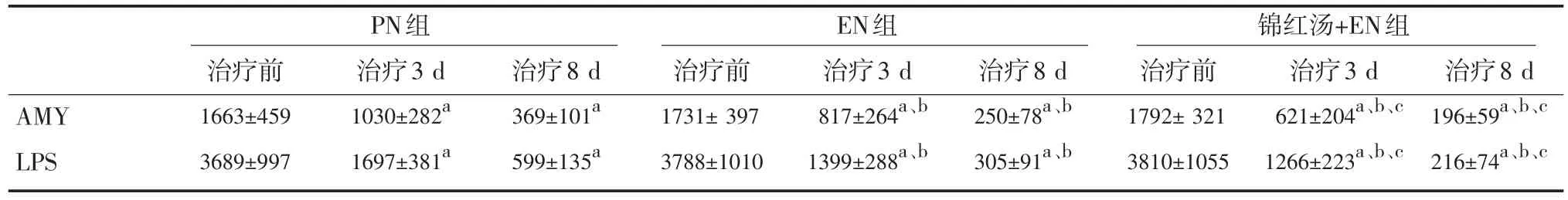
表4 3组血AMY、LPS比较(n=22,±s,U/L)
注:与同组治疗前比较,aP<0.05;与PN组同期比较,bP<0.05;与EN组同期比较,cP<0.05
AMY LPS PN组治疗前1663±459 3689±997治疗3 d 1030±282a 1697±381a治疗8 d 369±101a 599±135a EN组治疗前1731±397 3788±1010治疗3 d 817±264a、b 1399±288a、b治疗8 d 250±78a、b 305±91a、b锦红汤+EN组治疗前1792±321 3810±1055治疗3 d 621±204a、b、c 1266±223a、b、c治疗8 d 196±59a、b、c 216±74a、b、c
2.4 D-乳酸的变化 3组治疗后D-乳酸均较治疗前明显升高(P<0.05),3组间治疗后3 d的D-乳酸水平无明显差异(P>0.05)。治疗后8 d,D-乳酸水平虽处于高位,但EN组和锦红汤合EN组较PN组显著降低(P<0.05),锦红汤合EN组较EN组显著降低(P<0.05)。见表5。
表5 3组D-乳酸的比较(n=22,±s,mg/L)

表5 3组D-乳酸的比较(n=22,±s,mg/L)
注:与同组治疗前比较,aP<0.05;与PN组同期比较,bP<0.05;与EN组同期比较,cP<0.05
D-乳酸PN组治疗前6.54±1.28治疗3 d 9.76±2.68a治疗8 d 14.76±3.88a EN组治疗前5.98±1.16治疗3 d 10.10±2.90a治疗8 d 12.20±2.47a、b锦红汤+EN组治疗前6.88±1.08治疗3 d 10.44±2.98a治疗8 d 10.01±2.36a、b、c
3 讨论
SAP病情凶险,预后不良,并发症多,治疗棘手。近年来随着研究的深入,发现胰腺的损伤与肠道之间存在着密切的联系,肠道是应激反应的中心之一,炎症介质介导的肠道屏障损伤是SAP重要的病理生理变化之一[1-2]。炎症因子可破坏肠道黏膜上皮结构,增加黏膜通透性,直接导致细菌和(或)内毒素移位,肠道细菌、内毒素进入体循环引起肠源性内毒血症,并刺激活化的单核和巨噬细胞释放过量的细胞因子和炎性介质,诱发和(或)加重全身炎症反应,进一步加重胰腺炎病情,对机体产生“二次打击”,甚至导致多器官脏器功能衰竭,加速患者死亡[3-4]。此外,长期禁食也会引起黏膜萎缩,加快肠上皮细胞凋亡,从而破坏肠道屏障功能的完整性。营养治疗对SAP患者至关重要,可以刺激肠黏膜细胞生长,促进胃肠道激素分泌,保持肠黏膜结构完整,保障肠道固有菌群正常。但长期应用PN也会引起肠道功能衰竭,对SAP患者进行EN治疗可以保持肠道黏膜屏障功能稳定,减少内毒素与细菌移位,从而降低脓毒性并发症的发生率[5]。因此,保护SAP患者肠道屏障功能具有重要的临床意义。
在SAP发生发展过程中,多种炎性细胞因子起了重要的作用。其中TNF-α是参与炎症反应的最重要因子之一,在一定条件下对机体有利,但若产生过多或失调,会引起一系列炎性损害,为SAP中最早升高的细胞因子,对细胞因子级联释放具有重要意义,是评估SAP预后的主要指标[6]。TNF-α作为重要的始发因子与其它细胞因子和炎性介质引起多种因素形成的级联反应,诱导IL-2、IL-6和其他一系列细胞因子的产生,导致局部缺血和血栓形成,通过激活炎症细胞及其系列反应从而导致炎症介质的瀑布释放而造成广泛的组织损害[7]。 我们的研究发现,肠内营养组血浆炎性介质TNF-α和IL-6,在SAP治疗中,第3 d与第8 d的改善均比肠外营养组明显(P<0.05),说明肠内营养能减低SAP早期炎性介质的水平。其机理可能是EN有效改善肠道屏障功能,减少肠道细菌移位的发生,从而减低了炎症反应。PCT是一个全身性炎症标志物,在外周血血清中可测出浓度含量,是严重炎症的早期标志物,是反映全身感染的敏感、特异性指标[8]。作为非特异性抗炎因子,CRP是机体在应激状态下由肝脏合成的一种急性期反应蛋白,CRP水平的变化可在一定程度上反映机体应激反应水平的高低。本研究显示,SAP早期外周血血清PCT和CRP水平变化程度与治疗方式有一定的相关性,PN与EN治疗后第3 d,第8 d的PCT和CRP均有下降趋势,但EN组比PN组更加明显(P<0.05)。结果显示,EN能够抑制全身炎性反应,降低应激反应。
正常情况下,肠黏膜屏障功能正常,肠黏膜上皮细胞和细胞间的紧密连接可以有效阻止细菌、毒素等大分子物质通过。当病理状态时,肠上皮细胞和紧密连接受到破坏,肠黏膜通透性增加,细菌及其毒素等物质即可通过肠道入血,迸一步放大炎症反应。D-乳酸是由多种肠道细菌产生的代谢产物,由于哺乳动物机体组织不产生D-乳酸,体内亦无快速代谢酶系统,血清D-乳酸几乎全部来源于肠道细菌。正常情况下,D-乳酸作为大分子物质难以通过肠黏膜屏障进入血液,只有当肠道黏膜屏障出现破坏导致其通透性增加时才可能于外周血中检测出D-乳酸的存在。多项研究表明,D-乳酸是测量肠道黏膜功能尤其是肠黏膜机械屏障功能损害程度的敏感指标[9-10]。从理论上讲,PN可以导致肠黏膜萎缩,并继发肠黏膜屏障的损伤致其通透性增加引起细菌移位,导致胰腺、胰周坏死感染并引发败血症。EN能够维持肠道的完整性,增加肠道血流,刺激肠道收缩并释放免疫调节物质,抑制氧化应激和SIRS,减少细菌移位,降低感染风险[11-12]。本研究发现,PN组和EN组治疗后3 d的D-乳酸水平比治疗前虽有明显升高趋势,但二组之间无明显差异(P>0.05)。治疗后8 d,虽然D-乳酸水平仍处于上升阶段,但EN组水平低于PN组(P<0.05)。说明重症胰腺炎经过一周的炎性反应期后,肠道的黏膜通透性增加,处于感染的敏感期。治疗后8 d,EN组的水平低于PN组。说明重症胰腺炎早期肠内营养干预,可以降低肠黏膜通透性,减少细菌移位,从而减少感染的发生率。
SAP的症状和体征与中医古籍文献中的“胃脘痛”、“腹痛”、“胁痛”、“脾心痛”、“膈痛”、“结胸”等相似,属“胰瘅”范畴。祖国医学认为,本病主要因腑气壅实不通,实热蕴结于肠胃的阳明腑实证。著名中医及中西医结合专家顾伯华、徐长生根据本病的临床表现,遵“六腑以通为用”的理论,自创锦红汤治之,临床每获良效。方中大黄别名锦纹,味苦寒,《神农本草经》载:“破症瘕积聚,留饮宿食,荡涤肠胃,推陈致新,通利水谷,调中化食,安和五脏。”是清热通下之要药,为方中之君[13];红藤长于清热解毒、消痈止痛,与大黄配伍,能增强大黄的清热泻火之功,是为臣药(锦红之名即由方中君、臣药而来);蒲公英长于清热解毒消痈,剂量大时还有通下作用,与大黄、红藤合用,既可增加全方的清热通下功效,又能弥补大黄、红藤利湿方面的相对不足。三药合用,共奏清热解毒、通里攻下之功。本研究结果显示,治疗后第3 d,EN组和中药联合组TNF-α、IL-6、PCT、CRP平均较治疗前有一定程度的下降,但中药联合组显著低于EN组(P<0.05)。至治疗后第8 d,中药联合组TNF-α、IL一6、PCT、CRP水平均进一步下降,两组比较有显著性意义(P<0.05)。提示锦红汤具有下调机体血浆TNF-α、IL-6、PCT、CRP水平,从而抑制全身过度炎性反应、减轻应激反应,维持机体的功能的相对稳定的作用。而D-乳酸水平在治疗后8 d中医药联合组上升缓慢,明显低于EN组(P<0.05)。提示锦红汤具有保护重症胰腺炎肠黏膜屏障的功能,这可能与锦红汤清热解毒,通里攻下,促进胃肠蠕动,通过保护肠黏膜屏障功能,进而防止细菌和内毒素移位入血,避免对机体造成“二次打击”有关[14-15]。
早期EN可明显减少炎症介质的释放,同时联合中药锦红汤可进一步减少炎症介质,维护肠道黏膜屏障的完整,恢复肠道功能,从而减少SAP患者并发症的发生,改善预后。
[1]Capurso G,Zerboni G,Signoretti M,et al.Role of the gut barrier in acute pancreatitis[J].J Clin Gastroenterol,2012,46 Suppl: S46-51.
[2]Landahl P,Ansari D,Andersson R.Severe Acute Pancreatitis:Gut Barrier Failure,Systemic Inflammatory Response,Acute Lung Inju⁃ry,and the Role of the Mesenteric Lymph[J].Surg Infect,2015,16 (6):651-656.
[3]Warshaw AL.Improving the treatment of necrotizing pancreatitis-a step up[J].N Engl J Med,2010,362(16):1535-1537.
[4]Besselink MG,van Santvoort HC,Buskens E,et al.Probiotic pro⁃phylaxis in predicted severe acute pancreatitis:a randomized,dou⁃ble-blind,placebo-controlled trial[J].Lancet,2008,371(9613): 651-659.
[5]Merilainen S,Makela J,Koivukangas V,et al.Intestinal bacterial translocation and tight junction structure in acute porcine pancre⁃atitis[J].Hepatogastroenterology,2012,59(114):599-606.
[6]Tian H,Zhang X,Wu C,et al.Effects of Baicalin and Octreotide on the serum TNF-alpha level and apoptosis in multiple organs of rats with severe acute pancreatitis[J].Inflammation,2009,32(3): 191-201.
[7]Gregoric P,Sijacki A,Stankovic S,et al.SIRS score on admission and initial concentration of IL-6 as severe acute pancreatitis out⁃come predictors[J].Hepatogastroenterology,2010,57(98):349-354.
[8]Rau BM,Kemppainen EA,Gumbs AA,et al.Early assessment of pancreatic infections and overall prognosis in severe acute pancre⁃atitis by procalcitonin(PCT):a prospective international multi⁃center study[J].Ann Surg,2007,245(5):745-753.
[9]Li Y,Chen Y,Zhang J,Zhu JF,et al.Protective effect of gluta⁃mine-enriched early enteral nutrition on intestinal mucosal barrier injury after liver transplantation in rats[J].Am J Surg,2010,199(1): 35-42.
[10]Zhao Y,Qin G,Sun Z,et al.Effects of soybean agglutinin on intes⁃tinal barrier permeability and tight junction protein expression in weaned piglets[J].Int J Mol Sci,2011,12(12):8502-8512.
[11]Vieira JP,Araujo GF,Azevedo JR,et al.Parenteral nutrition ver⁃sus enteral nutrition in severe acute pancreatitis[J].Acta Cir Bras, 2010,25(5):449-454.
[12]Cao Y,Xu Y,Lu T,et al.Meta-analysis of enteral nutrition ver⁃sus total parenteral nutrition in patients with severe acute pancre⁃atitis[J].Ann Nutr Metab,2008,53(3):268-275.
[13]章学林,王玉凤,梁晓强,等.大黄及大黄素对大鼠胰腺细胞外基质降解作用的影响[J].上海中医药杂志,2012,46(6):95-97.
[14]许文捷,朱培庭,高炬,等.早期肠内营养联合锦红汤对重症急性胰腺炎患者血浆中炎性介质的影响[J].中国中西医结合外科杂志,2014,20(4):346-349.
[15]方邦江,高培阳,何松华,等.通下化瘀方早期干预重症急性胰腺炎胰腺微循环紊乱的临床研究[J].中西医结合学报,2007,5(2): 134-136.
(收稿:2016-12-10 修回:2017-02-20)
(责任编辑 齐清会)
Effects of Intestinal Mucosal Barrier in Early Enteral Nutrition with Jinhong Decoction in Patients with Severe Acute Pancreatitis
XU Wen-jie,ZHU Pei-ting,GAO Ju,et al.
Department of Surgery,Shu Guang Hospital,Affiliated Shanghai University of Traditional Chinese Medicine,Shanghai(201203),China
ObjectiveTo investigate the effect of intestinal mucosal barrier in the early enteral nutrition (EN)supplemented with Jinhong decoction in patients with severe acute pancreatitis(SAP).MethodsSixtysix SAP cases were randomly assigned into parenteral nutrition(PN)group,enteral nutrition(EN)group and Jin⁃hong decoction added EN(J+EN)group.In J+EN group,patients were given the nutrition same as that of EN,but added by Jinhong decoction.Blood samples were collected for the measurements of interleukin-6(IL-6)and tu⁃mor necrosis factor(TNF-α)by enzyme linked immunosorbent assay,and for C-reactive protein(CRP),procalcito⁃nin(PCT),amylase and lipase by biochemical assay the day before intervention of nutrition and on the 3rd and 8th days after intervention.ResultsThe plasma levels of inflammatory mediators,amylase and lipase were sig⁃nificantly reduced after nutritional intervention as compared with their levels on the day before intervention in all three groups.The plasma levels of IL-6,TNF-α,CRP,PCT,amylase and lipase in EN group were(68.85± 15.99)ng/L、(29.11±9.15)ng/L、(2.88±2.27)ng/mL、(279.23±87.43)mg/L、(817±264)U/L、(1399±288)U/L at the third day after treatment,and(41.97±11.11)ng/L、(12.37±8.01)ng/L、(1.86±1.05)ng/mL、(120.78± 34.45)mg/L、(250±78)U/L、(305±91)U/L at the eighty day after treatment,respectively.They were significant⁃ly less than those in PN group on the 3rd and 8th days.The plasma levels of IL-6,TNF-α,CRP,PCT,amylase and lipase at the 3rd day after intervention of nutri⁃tion in J+EN group were(59.42±12.62)ng/L、(26.21± 9.74)ng/L、(2.01±1.87)ng/mL、(246.32±70.74)mg/L、(621±204)U/L、(1266±223)U/L,and(29.11±9.11)ng/L、(10.91±6.91)ng/L、(0.98±0.75)ng/mL、(109.34±27.58) mg/L、(196±59)U/L、(216±74)U/L at the eight day.They were significantly less than those in PN group and EN group.The levels of D-lactic acid in three groups had no significant difference at the 3rd day after treatment. The D-lactic acid level in EN group at the 8th day was(12.20±2.47)mg/L,less than that in J+EN group(10.01± 2.36)mg/L.ConclusionEarly EN with Jinhong decoction would result in significant lowering levels of pro-in⁃flammatory cytokines and improve intestinal mucosal barrier,promote the recovery of SAP patients.
Severe acute pancreatitis;enteral nutrition;intestinal mucosal barrier;inflammatory mediators;Jinhong decoction
R657.5+1
A
1007-6948(2017)03-0223-05
10.3969/j.issn.1007-6948.2017.03.001
1.上海中医药大学附属曙光医院外科(上海 201203)
2.上海中医药大学附属龙华医院外科(上海 201203)
钮宏文,E-mail:hwniu@hotmail.com
