一种脂肪酶催化合成蔗糖酯反应的工艺优化
2017-06-28杜理华蒋志鹏
杜理华,沈 乐,蒋志鹏
(浙江工业大学 药学院,浙江 杭州 310014)
一种脂肪酶催化合成蔗糖酯反应的工艺优化
杜理华,沈 乐,蒋志鹏
(浙江工业大学 药学院,浙江 杭州 310014)
以脂肪酶TL IM(Thermomyceslanuginosus)为催化剂,以DMSO/叔戊醇为溶剂催化合成蔗糖与乙酸乙烯酯反应.实验系统地研究了脂肪酶催化合成蔗糖酯的影响因素,对溶剂比、底物的摩尔比、反应温度和时间进行探讨.研究结果表明:溶剂、底物摩尔比、温度及反应时间等方面对蔗糖酯化反应有不同程度上的影响.
脂肪酶;蔗糖酯;酯化反应;催化
表面活性剂,是指加入一定量就可以使溶液界面的状态发生明显变化,是能够产生润湿、乳化、起泡和增溶等作用的物质[1].蔗糖脂肪酸酯简称蔗糖酯,以蔗糖作为亲水基团,脂肪酸或脂肪醇作为亲油基团,这些特殊的基团能使其在溶液的表面铺张排列,因此蔗糖酯是一种天然的表面活性剂.除了能使溶液界面状态发生明显改变外,以糖酯作为表面活性剂还具有许多独特的作用[2]:糖基具有许多个羟基的极性,具有较强的亲水性;可降解有机物,使表面活性剂具有良好的生物降解性能;具有一定络合金属离子的作用,使得糖基非离子表面活性剂能够抗硬水;使表面活性剂具有一定的抑菌作用等.当前以糖为亲水基团开发的糖类表面活性剂已成为研究的热点领域[3],已广泛应用于石化能源、食品医药和化工材料等行业[4].研究发现:在药物衍生物结构修饰设计上加入糖基能改善药物亲疏平衡性,能加强药物对生物膜的吸附作用,提高药物生物利用度.为开发药物的新疗效和新型药物的研究提供了思路与方法.
过去糖酯多采用化学法合成,在高温高压下对羟基修饰合成,条件苛刻,对设备反应器要求比较高[5].自从Klibanov[6]开辟了非水酶学的研究领域以来,非水介质中的酶促催化合成的方法已经成为有机合成中一种非常重要的工具[7].酶催化反应具有反应条件温和、无污染、反应专一性和高效选择性等优点.使用酶催化合成蔗糖酯[8-9]能节约反应原料,提高筛选效率,从而能够节约成本,符合绿色化学思路[10].
1 实验部分
1.1 实验试剂
蔗糖(AR,国药集团化学试剂有限公司),月桂酸乙烯酯(AR,东京仁成工业株式会社),棕榈酸乙烯酯(AR,东京仁成工业株式会社),乙酸乙烯酯(AR,江苏永华精细化学品有限公司),叔戊醇(AR,国药集团化学试剂有限公司),DMSO(AR,无锡海硕生物有限公司),甲醇(AR,衢州巨化试剂有限公司),乙酸乙酯(AR,杭州双林化工试剂厂),Lipozyme TL IM(Novo Nordisk),硅胶薄板(G60,烟台江友硅胶开发有限公司),柱层析硅胶(300~400目,烟台江友硅胶开发有限公司),玻璃点样毛细管(华西医科大学仪器厂),其他主要试剂都为分析纯.
1.2 实验器材
电子天平(BS224,赛多利斯科学仪器厂),数显水浴恒温振荡器(SHA-C,金坛市江南仪器厂),真空干燥箱(XMTD-8222,上海精宏实验设备有限公司),三用紫外分析仪(ZF-I,上海顾村电光仪器厂),循环水式多用真空泵(SHB-III-A,杭州大卫科教仪器有限公司),低温冷却液循环泵(DLSB-200,杭州大卫科教仪器有限公司),磁力搅拌器(85-1,杭州大卫科教仪器有限公司),旋转蒸发仪(RE-2000,上海亚荣生化仪器厂),核磁共振仪NRM(AVANCE Ⅲ,瑞士Bruker公司,TMS内标),三用紫外分析仪(ZF-I,上海顾村电光仪器厂).
1.3 实验方法
称取0.034 g(0.1 mmol)蔗糖放入25 mL圆底烧瓶中,加入0.5 mL的DMSO,使其完全溶解后,加入0.5 mmol的乙烯酯类(月桂酸乙烯酯,乙酸乙烯酯,棕榈酸乙烯酯)和5 mL叔戊醇.混合均匀,加入0.2 g的TL IM酶.将该圆底烧瓶贴标签后,放入50 ℃恒温振荡箱中以200 r/min的速度振荡反应24 h.用TLC跟踪监测反应,展开剂比例为V(乙酸乙酯)︰V(甲醇)︰V(水)=25︰3.6︰1.
点板确定反应完全后,过滤脂肪酶.用冰水和乙酸乙酯萃取,取上层有机相,减压蒸馏.将反应产物用柱层析分离提纯,最后通过1H NMR表征分析.其反应式为
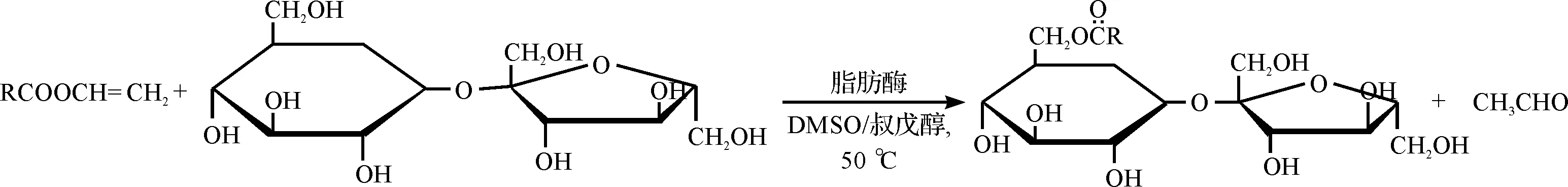
式中:R1=CH3(CH2)10为月桂酸乙烯酯;R2=CH3(CH2)14为棕榈酸乙烯酯;R3=CH3为乙酸乙烯酯.
通过上述实验方法分别对反应溶剂、反应底物浓度、反应温度以及反应时间等条件进行探究,系统了解这些条件对酶促蔗糖酯化反应产率的影响,对比总结得出最佳条件,从而得到最佳产率.
2 实验结果及分析
以下实验以蔗糖与月桂酸乙烯酯的反应为模型,对反应溶剂、底物浓度比、温度以及酶的选择等条件进行优化.
2.1 溶剂对酶促蔗糖酯化反应的影响
蔗糖为多羟基化合物,极性较强,只能溶于强极性有机溶剂中,但强极性溶剂会使酶部分或全部失活,从而降低酶的催化作用[11-12].因此,本实验采用多相合成的方法.利用DMSO将蔗糖溶解后,加入叔戊醇与其构成低共熔物,再进行酶促蔗糖酯化反应.实验选取DMSO与叔戊醇的溶剂比为1∶6,1∶7,1∶8,1∶9,1∶10,探究酶促蔗糖酯化反应的最佳溶剂比.
实验结果如图1所示,叔戊醇与DMSO的溶剂比对于酯交换产率的影响较小.结合DMSO极性较大且不易去除的因素,得出DMSO与叔戊醇的最佳比值为1∶9,产率为86%.
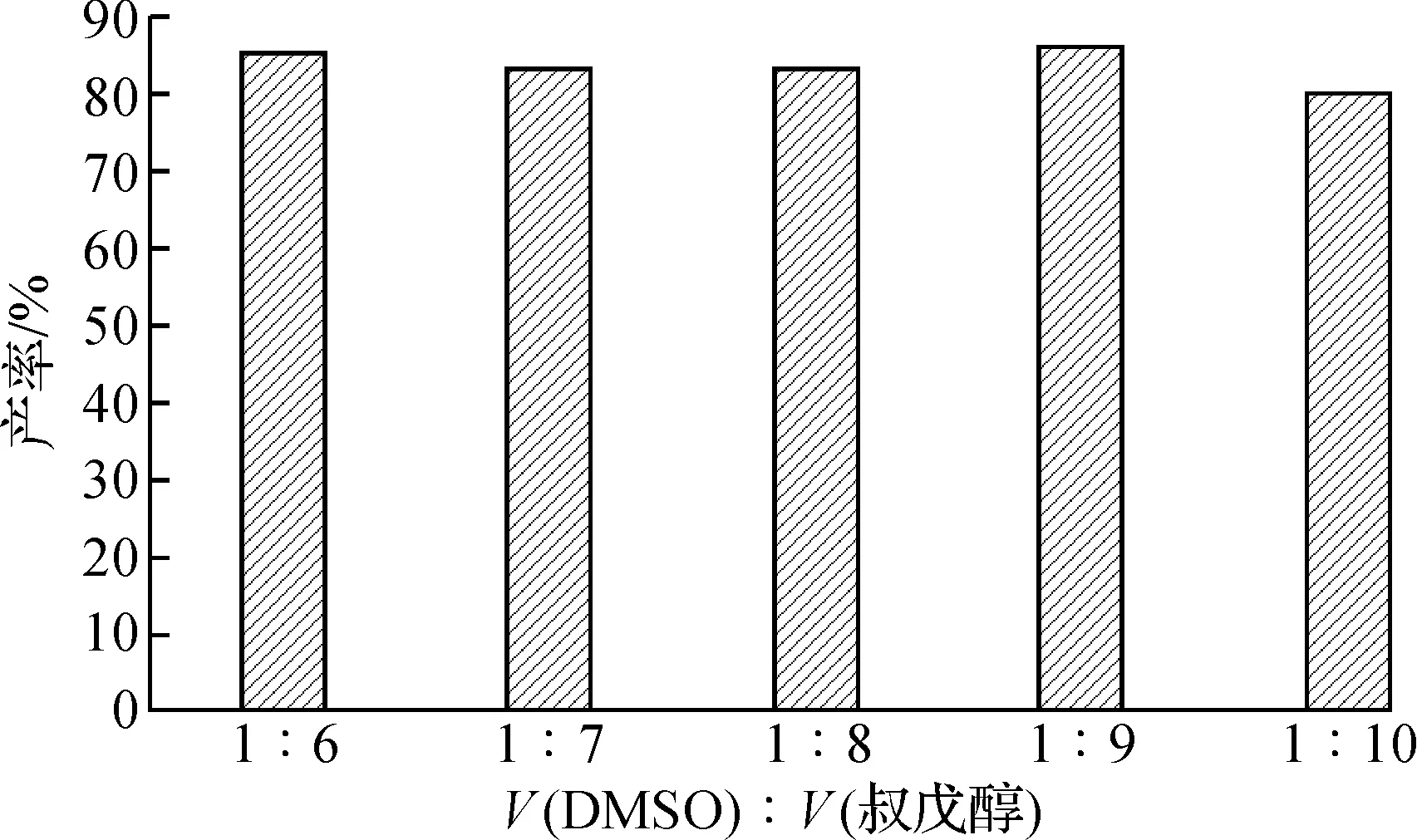
图1 反应溶剂比对蔗糖酯化反应的影响Fig.1 The influence of solvent ratio of on the reaction
2.2 底物浓度比对酶促蔗糖酯化反应的影响
两种反应物摩尔比不同可能会影响反应体系的整体极性,影响反应底物在酶催化活性中心附近的分布,从而影响反应速率和产率.实验选取蔗糖与月桂酸乙烯酯摩尔比为1∶3,1∶4,1∶5,1∶6,1∶7,探究底物比对酶促蔗糖酯化反应的影响.
实验结果如图2所示,随着月桂酸乙烯酯用量的增加,反应的产率也随之增高.当底物摩尔比为1∶5时,反应的产率为85%.继续增加月桂酸乙烯酯的用量,产率降低.得出最佳底物浓度比为1∶5,产率为85%.
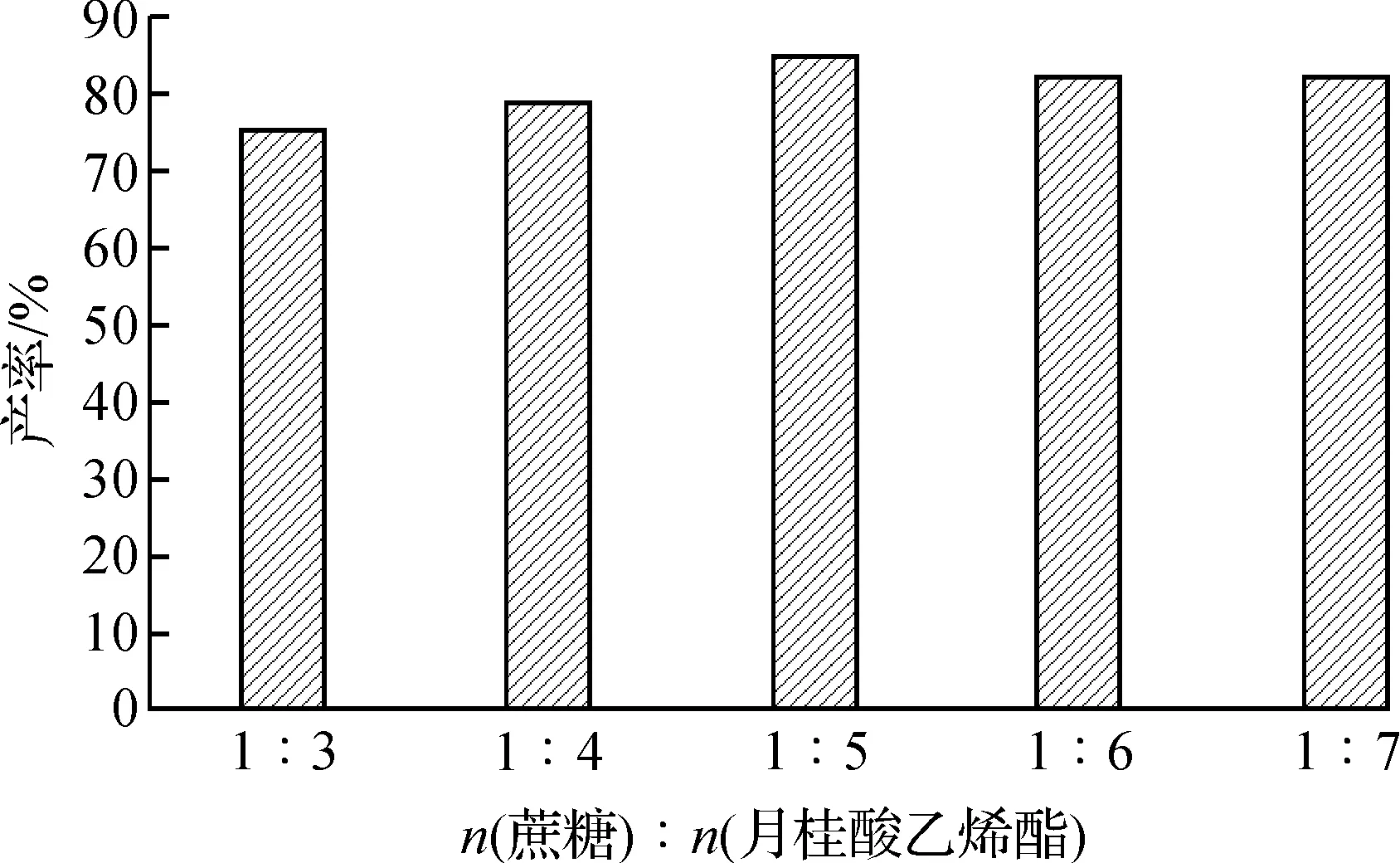
图2 底物摩尔比对蔗糖酯化反应的影响Fig.2 The influence of substrate ratio of on the reaction
2.3 温度对酶促蔗糖酯化反应的影响
在一定范围内,酶催化作用会随温度的升高而变强,而温度过高会导致酶失活,从而影响酶催化作用.实验选取35,40,45,50,55 ℃等5个温度,探究该脂肪酶的最适宜温度,使其对蔗糖酯化反应的催化效率达到最高.
实验结果如图3所示,当反应温度达到50 ℃时,反应的产率为86%,继续升高温度,产率明显下降.得出最佳温度为50 ℃,产率为86%.
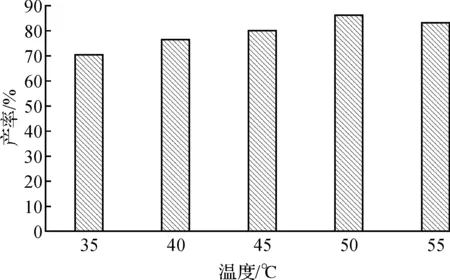
图3 反应温度对蔗糖酯化反应的影响Fig.3 The influence of reaction temperature on the reaction
2.4 时间对酶促蔗糖酯化反应的影响
反应时间过短,会导致反应不充分,影响反应产率;反应时间过长,则增加了副反应产生的可能性,也会导致产率降低.实验选取反应时间为2,4,6,8,10 h,探究酶促蔗糖酯化反应的最佳反应时间.
实验结果如图4所示,当反应时间达到8 h时,反应的产率为92%,继续反应,产率下降.得出最佳时间为8 h,产率为92%.
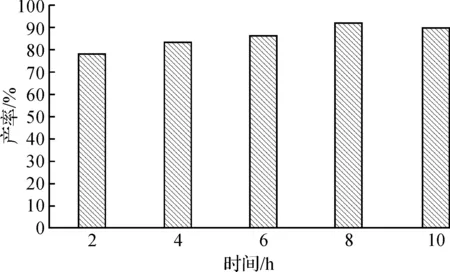
图4 反应时间对蔗糖酯化反应的影响Fig.4 The influence of reaction time on the reaction
2.5 不同酶对酶促蔗糖酯化反应的影响
改变酶促蔗糖酯化反应中的催化剂,分别改为脂肪酶Lipozyme RM IM、脂肪酶Novozym 435以及枯草杆菌碱性蛋白酶,结果如表5所示.
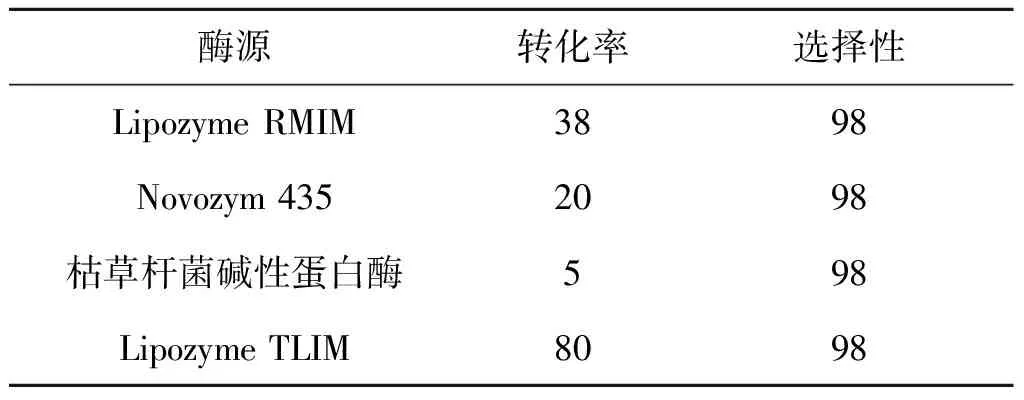
表5 酶对蔗糖酯化反应的影响
实验结果表明:对于蔗糖酯化反应而言,不同的酶对反应有着十分明显的影响.利用脂肪酶Lipozyme RMIM催化反应,蔗糖转化率为38%.而利用枯草杆菌碱性蛋白酶催化该反应,蔗糖转化率仅为5%.从表5的结果看出:对于酶促蔗糖的区域选择性酯化反应而言,最有效的催化剂为脂肪酶Lipozyme TLIM,蔗糖的转化率为80%,选择性为98%.
3 蔗糖区域选择性酯化产物的结构表征
本实验探究了由脂肪酶催化的蔗糖与乙烯酯类化合物(乙酸乙烯酯、月桂酸乙烯酯和棕榈酸乙烯酯)的酯化反应.经柱层析分离提纯得到3个酯化产物,并且每个化合物都通过1H NMR表征数据分析及验证.
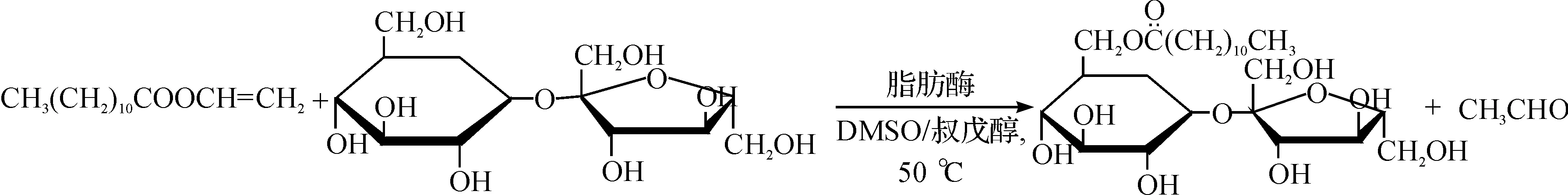
3.1 蔗糖和月桂酸乙烯酯反应
1H-NMR(DMSO-d6,δ,10-6):5.18~5.14(m,3H,蔗糖2β-OH,3α-OH和4β-OH),5.03(d,1H,J=5.5 Hz,蔗糖 3'β-OH),4.90(s,1H,蔗糖4'α-OH),4.83~4.80(t,1H,J=6.5 Hz,蔗糖 5'β-OH),4.58(d,1H,J=8.0 Hz,蔗糖1'β-OH),4.41~4.39(t,1H,J=5.0 Hz,蔗糖Hα-6α),4.24(d,1H,J=10.5 Hz,蔗糖 Hb-6α),4.04~3.99(m,1H,蔗糖 H-5β),3.92~3.86(m,2H,蔗糖 H-5'α和Hα-1'α),3.73(d,1H,J=6.0 Hz,蔗糖 Hb-1'α),3.60~3.47(m,4H,蔗糖H-3'α,H-4'β,Ha-6'β和Hb-6'β),3.35(m,1H,蔗糖 H-3β),3.22~3.19(m,1H,蔗糖 H-2β),3.09~3.04(m,1H,蔗糖 H-4β),2.31~2.29 (m,2H,a-CH2),1.52~1.50(t,2H,J=7.0 Hz,β-CH2),1.25 (m,16H,n-CH2),0.86(t,3H,J=7.0 Hz,CH3).产率为78%.
蔗糖和月桂酸乙烯酯反应式为
3.2 蔗糖和棕榈酸乙烯酯反应
蔗糖和棕榈酸乙烯酯反应式为
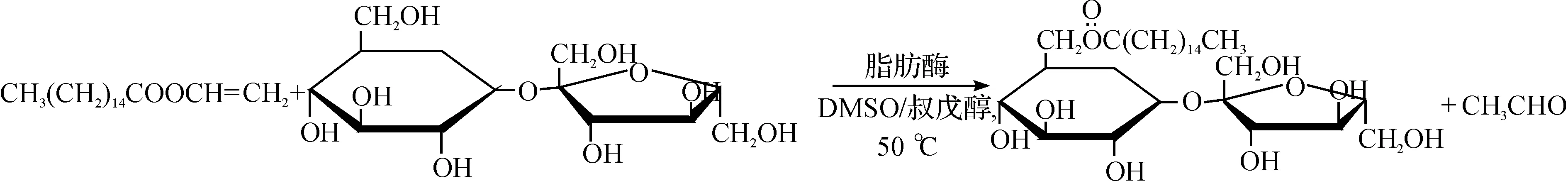
1H-NMR(DMSO-d6,δ,10-6):5.18~5.14(m,3H,蔗糖 2β-OH,3α-OH和4β-OH),5.03(d,1H,J=5.5 Hz,蔗糖 3'β-OH),4.90(s,1H,蔗糖 4'α-OH),4.83~4.80 (t,1H,J=6.5 Hz,蔗糖5'β-OH),4.58 (d,1H,J=8.0 Hz,蔗糖 1'β-OH),4.41~4.39 (t,1H,J=5.0 Hz,蔗糖 Hα-6α),4.24 (d,1H,J=10.5 Hz,蔗糖 Hb-6α),4.04~3.99 (m,1H,蔗糖 H-5β),3.92~3.86 (m,2H,蔗糖的H-5'α和Hα-1'α),3.73 (d,1H,J=6.0 Hz,蔗糖 Hb-1'α),3.60~3.47 (m,4H,蔗糖 H-3'α,H-4'β,Ha-6'β和Hb-6'β),3.35 (m,1H,蔗糖 H-3β),3.22~3.19 (m,1H,蔗糖 H-2β),3.09~3.04 (m,1H,蔗糖 H-4β),2.27 (m,1H,a-CH2),2.28~2.25 (m,2H,a-CH2),1.52~1.50 (t,2H,J=7.0 Hz,β-CH2),1.25 (m,24H,n-CH2),0.86 (t,3H,J=7.0 Hz,CH3).产率为80%.
3.3 蔗糖和乙酸乙烯酯反应
蔗糖和乙酸乙烯酯反应式为
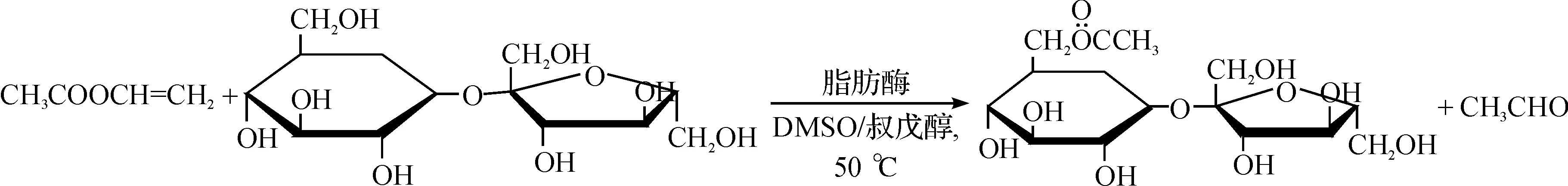
1H-NMR (DMSO-d6,δ,10-6):5.18~5.14 (m,3H,蔗糖 2β-OH,3α-OH和4β-OH),5.03 (d,1H,J=5.5 Hz,蔗糖 3'β-OH),4.90 (s,1H,蔗糖 4'α-OH),4.83~4.80 (t,1H,J=6.5 Hz,蔗糖5'β-OH),4.58 (d,1H,J=8.0 Hz,蔗糖 1'β-OH),4.41~4.39 (t,1H,J=5.0 Hz,蔗糖Hα-6α),4.24 (d,1H,J=10.5 Hz,蔗糖 Hb-6α),4.04~3.99 (m,1H,蔗糖 H-5β),3.92~3.86 (m,2H,蔗糖H-5'α和Hα-1'α),3.73 (d,1H,J=6.0 Hz,蔗糖 Hb-1'α),3.60~3.47 (m,4H,蔗糖H-3'α,H-4'β,Ha-6'β和Hb-6'β),3.35 (m,1H,蔗糖 H-3β),3.22~3.19 (m,1H,蔗糖 H-2β),3.09~3.04 (m,1H,蔗糖 H-4β),2.00 (3H,s,CH3).产率为82%.
4 结 论
本实验主要对固定化脂肪酶TL IM催化蔗糖与乙烯酯类化合物酯化反应的最适条件进行了研究,即在DMSO/叔戊醇为1︰9的两相非水介质中,蔗糖与乙烯酯类化合物的底物比为1︰5,反应温度为50 ℃,反应时间为8 h等条件时,反应达到最高产率.也由此可知:固定化脂肪酶TL IM催化蔗糖与乙烯酯类反应可行,也能得到较为理想的效果.
[1] KARLHEINZ H, OLIVER R. Sugar surfactants for consumer products and technical applications[J]. Fett lipid,1999,101(1):25-33.
[2] PUTERKA G J, FARONE W, PALMER T. Struc-functiona relationships affecting the insecticidal and miticidal activity of sugar ester[J]. Ecotoxicology,2003,96(3):636-644.
[3] UPPGARD L, STROM M, WOLD S. Multivariate quantiative structure activity relationships for the aquatic toxicity of alkyl polyglucosides[J]. Tenside surfactants detergents,2000,37(2):131-138.
[4] SHINODA K, CARLSSON A, LINDMAN B. On the importance of hydroxyl groups in the polar headgroup of nonionix surfactants and membrane lipids[J]. Advances in colloid and interface science,1996,64:253-271.
[5] FEUGE R O, ZERINGUE H J, WESSIN T, et al. Preparation of sucrose esters by interesterification[J]. American oil chemists society,1970,47(2):56-60.
[6] ZAKS A, KLIBANOV A M. Enzymatic catalysis in non-aqueous solvents[J]. Biological chemistry,1988,263(7):3194-3201.
[7] KRISHNA S H, KARANTH N G. Lipase and lipase-catalyzed esterification in nonaqueous media[J]. Catalysis reviews-science and engineering,2002,44(4):499-591.
[8] 寇秀芬,徐家立.酶法合成糖及糖醇酯[J].微生物学报,2000,40(2):193-197.
[9] 万会达,夏咏梅.酶催化区域选择性合成蔗糖酯的研究进展[J].日用化学工业,2010,40(1):48-53.
[10] 李美超,徐志花,马淳安,等.有机合成中的绿色化学[J].浙江工业大学学报,2002,30(5):500-504.
[11] 王萍,杜理华,何秀娟,等.蔗糖棕榈酸单酯的选择性酶促合成及其性能研究[J].浙江工业大学学报,2012,40(5):488-492.
[12] 钱俊青,宋大威,单昱东.微水相酸性蛋白酶催化蔗糖乙酸酯合成研究[J].浙江工业大学学报,2013,41(2):119-121.
(责任编辑:陈石平)
A study on a lipase catalyzed synthesis of sucrose ester reaction
DU Lihua, SHEN Le, JIANG Zhipeng
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
Experiment with lipase TL IM as catalyst, DMSO and tert-amyl alcohol as the reaction system catalytic synthesis of sucrose and vinyl acetate. The influencing factors of lipase catalyzed synthesis of sucrose esters were studied in the experiment.The molar ratios of solvents and substrates, reaction temperature and time were investigated.The results show that all the molar ratios of bothsolvents and substrates, temperature and reaction time have different degree of influenceon the sucrose esterification reaction.
lipase; sucrose ester; esterification reaction; catalyze
2016-09-14
国家自然科学基金资助项目(21306172);国家948计划资助项目(2014-4-29);浙江省自然科学基金资助项目(LY17B020010);浙江省公益农业计划项目(2014C32094)
杜理华(1979—),女,河南安阳人,副教授,硕士生导师,研究方向为药物合成新技术,E-mail:orgdlh@zjut.edu.cn.
R931.6
A
1006-4303(2017)03-0285-04
