社区老年人群性激素结合球蛋白与心血管发病风险的关联性
2017-06-27施美芳张爱伦张春燕王蓓丽潘柏申
李 钢 吴 炯 施美芳 张爱伦 张春燕 王蓓丽 郭 玮 潘柏申△
(1上海市宝山区友谊街道社区卫生服务中心检验科 上海 201900; 2复旦大学附属中山医院检验科 上海 200032)
社区老年人群性激素结合球蛋白与心血管发病风险的关联性
李 钢1吴 炯2施美芳1张爱伦2张春燕2王蓓丽2郭 玮2潘柏申2△
(1上海市宝山区友谊街道社区卫生服务中心检验科 上海 201900;2复旦大学附属中山医院检验科 上海 200032)
目的 探讨社区老年人群中性激素结合球蛋白(sex hormone binding globulin,SHBG)与心血管疾病(cardiovascular disease,CVD)之间的相关性。方法 于2014年选取上海市宝山区友谊社区1 916例老年人群(男796例、女1 120例),收集基础的流行病学资料并采集空腹静脉血进行检测,计算得到10年Framingham风险积分。将肥胖、收缩压、空腹血糖、脂类浓度及超敏C反应蛋白作为心血管疾病风险因子,Framingham风险积分作为心血管疾病事件预测危险积分,分析SHBG与它们之间的相关性。结果 存在心血管病史人群的SHBG均值低于不存在心血管病史人群(P<0.001);男性SHBG与腰围、臀围、BMI指数、收缩压、胆固醇、三酰甘油、高密度脂蛋白胆固醇、载脂蛋白A、超敏C反应蛋白的相关系数分别为-0.312、-0.307、-0.266、-0.113、0.155、-0.277、0.510、0.394、-0.130(P<0.01);女性SHBG与腰围、臀围、BMI指数、空腹血糖、胆固醇、三酰甘油、高密度脂蛋白胆固醇、载脂蛋白A和超敏C反应蛋白的相关系数分别为-0.236、-0.248、-0.168、-0.183、0.135、-0.264、0.445、0.358、-0.295 (P<0.001);SHBG水平的降低与Framingham积分的升高存在一致性(κ=0.062,P<0.001),且SHBG水平的升高会降低10年内CVD的发病风险(P<0.01)。结论 该社区老年人群基线SHBG水平与CVD风险因子之间存在负相关性,与CVD保护因子之间存在正相关性,并且低水平SHBG预示着更高的CVD发病风险。
性激素结合球蛋白; 心血管疾病风险因子; 社区老年人群; Framingham风险积分
心血管疾病(cardiovascular disease,CVD)是一种由于高脂血症、血液黏稠、动脉粥样硬化、高血压等所导致的心脏、大脑及全身组织发生缺血性或出血性疾病,具有高患病率、高致残率和高死亡率的特点。随着各类危险因素在人群中的流行,CVD发病率不断上升,对于人类健康的威胁也越来越大。
近年来关于新兴CVD生物标志物的探索不断取得进展。Canoy等[1]在成年男性中发现,在考虑到BMI指数、腰围、臀围、吸烟史等基础风险因子影响的情况下,性激素结合球蛋白(sex hormone binding globulin,SHBG)独立于血清总睾酮与传统CVD风险因子超敏C反应蛋白(high sensitive C reactive protein,CRP)、三酰甘油(triglyceride,TG)、血压存在负相关性,而与心血管疾病保护因子高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)存在正相关性。在另一项研究[2]中,患有多囊卵巢综合征的女性体内SHBG水平与CRP之间同样表现出了显著的负相关性。介于SHBG与心血管疾病风险因子表现出的这种相关性,研究者认为高水平的SHBG预示着发生CVD的风险降低。
然而在国内,尚未有相关的研究报导过中国人群SHBG与心血管疾病之间的关系。本文旨在通过横断面研究,探讨我国社区老年人群SHBG与心血管疾病之间的相关性,以期为CVD的早期预防提供新的依据。
资 料 和 方 法
研究对象 于2014年在上海市宝山区卫生服务中心的协助下建立了由9个居委调查点构成的上海市宝山区友谊社区老年人群随访队列,共计6 120名以60~80岁为主的社区老年人。采用随机数表法抽取了9个调查点中的2个调查点,选取自愿参与研究的常住人口1 938例。使用统一的流行病学调查表,获取其年龄、性别、吸烟情况、糖尿病史以及CVD发病情况等基础信息,同时借助上海市老年人群体检契机,测量入组人群的身高、体重、腰围、臀围、血压并以坐姿形式采集空腹(禁食12 h以上)静脉血标本。经3 000 r/min的转速离心10 min (离心半径16 cm)后从静脉血样本中分离得到血清,将这些血清样本冻存于-80 ℃环境中。剔除未留取血清标本的对象22例,共计入组1 916例社区老年人群(男性796例,女性1 120例)。
调查表内容 流行病学调查表中包括:(1)年龄;(2)性别;(3)吸烟情况(分为目前吸烟、有吸烟史已戒烟、不吸烟3类);(4)有无糖尿病;(5)脑血管疾病(分为缺血性卒中、脑出血、蛛网膜下腔出血、短暂性脑缺血发作、高血压、其他、未发现7类);(6)心脏疾病(分为心肌梗死、心绞痛、冠状动脉血运重建、充血性心力衰竭、心前区疼痛、其他、未发现7类);(7)有无高血压用药。
标本检测 使用罗氏Cobas E602全自动免疫分析系统及其商业化试剂检测留取血清样本中的免疫指标SHBG;使用罗氏Cobas E702全自动生化分析系统及其商业化试剂检测留取血清样本中的生化指标总胆固醇(cholesterol,CHO)、TG、 HDL-C、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、载脂蛋白A (apolipoprotein A,ApoA)、载脂蛋白B (ApoB)、脂蛋白A (lipoprotein a,LP(a))、空腹血糖和CRP。为防止样本反复冻融及仪器交叉污染引起的误差,标本复融后的一天内先后完成生化指标和免疫指标的检测。各项目的定标均采用罗氏自配校准品,质控采用伯乐质控品和临床靶值,在检测前保证质控结果在控(Westgard多规则:13S和22S);失控时分析具体原因并进行相应处理,直到重新在控后再进行标本检测。
统计人群基线情况 汇总各项基础流行病学资料以及检测得到的SHBG和生化指标,并初步分析SHBG在该人群中的分布特点。
寻找与SHBG存在相关性的CVD风险预测指标 根据SHBG水平将该人群分组,分析在SHBG分组下存在差异的CVD风险预测指标,并分析SHBG与这些指标存在的相关性。
计算Framingham风险积分 为了在横断面上获取该老年人群的10年心血管疾病发病情况,引入经典的10年Framingham风险积分,即以年龄、性别、血压、吸烟史、糖尿病史、TC、HDL-C作为风险因素,评估10年内由于心脏血管和大脑血管病变而产生的急性特发性疾病(包括心绞痛、急性心肌梗死、急性脑出血、急性脑栓死等)即心血管事件的风险。10年Framingham风险积分计算公式[3]如下:
男性:{1-0.88936exp(3.06×In-Age+1.12×In-CHO-0.93×In-HDL-C+1.93×In-SBP(treated)/2.00×In-SBP(untreated)+0.65×Smoking+0.57×Diabetes-23.9802)}×100%女性:{1-0.95012exp(2.33×In-Age+1.21×In-CHO-0.71×In-HDL-C+2.76×In-SBP(treated)/2.82×In-SBP(untreated)+0.53×Smoking+0.69×Diabetes-26.1931)}×100%
分析SHBG与Framingham风险积分之间的联系 将计算得到的Framingham风险积分按10%、20%、30% 3个切点进行分组,分析SHBG四分位数分组与Framingham风险积分分组之间的一致性。再以Framingham风险积分作为该人群10年心血管事件的替代终点,Framingham风险积分20%作为cut-off值,将该人群分为10年心血管疾病发病组与正常对照组,分析SHBG与10年心血管疾病事件之间的相关性。
统计学分析 使用IBM SPSS Statistics 22.0进行统计学分析。连续计量资料以均值(标准差)或者95%置信区间表示,分类计量统计资料以阳性率(例数)表示;P<0.05为差异有统计学意义。正态性检验采用独立样本Kolmogorov-Smironv检验(K-S检验)。两组间比较采用独立样本t检验;多组间比较采用方差分析;率的比较采用χ2检验;两变量相关性采用Pearson相关性分析;一致性分析采用kappa检验;采用二元Logistic线性回归分析计算SHBG分组对于预测10年心血管疾病事件的优势比(odds ratio,OR)。
结 果
研究人群基本资料 经正态性检验CRP是偏态分布资料,对其进行自然对数转换。入组人群平均年龄为(71.7±7.1)岁,其中1 170人(61.1%)存在CVD病史,185人(9.6%)目前吸烟。男性SHBG均值为(59.16±25.93) nmol/L,女性为(69.59±33.42) nmol/L,差异有统计学意义(P<0.001)。有CVD病史的人群SHBG均值为(63.05±30.21) nmol/L,无CVD病史的人群则为(69.49±32.34) nmol/L,差异有统计学意义(P<0.001)。
SHBG分组下各资料的分布情况 根据SHBG四分位数对该人群分组,结果表明,男性比(男性在该人群中所占的比例)、年龄、腰围、臀围、BMI指数、收缩压、吸烟率、空腹血糖、CHO、TG、HDL-C、LDL-C、Apo-A、CRP在SHBG四分组间存在显著的差异(P<0.05,表1)。
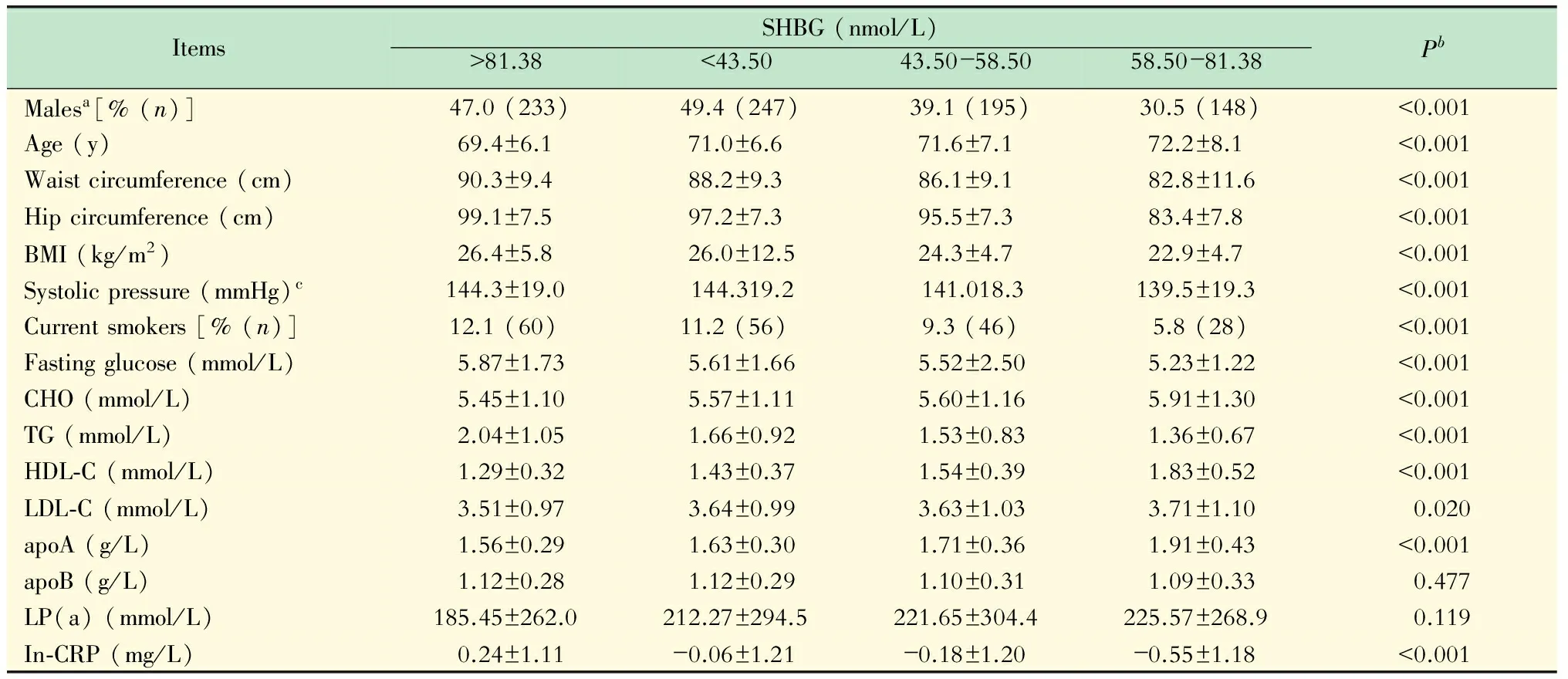
表1 各指标在不同SHBG水平下的分布情况
aThe proportion of males in population;bThe significance of variance analysis or chi square test;c1 mmHg=0.133 kPa.
SHBG与CVD风险因子 将SHBG与在SHBG四分组中存在显著差异的指标(年龄、腰围、臀围、BMI指数、收缩压、空腹血糖、CHO、TG、HDL-C、LDL-C、apoA、CRP)按性别纳入Pearson相关模型中。阳性结果如图1所示,男性SHBG与年龄、CHO、HDL-C、apoA之间存在正相关性(P<0.001),与腰围、臀围、BMI指数、收缩压、TG、CRP之间存在负相关性 (P<0.01);女性SHBG与年龄、CHO、HDL-C、apoA之间存在正相关性(P<0.001),与腰围、臀围、BMI指数、空腹血糖、TG、CRP之间存在负相关性(P<0.001)。
SHBG与Framingham 风险积分 根据计算得到的Framingham 风险积分将该人群分为4组,Framingham 风险积分>30%为极高危组、20%~30%为高危组、10%~20%为中危组、<10%为低危组(剔除了部分由于信息不全导致无法计算Framingham积分的研究对象254例),同时将该人群按SHBG四分位数分为4组,其交叉表格详见表2。进行kappa一致性检验和χ2检验后发现SHBG水平的降低与Framingham积分的升高存在一致性(P<0.001),随着SHBG水平的逐渐升高,Framingham积分逐渐向低危组偏移。
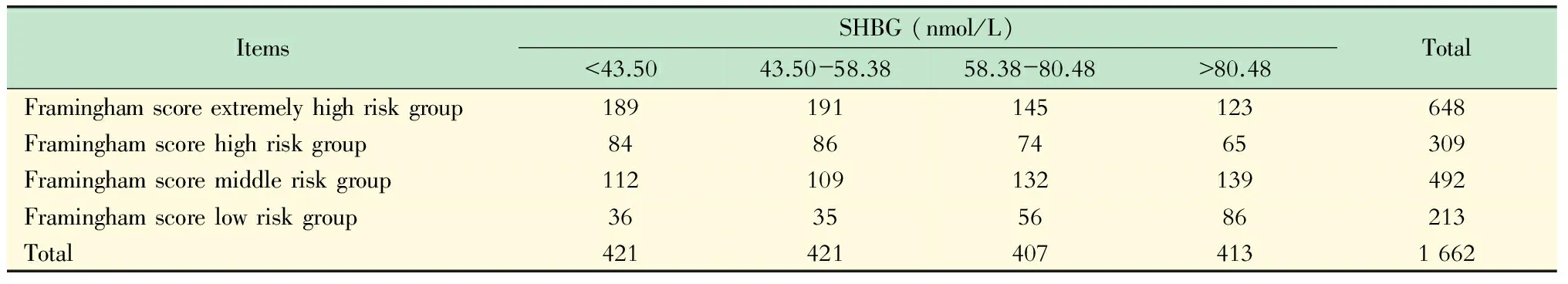
表2 SHBG分组与Framingham积分分组的交叉表格
Kappa consistency coefficient=0.062,P<0.001;χ2=62.759,P<0.001.
SHBG与10年CVD发病风险 根据Framingham心脏研究指南[3],以20%作为Framingham风险积分cut-off值,定义Framingham积分<20%的人群10年内 CVD发病风险较低,为正常对照组;Framingham积分>20%的人群10年内CVD发病风险较高,为疾病组。采用Logistic回归模型分析经年龄、吸烟情况、糖尿病史、收缩压、CHO、HDL-C校正后四分位数分组下的SHBG对于CVD发病风险的OR值。结果如表3所示,SHBG水平的升高会降低10年内CVD的发病风险,并且这种相关性独立于已纳入Framingham风险积分公式的各项指标(年龄、性别、吸烟情况、收缩压、糖尿病史、CHO以及HDL-C)。其中性别实际上是计算Framingham积分的关键内容,用于判断下一步采用的具体公式,因此认为性别也是纳入Framingham风险积分公式的指标之一。

r:Pearson correlation coefficient;P:The significance of Pearson correlation.
图1 SHBG与CVD风险因子之间存在的相关性
Fig 1 Correlation between SHBG and CVD risk factors
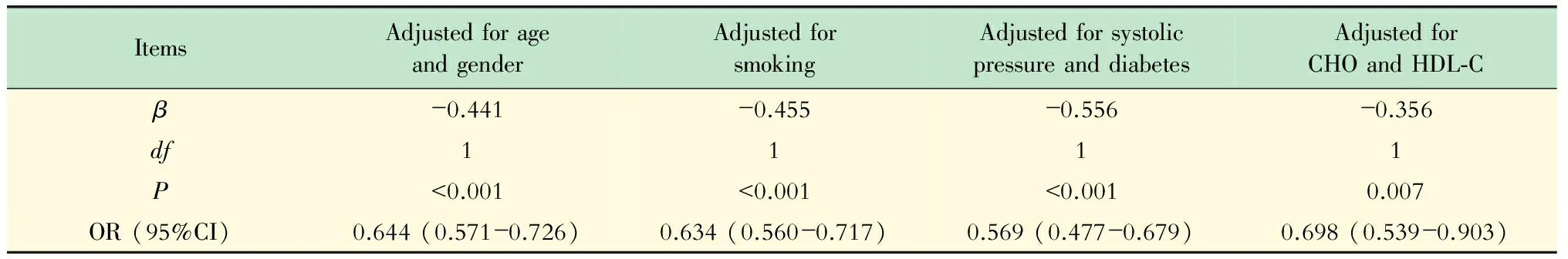
表3 SHBG与预测10年心血管事件之间的相关性
The crowd was subgrouped by SHBG quartiles;OR:the ratio of onset risk by one unit increase of SHBG grouping and original onset risk.
讨 论
SHBG是由两个相同的亚单位组成的同型二聚体,为一种大分子球蛋白,主要由肝细胞合成。人体内SHBG的主要功能是通过N末端的晶体结构与性激素结合从而运输性激素[4]。作为性激素转运的载体蛋白,SHBG通过多种途径参与人体内代谢过程,这导致了SHBG浓度水平在代谢性疾病中的异常表达。研究表明,基线血清SHBG浓度水平的升高与发生胰岛素抵抗(insulin resistance,IR)、2型糖尿病(type 2 diabetes mellitus,T2DM)、代谢综合征(metabolic syndrome,MS)的风险降低有关[5-6],而IR、T2DM、MS等引起的血脂异常、血液黏滞、血管病变等又是CVD的风险因素[7-8],因此,SHBG与CVD之间也一定存在着某种联系。本研究对上海市宝山区友谊社区老年人群的SHBG与CVD发病风险的关系进行了大样本量的调查。在这项社区老年人群队列中,以高血压为主的心血管发病率为61.1%,高于中国18岁及以上居民的整体患病率[9]。由于人体内的SHBG水平受雌二醇/睾酮的比值调控(即SHBG通过雌二醇刺激生成的同时受到睾酮抑制),该人群的SHBG在女性中的水平显著高于男性;另外该老年人群SHBG水平随着年龄上升而增加,表明其睾酮水平的下降较雌二醇水平的下降更加明显。
肥胖的发生通常会伴随着睾酮的降低以及雌激素的升高[10-11],本研究结果表明,肥胖同样会引起血清SHBG浓度的变化。在肥胖的发展过程中,随着肝脏的脂质堆积不断增加,肝细胞核因子-4ɑ (hepatic nuclear factor 4ɑ,HNF-4ɑ)水平不断下降,而过氧化物酶体增殖物激活受体γ蛋白水平不断上升,导致了血清中SHBG浓度的降低[12]。由于肥胖是发生心血管疾病的危险因素[13],本研究通过分析,发现肥胖指标腰围、臀围、BMI指数与SHBG之间存在负相关性,间接表明在该社区老年人群中低水平的SHBG会增加CVD的发病风险。一项基于人群的研究[14]发现,低水平的SHBG预示着更差的心血管健康状态,包括脂代谢紊乱、空腹血糖升高、高血压、缺乏运动、吸烟史、BMI指数升高以及不良的饮食习惯。本横断面研究证实SHBG与已知的CVD风险因子收缩压、空腹血糖、TG、CRP之间存在负相关性,与已知的CVD保护因子HDL-C、apoA之间存在正相关性,表明了低水平SHBG预示更高的CVD发病风险,不同性别的老年人群间仅表现出了略微的差异。有趣的是,另一项反映体脂含量的指标CHO却与SHBG之间呈正相关。Canoy等[1]在成年男性中发现,经吸烟、运动、教育情况、胰岛素水平、BMI指数、腰围的校正后,SHBG与CHO之间不存在相关性,另一项研究[2]表明女性SHBG与CHO之间也不存在相关性,而本研究人群中这种相关性出现了不同的结果,故关于SHBG与CHO之间的关系尚无定论。此外,本研究结果中低水平的SHBG组别中具有更高的吸烟率,但Field等[15]发现,中年吸烟男性的SHBG水平高于不吸烟的对照组,这可能揭示了吸烟对于不同年龄段人群性激素代谢有不同的影响。
10年Framingham风险积分是一套经典的CVD评估系统,本研究借此得以预估该社区老年人群10年CVD发病风险。通过计算Framingham风险积分发现,宝山区友谊社区老年人群10年CVD发病风险处在高危水平。随着Framingham风险积分的降低,该人群SHBG梯度水平逐渐升高。另外,在独立于已纳入10年Framingham风险积分计算公式指标(即传统的CVD风险因子)的情况下,SHBG水平的升高降低了人群10年CVD事件的风险。研究[16-17]表明,HNF-4ɑ是调节SHBG启动子的转录因子,HNF-4ɑ水平的下降抑制了SHBG的转录与合成;在肝HepG2细胞中,脂质堆积降低了HNF-4ɑ水平,进而降低了SHBG的表达。在本研究中,SHBG与脂类标志物之间存在很强的相关性,表明CVD的发生对于外周循环中SHBG水平的影响主要由于CVD患者体内脂代谢紊乱所引起。
虽然本横断面研究利用Framingham风险积分分析得到了SHBG与10年CVD事件之间的间接相关性,但仍然需要相应的随访数据做一项纵向研究,以分析该社区老年人群基线SHBG浓度水平与若干年后发生的CVD终点事件之间的直接相关性,来判断低水平SHBG是否为CVD事件的风险标志物,进一步完善我们的结论。此外,本文选取的研究对象是同一地区的老年人群,存在一定的地域局限性,不能代表我国老年人群的整体情况。
综上,上海市宝山区友谊社区老年人群基线SHBG水平与CVD风险因子之间存在负相关性,与CVD保护因子之间存在正相关性,并且低水平SHBG预示着更高的CVD发病风险。SHBG在临床CVD预防诊治中的应用价值有待进一步的探索。
[1] CANOY D,BARBER TM,POUTA A,etal.Serum sex hormone-binding globulin and testosterone in relation to cardiovascular disease risk factors in young men:a population-based study[J].EurJEndocrinol,2014,170(6):863-872.
[2] BALDANI DP,SKRGATIC L,CERNE JZ,etal.Association between serum levels and pentanucleotide polymorphism in the sex hormone binding globulin gene and cardiovascular risk factors in females with polycystic ovary syndrome[J].MolMedRep,2015,11(5):3941-3947.
[3] D′AGOSTINO RB SR,VASAN RS,PENCINA MJ,etal.General cardiovascular risk profile for use in primary care:the Framingham Heart Study[J].Circulation,2008,117(6):743-753.
[4] WU TS,HAMMOND GL.Naturally occurring mutants inform SHBG structure and function[J].MolEndocrinol,2014,28(7):1026-1038.
[5] LI C,FORD E S,LI B,etal.Association of testosterone and sex hormone-binding globulin with metabolic syndrome and insulin resistance in men[J].DiabetesCare,2010,33(7):1618-1624.
[6] SORIGUER F,RUBIO-MARTIN E,FERNANDEZ D,etal.Testosterone,SHBG and risk of type 2 diabetes in the second evaluation of the Pizarra cohort study[J].EurJClinInvest,2012,42(1):79-85.
[7] MAGNUSSEN CG,CHERIYAN S,SABIN MA,etal.Continuous and dichotomous metabolic syndrome definitions in youth predict adult yype 2 diabetes and carotid artery intima media thickness:the cardiovascular risk in young finns study[J].JPediatr,2016,171:97-103 e3.
[8] WONG ND,ZHAO Y,PATEL R,etal.Cardiovascular risk factor targets and crdiovascular disease event risk in diabetes:a pooling project of the atherosclerosis risk in communities study,multi-ethnic study of atherosclerosis,and Jackson Heart Study[J].DiabetesCare,2016,39(5):668-676.
[9] 陈伟伟,高润霖,刘力生.《中国心血管病报告2015》概要[J].中国循环杂志,2016,31(7):617-622.
[10] FUI MN,DUPUIS P,GROSSMANN M.Lowered testosterone in male obesity:mechanisms,morbidity and management[J].AsianJAndrol,2014,16(2):223-231.
[11] KARIM R,MACK WJ,HODIS HN,etal.Influence of age and obesity on serum estradiol,estrone,and sex hormone binding globulin concentrations following oral estrogen administration in postmenopausal women[J].JClinEndocrinolMetab,2009,94(11):4136-4143.
[12] SAEZ-LOPEZ C,RIVERA-GIMENEZ M,HERNANDEZ C,etal.SHBG-C57BL/ksJ-db/db:a new mouse model to study SHBG expression and regulation duringobesity development[J].Endocrinology,2015,156(12):4571-4581.
[13] HAN TS,LEAN ME.A clinical perspective of obesity,metabolic syndrome and cardiovascular disease[J].JRSMCardiovascDis,2016,5:1-13.
[14] JASPERS L,DHANA K,MUKA T,etal.Sex steroids,sex hormone-binding globulin and cardiovascular health in men and postmenopausal women:the Rotterdam Study[J].JClinEndocrinolMetab,2016,101(7):2844-2852.
[15] FIELD AE,COLDITZ GA,WILLETT WC,etal.The relation of smoking,age,relative weight,and dietary intake to serum adrenal steroids,sex hormones,and sex hormone-binding globulin in middle-aged men[J].JClinEndocrinolMetab,1994,79(5):1310-1316.
[16] 庞晓娜,胡予.性激素结合球蛋白在代谢综合征中的作用[J].中国临床医学,2013,20(1):102-104.
[17] PUGEAT M,NADER N,HOGEVEEN K,etal.Sex hormone-binding globulin gene expression in the liver:drugs and the metabolic syndrome[J].MolCellEndocrinol,2010,316(1):53-59.
Research on the association between sex hormone binding globulin and the risk of developing cardiovascular diseases in community elderly population
LI Gang1, WU Jiong2, SHI Mei-fang1, ZHANG Ai-lun2, ZHANG Chun-yan2, WANG Bei-li2, GUO Wei2, PAN Bai-shen2△
(1DepartmentofLaboratory,BaoshanDistrictFriendshipStreetCommunityHealthServiceCenter,Shanghai201900,China;2DepartmentofLaboratory,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
Objective To explore the correlation between sex hormone binding globulin (SHBG) and cardiovascular disease (CVD) in community elderly population. Methods In 2014,1916 elderly people (796 males,and 1 120 females) were selected from Baoshan District Friendship Community,Shanghai.We collected basic epidemiological data and fasting venous blood samples to carry out the detection of biomarkers,and then calculated their ten-year Framingham risk score.In this study,obesity,systolic blood pressure,fasting blood glucose,lipid concentration,and high-sensitive C-reactive protein
were considered as CVD risk factors; Framingham risk score was considered as a CVD event prediction risk score.We analyzed the correlations of these factors with SHBG. Results SHBG mean values in the population with a history of CVD were lower than those without a history of CVD (P<0.001).The correlation coefficient between male SHBG and waist circumference,hip circumference,BMI,systolic pressure,cholesterol,triglycerides,high density lipoprotein cholesterol,apolipoprotein A,high-sensitive C-reactive protein were -0.312,-0.307,-0.266,-0.113,0.155,-0.277,0.510,0.394 and -0.130,respectively (P<0.01).The correlation coefficient between female SHBG and waist circumference,hip circumference,BMI,fasting glucose,cholesterol,triglycerides,high density lipoprotein cholesterol,apolipoprotein A,high-sensitive C-reactive protein were -0.236,-0.248,-0.168,-0.183,0.135,-0.264,0.445,0.358 and -0.295,respectively (P<0.001).The decrease of SHBG level was consistent with the increase of Framingham score (κ=0.062,P<0.001).Elevated level of SHBG would reduce the risk of CVD in ten years (P<0.01). Conclusions There was a negative correlation between baseline SHBG level and CVD risk factors,positive correlation between baseline SHBG level and CVD protection factors in community elderly population; lower SHBG level indicated higher risk of developing CVD events.
sex hormone binding globulin; cardiovascular disease risk factors; community elderly population; Framingham risk score
上海申康医院发展中心课题(SHDC22014017);上海市卫生系统先进适宜推广技术项目(2013SY065);国家自然科学基金面上项目(81572064);上海市卫生计生系统重要薄弱学科建设项目(2015ZB0201);上海市宝山区科学技术委员会科研项目(14-E-43)
R541
A
10.3969/j.issn.1672-8467.2017.03.008
2016-07-14;编辑:张秀峰)
△Corresponding author E-mail:pan.baishen@zs-hospital.sh.cn
*This work was supported by the Project of Shanghai Shenkang Hospital Development Center (SHDC22014017),the Advanced Technology Project of Shanghai Health System (2013SY065),the General Program of National Natural Science Fundation of China (81572064),the Important Weak Discipline Construction Project of Shanghai Health and Family Planning System (2015ZB0201) and the Project of Shanghai Baoshan District Science and Technology Commission (14-E-43).
