经皮微波消融同步肝动脉化疗栓塞治疗胃肠胰神经内分泌肿瘤肝转移的临床疗效
2017-06-27高珊珊楼文晖吴梦飞龚高全刘凌晓王小林
高珊珊 浦 宁 楼文晖 吴梦飞 陈 颐 龚高全 刘凌晓△ 王小林
(1上海市影像医学研究所 上海 200032; 2复旦大学附属中山医院介入治疗科,3普外科 上海 200032)
经皮微波消融同步肝动脉化疗栓塞治疗胃肠胰神经内分泌肿瘤肝转移的临床疗效
高珊珊1,2浦 宁3楼文晖3吴梦飞2陈 颐1,2龚高全1,2刘凌晓1,2△王小林1,2
(1上海市影像医学研究所 上海 200032;2复旦大学附属中山医院介入治疗科,3普外科 上海 200032)
目的 研究经皮微波消融(microwave ablation,MWA)同步肝动脉化疗栓塞(transarterial chemoembolization,TACE)治疗胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NENs)肝转移的安全有效性以及预后影响因素。方法 回顾性分析2013~2016年接受经皮MWA同步TACE治疗的19例GEP-NENs伴肝转移患者。根据mRECIST标准评估客观疗效,利用SPSS 21.0软件统计分析患者总生存期(overall survival ,OS)、无进展生存期(progression free survival ,PFS)及相关预后影响因素。结果 所有患者均可评价疗效:完全缓解(complete remission,CR) 1例(5%),局部缓解(partial remission,PR) 3例(16%),疾病进展(progressive disease,PD) 7例(37%),疾病稳定(stable disease,SD) 8例(42%),有效率(response rate,RR)为21%,疾病控制率(disease control rate,DCR)为63%。全组患者的中位PFS和中位OS分别为25和34个月,1年、3年生存率分别为95%、84%。单因素生存分析发现,血清CA199,肝转移灶病理WHO分级以及肝转移灶肿瘤负荷是患者生存预后的主要风险因素,其中肝转移灶WHO分级达到G3往往提示患者中位OS较差(P<0.05),而肝转移灶肿瘤负荷与中位PFS呈负相关性(P<0.05)。此外,经皮MWA同步TACE治疗GEP-NETs后,CgA水平较术前明显降低,且大部分降至正常水平(P<0.05)。结论 经皮MWA同步TACE是治疗GEP-NENs肝转移的安全有效方法。
微波消融; 动脉化疗栓塞; 胃肠胰神经内分泌瘤; 肝转移
神经内分泌肿瘤(neuroendocrine neoplasms,NEN)是一类起源于脏器神经内分泌细胞和肽能神经细胞,具有显著异质性及恶性潜质的肿瘤,其中以胃肠胰神经内分泌肿瘤(gastroenteropancreatic NEN,GEP-NENs)最为常见,约占NEN的50%~70%。过去普遍认为NEN在消化系统中并不常见,但近年来,随着诊疗技术和病理诊断的进步,其检出率明显增加,以致发病率也呈递增趋势[1]。临床根据其是否具有外分泌功能以及相应面色潮红、出汗、腹泻等症状,分为功能性和无功能性神经内分泌肿瘤,约60%~90%的GEP-NENs属于无功能性肿瘤,由于早期缺乏明显的临床症状,发现时大多已处于相对晚期且伴有肝转移[2]。Karl等[3]对3 851例手术切除的胰腺神经内分泌肿瘤(pancreatic NEN,pNEN)患者进行回顾性分析发现远处转移是pNENs患者预后的独立危险因素。国内也有数据证明远处转移属于GEP-NENs复发的高危因素,与预后明显相关,与Karl等的研究结果相一致[4]。因此首发诊断为GEP-NENs肝转移患者的预后往往也较差。尽管目前临床上有多种治疗NEN伴肝转移的方式且手术切除是唯一可能治愈的方法,但是伴有Ⅱ型或Ⅲ型肝转移的患者并不能耐受转移灶完全切除术,因此只有很少一部分的患者可以接受手术治疗[5]。此外,其他的姑息性治疗手段,包括生长抑素类似物治疗、分子靶向药物治疗、选择性内部放射治疗和肽受体放射性核素治疗等,虽可减少肿瘤负荷和控制疾病进展,但疗效并不显著,且恶心及血压、血糖升高等不良反应明显[6]。因此,临床急需寻找一种新的治疗方法来提高GEP-NENs伴肝转移患者的生活质量,延长生存期。热消融包括射频消融(radio frequency ablation,RFA)与微波消融(microwave ablation,MWA)因安全、微创、可重复性且操作简单等特点,已经越来越被认可并临床推广。研究表明,MWA在消融直径、效率、散热效果以及手术时间等方面已经明显优于RFA。已有证据表明,MWA同步TACE治疗肝内胆管细胞癌是安全有效的,并可以显著减少栓塞过程中化疗药物的使用剂量[7]。并且,MWA同步TACE治疗理论上可实现栓塞供养肿瘤病灶的主要动脉同时消灭肿瘤边缘因MWA不彻底而残留的肿瘤细胞。GEP-NENs中国专家共识中针对肝脏局部病灶的处理中也明确提出TACE以及热消融常用于控制pNENs 的肝转移灶,有效率超过50%,在症状缓解、肿瘤标志物下降以及影像学缩小等方面临床受益明显[8]。近年来,复旦大学附属中山医院开展了MWA同步TACE治疗在GEP-NENs肝转移患者中的应用,对于无法手术切除的患者达到了一定的疗效。本文回顾性的分析了我院接受MWA同步TACE治疗GEP-NENs肝转移患者的疗效及预后影响因素。
资 料 和 方 法
一般资料 收集从2013年5月至2016年10月,在我院接受MWA同步TACE治疗的19例GEP-NENs肝转移患者的资料。回顾性分析入组患者中男性12例(65%),女性7例(35%),年龄33~70岁,平均(55.8±9.5)岁。原发肿瘤均为单发,其中例为功能性2例,无功能性17例,且其中3例发现时原发病灶已经无法手术,行原发部位手术后切除的16例患者中,1例是先发现肝转移部位病灶后,经过病理诊断后发现原发病灶位置,2例经介入治疗术后对原发部位肿瘤进行根治性切除术。原发肿瘤有9例位于胰腺、5例位于胃部、5例位于结肠。肝脏转移部位最大肿瘤直径约0.8~5.8 cm,平均(2.94±1.42)cm。本组病例均行肝穿刺活检通过镜下形态学诊断标准及对标志性神经内分泌蛋白免疫组织化学染色,如嗜铬粒蛋白A (chromogranin A,CgA)、神经特异性烯醇化酶(neuro-specific enolase,NSE)、突触素(synaptophysin,Syn)等,均证实为GEP-NENs。按WHO分级标准:6例为神经内分泌瘤G1,9例为神经内分泌瘤G2,4例为神经内分泌癌G3。8例患者有局部淋巴结浸润,2例有肝外远处转移(表1)。
入选标准 (1)根据影像学(超声、CT、MRI)检查,血清肿瘤标记物、特异的临床症状、病史与体征及术中穿刺病理等资料,确诊为GEP-NENs肝转移;(2)影像学资料(或联合术中探查)表明肿瘤边界及侵犯情况,确认肝转移病灶无法行根治性手术切除;(3)中性粒细胞计数>3.5×109/L,血小板计数>45×109/L;血肌酐<115 μmol/L;凝血酶原时间延长<3 s;(4) ECOG评分≤2;(5)胃肠胰神经内分泌肿瘤局部肝转移病灶直径<6 cm;(6)排除TACE以及微波消融相关禁忌证;(7)患者自愿接受MWA同步TACE治疗术。
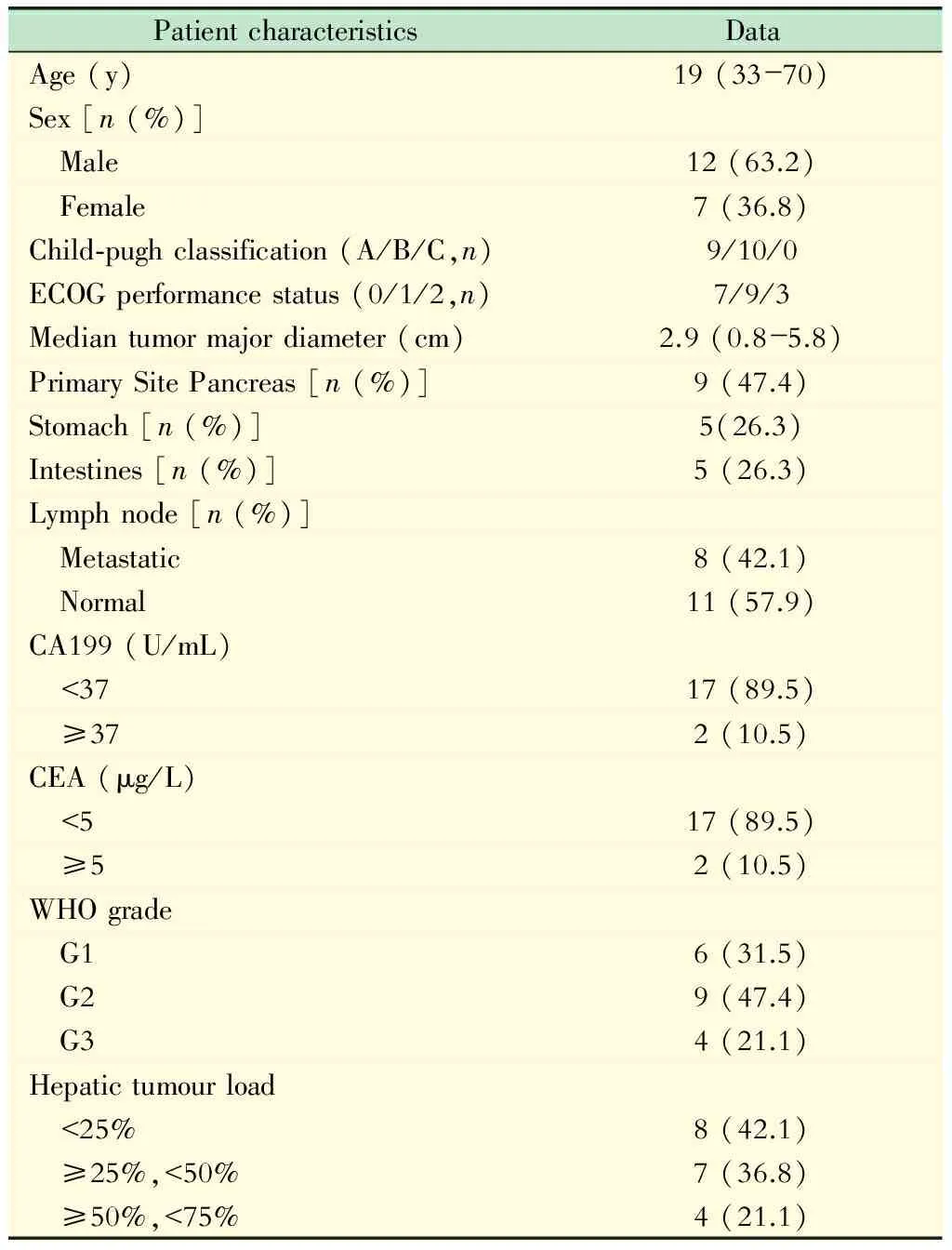
表1 19例患者的临床基本资料
排除标准 (1)门静脉栓塞以及伴有严重肝、肾功能障碍;(2)胆红素>6 mg/dL、有凝血障碍或严重的出血倾向;(3)严重感染;(4)肝肿瘤负荷> 75%;(5)合并严重高血压、心脏病或脑血管疾病等。
治疗方法 所有患者入院后,接受MWA同步TACE治疗前进行全面筛查,确保患者符合入组标准,可以进行MWA同步TACE治疗,避免出现致命性的术中或术后并发症。患者术前常规行平扫+增强CT/MRI扫描,对肿瘤大小、数量以及与周围邻近血管、脏器的关系等进行影像学评估,为制定手术计划提供依据。具体手术过程如下:
患者仰卧位,心电监护,取右侧股动脉穿刺点,常规消毒铺巾,以2%利多卡因5 mL局麻穿刺部位。穿刺右股动脉成功后,引入5F鞘,以5F RH导管插管经股动脉到腹主动脉,然后到达腹腔干的分支,最后到达肝固有动脉,超选供应肿瘤的小动脉分支。常规行肝脏和肠系膜上动脉造影,评估血管解剖特点、肿瘤血供和门静脉开放等情况。术中结合术前CT/MRI影像学表现在超声(sonoscape S40)引导下对局部肝转移病灶进行定位,定位后以2%利多卡因局麻穿刺部位,14 G微波穿刺针(南京维京九洲医疗器械研发中心)沿最大径进入该病灶中心层面,针尖超过该病灶远端约0.5 cm。根据患者肝脏局部病灶大小及性质设置合适的热消融条件,术中超声实时引导下可见该病灶及周边均匀高回声。消融结束后拔出消融针,再次造影显示原肿瘤染色区域染色情况,血供丰富的病灶一般先用表阿霉素20 mg加碘油混悬液注入阻塞肿瘤供血动脉小分支,碘化油的剂量主要取决于血液供应、肿瘤大小和数目及肝脏功能,最后用明胶海绵颗粒阻塞供血动脉主干,直到血流停滞。对于肿瘤染色不显著的肝转移病灶,我们则会以选择(300~500 μm)明胶海绵颗粒栓塞进一步加强栓塞供肿瘤血管分支。为了避免治疗后肝功能失代偿,对于肝脏肿瘤负荷超过50%的患者,我们采用选择性肝脏分叶栓塞进行介入治疗,每次重点栓塞左右一侧叶病灶,1个月后再重点栓塞另一侧,选择周期性介入治疗的方案治疗。同时从肝动脉导管选择原发病灶供血动脉进行灌注化疗:草酸铂(100 mg/m2)+表阿霉素30 mg。首次经TACE同步MWA治疗的5例患者,因术后出现新的肝转移病灶再次选择TACE同步MWA治疗。所有患者术后24 h监测生命体征,常规进行镇痛、保肝、止吐、抑酸、预防性使用抗生素等处理,以防肝脓肿等并发症。术后1天监测肝肾功能以及血常规变化,患者一般情况恢复,给予出院。根据患者治疗后的具体情况,嘱患者间隔约1~3个月后门诊随访复查。
疗效评价 3个月之内或者下一次门诊复查时进行疗效评估,包括患者主诉、症状、体征、肝转移病灶体积变化、常规实验室检测(血常规、血生化、肿瘤标志物和肝功能)和影像学检查(MRI或CT)。根据mRECIST标准[9],分为4组:(1)完全缓解(complete remission,CR):所有目标病灶(动脉期增强显影)全部消失;(2)局部缓解(partial remission,PR):目标病灶(动脉期增强显影)的最大直径总和缩小≥30%,多个病灶:选取2~5个最大病灶进行测量;(3)疾病稳定(stable diaease,SD):肿瘤体积减少<30%,或增大>20%;(4)疾病进展(progressive disease,PD):目标病灶(动脉期增强显影)的直径总和增加≥20%或者出现新的肿瘤病灶。RR=CR+PR,DCR=CR+PR+SD。
随访 所有患者出院后进行电话随访以及门诊复查,随访至2016年12月25日。总生存期(overall survival,OS)的定义为从患者首次接受TACE开始至患者死亡或发生截止事件的时间。无进展生存期(progression free survival,PFS)定义为从接受MWA同步TACE治疗开始至疾病出现进展或患者死亡的时间。患者下一次门诊复查时评估为SD及以上的患者会进行下一次介入治疗,直到患者身体条件不可以耐受介入手术治疗时停止。患者每次治疗前复查肝、肾功能、血常规、出凝血以及NSE、CgA、 CEA、CA199等神经内分泌肿瘤相关标志物,并与上一次治疗前的检查结果相比较。
结 果
影像学评估 19例患者经过分析前后影像学资料,依据mRECIST标准评价客观疗效,所有患者均可评价疗效,1例CR (5%)(图 1),3例PR (16%),7例PD (37%),8例SD (42%),RR为21%,DCR为63%。
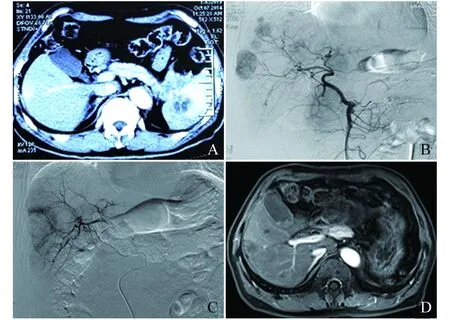
A:Preoperative CT scan indicated a lesion with abundant blood supply in the right lobe of liver and occupation upon pancreatic tail and spleen in arterial phase.B:The angiography in the first intervention operation prompted multiple tumor staining with abundant blood supply during arterial phrase in the liver.C:DSA angiography after TACE with MRA indicated the range of ablation was beyond the tumor edge,the tumor staining disappeared,and peripheral blood staining increased after congestion and edema,which exhibited a complete ablation.D:Two years after TACE with MRA,the MR dynamic enhancement in early arterial phrase showed the range of complete ablation in right lobe of liver was decreased compared to the previous with no peripheral enhancement or new lesions.
图 1 60岁男性胰腺NEN肝转移行超声引导下MWA同步联合TACE治疗
Fig 1 MWA combined with TACE was performed on a 60-year- old male with the pancreas NEN with liver metastasis
生存分析 本研究随访截止日期为2016年12月25日,随访时间(17.7±14.6)个月(随访时间窗:1~44个月),19例患者中除3例患者死亡外其余16例均存活。1名患者因为消化道大出血抢救无效死亡,2名患者由于肿瘤终末期患者全身器官衰竭死亡。并没有发现治疗相关并发症引起的死亡。全组患者的中位PFS和中位OS分别为25和34个月。1年和3年生存率分别为95%和84%。单因素生存分析发现,肝转移灶病理WHO分级以及肝转移灶肿瘤负荷是患者生存预后的主要风险因素,其中肝转移灶WHO分级达到G3往往提示患者中位OS较差(P=0.019,图2),而肝转移灶肿瘤负荷与中位PFS呈负相关性(P=0.005)。
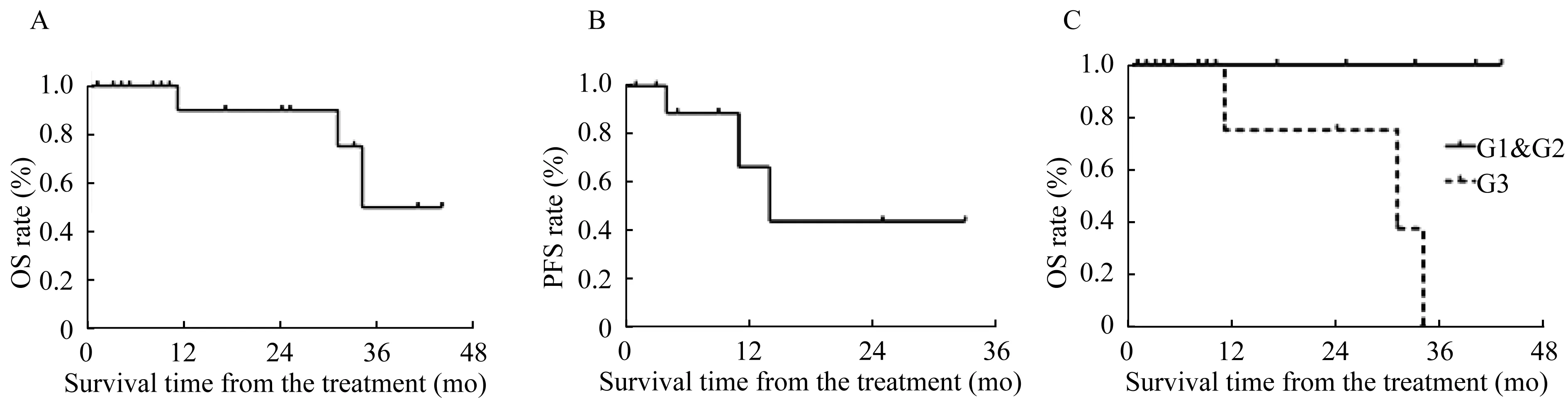
A:Kaplan-Meier estimate of OS.B:Kaplan-Meier estimate of PFS.C:OS of patients with different WHO classification.
图2 患者生存分析
Fig 2 Analysis on survival time of patients
术中、术后并发症 术中所有患者均可耐受手术。术中未见皮肤烧伤、对比剂外渗,新生动静脉瘘形成。碘油栓塞后,靶病灶区域染色基本消失。术后3天内19例患者出现轻度发烧、中上腹部疼痛,经积极对症处理后症状缓解。部分患者会出现不同程度的化疗反应:恶心、呕吐、便秘等,经内科处理后症状消失。19例患者术前丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)分别为(24.2±7.8)U/L和(27.5±10)U/L。术后3天部分患者ALT、AST升高明显。但是术后1个月ALT和AST分别降至(20.5±6.5)U/L和(14.2±6.7)U/L,差异无统计学意义。介入治疗前后胆红素差异无统计学意义。术后均未出现胆道损伤,肝、肾功能衰竭等并发症,1例胰十二指肠术后患者同步消融术后出现肝脓肿,经积极穿刺引流脓液后患者脓腔自净(图 3),31个月后因上消化道出血死亡。
统计学方法 采用SPSS21.0版软件进行统计学处理。单因素生存分析采用Kaplan-Meier法并绘制生存曲线。P<0.05为差异有统计学意义。
讨 论
GEP-NENs临床上较为少见,可分为功能性和无功能性,两者在形态学上无并无明显差异,前者肿瘤细胞会分泌激素及活性胺等引起相应的临床综合征。肝脏是GEP-NENs最常见的转移部位,对伴有肝转移的患者的治疗长期以来一直是个棘手的问题。GEP-NENs肝转移灶多呈多中心性,仅10%患者转移病灶局限于某一肝段或者叶而行根治性手术切。本组患者中大多数患者肝脏表现为多发转移灶,占89%。对于GEP-NENs肝转移患者往往缺乏有效的治疗方式,TACE、RFA、MWA等姑息性治疗手段在临床上已经被广泛用于无法手术切除肝转移灶者的治疗。有文献报道,RFA能够彻底消融直径3 cm的直肠癌肝转移,效果等同于肝切除术[10]。但是,RFA由于热沉效应,比较容易出现碳化,而影响其RFA范围及效果,而MWA是利用水分子在微波震荡电场的剧烈运动摩擦生热导致细胞凝固性坏死,不受热沉效应的影响,且能在更短时间内达到更完全、更大范围的肿瘤灭活。此外,MWA还可以实现同一病灶多点消融以及多个病灶同时消融,有效的扩大了消融区范围[11]。越来越多的证据表明,MWA不仅能对肿瘤产生直接杀伤作用,而且还改变了肿瘤内的免疫格局,增强了局部的抗肿瘤免疫应答。有研究发现,MWA后热休克蛋白(HSP70)表达增加在激活抗肿瘤免疫反应中起着关键作用,细胞内的HSP通过抑制细胞凋亡保护组织免受损伤,而分泌至细胞外的HSP则参与各种抗原免疫过程,促进肿瘤特异性抗原的表达,诱导特异性CD4+和CD8+T淋巴细胞反应,从而增强机体抗肿瘤免疫[12]。众所周知,TACE能够发现常规对比增强CT或磁共振成像看不见的一些微小病灶,因此术中可以有效地处理这些微小病灶,同步TACE治疗过程中可以及时发现MWA相关并发症,如出血或动静脉短路等,并作出及时处理。本组病例我们采用超声引导下先行MWA后即刻行TACE治疗,这样可进一步提高瘤体周边未受到消融的区域和受到亚致死热损伤肿瘤组织的药物浓度,以及对化疗药物的敏感性,使得局部坏死更彻底,可进一步解决局部复发率的问题。如果先行TACE再做MWA的话,可能会造成图像干扰,及残留部分病灶。已有文献报道MWA同步TAC治疗大肝癌以及巨块型肝癌临床疗效显著,并且有效地减少了碘油以及化疗药物用量,减少肝脏不良反应,明显改善患者预后[13]。本组中1例(1/6)患者肿瘤原发灶先行胰十二指肠切除术后又接受MWA同步TACE治疗,术后发生肝多发脓肿,考虑肠道细菌返流所致胆源性感染,与文献报道胆肠手术后48%的肝脓肿发生率相比较低[14],说明在提前1天肠道清洁准备,围手术期合理应用抗生素及术后密切随访下,可以明显降低并发症发生率。
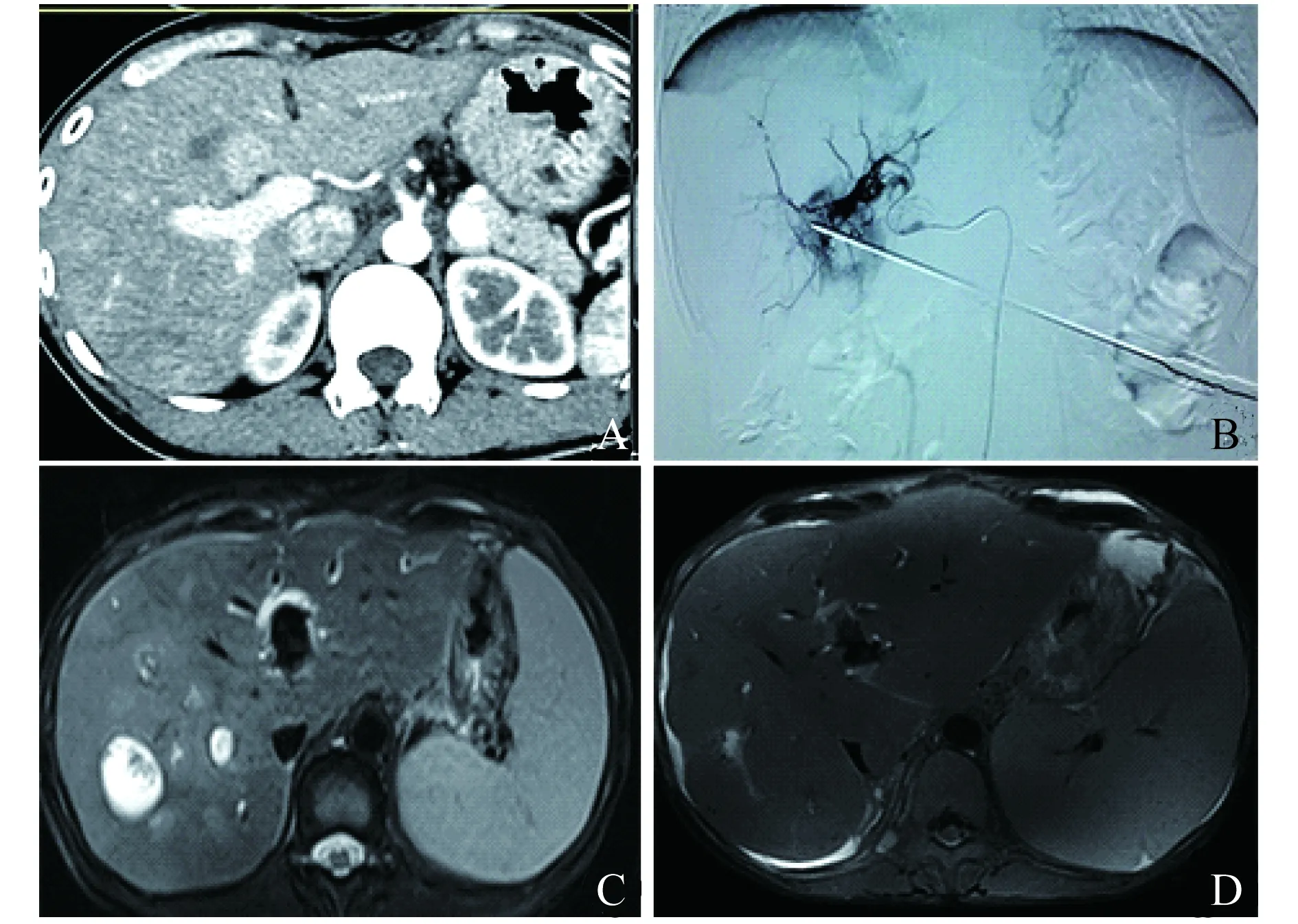
A:Gastrinoma in stage of G2 was detected by post-operative pathology after Child operation.Three years later,Contrast-enhanced CT scan indicated strengthening signals in the inside left hepatic lobe during early arterial phrase.B:TACE with MRA operation.C:One month after surgery,MRI scan showed multiple abscesses were observed in the right hepatic lobe with a high fever ten days after operation.D:After positive treatment with puncture drain and antibiotics,the vomica was self-purified and remained stable condition.Massive hemorrhage of upper gastrointestinal tract leading to death was occurred.
图3 MWA同步TACE术后肝右叶多发脓肿
Fig 3 Right liver lobe with conventional multiple abscesses after MWA combined with synchronous TACE
我们临床研究发现,接受WMA联合TACE治疗的患者中位PFS为25个月,中位OS为34个月,相比于Kitano等[15]报道的TACE单独治疗NET肝转移的中位OS 28个月显著延长。有研究表明,3年随访MWA同步TACE治疗肠癌肝转移中1年和2年的总存活率分别为46.7%和25.4%,而中位PFS 为5个月,中位OS为11.0个月[16]。Robert 等[17]报道5年随访单纯MWA治疗NET肝转移的中位OS为18个月,中位PFS为8个月。相比之下,MWA同步TACE治疗GEP-NENs不可切除的肝转移能够明显延长患者生存期。单因素生存分析发现,肝转移灶病理WHO分级,接受治疗时肝转移灶肿瘤负荷大小是患者预后的主要影响因素,当WHO分级达到G3时,往往提示患者的预后相对较差,本组有4例G3患者,按照指南先行化疗,进展后行MWA同步TACE治疗,对病灶行减瘤处理。其中2例存活时间超过24个月。提示我们需要前瞻性的精确分层的临床研究来进一步验证NEN-G3肝转移患者是否应该接受MWA同步TACE治疗。而对于肿瘤分级为G1/G2,分化良好以及血供丰富的病灶,进行MWA同步TACE治疗后生存期及临床获益明显。与文献报道结果相一致[18]。血清肿瘤标志物CA199、CEA、AFP是消化道来源肿瘤以及原发性肝癌患者术后最常用的随访指标。但是本研究发现其在无功能NEN肝转移患者当中普遍处于正常范围,差异并无统计学意义。考虑这也是影响GEP-NENs早期发现以及预后监测的一大难题。CgA广泛分布于神经内分泌细胞的嗜铬性颗粒内,由于其半衰期较长而成为评估整个神经内分泌系统活性的重要指标。中国临床肿瘤学会神经内分泌肿瘤专家委员会明确提出CgA是GEP-NENs中最常用的肿瘤标志物,可用于协助诊断、指导治疗和评估疗效,还可用于伴随肝转移患者的随访[8]。相关临床研究表明,血浆CgA与NEN肿瘤的分级、分化有关,且诊断价值优于NSE,血浆CgA在早期诊断功能性与非功能性神经内分泌肿瘤中敏感性分别为54.9%和63.2%。一旦患者血浆CgA水平明显升高,往往提示预后较差[19]。并且在治疗过程中监测血浆CgA 动态变化也具有重要价值[20]。本研究随访发现19例患者治疗前血浆CgA和NSE分别为(178.4±104.4)ng/mL和(20±14.9)ng/mL,同步治疗1个月后患者血浆CgA和NSE水平分别为(57.6±29.4)ng/mL和(13.4±7.4)ng/mL,较术前明显降低,且大部分降低至正常水平(P值分别为0.003和0.093),有利于患者预后。血浆CgA水平诊断NENs可能与肿瘤的大小、分级与分化有关,但生长抑素类似物以及某些疾病等可以影响血浆CgA水平。所以在选择CgA 检测方法及解读结果时应特别谨慎[19]。血浆CgA 是诊断pNENs的首选生化指标,而神经内分泌癌(neuroendocrine carcinoma,NEC)患者的血浆CgA大部分为阴性,此时检测NSE可协助NEC的诊断及随访[8]。随着精准医学的提出,分子靶向治疗已经成为近年来医药研究的热点,对于GEP-NENs伴肝转移分子靶向治疗的问题,新型多靶向性的蛋白酪氨酸激酶抑制剂舒尼替尼以及哺乳动物雷帕霉素靶蛋白抑制剂伊维莫司治疗转移性的pNETs 已经显示出一定的疗效及耐受性[21-22],但还缺乏分层大样本的前瞻性头对头对照临床研究。由于本文仅为一个小样本回顾性研究,不可避免地存在着一些偏倚,我们后续也将会有样本量更大的临床前瞻性研究来验证和丰富我们的结论。
本研究结果表明MWA同步TACE治疗GEP-NENs肝转移是安全有效的,本疗法在扩大手术适应证的同时,与单一治疗相比未发现其他不良反应;术中实时动态DSA提高了肝转移病灶的显示率,结合术中超声可进一步明确肿瘤大小、数目、与周围血管关系以及微小病灶;能及时发现术中出血、动静脉瘘、对比剂外渗等并发症,并可及时处理。MWA同步TACE治疗不仅可以针对肝转移病灶进行治疗,同时对无法切除的原发病灶进行局部灌注化疗,延长了患者的无疾病进展时间,并且治疗间隔相对延长,总体提高了生存率。此外,综合评估患者肝转移灶WHO分级、肿瘤负荷大小以及血清CgA,针对不同患者个体化制定更为合理、有效的综合治疗方案,对提高疾病治疗有效率、改善患者的预后将具有重要的意义。
[1] FRILLING A,AKERSTROM G,FALCONI M,etal.Neuroendocrine tumor disease:an evolving landscape[J].EndocrRelatCancer,2012,19(5):R163-R185.
[2] FALCONI M,ERIKSSON B,KALTSAS G,etal.ENETS consensus guidelines update for the management of patients with functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors[J].Neuroendocrinology,2016,103(2):153-171.
[3] BILIMORIA KY,TALAMONTI MS,TOMLINSON JS,etal.Prognostic score predicting survival after resection of pancreatic neuroendocrine tumors:analysis of 3851 patients[J].AnnSurg, 2008,247(3):490-500.
[4] HAN X,XU X,JIN D,etal.Clinicopathological characteristics and prognosis-related factors of resectable pancreatic neuroendocrine tumors:a retrospective study of 104 cases in a single Chinese center[J].Pancreas,2014,43(4):526-531.
[5] KULKE MH,BENSON AR,BERGSLAND E,etal.Neuroendocrine tumors[J].JNatlComprCancNetw,2012,10(6):724-764.
[6] CHUNG C.Management of neuroendocrine tumors[J].AmJHealthSystPharm,2016,73(21):1729-1744.
[7] YANG GW,ZHAO Q,QIAN S,etal. Percutaneous microwave ablation combined with simultaneous transarterial chemoembolization for the treatment of advanced intrahepatic cholangiocarcinoma[J].OncoTargetsTher,2015,8:1245-1250.
[8] 中国临床肿瘤学会神经内分泌肿瘤专家委员会.中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J].临床肿瘤学杂志,2016,21(10):927-946.
[9] LENCIONI R,LLOVET JM.Modified RECIST (mRECIST) assessment for hepatocellular carcinoma[J].SeminLiverDis,2010,30(1):52-60.
[10] WANG J,LIANG P,YU J,etal.Clinical outcome of ultrasound-guided percutaneous microwave ablation on colorectal liver metastases[J].OncolLett,2014,8(1):323-326.
[11] LUCCHINA N,TSETIS D,IERARDI AM,etal.Current role of microwave ablation in the treatment of small hepatocellular carcinomas[J].AnnGastroenterol,2016,29(4):460-465.
[12] CHU KF,DUPUY DE.Thermal ablation of tumours:biological mechanisms and advances in therapy[J].NatRevCancer,2014,14(3):199-208.
[13] 司增梅,钱晟,刘嵘,等.微波消融同步联合TACE治疗大肝癌和巨块型肝癌的临床疗效分析[J].复旦学报(医学版),2016,43(5):563-568.
[14] WOO S,CHUNG JW,HUR S,etal.Liver abscess after transarterial chemoembolization in patients with bilioenteric anastomosis:frequency and risk factors[J].AJRAmJRoentgenol,2013,200(6):1370-1377.
[15] KITANO M,DAVIDSON GW,SHIRLEY LA,etal. Transarterial chemoembolization for metastatic neuroendocrine tumors with massive hepatic tumor burden:is the benefit worth the risk?[J].AnnSurgOncol,2016,23(12):4008-4015.
[16] WU ZB,SI ZM,QIAN S,etal.Percutaneous microwave ablation combined with synchronous transcatheter arterial chemoembolization for the treatment of colorectal liver metastases:results from a follow-up cohort[J].OncoTargetsTher,2016,9:3783-3789.
[17] MARTIN RC,SCOGGINS CR,MCMASTERS KM.Safety and efficacy of microwave ablation of hepatic tumors:a prospective review of a 5-year experience[J].AnnSurgOncol,2010,17(1):171-178.
[18] SORBYE H,WELIN S,LANGER SW,etal.Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3):the NORDIC NEC study[J].AnnOncol,2013,24(1):152-160.
[19] HAN X,ZHANG C,TANG M,etal.The value of serum chromogranin A as a predictor of tumor burden,therapeutic response,and nomogram-based survival in well-moderate nonfunctional pancreatic neuroendocrine tumors with liver metastases[J].EurJGastroenterolHepatol,2015,27(5):527-535.
[20] WANG YH,YANG QC,LIN Y,etal.Chromogranin A as a marker for diagnosis,treatment,and survival in patients with gastroenteropancreatic neuroendocrine neoplasm[J].Medicine(Baltimore),2014,93(27):e247.
[21] RAYMOND E,DAHAN L,RAOUL JL,etal. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors[J].NEnglJMed,2011,364(6):501-513.
[22] YAO JC,SHAH MH,ITO T,etal. Everolimus for advanced pancreatic neuroendocrine tumors[J].NEnglJMed,2011,364(6):514-523.
Clinical value of percutaneous microwave ablation combined with synchronous transarterial chemoembolization for the treatment of gastroenteropancreatic neuroendocrine neoplasms with liver metastases
GAO Shan-shan1,2, PU Ning3, LOU Wen-hui3, WU Meng-fei2, CHEN Yi1,2, GONG Gao-quan1,2, LIU Ling-xiao1,2△, WANG Xiao-lin1,2
(1ShanghaiInstituteofMedicalImaging,Shanghai200032,China;2DepartmentofInterventionalRadiology,3DepartmentofGeneralSurgery,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
Objective To investigate the safety,effectiveness and prognosis of percutaneous microwave ablation (MWA) combined with synchronous transarterial chemoembolization (TACE) to treat of gastroenteropancreatic neuroendocrine neoplasms (GEP-NENs) with liver metastases (LMs).
Methods This retrospective study included 19 cases of GEP-NENs with LMs patients who
percutaneous MWA combined with synchronous TACE treatment from 2013 to 2016.The mRECIST standard was selected to assess the curative effect.SPSS 21.0 software was applied in the statistical analysis of overall survival (OS),progression-free survival (PFS) and factors related to prognosis.Results All patients were capable of curative effect evaluation,including 1 case of complete remission (CR),3 cases of partial remission (PR),7 cases of progressive disease (PD) and 8 cases of stable disease (SD) respectively accounting for 5%,16%,37%,42%,which exhibited 21% of response rate (RR) and 63% disease control rate (DCR).In the present study,the median OS and median PFS was respectively 25 months and 34 months,and the one-year survival and three-year survival was respectively 95% and 84%.Serum CA199,the WHO classification of LMs and the tumor burden of LMs were the major risk factors of prognosis through single factor analysis of survival,which showed that G3 of the WHO classification of LMs predicted a poor OS (P<0.05) and tumor burden of LMs was negatively related to PFS (P<0.05).It was obviously observed that serum CgA was decreased by the therapy of percutaneous MWA with synchronous TACEfor GEP-NENs (P<0.05). ConclusionsPercutaneous MWA combined with synchronous TACE is a safe and effective method to treat GEP-NENs with LMs.
microwave ablation; transarterial chemoembolization; gastroenteropancreatic neuroendocrine neoplasms; liver metastases
国家自然科学基金青年项目(81201170);上海市卫生和计划生育委员会科研项目(20160277,20134458);上海市慈善基金会荣昶专项基金
R735.9
A
10.3969/j.issn.1672-8467.2017.03.003
2017-01-05;编辑:王蔚)
△Corresponding author E-mail:liu.lingxiao@zs-hospital.sh.cn
*This work was supported by the Youth Project of National Natural Science Foundation of China (81201170),the Fund from Shanghai Municipal Commission of Health and Family Planning (20160277,20134458),and Rong Chang Special Fund of Shanghai Charity Foundation.
