不同端粒片段通过沉默信息调节因子1/抑癌基因P53促进血管平滑肌细胞凋亡
2017-06-27吕娟王红
吕娟,王红
不同端粒片段通过沉默信息调节因子1/抑癌基因P53促进血管平滑肌细胞凋亡
吕娟,王红
目的:研究不同端粒寡核苷酸序列对大鼠胸大动脉平滑肌细胞(A7R5) 凋亡的影响,及沉默信息调节因子1(SIRT1)/抑癌基因P53(P53)信号通路是否参与调控端粒寡核苷酸序列诱导A7R5的凋亡。
方法:将三种端粒重复序列端粒寡核苷酸序列的二聚体、四聚体、六聚体[TE-12(TTAGGG)2、TE-24(TTAGGG)4、TE-36(TTAGGG)6]转染至A7R5,分别作为TE-12组、TE-24组、TE-36组,另设A7R5空白为阴性对照组。应用流式细胞仪检测各端粒寡核苷酸序列转染后A7R5的凋亡情况。采用逆转录多聚酶联反应(RT-PCR)及蛋白免疫印迹(Western-blot)检测TE-12组、TE-24组、TE-36组及阴性对照组SIRT1、P53基因及蛋白水平。
结果:将TE-12、TE-24、TE-36成功转染进A7R5,各组转染率差异无统计学意义。TE-12组A7R5凋亡率明显高于TE-36组、TE-24组和阴性对照组,TE-24组细胞凋亡率最低,但亦明显高于阴性对照组,差异均有统计学意义(P均<0.05)。TE-12组A7R5SIRT1mRNA及蛋白水平明显高于TE-36组、TE-24组和阴性对照组,差异均有统计学意义(P均<0.05)。TE-24组A7R5P53mRNA及蛋白水平明显低于TE-36组、TE-12组和阴性对照组,差异均有统计学意义(P均<0.05)。
结论:端粒寡核苷酸序列促进A7R5的凋亡。不同结构的端粒寡核苷酸序列引起A7R5凋亡程度不同,在选取的三种结构中,端粒单链序列TE-12引起A7R5凋亡最明显。端粒寡核苷酸序列对A7R5凋亡的作用可能与SIRT1/P53信号通路有关。
寡核苷酸类; 肌,平滑,血管; 凋亡
(Chinese Circulation Journal, 2017,32:612.)
针对增龄而出现的血管老化问题已成为防治心血管疾病的新靶点[1]。血管老化作为一种退行性疾病,其病理改变主要涉及内皮细胞和平滑肌细胞的凋亡[2-4]。端粒学说是目前被认可的衰老机制之一,研究发现端粒长度缩短启动了细胞凋亡过程,端粒可能通过细胞凋亡的形式与血管老化有密切联系[5-6]。当端粒因分裂而缩短至临界长度时,细胞停止分裂走向凋亡,但具体机制尚不清楚[7-10]。沉默信息调节因子1(SIRT1)为哺乳动Sirtuins家族成员之一,是依赖烟酰胺腺嘌呤二核苷酸 (NAD+)的第 III 类组蛋白去乙酰化酶。SIRT1是重要的抗衰老蛋白,通过使多个蛋白质去乙酰化而改变其活性,涉及细胞内基因沉默、能量代谢、抗细胞凋亡和氧化应激等多种生物功能[11-13]。抑癌基因P53(P53)的细胞内活性作用主要体现在对细胞周期的阻滞、促进细胞凋亡和DNA修复[14]。近期研究表明,SIRT1去乙酰化酶与细胞凋亡关系密切,SIRT1还可通过将P53蛋白第382位赖氨酸残基乙酰化,降低P53蛋白与DNA顺式元件的结合能力,从而抑制细胞凋亡[15-19]。端粒是否通过SIRT1/P53通路调节平滑肌细胞的凋亡,目前尚少见报道。本实验旨在探讨不同端粒寡核苷酸序列对平滑肌细胞凋亡的影响,以及SIRT1/P53通路是否参与其中的调控。
1 材料与方法
1.1 实验细胞与主要材料
大鼠胸大动脉平滑肌细胞(A7R5)购自上海生物科技有限公司,澳洲胎牛血清、Gene JET RNA Purification kit、Maxima SYBR Green/ROXqPCR Master Mi购自北京宝赛生物技术有限公司,端粒寡核苷酸序列(带修饰和荧光标记)、Invitrgen-MA5-17142、DOTAP LIPosomalTranstreagen购自北京中杉金桥生物技术有限公司,P53、SIRT1一抗、二抗均为上海迈瑞尔化学技术有限公司产品。Annexin V-PI细胞凋亡检测试剂盒购自上海华雅思创生物科技有限公司。
1.2 不同端粒寡核苷酸序列细胞的转染
将三种端粒重复序列,端粒寡核苷酸序列的二聚体、四聚体、六聚体[TE-12(TTAGGG)2、TE-24(TTAGGG)4、TE-36(TTAGGG)6]转染至A7R5[20-23]。转染方法按寡核苷酸转染试剂盒所述方法,具体步骤如下:(1)转染前一天将A7R5种入六孔板,密度为80%,标记为TE-12组、TE-24组、TE-36组,另设A7R5空白为阴性对照组(2)转染当天每个孔分为两支离心管,第一支加入2.5 μg寡核苷酸片段后用无血清培养基补至25 μl,第二支加入25 μl无血清培养基和25 μl阳离子脂质体二油酰磷脂酰胆碱(DOTAP lipo)转染试剂。将第一管核酸溶液慢慢加入第二管,轻轻混匀,室温孵育12 min;(3)将步骤2中所得混合液加入对应孔中;(4)37℃,5% CO2培养24 h;(5)荧光显微镜下观察转染效率。
1.3 转染不同端粒寡核苷酸序列后检测A7R5凋亡率
采用流式细胞仪技术,使用Annexin V/ propidium iodide(PI)凋亡检测试剂盒检测细胞凋亡[24-25]。按照试剂说明书,收集1×106个细胞并重悬于200 μl缓冲液,分别加入5 μl染料Annexin V和5 μl PI,室温避光孵育15 min。用流式细胞仪检测细胞凋亡情况,记录1×104个细胞并用随机软件分析凋亡细胞比例。
1.4 实时定量多聚酶联反应(qRT-PCR) 分析SIRT1信使核糖核酸(mRNA)和P53 mRNA水平
提取细胞总RNA并精制,反转录为互补脱氧核糖核酸(cDNA)。在NCBI网站上进行引物设计,并交引物合成公司合成[26-27]。引物序列如下:
P53:F2-CAGCACAGGAACCTGGAACTGAGG,P53:R2-AGGTGGAAGCCATAGTTGCCTTGG,SIRT1:F2-CGGACAGTTCCAGCCATCTCTGTG,SIRT1:R2-TTGGATTCCTGCAACCTGCTCCAA,β-actin:F1-CCATCTATGAGGGTTACGCGCTCC,β-actin:R2-CACGATTTCCCTCTCAGCTGTGGT,通过设定的程序[恒温段:50℃2 min;95℃10 min。循环段:95℃ 20 s;58℃20 s;72℃ 20 s(读取荧光),循环段为40个循环。熔解段:95℃ 15 s;60℃ 1 min;95℃ 15 s(读取荧光)]扩增相应的基因,用随机系统进行数据分析,计算目的基因的循环数(Ct)值,以-ddCt作为目的基因表达水平[-ddCt=(Ct目的基因—Ct内参基因)处理组—(Ct目的基因—Ct内参基因)正常组]。所有反应独立重复3次。
1.5 SIRT1、P53蛋白检测
端粒寡核苷酸序列转染细胞后于24 h收集细胞。依据试剂盒说明提取收集细胞的蛋白,并进行蛋白浓度的定量[28]。加入2倍的上样缓冲液,沸水中煮5 min,使蛋白变性。每个上样孔加等量蛋白,进行SDS聚丙烯酰胺凝胶电泳(配制10%的分离胶和5%的浓缩胶)。将凝胶上的蛋白带转移到聚偏二氟乙烯膜(PVDF)上,4℃封闭过夜。分别加入特异性的一抗,稀释度(抗体与封闭液的体积比)为1:800~1000,在摇床上室温反应2~3 h后再与辣根过氧化物酶标记的二抗(1:1500)孵育1~2 h,最后用电化学(ECL)发光试剂盒发光,在暗室中进行压片、洗片。
1.6 统计学分析
应用SPSS 17.0软件对数据进行统计学分析。各组数据均符合正态性,计量资料以表示。符合方差齐性检验数据,采用单因素方差分析。方差不齐数据,则采用两独立样本秩和检验(Mann-Whitney U)进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同端粒寡核苷酸序列细胞转染的情况
TE-12、TE-24、TE-36成功转染至A7R5细胞,三组的转染率分别是(54.42±4.98)%、(56.34±3.76)%、(58.24±2.98)%,各组转染率差异无统计学意义(P>0.05),不影响其凋亡率,可以进行后续试验。图1
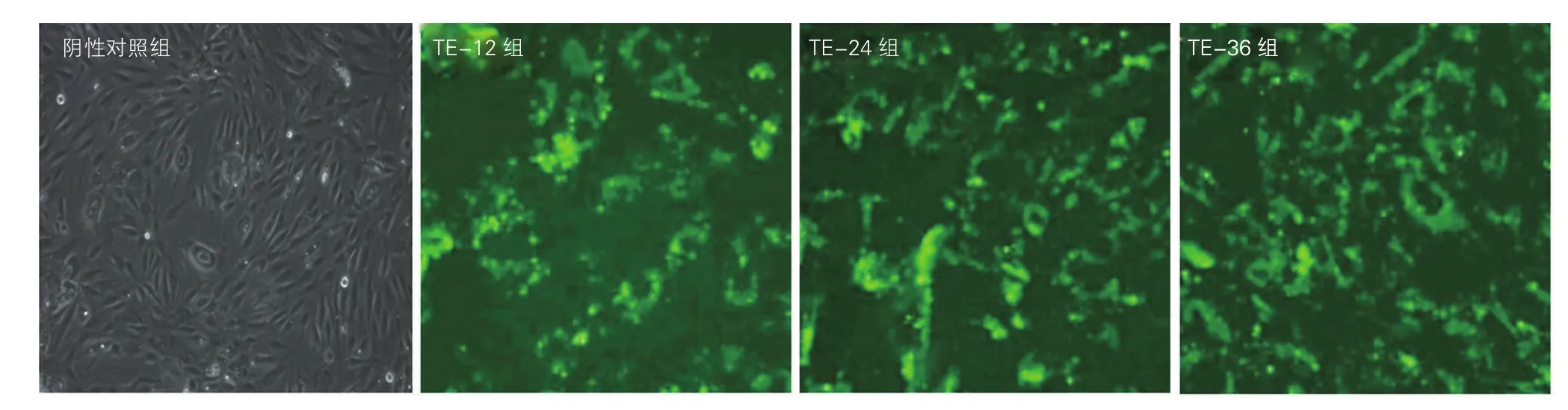
图1 荧光显微镜下显示大鼠胸大动脉平滑肌细胞对荧光标记的寡核苷酸序列的摄取结果
2.2 转染不同端粒寡核苷酸序列后检测A7R5凋亡率
TE-12组、TE-24组、TE-36组及阴性对照组的凋亡率分别是(24.52±2.14)%、(11.22±2.98)%、(17.31±3.76)%、(5.26±2.27)%。TE-12组A7R5凋亡率明显高于TE-36组、TE-24组和阴性对照组;TE-36组A7R5凋亡率明显高于TE-24组和阴性对照组;TE-24组A7R5凋亡率明显高于阴性对照组;差异均有统计学意义(P均<0.05)。图2
2.3 各组A7R5SIRT1 mRNA及P53 mRNA水平检测结果
各组A7R5SIRT1 mRNA水平比较:TE-12组、TE-24组、TE-36组及阴性对照组A7R5 SIRT1mRNA相对表达量分别为1.32±0.01、1.10±0.02、1.22±0.03、 0.92±0.01。TE-12组A7R5 SIRT1mRNA相对表达量明显高于TE-36组、TE-24组和阴性对照组(P均<0.05);TE-36组明显高于TE-24组和阴性对照组(P均<0.05);TE-24组明显高于阴性对照组(P<0.05),差异均有统计学意义。
各组A7R5P53 mRNA水平比较:TE-12组、TE-24组、TE-36组及阴性对照组A7R5P53mRNA相对表达量分别为0.72±0.01、0.45±0.02、0.58±0.03、0.91±0.03。TE-24组A7R5 P53 mRNA相对表达量明显低于TE-36组、TE-12组和阴性对照组(P均<0.05);TE-36组明显低于TE-12组和阴性对照组(P<0.05);TE-12组明显低于阴性对照组(P<0.05),差异均有统计学意义。
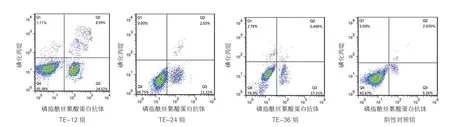
图2 各组转染后大鼠胸大动脉平滑肌细胞凋亡率流式细胞仪检测结果
2.4 各组A7R5 SIRT1蛋白及P53蛋白水平检测结果
各组A7R5 SIRT1 蛋白水平比较:TE-12组、TE-24组、TE-36组及阴性对照组A7R5 SIRT1蛋白相对表达量分别为1.92±0.01、1.51±0.02、1.61±0.01、0.50±0.01。TE-12组A7R5 SIRT1蛋白相对表达量明显高于TE-36组、TE-24组和阴性对照组(P均<0.05);TE-36组明显高于TE-24组和阴性对照组(P均<0.05);TE-24组明显高于阴性对照组(P<0.05),差异均有统计学意义。图3

图3 各组转染后大鼠胸大动脉平滑肌细胞SIRT1蛋白水平的蛋白免疫印迹检测结果
各组A7R5 P53蛋白水平检测比较:TE-12组、TE-24组、TE-36组及阴性对照组A7R5 P53蛋白相对表达量分别为1.21±0.01、0.73±0.01、0.92±0.03、1.51±0.02。TE-24组A7R5 P53蛋白相对表达量明显低于TE-36组、TE-12组和阴性对照组(P均<0.05);TE-36组明显低于TE-12组和阴性对照组(P均<0.05);TE-12组明显低于阴性对照组(P<0.05),差异均有统计学意义。图4
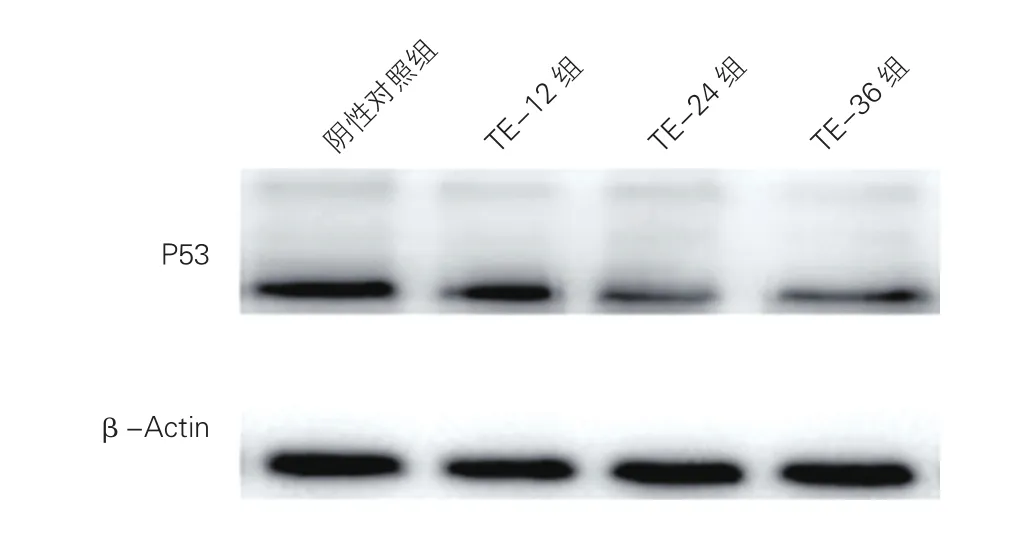
图4 各组转染后大鼠胸大动脉平滑肌细胞P53蛋白水平的蛋白免疫印迹检测结果
3 讨论
大量研究表明,端粒在触发细胞周期阻滞和细胞凋亡方面起作用。将合成的寡核苷酸序列导入细胞,可阻滞细胞周期导致细胞凋亡[29]。端粒结构的异常在多种细胞系中均能引起细胞凋亡,目前认为真核细胞的分裂增殖潜力由细胞的端粒长度控制,随着细胞的分裂 , 端粒DNA逐渐丢失[30]。
本实验研究结果显示不同端粒寡核苷酸序列引起A7R5细胞的凋亡率不同,具有端粒单链结构的TE-12引起细胞凋亡最明显,其次是具有一个G-四聚体和一个单链结构的TE-36,而四个端粒重复序列的TE-24因为形成了一个G-四聚体结构,诱导凋亡作用最弱。这种效应的差别可能是由于端粒单链结构能够模拟端粒开环后3’悬突的暴露,更易被识别为DNA的损伤信号[29-30]。此外,TE-12组、TE-36组、TE-24组的SIRT1mRNA和蛋白水平依次降低,并高于阴性对照组。而TE-12组、TE-36组、TE-24组的P53 mRNA和蛋白表达水平依次降低的,却低于阴性对照组,可见SIRT1参与了端粒寡核苷酸序列诱导的A7R5的凋亡,同时还下调了P53蛋白的表达水平。综合以上结果,可以看到TE-12组、TE-24组、TE-36组三组转染端粒寡核苷酸序列后,SIRT1、P53基因及蛋白水平与细胞凋亡的变化趋势一致,即TE-12组SIRT1、P53表达最高,凋亡也最明显。由此提示,端粒寡核苷酸序列可能通过SIRT1/P53途径促进平滑肌细胞的凋亡,并且对不同序列的调控可能还存在差异。
本研究为端粒寡核苷酸序列对A7R5的作用及相关机制做了新的探讨,对血管老化的基础研究提供了新的思路,但具体调控机制较复杂,尚需进一步深入研究。
[1] Butt HZ, Atturu G, London NJ. Telomere length dynamics in vascular disease: a review. Eur J Vasc Endova Scsurg, 2010, 40: 17-26.
[2] Saliques S, Zeller M, LorinJ. Telomere length and cardiovascular disease. Arch Cardiovasc Dis, 2010, 103: 454-921.
[3] Peng Y, Huang S, Cheng B. Mesenchymal stem cells: a revolution in therapeutic strategies of age-related diseases. Ageing Res Rev, 2013, 12: 103-150.
[4] Nilsson PM. Impact of vascular aging on cardiovascular disease: the role of telomere biology. J Hypertens, 2012, 30: 9-12.
[5] Rubtsova MP, Vasilkova DP, Malyavko AN. Telomere lengthening and other functions of telomerase. Acta Naturae, 2012, 4: 44-61.
[6] Chen C, Mu XY, Zhou Y. Ginsenoside rg1 enhances the resistance of hematopoietic stem/progenitor cells to radiation-induced aging in mice. Acta Pharmacol Sin, 2014, 3: 143-150.
[7] Garcia-Beccaria M, Martinez P, Mendez-Pertuz M. Therapeutic inhibition of trf1 impairs the growth of p53-deficient k-rasg12vinduced lung cancer by induction of telomericdna damage. Embo Mol Med, 2015, 7: 30-49.
[8] Bairley RC, Guillaume G, Vega LR. A mutation in the catalytic subunit of yeast telomerase alters primer-template alignment while promoting processivity and protein-dna binding. J Cell SCI, 2011, 124: 42-52.
[9] Lotfi RA, Zawahry KM, Kamar ZA. Effects of smoking on human telomerase reverse transcriptase expression in the skin. Int J Dermatol, 2014, 53: 5-12.
[10] Salminen A, Kaarniranta K, Kauppinen A. AMPK and HIF signaling pathways regulate both longevity and cancer growth: the good news and the bad news about survival mechanisms. Biogerontology, 2016, 17: 655-680.
[11] Calapre L, Gray ES, Kurdykowski S, et al. Heat-mediated reduction of apoptosis in UVB-damaged keratinocytes in vitro and in human skin ex vivo. BMC Dermatol. 2016, 16: 6-10.
[12] Moslehi J, Depinho RA, Sahin E. Telomeres and mitochondria in the aging heart. Circ Res, 2012, 110: 226-371.
[13] Knyphausen P, de Boor S, Kuhlmann N, et al. Insights into lysine deacetylation of natively folded substrate proteins by sirtuins. J Biol Chem, 2016 , 291: 14677-14694.
[14] Impey SG, Hammond KM, Shepherd SO, et al. Fuel for the work required: a practical approach to amalgamating train-low paradigms for endurance athletes. Physiol Rep, 2016, 4: 32-52.
[15] Takahashi-Niki K, Ganaha Y, Niki T, et al. Ariga HDJ-1 activates SIRT1 through its direct binding to SIRT1. Biochem Biophys Res Commun. 2016, 474: 131-136.
[16] 张庆勇, 陈燕萍, 刘芬, 等. 人参皂苷Rg1对大鼠急性心肌缺血抗氧化损伤指标及超微结构的影响. 中国循环杂志, 2015, 30: 164-167.
[17] Asaka R, Miyamoto T, Yamada Y, et al. Sirtuin 1 promotes the growth and cisplatin resistance of endometrial carcinoma cells: a novel therapeutic target. Lab Invest, 2015, 95: 1363-1373.
[18] Lee WY, Lee WT, Cheng CH, et al. Repositioning antipsychotic chlorpromazine for treating colorectal cancer by inhibiting sirtuin 1. Oncotarget, 2015, 6: 27580-27595.
[19] Song TY, Yeh SL, Hu ML, et al. A Nampt inhibitor FK866 mimics vitamin B3 deficiency by causing senescence of human fibroblastic Hs68 cells via attenuation of NAD(+)-SIRT1 signaling. Biogerontology, 2015, 16: 789-800.
[20] Gollavilli PN, Kanugula AK, Koyyada R, et al. AMPK inhibits MTDH expression via GSK3β and SIRT1 activation: potential role in triple negative breast cancer cell proliferation. FEBS J, 2015, 282: 3971-3985.
[21] Carnevale D, Pallante F, Fardella V, et al. The angiogenic factor PlGF mediates a neuroimmune interaction in the spleen to allow the onset of hypertension. Immunity, 2014 , 41: 737-752.
[22] Torma F, Koltai E, Nagy E, et al. Exercise increases markers of spermatogenesis in rats selectively bred for low running capacity. PLoS One, 2014, 9: e114075.
[23] Smit-McBride Z, Forward KI, Nguyen AT, et al. Age-dependent increase in miRNA-34a expression in the posterior pole of the mouse eye. Mol Vis, 2014, 5: 1569-1578.
[24] Asaka R, Miyamoto T, Yamada Y, et al. Sirtuin 1 promotes the growth and cisplatin resistance of endometrial carcinoma cells: a novel therapeutic target. Lab Invest, 2015, 95: 1363-1373.
[25] Park JH, Lee SW, Yang SW, et al. Modification of DBC1 by SUMO2/3 is crucial for p53-mediated apoptosis in response to DNA damage. Nat Commun, 2014, 18: 54-83
[26] 董丽君, 汤宝鹏, 周贤惠, 等. 心房肌基质金属蛋白酶及其抑制剂、凋亡相关基因表达改变与增龄性心房颤动关系的研究. 中国循环杂志, 2014, 29: 1034-1038.
[27] Shinozaki S, Chang K, Sakai M, et al. Inflammatory stimuli induce inhibitory S-nitrosylation of the deacetylaseSIRT1 to increase acetylation and activation of p53 and p65. Sci Signal, 2014, 7: ra106.
[28] 商青青, 周建业, 胡盛寿. 端粒长度的影响因素及其与心血管疾病的关系. 中国分子心脏病学杂志 , 2012, 2: 125-128.
[29] 吕娟, 王红. 端粒长度对心血管疾病预测价值的研究进展. 西南国防医药, 2016, 3: 42-44.
[30] Zhang L, Yu Y, Xia X, et al. Transcriptionfactor E2-2 inhibits the proliferation of endothelial progenitor cells by suppressingautophagy. Int J Mol Med, 2016,37: 1254-1262.
Different Telomere Fragments Promote Rat’s Vascular Smooth Muscle Cell Apoptosis by Silent Information Regulator 1/Cancer Suppressor Gene P53
LV Juan, WANG Hong.
Kunming Medical University, Kunming General Hospital of Chengdu Military Region, Kunming (650031), Yunnan, China
WANG Hong, Email: wangh43@126.com
Objective: To study the influence of different telomere oligonucleotide on rat’s thoracic aortic smooth muscle (A7R5 ) cell apoptosis and to clarify weather silent information regulator 1 (SIRT1)/cancer suppressor gene (P53) signaling pathway involved in oligonucleotide induced cell apoptosis.
Methods: 3 telomere repeat sequences of TE-12 (TTAGGG)2, TE-24 (TTAGGG)4and TE-36 (TTAGGG)6were respectively transfected into rat’s A7R5 cells as TE-12 group, TE-24 group and TE-36 group; in addition, blank A7R5 cells were used as Control group. Transfection induced A7R5 cell apoptosis was detected by flow cytometry, mRNA and protein expressions of SIRT1 and P53 in A7R5 cells were examined by RT-PCR and Western blot analysis in different groups.
Results: Successful ransfection rates were similar among 3 groups. Compared with Control group and TE-36, TE-24 groups, the highest apoptosis rate of A7R5 cells was found in TE-12 group and the lowest was found in TE-24 group which was still higher than that in Control group, all P<0.05. mRNA and protein expressions of SIRT1 was obviously higher inTE-12 group than the other 3 groups, all P<0.05; mRNA and protein expressions of P53 was obviously lower in TE-24 group than the other 3 groups, all P<0.05.
Conclusion: Telomere oligonucleotide sequence may promote rat’s A7R5 cell apoptosis; different sequence had various influence and the strongest effect was observed in TE-12 sequence. The above impact might be related to SIRT1/P53 signaling pathway.
Oligonucleotides; Muscel, smooth, vessel; Apoptosis
2016-09-11)
(编辑:常文静)
国家自然科学基金(81270224)
650031 云南省昆明市,成都军区昆明总医院 高干病房
吕娟 硕士研究生 主要从事冠心病的发病机制和预防研究工作 Email:1962991930@qq.com 通讯作者:王红 Email:wangh43@126.com
R54
A
1000-3614(2017)06-0612-05
10.3969/j.issn.1000-3614.2017.06.019
