血清血小板源性生长因子与冠状动脉粥样硬化斑块超声显像特征的关系研究
2017-06-27于彩红
于彩红
血清血小板源性生长因子与冠状动脉粥样硬化斑块超声显像特征的关系研究
于彩红
目的:采用血管内超声(IVUS)技术检测不同类型冠心病患者冠状动脉内粥样硬化斑块的性质及其与血清血小板源性生长因子(PDGF)的关系研究。
方法:选取2011-01至2013-10期间胜利油田中心医院住院并行冠状动脉造影检查的患者106例作为研究对象,其中急性冠状动脉综合征患者(ACS组)60例,稳定性心绞痛患者(SAP组)46例。记录患者性别、年龄、吸烟史、高血压病史、糖尿病病史等基本资料,采用双抗体夹心酶联免疫吸附法(ELISA法)检测患者血清PDGF水平。同时对两组患者进行IVUS 检查 ,详细记录罪犯血管最狭窄处冠状动脉粥样斑块形态、性质、斑块破裂、血栓形成、重构情况以及病变处外弹力膜面积、管腔面积、斑块面积、偏心指数等。比较两组斑块性质、斑块破裂和血栓形成发生率、正性重构比率以及外弹力膜面积、偏心指数等的差异,以及不同斑块性质血清PDGF水平的差异。
结果:(1)SAP组血清PDGF浓度为(3.64±0.60)ng/L显著高于ACS组(2.12±0.51)ng/L,两组比较差异有统计学意义(P<0.05)。(2)SAP组患者冠状动脉病变以硬斑块为主,ACS组患者斑块以软斑块为主。与SAP组比较,ACS组患者斑块破裂、血栓形成、正性重构发生率高,且ACS组较SAP组斑块以偏心斑块为主,偏心指数低,差异均有统计学意义(P<0.05~0.01)。与SAP组比较,ACS组患者病变血管外弹力膜面积较大,差异有统计学差异(P<0.01)。(3)纤维斑块、钙化斑块、混合斑块(硬斑块)血清PDGF水平均低于软斑块,差异有统计学意义(P<0.05~0.01)。
结论:PDGF参与冠状动脉粥样硬化斑块的形成,在ACS的发病中起着重要作用,斑块越不稳定,PDGF的浓度越高,检测血清PDGF水平有助于诊断和预测ACS的发生,使ACS的诊断流程和治疗策略的选择更趋于合理和规范。关键词 冠状动脉疾病;血小板源性生长因子;超声心动描记术
(Chinese Circulation Journal, 2017,32:560.)
冠心病包括稳定性心绞痛(SAP) 和急性冠状动脉综合征(ACS)。ACS 发病机制是在冠状动脉粥样硬化(AS)病变基础上出现易损斑块的裂缝、糜烂及破裂,继发血栓形成;ACS 的发生与斑块狭窄的严重程度无关,而与斑块的易损性有关[1]。如何预测斑块的不稳定性和增加斑块的稳定,减少ACS的发生成为一个全球热门话题。血小板源性生长因子(PDGF)是1974年Borkham-Kamphorst等[2]首先发现的,它是目前发现的最强有力的血管平滑肌细胞(VSMC)化学趋化因子[3]。目前斑块稳定性与PDGF的相关性尚少见相关报道,基于这一思路本课题通过血管内超声(IVUS)对冠心病患者进行斑块稳定性检测,同时进行PDGF水平检测,旨在将在体证实PDGF可能与斑块稳定有关,为临床早期预防和治疗ACS提供新的理论依据。
1 资料与方法
对象:本课题研究入选 2011-01至2013-10期间在我院心内科住院并行冠状动脉造影检查的106例患者。依据冠状动脉造影结果和临床表现对研究对象进行分组:ACS组60例,男性36例,女性24例,平均年龄(64.0±3.7)岁。SAP组46例,男性26例,女性20例,平均年龄(61.1±3.6)岁。排除标准:严重的心、肝、肾功能异常,感染、肿瘤、结缔组织病等疾病。所有患者均签署知情同意书自愿入组。冠状动脉造影:对入选对象采用飞利浦FD-10心血管数字减影机进行造影检查以明确血管病变部位的狭窄程度。冠状动脉造影时均进行多个体位的投射,明确病变血管支数,其中对罪犯血管做详细记录。以上手术由2名以上有经验的副主任医师分析完成。
IVUS检查:冠状动脉造影结束后,对所有患者进行IVUS检查,即刻动脉鞘内注入肝素6000 IU 抗凝,冠状动脉内注入硝酸甘油200 μg,分别对冠状动脉造影所确定的靶血管进行IVUS 检查,IVUS 仪为美国BostonScientific iLab 公司制造的IVUS诊断仪,探头频率40 MHz。在X 线透视下将IVUS探头沿0.5 mm 导丝送至靶病变远端至少10 mm,使用机械回撤装置以1 mm/s 的速度回撤探头至指引导管内,与超声图像分析仪相连,分别获得斑块远端、斑块处及斑块近端的血管短轴的二维超声图像,录像记录全部过程以供脱机回放分析和存档。在同一血管段的病变部位和相应的参考部位进行测量。并以血管外膜回声为参照,根据斑块回声的强弱,可对病变血管斑块性质判定[4],回声区或正常回声的斑块内有较弱的回声区或无回声区 。(1)纤维性斑块:粥样硬化斑块的回声与血管外膜回声一致。(2)钙化性斑块:比血管外膜回声强并且后方有清楚的声影。(3)混合性斑块:具有以上几种斑块的回声特征。其中纤维性斑块、钙化性斑块、混合性斑块统称为硬斑块。(4)横截面积:总截面积[外弹力膜面积],管腔面积+斑块面积。(5)面积狭窄率(%):斑块面积/总截面积×100%。(6)偏心指数=斑块最小直径/斑块最大直径,其中<0.5时为偏心性斑块。(7)重构指数等于病变处血管横截面积/平均参考血管面积,正性重构时重构指数>1,负性重构时重构指数≤0.95。(8)重塑指数在0.95与1.05之间为无重塑。(9)分析并记录斑块性质的判断、血栓形成的机率、正性重构、负性重构、无重构、病变处外弹力膜面积、病变处管腔面积、病变处斑块面积、偏心指数等。
标本的采集和储存: 所有患者于入院后24 h内采取清晨空腹安静状态下静脉血10 ml,立即分离血清并放置于-80℃冰箱冻存。标本收齐后采用酶联免疫吸附(ELISA)方法测得血清PDGF水平,血清PDGF的试剂盒由上海哈灵生物科技有限公司提供,试验相关操作按照试剂盒说明进行。
PDGF试剂盒ELISA检测原理及方法:本试剂盒应用双抗体夹心ELISA法测定标本中人PDGF水平。采用纯的PDGF抗体包被微孔板,再往微孔中顺序加入PDGF抗原,继而形成抗体-抗原-酶标抗体复合物(IC),然后洗涤,最后加入底物使之显色。底物可在与之相关的酶的作用下变成蓝色,而后可在酸的作用继续转化,变成黄色。最终颜色的深浅可以反应出样品中的PDGF水平。加入终止液30 min内,采用酶标仪于350 nm波长下进行吸光度(OD值)的测定。绘制标准曲线,通过OD值查找对应的PDGF水平。
待测样品的实际浓度计算方法:应用Microsoft office 、EXCEL2003,以OD值为纵坐标,以标准物的浓度为横坐标,绘制出标准曲线,然后依据样品的OD值查出相应的PDGF水平。
统计学分析方法:采用SPSS19.0统计学软件包进行数据分析。以来表示计量资料,采用t检验。各组间差异用单因素方差分析,两个率之间比较用卡方检验,多个率之间采用方差分析。以P<0.05表示差异有统计学意义。
2 结果
一般资料比较(表1):两组各项指标比较结果显示差异无统计学意义(P均>0.05)。
冠状动脉造影结果: SAP组46例患者病变血管支数为68支,其中单支病变30例,双支病变10例,三支病变6例;前降支为36支,回旋支18支,右冠状动脉14支。ACS组患者病变血管支数为75支,其中单支病变49例,双支病变7例,三支病变4例;前降支为38支,回旋支20支,右冠状动脉17支。两组病变血管支数、病变血管的部位比较差异均无统计学意义(P>0.05)。
表1 两组患者一般临床资料比较[例(%),s]

表1 两组患者一般临床资料比较[例(%),s]
组别例数男/女年龄 (岁)高血压血脂异常糖尿病家族史稳定性心绞痛组4626/2061.1±3.619 (47.5)15 (37.5)9 (22.5)12 (30.0)急性冠状动脉综合征组6036/2464.0±3.721 (32.3)17 (26.2)10 (15.4)11 (16.9)
血清PDGF水平比较:SAP组血清PDGF浓度为(3.64±0.60)ng/L显著高于ACS组(2.12±0.51)ng/L,两组比较差异有统计学意义(P<0.05)。
IVUS检查结果:表2显示,SAP组患者冠状动脉病变以硬斑块为主,ACS组患者斑块以软斑块为主。与SAP组比较,ACS组患者斑块破裂、血栓形成、正性重构发生率高,且ACS组较SAP组斑块以偏心斑块为主,偏心指数低差异均有统计学意义(P<0.05~0.01)。外弹力膜面积两组比较差异有统计学差异(P<0.01)。
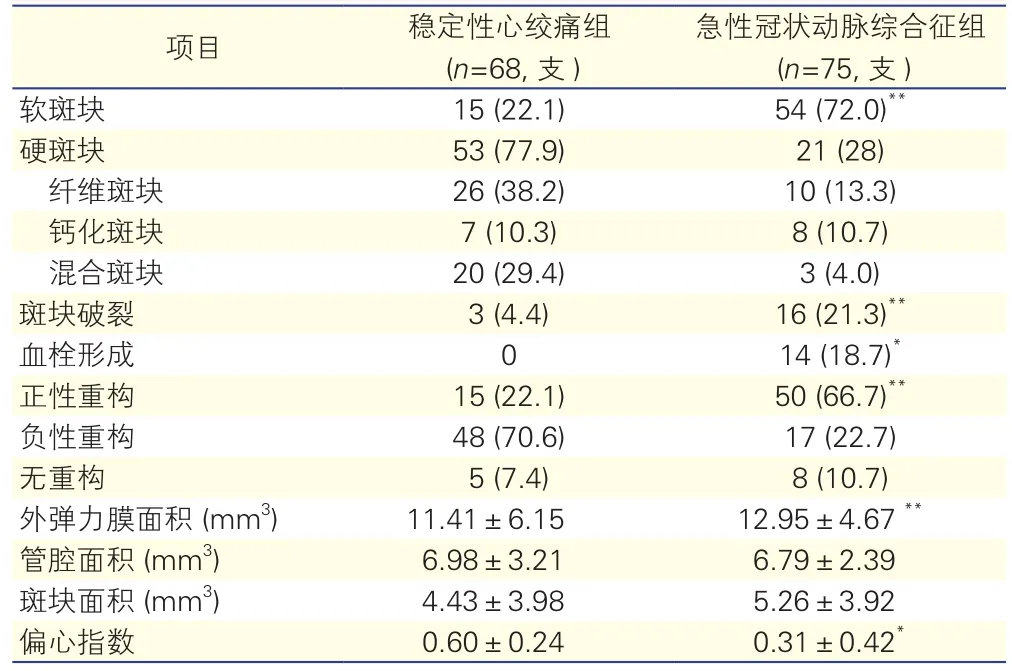
表2 两组患者143支冠状动脉病变处血管内超声检查结果比较[支(%),±s]
不同斑块性质间PDGF水平比较(表3):两组患者143支冠状动脉病变处硬斑块(纤维斑块、钙化斑块、混合斑块)血清PDGF水平均低于软斑块,差异均有统计学意义(P<0.05或0.01);纤维斑块、钙化斑块、混合斑块间比较血清PDGF水平均差异无统计学意义(P>0.05)。
表3 两组患者143支冠状动脉病变处不同性质斑块的血清血小板源性生长因子水平比较 ()

注:与软斑块相比*P<0.05**P<0.01
3 讨论
冠心病是严重危害人类健康的常见病和多发病,其病理基础是 AS。传统观点认为,AS是一个进行性的线性发展过程,由于脂质的沉积动脉内膜下的斑块逐渐增大突入管腔,造成管腔狭窄和组织缺血,最终导致不良心血管事件的发生,因此AS治疗的重点是AS斑块的消退。然而近年研究揭示了AS是一个稳定期和不稳定期交替的非线性过程,这一过程取决于斑块的易损性[5]。易损斑块可导致斑块破裂和血栓形成,斑块是否破裂取决于内因—斑块的内在组织特性和外因—斑块所受的应力—应变关系的相互作用,内因起着主导作用。因此,早期识别易损斑块并进行有效地干预,对于不良心血管事件的预防具有十分重要的意义。研究AS斑块不稳定的因素,促使易损斑块向稳定方向转变,是预防不良心血管事件的重要方法。通过对AS病变处分离得到的人类动脉平滑肌细胞进行培养发现其能表达PDGF基因,并分泌一种因子PDGF[6]。在AS病理形成过程中,VSMCs的迁移和增殖可在多种生长因子的调节下完成,其中PDGF参与了对VSMCs增殖的调控[7]。PDGF是一种具有促细胞分裂增殖、细胞趋化以及致血管收缩等生物效应的肽类生长因子,正常时贮存在细胞内和血小板的颗粒内,血小板激活或血管受损时释放至细胞外环境[8]。研究表明,PDGF通过与相应的特殊受体结合,从而导致VSMCs迁移、增殖[9]。Cao 等[10]首先发现冠心病患者血浆PDGF水平增高。继而Helgadottir等[11]放射免疫方法检测正常人、稳定性心绞痛和不稳定性心绞痛患者冠状窦内血浆PDGF水平,结果显示不稳定性心绞痛患者血浆PDGF水平明显高于稳定性心绞痛和正常对照组,三者主动脉根部PDGF水平无差异。Bressler等[12]用同样方法测定外周静脉血中的PDGF水平,结果同样发现不稳定性心绞痛及心肌梗死患者血浆PDGF水平高于稳定性心绞痛及正常组,Pasalić等[13]酶联免疫方法发现心肌梗死后其静脉血PDGF水平较稳定性心绞痛及正常人显著升高。
本研究中旨在观察血清PDGF水平与冠心病的临床表现的相关性及能否作为冠心病风险早期的预测及评估生物学指标,结果表明ACS组血清PDGF水平显著高于SAP组,差异有统计学意义(P<0.05)。
IVUS即通过超声技术直观观察血管腔内情况,并能实时、直观观察腔内情况等优点。通过IVUS把冠状动脉血管壁及血管内斑块特点并作进一步的图像分析处理,通过对其图像的预处理,降低图像的复杂度,并使图像清晰,然后采用GVF-Snake算法测算血管腔的面积、血管厚度,并且可以识别早期冠状AS斑块。可准确地显示冠状动脉管腔的大小和形态、管壁的解剖结构以及斑块的特征。使冠状动脉造影难以评价的图像,如偏心斑块等的诊断成为可能,超声的穿透特性提供了斑块的独特图像,而不仅是管腔的变化[14]。本研究通过IVUS 检测发现,ACS组与SAP组血管外弹力膜面积无差异,与SAP组相比,ACS以偏心斑块为主,以正性重构多见。与此同时我们检测了不同斑块的PDGF的水平,发现软斑块时PDGF的水平明显高于硬斑块时PDGF的水平。 说明,斑块越不稳定PDGF浓度越高。因此PDGF与心血管疾病严重程度关系密切,血清PDGF水平的测定可提供心血管疾病的预后信息,指导治疗方案的选择,甚至可能评估临床疗效,很有可能成为新的心血管生化标志物。
我们的研究受多种因素的限制,尚存在一些局限性和不足之处:(1)本研究未能对血清PDGF进行动态检测。(2)本研究属于小样本对照研究,该结果还需要进一步增加样本量并开展相关研究,以获取大量的循证医学的支持。
[1] 杨永主编. 动脉粥样硬化性心血管疾病基础与临床. 北京: 科学出版社, 2004.
[2] Borkham-Kamphorst E, Meurer SK, Van de Leur E, et al. PDGF-D signaling in portal myofibroblasts and hepatic stellate cells proves identical to PDGF-B via both PDGF receptor type α and β. Cell Signal, 2015, 27: 1305-1314.
[3] Kaltalioglu K, Coskun-Cevher S. A bioactive molecule in a complex wound healing process: platelet-derived growth factor. Int J Dermatol, 2015, 54: 972-977.
[4] 王君哲, 高峰. 血管内超声在冠状动脉临界病变诊疗中的临床应用. 中国循环杂志, 2014, 29: 1049-1050.
[5] 陈韵岱. 急性冠脉综合征易损斑块的研究进展. 中国循环杂志, 2007, 22: 390-392.
[6] Clement DL, Mally S, Stock C, et al. PDGFRα signaling in the primary cilium regulates NHE1-dependent fibroblast migration via coordinated differential activity of MEK1/2-ERK1/2-p90RSK and AKT signaling pathways. Cell Sci, 2013, 126: 953-965.
[7] 舒强, 凌光烈, 蒋健. 血管紧张素Ⅱ Ⅰ型受体拮抗剂抑制动脉损伤后中膜平滑肌细胞血小板源性生长因子的表达及细胞迁徙. 中国病理生理杂志, 2007, 23: 1636-1638.
[8] Raines EW. PDGF and cardiovascular disease. Cytokine Growth Factor Rev, 2004, 15: 237-254.
[9] Nomivama T, Nakamachi T, Gizard F, et al. The NR4A orphan nuclear receptor NOR1 is induced by platelet-derived growth factor and mediates vascular smooth muscle cell proliferation. Biol Chem, 2006, 28: 33467- 33476.
[10] Cao R, Br. kenhielm E, Pawliuk R, et al. Angiogenic synergism, vascular stability and improvement of hind-limb ischemia by a combination of PDGF-BB and FGF22. Nat Med, 2003, 9: 604-613.
[11] Helgadottir A, Thorleifsson G, Manolescu A, et al . A common variant on chromosome 9p2l affects the risk of early-onset coronary arterydisease. Science, 2007, 316: 1491-1493.
[12] Bressler J, Folsom AR, Couper DJ, et al. Genetic variants identified in a European genome-wide association study that were found to predict incident coronary heart disease in the atherosclerosis risk in communities study. Am J Epidemiol, 2010, 171: 14-23.
[13] Pasalić D, Marinković N, Grsković B, et al. C-reactive protein gene polymorphisms affect plasma CRP and honiocys-teine concentrations in subjects with and without angiographically confirmed coronary artery disease. Mol Biol Rep, 2009, 36: 775-780.
[14] 王增良, 杨树森. 血管超声在冠状动脉介入治疗中的应用进展. 心血管病学进展, 2012, 3: 349-352.
Correlation Study Between Serum Platelet Derived Growth Factor Level and Ultrasound Imaging Features of Coronary Atherosclerotic Plaques in Relevant Patients
YU Cai-hong.
Department of Cardiology, Central Hospital of Shengli Oil Field, Dongying (257000), Shandong, China
Objective: To detect the features of atherosclerotic plaques and their correlation to serum platelet derived growth factor (PDGF) level in patients with different types of coronary artery disease (CAD) by intravascular ultrasound (IVUS).
Methods: A total of 106 patients admitted in our hospital with coronary angiography from 2011-01 to 2013-10 were enrolled and divided into 2 groups: Acute coronary syndrome (ACS) group, n=60 and Stable angina pectoris (SAP) group, n=46. Basic information as gender, age, history of smoking, hypertension and diabetes were recorded in all patients; serum levels of PDGF were measured by ELISA. IVUS was conducted to examine coronary atherosclerotic plaque morphology, property, rupture, thrombosis and refactoring in criminal vessels; meanwhile, external elastic membrane area, lumen area, plaque area and eccentric index were determined at the lesion site. The above parameters were compared between 2 groups and the correlation of different types of plaques to serum levels of PDGF were studied.
Results:①Serum PDGF level in SAP group was higher than ACS group (3.64±0.60) ng/L vs (2.12±0.51) ng/L, P<0.05.②The patients in SPA group were mainly having hard plaque and in ACS group were mainly having soft plaque. Compared with SAP group, ACS group had the higher incidences of plaque rupture, thrombosis and positive refactoring; ACS group wasmainly with eccentric plaque with low eccentric index all P<0.05-0.01; ACS group had the larger external elastic membrane area at the lesion site, P<0.05. ③The patients with fibrous plaque, calcified plaque and mixed plaque (hard plaque) had the lower serum levels of PDGF than those with soft plaque, P<0.05.
Conclusion: PDGF had been involved in atherosclerotic plaque formation and it played an important role in ACS pathogenesis. The patients with unstable plaques had the higher serum PDGF level, therefore PDGF detection may help ACS diagnosis and prediction.
Coronary artery disease; Platelet derived growth factor; Echocardiography
2016-07-03)
(编辑:梅平)
山东省医药卫生科技发展计划项目(2011HW075)
257000 山东省东营市, 胜利油田中心医院 内科
于彩红 主治医师 学士 主要从事内科学研究 Email:yucaihong@163.com
R541.4
A
1000-3614(2017)06-0560-04
10.3969/j.issn.1000-3614.2017.06.008
