灵芝多糖对长期运动大鼠巨噬细胞吞噬功能及NO和IL-1β表达的影响
2017-06-26康峰
康 峰
(河南中医药大学,河南郑州 450000)
灵芝多糖对长期运动大鼠巨噬细胞吞噬功能及NO和IL-1β表达的影响
康 峰
(河南中医药大学,河南郑州 450000)
探讨灵芝多糖(GLP)对长期运动大鼠巨噬细胞吞噬功能及NO、IL-1β表达的影响。分别用低剂量(4.5 mg/mL)、中剂量(9 mg/mL)、高剂量(18 mg/mL)的GLP灌胃大鼠模型并给予持续30d游泳运动训练,正常组和对照组用生理盐水灌胃,正常组不进行运动训练。检测贴壁巨噬细胞分泌NO、IL-1β水平,Western blot检测巨噬细胞中iNOS水平,并检测巨噬细胞吞噬鸡红细胞能力及巨噬细胞活性。结果表明,对照组中NO含量和巨噬细胞吞噬率显著低于正常组(P<0.05),中剂量组和高剂量组NO水平显著高于对照组(P<0.05);对照组巨噬细胞iNOS水平极显著低于正常组(P<0.01),低、中、高剂量组巨噬细胞iNOS水平极显著高于对照组(P<0.01);低、中剂量组巨噬细胞吞噬率显著高于对照组(P<0.05),高剂量组巨噬细胞吞噬率显著高于对照组(P<0.01);中剂量组巨噬细胞吞噬指数极显著高于对照组(P<0.01);对照组巨噬细胞活性极显著低于正常组(P<0.01),低、中、高剂量组巨噬细胞活性均极显著高于对照组(P<0.01)。说明GLP能促进巨噬细胞分泌NO、IL-1β,提高巨噬细胞吞噬功能和巨噬细胞活性。
巨噬细胞;灵芝多糖;吞噬功能;一氧化氮
机体的免疫能力是机体抵抗外界致病因素的重要组成部分,与身体体质密切相关。运动对机体免疫能力的作用较为复杂[1]。运动时间、运动强度等都可以引起免疫功能的改变[2]。巨噬细胞属于免疫细胞,在免疫系统中发挥重要作用。巨噬细胞可以吞噬细胞残片和病原体,促进机体康复[3]。不同运动强度和运动环境影响巨噬细胞的吞噬功能[4]。
灵芝多糖(GLP)广泛存在于灵芝属真菌的子实体和菌丝体中,属于葡聚糖。灵芝多糖具有提高免疫力、抗肿瘤、抗衰老、保护心血管系统等多种功效[5-6]。为了明确灵芝多糖对长期运动大鼠巨噬细胞功能的影响,本研究构建长期运动大鼠模型,同时给予灵芝多糖灌胃,用ELISA、Western blot等方法检测灵芝多糖对巨噬细胞吞噬功能、细胞活性和NO、IL-1β表达的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar雄性大鼠55只,2月龄,体重160 g~230 g,购自于郑州大学医学实验室。
1.1.2 主要试剂 胎牛血清购自于杭州四季青生物科技有限公司;RPMI1640培养基购自于美国Sigma;青链霉素购自于北京索莱宝生物科技有限公司;IL-1β、iNOS、GAPDH单克隆抗体购自于美国CST公司;GLP购自于杭州众芝康菇生物技术有限公司;ELISA检测试剂盒、BCA蛋白浓度检测试剂盒购自于上海纪宁生物科技有限公司。
1.1.3 主要仪器 MK3酶标仪购自于美国Thermo公司;BXF-88显微镜购自于上海炳宇光学仪器有限公司。
1.2 方法
1.2.1 动物分组及运动训练 所有实验动物随机分为5组,每组11只大鼠。分别为正常组、对照组和低、中、高剂量组。低、中、高剂量组分别灌胃GLP浓度为4.5 mg/mL、9 mg/mL、18 mg/mL(每只大鼠每天每千克体重灌胃10 mL)。正常组、对照组用等量的生理盐水灌胃。除正常组以外,其他4组大鼠均在水温32℃的游泳池中游泳训练,第1天游泳时间为25 min,此后每天增加5 min,增加至40 min后不再增加训练时间,此后每天游泳训练40 min,持续30 d。游泳训练和GLP灌胃同时进行。
1.2.2 巨噬细胞分离 大鼠运动训练及灌胃30 d后,腹腔注射RPMI1640培养液5 mL后,轻轻揉其腹部,眼球放血,颈椎脱臼处死大鼠。用注射器从大鼠侧腹部吸出腹腔内的液体。转移到离心管中,1 500 r/min、4℃离心10 min,弃掉上清液,加入适量含有10% FBS的RPMI1640细胞培养液,调整细胞浓度为3×106个/mL,将细胞接种到96孔细胞培养板中,放置于37℃、体积分数为5% CO2培养箱中培养3.5 h,弃上清液,加入冰预冷的含有10% FBS的RPMI1640细胞培养液洗涤后,贴壁细胞即为巨噬细胞。
1.2.3 巨噬细胞分泌NO水平检测 取贴壁的巨噬细胞培养48 h,取上清液100 μL。加入浓度为300 g/L的硫酸锌5 μL充分混合后,5 000 r/min离心10 min,将上清液转移到EP管中,加入等体积的Griess溶液,混合均匀后,放置于室温下缓慢震荡10 min,用滤光片酶标仪检测550 nm处每孔中的吸光度,Griess溶液能与检测样品相互作用生成亚硝酸盐,NO的含量与亚硝酸盐含量相同。根据亚硝酸盐标准品计算待测样品中的NO水平。
1.2.4 iNOS表达水平检测 收集培养48 h的巨噬细胞,用冰预冷的PBS洗涤细胞2次,在细胞中加入细胞裂解液,放置于冰上裂解细胞35 min,用移液枪转移细胞裂解液至离心管中,4℃、14 000 r/min离心15 min,吸取蛋白上清液至EP管中。蛋白浓度测定按照BCA蛋白浓度检测试剂盒检测。Western blot检测iNOS的表达水平,步骤同1.2.5。
1.2.5 巨噬细胞分泌IL-1β含量检测 取贴壁的巨噬细胞培养48 h,取上清液,一部分按照ELISA检测试剂盒说明书检测上清液中的IL-1β水平。一部分按照Western blot方法检测IL-1β含量。方法为上清液与Loading buffer充分混合后,放在100℃的孵育器上煮沸5 min。SDS-PAGE凝胶电泳,每孔加入50 μL的变性蛋白样品。80 V电压电泳30 min后,调整电压至120 V至电泳结束。取出蛋白凝胶4℃转印至PVDF膜上,经50 g/L脱脂奶粉封闭2 h后,依次与一抗(400倍稀释)、二抗(1000倍稀释)孵育反应后,PBST洗涤3次。转移到暗室中,滴加显色液,显影、定影后,曝光。分析蛋白表达水平。
1.2.6 巨噬细胞吞噬功能检测 将制备的巨噬细胞用RPMI1640培养基悬浮,充分混合后,加入Hanks液后,与适量的鸡红细胞混合均匀,调整巨噬细胞与鸡红细胞数量比例约为1∶600,放置于37℃孵育反应0.5 h,期间每隔10 min震荡混匀1次。1 000 r/min离心10 min,吸取细胞悬浮液滴加到载玻片上,制作细胞悬液涂片。用丙酮和甲醇混合液固定后,滴加Giemsa染液孵育8 min。显微镜下观察100个巨噬细胞中吞噬鸡红细胞的巨噬细胞数目。计算吞噬率,吞噬率=100%×100个巨噬细胞中吞噬鸡红细胞的巨噬细胞数量/100。吞噬指数=100%×100个巨噬细胞总共吞噬的鸡红细胞数目/1001.2.7 MTT法检测巨噬细胞活性 取浓度为3×106个/mL的巨噬细胞,接种到96孔细胞培养板中,每孔中加入100 μL细胞悬液,每组设置5个复孔,同时设置空白组,空白组不加入细胞悬浮液,用等量的DMSO溶液代替,放置于37℃、体积分数为5% CO2培养箱中培养2 h,观察细胞贴壁后,弃掉细胞培养液及未贴壁的细胞,加入Hanks液洗涤细胞2次,在细胞中加入适量的细胞培养液,放在37℃环境下反应2 h后,在细胞中加入MTT溶液10 μL,MTT溶液浓度为5 mg/mL,充分混合后,放置于37℃孵育4 h,弃掉上清液,加入DMSO溶液100 μL,振荡混合40 s,酶标仪检测579 nm吸光度。
1.3 统计学分析

2 结果
2.1 巨噬细胞分泌 NO水平检测结果
对照组NO含量显著低于正常组(P<0.05),中、高剂量组NO水平显著高于对照组(P<0.05)。说明长期运动能降低巨噬细胞分泌NO的水平,灵芝多糖能有效提高巨噬细胞分泌NO水平。
对照组巨噬细胞iNOS水平显著低于正常组(P<0.01),低、中、高剂量组巨噬细胞iNOS水平显著高于对照组(P<0.01)(图1)。
2.2 巨噬细胞分泌IL-1β水平检测结果
对照组IL-1β含量显著低于正常组(P<0.05),中、高剂量组IL-1β含量显著高于对照组(P<0.05);对照组IL-1β水平显著低于正常组(P<0.01),低、中剂量组IL-1β水平显著高于对照组(P<0.05),高剂量组IL-1β水平极显著高于对照组(P<0.01)(图2)。
2.3 巨噬细胞吞噬功能检测结果
对照组巨噬细胞吞噬率显著低于正常组(P<0.05),低、中剂量组巨噬细胞吞噬率显著高于对照组(P<0.05);高剂量组巨噬细胞吞噬率极显著高于对照组(P<0.01);中剂量组巨噬细胞吞噬指数极显著高于对照组(P<0.01)(图3)。
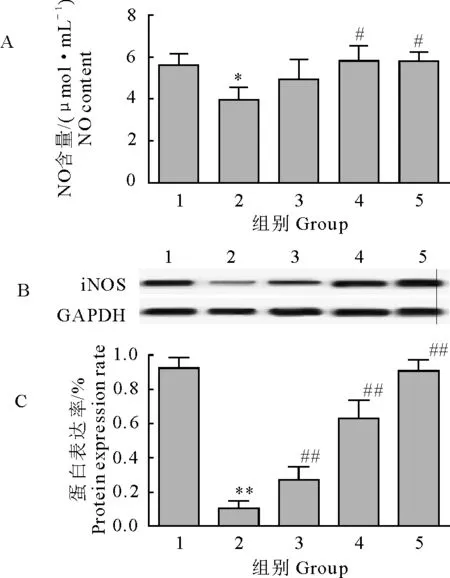
1.正常组;2.对照组;3.低剂量组;4.中剂量组;5.高剂量组;A.NO含量;B.Western blot检测结果;C.iNOS蛋白表达率*P<0.05 vs 正常组;#P<0.05 vs 对照组;##P<0.01vs 对照组1.Normal group; 2.Control group; 3.Low dose group; 4.Middle dose group; 5.High dose group; A.NO content; B.Western blot test results; C.iNOS protein expression rate
Note:*P<0.05 vs normal group; #P<0.05 vs control group; ##P<0.01vs control group
图1 巨噬细胞分泌NO含量检测结果
Fig.1 Detection results of NO in macrophages
2.4 巨噬细胞活性检测结果
对照组巨噬细胞活性极显著低于正常组(P<0.01),低、中、高剂量组巨噬细胞活性均极显著高于对照组(P<0.01)(图4)。
3 讨论
巨噬细胞参与机体的特异性和非特异性免疫系统。当机体出现受损组织和细胞时,巨噬细胞能够吞噬清除损坏的细胞和组织碎片,促进机体恢复[7-9]。巨噬细胞吞噬功能与运动有关[10]。GLP具有扶正固本、增强机体免疫力的作用[11]。癌症晚期服用GLP可以增加患者的免疫功能[12]。GLP参与改善运动后的巨噬细胞吞噬功能的恢复[13]。NO在生物体内发挥重要作用,是一种效应分子。NO广泛存在于神经系统、免疫系统、心血管系统等组织系统中[14]。在一氧化氮合酶(iNOS)的作用下,精氨酸被催化生成NO。NO含量异常会引起机体免疫系统和炎症反应异常[15]。NO水平下调,巨噬细胞吞噬功能减弱。研究表明,运动会对机体内NO含量产生影响,NO含量的变化与运动时间和运动强度有关[16]。高强度的运动会导致机体内NO水平下降[17]。一次性竭力运动小鼠NO含量明显高于静息状态下NO水平[18]。本研究结果表明,长期运动可以明显降低巨噬细胞分泌NO水平,用中剂量和高剂量的GLP灌胃后,巨噬细胞分泌NO水平逐渐恢复。说明GLP可以恢复巨噬细胞分泌NO。
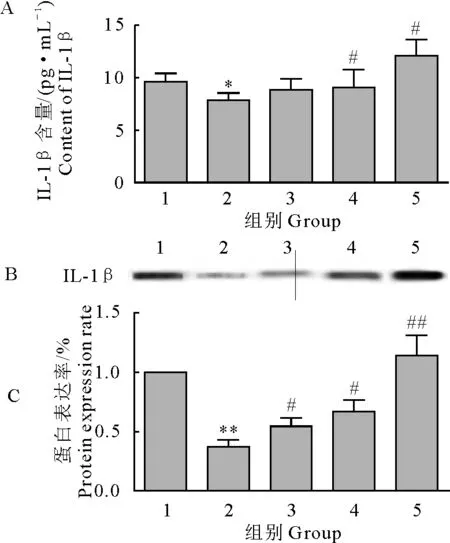
1.正常组;2.对照组;3.低剂量组;4.中剂量组;5.高剂量组;A.ELISA法检测结果;B.Western blot结果图;C.IL-1β蛋白表达率
*P<0.05 vs 正常组;**P<0.01 vs 正常组;#P<0.05 vs 对照组;##P<0.01 vs 对照组
1.Normal group; 2.Control group; 3.Low dose group; 4.Middle dose group; 5.High dose group; A.ELISA test results; B.Western blot results; C.IL-1β protein expression rate
*P<0.05 vs normal group;**P<0.01 vs normal group; #P<0.05 vs control group; ##P<0.01 vs control group
图2 巨噬细胞分泌IL-1β水平检测结果
Fig.2 The detection results of macrophage secreting IL-1β

1.正常组;2.对照组;3.低剂量组;4.中剂量组;5.高剂量组;A.巨噬细胞吞噬率;B.巨噬细胞吞噬指数 *P<0.05 vs 正常组;#P<0.05 vs 对照组;##P<0.01 vs 对照组1.Normal group; 2.Control group; 3.Low dose group; 4.Middle dose group; 5.High dose group; A.Macrophage phagocytic rate; B.Macrophage phagocytic index
*P<0.05 vs normal group; #P<0.05 vs control group; ##P<0.01 vs control group
图3 巨噬细胞吞噬功能检测结果
Fig.3 Results of phagocytic function of macrophage

1.正常组;2.对照组;3.低剂量组;4.中剂量组;5.高剂量组;**P<0.01 vs 正常组;##P<0.01 vs 对照组
1.Normal group; 2.Control group; 3.Low dose group; 4.Middle dose group; 5.High dose group; vs **P<0.01vs normal group; ##P<0.01 vs control group
图4 巨噬细胞活性检测结果
Fig.4 Detection results of macrophage activity
IL-1β由巨噬细胞产生,在抗原呈递、细胞生长、炎性反应等过程中发挥重要作用。局部低浓度的IL-1β可以促进T细胞的活化,诱导B细胞的增殖和抗体分泌[19]。本研究结果表明,长期运动训练能够造成IL-1β水平的降低,巨噬细胞吞噬功能及活性下降;灌胃GLP后,巨噬细胞分泌IL-1β的水平得到恢复。巨噬细胞与鸡红细胞混合后,长期运动大鼠巨噬细胞吞噬功能下降,而灌胃GLP后的巨噬细胞吞噬功能得到恢复。
活细胞内产生的琥珀酸脱氢酶能够与MTT结合生成复合物。利用MTT可以有效检测巨噬细胞活性。细胞活性越大,OD值越大。本研究结果表明,长期运动能够降低巨噬细胞的活性,而GLP可以恢复巨噬细胞的活性。 综上所述,长期运动能够降低巨噬细胞的吞噬功能和活性,抑制巨噬细胞分泌NO和IL-1β,GLP可提高长期运动大鼠巨噬细胞吞噬功能和细胞活性,促进巨噬细胞分泌NO和IL-1β。
[1] 肖卫华,陈佩杰.运动对巨噬细胞功能的影响及机制研究进展[J].中国运动医学杂志,2015,34(11):1126-1131.
[2] Abdelhamid R,Merriwether E,Kolker S,et al.Exercise attenuates LPS-induced musculoskeletal hyperalgesia in mice by preventing excessive macrophage activation[J].J Pain,2015,4(16):S40.
[3] Da Silva Rossato J,Krause M,Fernandes A J M,et al.Role of alpha-and beta-adrenoreceptors in rat monocyte/macrophage function at rest and acute exercise[J].J Physiol Biochem,2014,70(2):363-374.
[4] Jeong J H,Lee Y R,Park H G,et al.The effects of either resveratrol or exercise on macrophage infiltration and switching from M1 to M2 in high fat diet mice[J].J Exerc Nutri Biochem,2015,19(2):65.
[5] 蔡庆超,林志彬,李卫东.灵芝多糖肽通过调节肿瘤微环境中 Treg 水平抑制小鼠 LLC 种植瘤生长[J].中国药理学通报,2015,31(11):220-221.
[6] 李宜培,王雪银,陈 洁,等.灵芝多糖肽对阿尔茨海默病大鼠β淀粉样蛋白含量和tau蛋白过度磷酸化的影响[J].中华实用诊断与治疗杂志,2015,29(9):862-865.
[7] 罗进芳,朱瑞丽,易 浪,等.青藤碱对 LPS,IL-4 诱导的小鼠 RAW264.7 巨噬细胞极化的影响[J].中国免疫学杂志,2015,31(1):56-60.
[8] Babaev V R,Yeung M,Erbay E,et al.Deficiency in hematopoietic cells suppresses macrophage apoptosis and increases atherosclerosis in low-density lipoprotein receptor null mice[J].Arterioscl Thromb Vasc Biol,2016,36(6):1122-1131.
[9] Babicky M L,Harper M M,Mose E S,et al.Abstract A26:The RON tyrosine kinase accelerates pancreatic duct neoplasia and activates a positive autocrine/paracrine signaling loop that promotes alternative macrophage activation[J].Cancer Res,2016,76(15):A26-A26.
[10] Liu Y J,Du J L,Cao L P,et al.Anti-inflammatory and hepatoprotective effects of Ganoderma lucidum polysaccharides on carbon tetrachloride-induced hepatocyte damage in common carp (CyprinuscarpioL.)[J].In Immunopharmacol,2015,25(1):112-120.
[11] Nagai K,Ueno Y,Tanaka S,et al.Tu1851 the potential role of polysaccharides derived from ganoderma lucidum fungus mycelia (designated as MAK) on ameliorating indomethacin-induced small intestinal injuries through GM-CSF[J].Gastroenterology,2015,148(4):S919.
[12] Cheng S,Sliva D.Ganoderma lucidum for cancer treatment we are close but still not there[J].Integ Cancer Thera,2015,14(3):249-257.
[13] Habijanic J,Berovic M,Boh B,et al.Submerged cultivation of ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-α,IL-12,IFN-γ,IL-2,IL-4,IL-10 and IL-17[J].New Biotechnol,2015,32(1):85-95.
[14] 罗 军,魏燕璇,王 毅,等.有氧运动对老年稳定性心绞痛患者血浆炎症指标及血小板功能的影响[J].中国老年学杂志,2015,35(03):577-579.
[15] 徐国卫,刘 欣,王新成,等.运动疗法对脑梗死患者神经功能的影响及机制研究[J].中国实用神经疾病杂志,2015,18(18):31-32.
[16] Kresta J Y,Oliver J M,Jagim A R,et al.Effects of 28 days of beta-alanine and creatine supplementation on muscle carnosine,body composition and exercise performance in recreationally active females[J].J Int Soc Sport Nutri,2014,11(1):1.
[17] Miller P E,Alexander D D,Perez V.Effects of whey protein and resistance exercise on body composition:a meta-analysis of randomized controlled trials[J].J Am College Nutri,2014,33(2):163-175.
[18] Schubert M M,Sabapathy S,Leveritt M,et al.Acute exercise and hormones related to appetite regulation:a meta-analysis[J].Sports Med,2014,44(3):387-403.
[19] Palsson-McDermott E M,Curtis A M,Goel G,et al.Pyruvate kinase M2 regulates Hif-1α activity and IL-1β induction and is a critical determinant of the warburg effect in LPS-activated macrophages[J].Cell Metab,2015,21(1):65-80.
Effects of GLP on Phagocytic Function of Macrophages and Expressions of NO and IL-1β in Rat Model of Long Term Exercise
KANG Feng
(HenanUniversityofTraditionalChineseMedicine,Zhengzhou,Henan,450000,China)
To investigate the effects ofGanodermalucidumpolysaccharides (GLP) on the phagocytic function of macrophages and the expressions of NO and IL-1 in rats with long-term exercise,the rats were administered with low dose (4.5 mg/mL),middle dose (9 mg/mL) and high dose (18 mg/mL) of GLP,and the rats were administered with swimming training for 30 days.At the same time,the normal group and control group were set,the normal group and control group were given normal saline to fill the stomach,and the normal group did not exercise.NO and IL-1 levels were detected in the supernatant of cultured 48 h cells.Western blot was used to detect the iNOS level of macrophages,and the ability of macrophage phagocytosis of chicken red blood cells and the activity of macrophages were also detected.Results showed that the content of NO in the control group was significantly lower than that in the normal group (P<0.05); The levels of NO in the middle dose group and high dose group were significantly higher than that in the control group (P<0.05).The levels of iNOS in the control group were significantly lower than those in the normal group (P<0.01),and the iNOS levels in the low,medium and high dose groups were significantly higher than those in the control group (P<0.01).The phagocytosis rate of low dose group was significantly higher than that of the control group (P<0.05); High dose group of macrophages were significantly higher than the control group (P<0.01).The phagocytic index of macrophage in the middle dose group was significantly higher than that in the control group (P<0.01).The activity of macrophages in control group was significantly lower than that in normal group (P<0.01); the activities of macrophages in low,medium and high dose group were significantly higher than that in control group (P<0.01).In conclusions,GLP can promote the secretion of NO and IL-1β,and improve the phagocytic function and activity of macrophages.
macrophage; GLP; phagocytic function; NO
2016-10-21
康 峰(1980-),男,河南巩义人,硕士,讲师,主要从事动物运动康复训练。
S852.4;852.2
A
1007-5038(2017)06-0061-05
