我国鸭疫里氏杆菌病流行概述
2017-06-26吴彩艳程淑琴张建峰李娟林栩慧董嘉文吕敏娜廖申权戚南山孙铭飞刘雅红
吴彩艳,程淑琴,张建峰,李娟,林栩慧,董嘉文,吕敏娜,廖申权,戚南山,孙铭飞*,刘雅红
( 1.广东省农业科学院动物卫生研究所, 广东省兽医公共卫生公共实验室, 广东省畜禽疫病防治研究重点实验室,广东广州 510640; 2.华南农业大学兽医学院,广东广州 510642;3. 河北旅游职业学院,河北承德 067000)
专论与讲座
我国鸭疫里氏杆菌病流行概述
吴彩艳1,2△,程淑琴3△,张建峰1,李娟1,林栩慧1,董嘉文1,吕敏娜1,廖申权1,戚南山1,孙铭飞1*,刘雅红2*
( 1.广东省农业科学院动物卫生研究所, 广东省兽医公共卫生公共实验室, 广东省畜禽疫病防治研究重点实验室,广东广州 510640; 2.华南农业大学兽医学院,广东广州 510642;3. 河北旅游职业学院,河北承德 067000)
鸭疫里氏杆菌因其血清型多且复杂,抗药性严重,其已成为危害我国养鸭业的一种主要疾病。为进一步提高对鸭疫里氏杆菌病的防控水平,论文就该病的流行病学、诊断方法及疫苗研制等方面的研究进展进行综述,以期为指导临床安全合理用药及制定综合防控措施提供参考。
鸭疫里氏杆菌病;流行病学;诊断方法;疫苗研制
鸭疫里氏杆菌病又称鸭传染性浆膜炎、新鸭病、鸭疫综合征,是由鸭疫里氏杆菌(Riemerellaanatipestifer,RA)引起的一种接触性传染病,目前已成为严重危害养鸭生产的主要疾病[1]。该病以纤维素性心包炎、肝周炎和气囊炎为主要病变特征,病死率高达90%,给养鸭业造成了巨大的经济损失。目前国际上公认RA有21个血清型,主要有1、2、3、4、5、6、7、8、9、10型等,国内流行较多的是1型和2型,其他血清型伴随发生,但各型之间几乎无交叉保护性[2],因此给免疫预防造成极大困难。该病流行之广泛,危害之严重,血清型变化之迅速为当前畜禽疾病所罕见。目前主要采用药物治疗鸭疫里氏杆菌病,但是由于药物的长期使用,临床上已经出现非常严重的抗药性问题以及药物残留问题。本文就鸭疫里氏杆菌病在我国的流行情况、诊断方法及疫苗研制等方面的研究进展进行阐述,以期为安全、有效、科学的防控该病提供参考。
1 我国鸭疫里氏杆菌病流行情况
自北京地区首次发生鸭疫里氏杆菌病以来,除西藏等少数省区外,该病几乎在全国各地均有发生。山东、江苏、安徽、浙江、湖北、四川、贵州、广西、广东省等地区均有鸭疫里氏杆菌病的报道,且各地发生的血清型也不尽相同(表1)。随着养鸭量的逐年攀升,鸭疫里氏杆菌病的发生率也逐渐增加,并且呈愈演愈烈的趋势。对于该病的防控,主要采用灭活疫苗免疫与药物预防相结合的方式。但是由于当前的灭活疫苗尚不能涵盖所有流行的血清型,因此,灭活疫苗的免疫效果并不理想,应用受到限制,药物仍是防控的主要手段,虽然在一定程度上降低了该病的发生,但是由于抗生素的不合理使用,致使RA产生严重的抗药性。从总体情况来看,我国流行的RA以1型和2型为主,但多血清型流行已成为基本态势。由于各单位拥有的RA标准阳性血清型不足,导致部分RA分离株的血清型未能进行鉴定,因此,尚有部分地区RA流行的血清型不明确。
2 鸭疫里氏杆菌病诊断方法研究进展
2.1 RA病原检测方法
对于鸭疫里氏杆菌病的诊断方法,除传统实验室诊断方法外,近年发展了以分子生物学为基础的PCR快速检测方法,其建立的依据是扩增RA基因组中保守区域的目标基因,即16S rRNA 基因或外膜蛋白 A (OmpA )基因。根据RA 16S rRNA基因的保守序列设计特异性引物,分别以RA全菌体、基因组DNA、菌液等为模板建立PCR快速检测方法[19-21]。临床上,大肠杆菌病和鸭疫里氏杆菌病病变类似,肉眼不易鉴别诊断,覃宗华等[22]针对 RA和E.coli的16S rRNA 基因序列设计了种特异性引物,以鸭肝脏组织悬液煮沸后的上清、细菌培养物或基因组 DNA为模板,分别扩增出长度为342 bp和718 bp的DNA片段,建立了一种能够快速鉴别诊断两种疾病的双重PCR 检测方法。为进一步提高PCR检测方法的灵敏性,刘拂晓等[23]利用基于RA 16S rRNA的荧光定量PCR 检测方法,分别对自然和人工感染病例不同脏器的RA进行定量检测,结果以脑组织和心脏中的RA含量最高。谢永福等[24]根据RA 16S rRNA基因建立了套式PCR检测方法,其最小检测量是常规PCR的1 000倍,大大提高了检测方法的灵敏性。
OmpA是一种重要的免疫原性蛋白,为各血清型RA所共有,由于其基因序列具有高度保守性,因此可以作为鉴别诊断RA的靶基因。利用针对OmpA基因建立的PCR快速检测方法,对RA纯培养菌及病死鸭病料组织进行检测,均可扩增出 592 bp 的目的条带,并且该方法特异性较好[25]。也可以将OmpA基因也可以作为目标基因用于大肠杆菌病和鸭疫里氏杆菌病的鉴别诊断[26]。以OmpA基因为靶基因建立的real-time PCR快速检测方法,最低能检测的DNA模板浓度为8.0 拷贝/μL,菌液浓度为8.0× 103CFU/mL,极大地提高了检测方法的灵敏性,该方法适用于RA的快速诊断、流行病学调查、种鸭引进隔离检疫以及活鸭及其产品的进出口检验检疫等[27]。季权安等[28]建立的基于OmpA基因的菌落PCR方法,最低检出量为80个RA,该方法更加快速简捷,在临床应用上具有较好的实用价值。随着科学研究的深入,将会有更多的靶基因被发现,相应的检测方法也会更迅速、更简便、更准确。
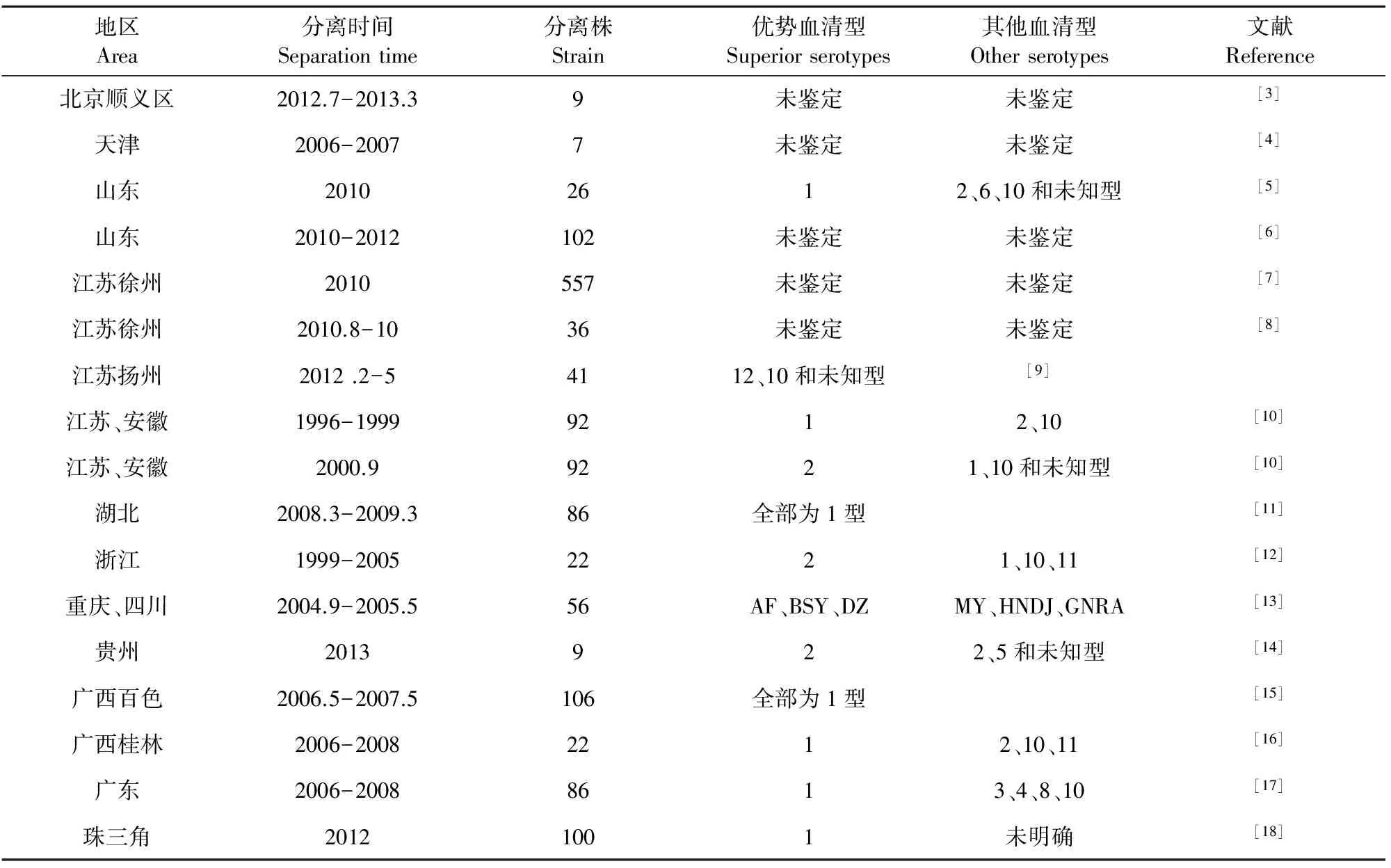
表1 中国各地区RA流行情况调查
2.2 RA抗体检测方法
酶联免疫吸附试验(ELISA)是目前发展最快、应用最广的免疫学检测技术之一。具有快速、敏感、简便等优点被广泛应用于感染性疾病的检测。目前国内外报道的检测鸭疫里氏杆菌抗体的各种ELISA方法,主要用于RA的感染以及免疫后抗体水平的监测,在试验研究和临床应用中都具有良好的应用价值。刘学贤等[29]以RA1细菌悬液为包被抗原建立的间接ELISA方法,可以用于RA的早期诊断及疫苗免疫效力的评价,利用该方法对江苏省部分地区送检的235份鸭血清进行检测,阳性率为48.1%。吴彩艳等[30]建立了以甲醛灭活的RA1全菌体为包被抗原的间接ELISA方法,该方法与全菌体裂解抗原[31]及重组p25蛋白[32]为包被抗原的间接ELISA方法相比较,三者均可以检测不同血清型RA阳性血清,结果符合性良好。三种方法中以灭活的全菌体抗原制备最为简单,经济快速,不受条件限制且易于保存,因此该方法适于在临床检测中推广应用。此外,么乃全等[33]以重组的Camp蛋白及季慕寅等[34]以重组的OmpA 蛋白为包被抗原,分别建立了可以检测RA多种血清型抗体的间接ELISA方法,二者均可用于雏鸭免疫后抗体水平的监测。
3 鸭疫里氏杆菌病疫苗的研制
由于RA广泛而严重的抗药性,以及公众对食品中抗生素残留问题的重视和公共卫生安全的要求,药物的使用将会受到越来越严格的限制,而疫苗免疫是解决传染病的最佳选择。然而RA各血清型间缺乏交叉保护,加之各地流行的RA血清型又不尽相同,因此制备通用疫苗是最理想的解决途径。但在实际生产中由于疫苗生产工艺的限制,针对鸭疫里氏杆菌病的通用疫苗目前尚未问世。现阶段我国预防鸭疫里氏杆菌病仍以免疫灭活疫苗为主,弱毒活疫苗及含菌体成分疫苗尚处于研究阶段。
3.1 灭活疫苗的研制
由于制作工艺的限制,目前的鸭疫里氏杆菌病灭活疫苗尚未涵盖当前流行的所有血清型,因此实际生产中以当地流行的血清型研制灭活疫苗对控制本地发生的鸭疫里氏杆菌病具有普遍意义。现阶段灭活疫苗的种类主要有单价苗、二价苗、三价苗、四价苗和二联苗等。王小兰等[35]和杨灵芝等[36]分别研制的2型和10型单价油乳剂灭活疫苗,可有效抵抗同型强毒RA的攻击。傅元华等[37]和孟超等[38]分别采用1型和2型RA制备了二价油乳剂灭活疫苗,可有效保护鸭和鹅不被同型RA的感染。谢永平等[39]和田令等[40]研制的RA1、2、3型三价油乳剂灭活疫苗,免疫保护期达50 d,可满足肉鸭养殖生产的需要。程安春等[41]将1、2、4、5型RA灭活后制成的四价铝胶复合佐剂疫苗,免疫雏鸭后可有效抵抗1、2、4、5型RA强毒的感染。Sandhu等[42]研制的RA与E.coli二联灭活疫苗均可有效保护雏鸭不感染大肠杆菌病和鸭疫里氏杆菌病。
在疫苗生产中,通常添加各种佐剂作为非特异性免疫增强剂来增强疫苗的免疫保护效果,常用的佐剂主要有铝胶、油乳剂、蜂胶、黄芪多糖等,佐剂不同,疫苗的保护效果也不尽相同。陈洁等[43]从安全性和保护效果两方面对RA1油乳剂、蜂胶及黄芪多糖灭活疫苗的保护效果进行比较,发现3种佐剂疫苗的保护率分别为92%、84%、96%,结果说明黄芪多糖灭活疫苗的保护效果最佳。吉凤涛等[44]对RA1、2、7型三价蜂胶灭活苗和油乳剂灭活苗的免疫保护效果进行评价,发现雏鸭免疫蜂胶灭活苗第3天即可产生部分抵抗力,疫苗的完全保护作用可持续至第120天;而接种油乳剂灭活苗的雏鸭于免疫后第10天才开始表现出部分抵抗力,但疫苗的完全保护作用也可持续至免疫后第120天。比较2种佐剂疫苗的效果可以看出,蜂胶灭活苗具有产生诱导免疫保护作用速度快,免疫持续时间长等优点,而油乳剂灭活苗虽然免疫持续期较长,但诱导产生保护力的速度较慢。
3.2 活疫苗的研制
国外有报道使用RA弱毒活疫苗,Sandhu等[45]将RA1、2、5型自然弱毒株制成三价活疫苗,免疫雏鸭后无明显的副作用,对同型强毒的攻击保护期长达42 d。国内目前尚未见该方面的报道。
3.3 菌体成分疫苗的研究
菌体成分疫苗包括亚单位疫苗和基因工程疫苗。RA此类疫苗目前尚处于研发阶段,亚单位疫苗重点集中在外膜蛋白和荚膜相关成分上。Omp 是革兰氏阴性菌外膜的主要结构成分,具有免疫原性,不仅能激发机体的体液免疫,还可以激发引起细胞免疫,被用于试制疫苗的研究,展现出良好的应用前景。李清竹[46]以重组的RA1 Omp蛋白与弗氏完全佐剂乳化后免疫雏鸭,可保护雏鸭免受同型强毒的攻击,结果表明该蛋白具有良好的免疫原性,能同时刺激机体产生体液免疫和细胞免疫。
RA的其他免疫原性蛋白也在不断被发现,么乃全等[33]研究证明 Camp 蛋白具有良好的免疫原性,并且为多种血清型RA的共同抗原,在 RA 亚单位疫苗开发中具有良好的应用价值。除外膜蛋白外,荚膜作为菌体成分之一,也是一种非常重要的保护性抗原。齐冬梅等[47]用制成的RA1荚膜油乳佐剂疫苗免疫雏鸭后,对同源菌株的攻击保护率可达90%,通过与其他RA1不同佐剂灭活疫苗免疫效力的比较发现,荚膜油乳剂苗的保护效果最佳,其次为油乳剂灭活苗、蜂胶灭活苗、铝胶灭活苗、无佐剂灭活苗。上述研究工作的开展为亚单位疫苗的研究提供了候选抗原,也为该类疫苗的研制奠定了基础。
4 展望
从我国的地里位置看,由北向南,自西向东鸭疫里氏杆菌病的发病趋势明显加重。该病在南方地区较北方地区多发,原因可能是南方地区气候温暖湿润造成了该病易发、频发。从流行情况看,我国RA流行的血清型复杂多变,提示当前鸭疫里氏杆菌病的防控形势异常严峻。从检测方法来看,随着科技的发展,RA的检测技术将会更加快速、简便、易行。从疫苗研发角度来看,因灭活疫苗的局限性,使其应用受限,而亚单位疫苗和基因工程疫苗因其自身优点,必将是未来科研工作的热点和重点,预计未来我国防控鸭疫里氏杆菌病的水平将得到进一步提高。参考文献:
[1] Leavit S, Ayroud M.Riemerellaanatipestiferinfection of domestic ducklings[J]. Can Vet J, 1997, 38(2): 113.
[2] Liu H W, Wang X L, Ding C,et al. Development and evaluation of a trivalentRiemerellaanatipestiferinactivated vaccine [J].Clin Vac Immunol, 2013, 20(5): 691-697.
[3] 刘 洋, 王玉田, 刘甜甜,等. 北京顺义区肉鸭大肠杆菌与鸭疫里默氏杆菌感染情况的调查[J]. 中国兽医杂志, 2014, 50(12): 20-22.
[4] 李秀丽, 王英珍, 任卫科,等. 天津地区鸭疫里默氏杆菌的分离鉴定及药敏试验[J]. 天津农业科学, 2008, 14(6): 9-11.
[5] 林树乾, 何元龙, 赵增成, 等. 山东省鸭疫里默氏杆菌的分离鉴定和血清型分析[J]. 山东农业科学, 2010(12): 92-94.
[6] 李振清. 山东省鸭疫里默杆菌病的流行病学调查与耐药性分析[J]. 黑龙江畜牧兽医, 2014(5): 134-136.
[7] 钱学智. 徐州地区鸭疫里默氏杆菌病的流行病学调查[J]. 禽业技术, 2011(11): 126-129.
[8] 陈永亮, 戚邦帅. 徐州地区鸭疫里氏杆菌的分离鉴定与药敏试验[J]. 畜牧与兽医, 2012, 44(3): 81-83.
[9] 刘运镇, 陈 高, 徐婷婷, 等. 苏中地区鸭疫里氏杆菌血清型鉴定和药敏试验[J]. 江苏农业科学, 2013, 41 (2): 185-187.
[10] 胡清海, 张知良, 苗晋锋, 等. 江苏安徽两省鸭疫里默氏杆菌病的流行病学调查研究[J]. 中国兽医科技, 2001, 31 (8): 12-13.
[11] 艾地云, 姚 琪, 罗 玲, 等. 湖北部分地区鸭疫里氏杆菌的分离鉴定[J]. 动物医学进展, 2011, 32(9): 46-50.
[12] 蔡秀磊, 韦 强, 崔言顺, 等. 浙江省22 株鸭疫里默氏杆菌的血清型鉴定及耐药性研究[J]. 浙江农业学报, 2007, 19(1): 46-49.
[13] 黄承洪, 李继祥, 黄 伟, 等. 重庆和四川地区鸭疫里默氏杆菌流行动态研究[J]. 中国预防兽医学报, 2007, 29(1): 67-70.
[14] 傅心亮, 嵇辛勤, 文 明, 等. 贵州鸭疫里默氏杆菌的分离鉴定及耐药性分析[J], 中国畜牧兽医, 2013, 40(8): 155-158.
[15] 言天久. 百色市鸭疫里氏杆菌病流行病学调查与防治的研究[M]. 兽医硕士学位论文, 2007,12: 1.
[16] 阳艳洁, 蒋福信, 王 星, 等. 桂林市鸭疫里氏杆菌的血清型鉴定及耐药性分析[J]. 养禽与禽病防治, 2011, 11: 2-4.
[17] 吴彩艳,覃宗华,袁建丰,等. 广东地区鸭疫里氏杆菌的血清型及抗药性情况调查[J]. 畜牧与兽医, 2009, 41(5): 22-25.
[18] 张济培, 张小峰, 陈建红, 等. 珠三角及邻地鸭疫里默氏杆菌主要生物学特性的研究[J]. 中国预防兽医学报, 2012, 34(2) : 100-103.
[19] 郭远奎. 鸭疫里默氏杆菌PCR快速检测方法的建立[J]. 家禽科学, 2009, 11: 6-8.
[20] 林树乾, 张 燕, 于可响, 等. 鸭疫里默氏杆菌PCR 快速检测方法的建立与应用[J]. 山东农业科学, 2009, 8: 107-110.
[21] 冯金牛, 阮二垒, 杨丽云, 等. 鸭疫里氏杆菌的分离与16S rRNA 的鉴定[J]. 动物医学进展, 2010 , 31(6): 73-76 .
[22] 覃宗华, 蔡建平, 吕敏娜, 等. 鸭疫里氏杆菌病和大肠杆菌病鉴别诊断双重 PCR方法的建立和应用[J]. 畜牧兽医学报, 2008, 39(4): 517-521.
[23] 刘拂晓, 李明义, 范根成,等. 鸭疫里默氏杆菌荧光定量PCR 检测方法的建立[J]. 中国兽医学报, 2010, 30 (6): 756-761.
[24] 谢永福,陈芳艳,冯金牛. 鸭疫里默氏杆菌巢式PCR检测方法的建立[J]. 中国家禽, 2013, 35(9): 19-22.
[25] 王 璇,徐景峨,潘淑惠. 鸭疫里氏杆菌PCR快速检测方法的建立[J]. 中国畜牧兽医, 2011, 38(12): 100-102.
[26] 王春平, 韦 强, 鲍国连. 鸭疫里默氏菌病和大肠杆菌病多重PCR 诊断方法的建立[J]. 中国兽医学报, 2010, 30(3): 352-355.
[27] 谢永平, 盘宝进, 陈泽祥. 鸭疫里默氏杆菌实时荧光定量PCR快速检测方法的建立与应用研究[J]. 中国畜牧兽医, 2010, 37 (10) : 87-92.
[28] 季权安, 刘 燕, 肖琛闻. 鸭疫里默氏杆菌 PCR 快速检测方法的建立[J]. 浙江农业学报, 2012, 24( 3) : 388-391.
[29] 刘学贤, 龚建林, 单艳菊, 等. 鸭疫里默氏杆菌ELISA 检测方法的研究及初步应用[J]. 中国家禽, 2009, 31(22): 52-54.
[30] 吴彩艳,覃宗华,袁建丰,等. 鸭疫里氏杆菌抗体检测的全菌体抗原间接ELISA 方法的建立[J].养禽与禽病防治, 2009(6): 4-7.
[31] 李富祥, 杨 斌, 常志顺, 等. 间接 ELISA 检测鸭疫里默氏杆菌血清抗体方法的建立[J]. 中国畜牧兽医, 2010, 37(1): 202-205.
[32] 辜新贵, 袁建丰, 覃宗华, 等. 鸭疫里氏杆菌重组蛋白P25 间接 ELISA 检测方法的建立[J]. 中国兽医科学, 2008, 38(3): 218-223.
[33] 么乃全, 高云航, 于 丹. 鸭疫里氏杆菌吉林分离株camp基因的克隆、表达及间接 ELISA 检测方法的建立[J]. 中国预防兽医学报, 2013, 35 (1) : 54-57.
[34] 季慕寅, 王 晴, 翟志鹏. 鸭疫里氏杆菌多种血清型间接ELISA 检测方法的建立[J]. 微生物学通报, 2015, 42(11): 2260-2269.
[35] 王小兰, 胡青海, 韩先干,等. 血清2型鸭疫里默氏杆菌制苗用菌株的筛选及灭活油乳剂疫苗的研制[J]. 中国动物传染病学报, 2012, 20(1): 54-58.
[36] 杨灵芝, 姜世金, 马景霞, 等. 鸭疫里默氏杆菌(10型)灭活疫苗的研制[J]. 上海畜牧兽医通讯, 2011(4): 2-5.
[37] 傅元华, 施彬彬, 赵宝华, 等. 鸭疫里默氏杆菌病二价油乳剂疫苗的研制[J].中国家禽, 2011, 33(9): 62-62.
[38] 孟超, 李宝臣, 叶曼曼, 等. 鸭传染性浆膜炎二价灭活疫苗的效果评价研究 [J].浙江畜牧兽医, 2014(6): 6-8.
[39] 谢永平, 张泽祥, 话力平, 等. 鸭疫里氏杆菌病三价油乳剂灭活疫苗的研究[J]. 动物医学进展, 2010, 31(7): 10-12.
[40] 田 令, 岳 华, 汤 承. 西南地区鸭疫里默氏菌血清型调查和三价灭活油乳剂疫苗的研制[J].四川畜牧兽医, 2010(3): 22-23.
[41] 程安春, 汪铭书, 郭宇飞, 等. 鸭疫里氏杆菌铝胶复合佐剂 4 价灭活疫苗的比较[J]. 中国兽医学报, 2005, 25(2): 152-157.
[42] Sandhu R,Aronow WS, Rajdev A. Relation of cardiac troponin I levels with in-hospital mortality in patients with ischemic stroke, intracerebral hemorrhage, and subarachnoid hemorrhage[J]. Am J Cardiol, 2008, 102(5): 632-634.
[43] 陈 洁, 金尔光, 陈 橙, 等.Ⅰ型鸭疫里默氏杆菌三种佐剂灭活疫苗研制及免疫效果比较[J]. 中国家禽, 2010, 32(1): 27-30.
[44] 吉凤涛, 任 锐, 吕雪峰, 等. 鸭疫里默氏杆菌多价灭活苗研制的研究报告[J]. 吉林畜牧兽医, 2011(12): 1-5.
[45] Sandhu NS, Maharlouei B, Patel B. Simultaneous bilateral infraclavicular brachial plexus blocks with low-dose lidocaine using ultrasound guidance[J]. Anesthesiology, 2006 , 104(1): 199-201.
[46] 李清竹. 血清Ⅰ型鸭疫里默氏杆菌OmpA/ MotB蛋白免疫原性初探[D]. 兽医硕士学位论文, 2015.
[47] 齐冬梅, 赖月辉, 巫月生, 等.Ⅰ型鸭疫里默氏杆菌荚膜免疫的研究[J].中国兽药杂志, 2009, 43 (4) : 17-19.
Introduction to Epidemiology of Riemerellosis Anatipestifer Disease in China
WU Cai-yan1,2, CHENG Shu-qin3, ZHANG Jian-feng1,LI Juan1, LIN Xu-hui1, DONG Jia-wen1, LV Min-na1, LIAO Shen-quan1, QI Nan-shan1, SUN Ming-fei1, LIU Ya-hong1
(1.InstituteofAnimalHealth,GuangdongAcademyofAgriculturalSciences,GuangdongProvincialKeyLaboratoryofLivestockDiseasePrevention,GuangdongOpenlaboratoryofVeterinaryPublicHealth,Guangzhou,Guangdong,510640,China;2.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China;3.HebeiTourismVocationalCollege,Chengde,Hebei,067000,China)
In recent years, the duck septicaemia caused byRiemerellaanatipestiferin young ducks has been a main disease which harming to the duck breeding industry because of diversity serotype and serious resistance. In this paper, we reviewed the latest epidemiology, diagnosis technique and vaccine development forRiemerellaanatipestiferinfection combining with our research results in order to guide using of drugs rationally and provide some suggests to control this disease.
Riemerellaanatipestiferinfection; epidemiological investigation; diagnosis; vaccine development
2016-11-07
广东省科技计划项目(2015A020210086,2013B031500005,2014A020208052,2015B020230004);国家星火计划项目(2015GA780050);广州市科技计划项目(201510010250)
吴彩艳(1978-),女(蒙古族),内蒙古赤峰人,副研究员,主要从事禽传染病研究。 △同等贡献作者,*通讯作者
S852.617
A
1007-5038(2017)06-0086-05
