microRNA-616在肝细胞癌侵袭转移中的作用机制研究
2017-06-26刘欣许秋然张美齐蔡文伟刘青光涂建锋
刘欣 许秋然 张美齐 蔡文伟 刘青光 涂建锋
microRNA-616在肝细胞癌侵袭转移中的作用机制研究
刘欣 许秋然 张美齐 蔡文伟 刘青光 涂建锋
目的 探讨microRNA-616(miR-616)在肝细胞癌(HCC)中的表达及其在HCC侵袭转移中的作用机制。方法通过qRT-PCR检测miR-616在60例HCC及癌旁组织中的表达,同时检测miR-616在不同肝癌细胞系中的表达情况;免疫组织化学染色检测miR-616在HCC及癌旁组织中波形蛋白(vimentin)、上皮型钙黏素(E-cadherin)及同源性磷酸酶-张力蛋白(PTEN)的表达情况;qRT-PCR检测miR-616在人正常永生化肝细胞(LO2)及5种不同肝癌细胞系(HepG2、SMMC-7721、Hep3B、Hu7)中的表达水平;使用miR-616抑制物作用Hep3B细胞,TranswellTM实验检测miR-616抑制后Hep3B细胞侵袭能力变化;应用miR-616抑制物及PTEN siRNA转染Hep3B细胞,qRT-PCR检测Hep3B中miR-616、vimentin、PTEN、E-cadherin的mRNA水平,Western blot法检测癌细胞中vimentin、PTEN、E-cadherin的蛋白水平。结果 miR-616在HCC组织中表达水平高于对应癌旁组织;miR-616在不同肝癌细胞系中表达均高于LO2细胞;miR-616高表达与低表达在血管侵犯、Edmonson-Steiner分级、TNM分期比较差异均有统计学意义(均P<0.05);miR-616高表达肝癌组PTEN及E-cadherin水平低于miR-616低表达肝癌组,而vimentin水平高于miR-616低表达肝癌组,相关性分析结果显示HCC组织中miR-616与E-cadherin、PTEN水平呈负相关,与vimentin水平呈正相关;在肝癌细胞中抑制miR-616后PTEN及E-cadherin表达水平上调,而vimentin表达降低,Hep3B细胞的侵袭能力明显降低。结论 miR-616在HCC组织中表达上调,其表达与HCC恶性临床病理特征有关,miR-616促进肝癌细胞侵袭转移的作用可能与其抑制PTEN表达及诱导上皮间质转化有关。
miR-616 肝细胞癌 侵袭 靶基因同源性磷酸酶-张力蛋白 上皮间质转化
【 Abstract】 Objective To investigate the expression of miR-616 in human hepatocellular carcinoma and its effects on tumor invasion and metastasis. Methods The expression of miR-616 was detected with real-time quantitative PCR(qRT-PCR) in 60 specimens of hepatocellular carcinoma (HCC)tissues and corresponding adjacent normal tissues;and also in human HCC HepG2,SMMC-7721,Hep3B,Hu75 cells and normal liver LO2 cells.The expression of vimentin,phosphatase,tensin homolog (PTEN)and E-cadherin was detected with immunohistochemical S-P method.The miR-616 inhibitor was transfected into Hep3B cells in vitro,cell invasion was analyzed by Transwell?assay.The expression of PTEN,E-cardhern and vimentin mRNAs and proteins after transfection was detected by qRT-PCR and Western blotting,respectively. Results The expression of miR-616 in HCC tissues was higher than that in matched tumor-adjacent normal tissues;and it was significantly correlated with venous infiltration,high Edmondson-Steiner grades and lymph node metastasis and TNM tumor stages in HCC.Elevated miR-616 expression was observed in HCC cell lines HepG2,SMMC-7721,Huh7 and Hep3B as compared with that in LO2 hepatic cell line.Furthermore,miR-616 expression was negatively correlated with E-cadherin and PTEN,positively correlated with vimentin in HCC tissues.The miR-616 inhibitor suppressed the migration and invasion in Hep3B cells;and it increased the expression of E-cadherin and PTEN,while decreased the expression of vimentin in Hep3B cells.In addition,down-regulation of PTEN' expression partially abrogated the effect of miR-616 inhibitor in HCC cells. Conclusion The expression of miR-616 in HCCtissues is significantly up-regulated,and it can promote proliferation and induce apoptosis of HCC cells by down-regulating the expressions of PTEN.
【 Key words】 microRNA-616 Hepatocellular carcinoma Migration and invasion Phosphatase and tensin homolog (PTEN) Epithelial-mesenchymal transition
肝细胞癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,其已成为亟待解决的医学界问题[1]。目前在世界范围内HCC的治疗取得了一定的进展[2],但是HCC发生、发展的具体分子机制仍不十分清楚。微小RNA(microRNA)是一类由18~25个核苷酸构成的小分子非编码RNA,microRNA可与靶基因mRNA的3′端非编码区(3′UTR)互补结合,下调靶基因的表达水平[3]。许多microRNA已被证实在HCC中异常表达,在肿瘤侵袭、转移及发生、发展中起到重要作用[4-6]。mircoRNA-616(miR-616)是近期发现新的癌症相关mircoRNA。有研究发现miR-616在胃癌组织中过表达[7],在肺癌和前列腺癌患者的血清中显著升高[8-9]。但其在HCC中的表达及作用机制尚不明确。笔者通过检测miRNA-616与上皮间质转化(EMT)相关标志物及其潜在靶基因同源性磷酸酶-张力蛋白(PTEN)在HCC组织中的表达情况,应用人工合成的miR-616抑制物及PTEN siRNA转染HCC Hep3B细胞,研究miR-616在HCC侵袭、转移及发展中的作用,为HCC的诊断及生物治疗提供实验依据。
1 材料和方法
1.1 材料 本课题经过西安交通大学医学院附属第一医院伦理审核批准,收集2014年9月1日至2015年8月30日期间于西安交通大学医学院附属第一医院普外科行外科手术切除的60例患者的肝癌组织和其相对应的癌旁组织(距切缘>2cm)标本,年龄25~64岁,中位年龄49岁。所有患者均知情同意,并签署相关文件,纳入标准为所有患者手术前均未行生物靶向治疗及放化疗。组织标本离体20min内取材,共2份,分别置入液氮或甲醛溶液中保存。LipofectamineTM2000及TRIzol试剂采购于Invitrogen公司;real-time PCR试剂盒(Super-Real PreMix,SYBRRGreen,FP204)及mRNA逆转录试剂盒(Quant Reverse Transcriptase,ER103)采购于自北京天根生化科技有限公司;miR-616引物、RNU6B引物、miR-616抑制物及抑制物相应阴性对照均购自中国GeneCopoeia公司;PTEN siRNA(上游引物:5′-AACCCACCACAGCUAGAACTT-3′),空白对照siRNA(上游引物:5′-UUCUCCGAACGUGUCACGUTT-3′)由上海生工生物科技有限公司合成;1×DMEM细胞培养液采购于Mediatech公司,胎牛血清(fetal bovine serum,FBS)购于美国Gibco公司;人正常永生化肝细胞(LO2)及肝癌细胞系(HepG2、SMMC-7721、Hep3B、Hu7)购于中科院上海生物化学与细胞生物研究所;TranswellTM小室试剂盒购于瑞士Roche公司;兔抗人PTEN抗体及兔抗人E-cadherin抗体购于英国Abcam公司,小鼠抗抗人vimentin抗体人及小鼠β-actin单克隆抗体购自美国Santa Cruz公司;生物素标记的山羊抗小鼠 IgM(A2086),小鼠抗兔IgG(211-065-109)购于中国爱美捷科技有限公司。
1.2 方法
1.2.1 qRT-PCR检测肝癌组织、相应癌旁组织、LO2及肝癌细胞系中miR-616 mRNA的水平[4]按TRIzol试剂说明书提取肝癌组织、相应癌旁组织、LO2及肝癌细胞系(HepG2、SMMC-7721、Hep3B、Hu7)总RNA。按逆转录试剂盒说明书设置:2×SuperReal Premix 12.5μl;无RNase双蒸水9μl;上、下游引物(10μmol/L)各0.75μl。按如下条件进行PCR反应:94℃预变性10min,94℃变性10s,57℃退火、延伸30s,扩增35个循环,扩增结束后制作熔解曲线。内参为RNU6B,采用2-△△Ct法计算miR-616 mRNA相对表达量,同一个样本独立重复进行3次实验。
1.2.2 免疫组织化学染色检测HCC组织中PTEN、E-cadherin及vimentin表达水平[4]HCC组织标本进行脱水后石蜡包埋,4μm切片。切片在脱蜡水化后于枸橼酸缓冲液(pH6.0)中进行抗原热修复;H2O2溶液(30ml/L)作用切片后,山羊血清封闭后PBS溶液稀释的1∶500的PTEN抗体、vimentin抗体、E-cadherin抗体4℃孵育8~12h;然后小鼠抗兔IgG及山羊抗小鼠IgM在37℃下孵育50min;洗涤后滴加辣根过氧化物酶-链酶卵白素复合物进行反应,DAB显色后进行苏木素复染,常规脱水透明,中性树胶封片。每张切片经由2位高年资病理医师,在高倍镜(×400)下随机选取10个视野,按文献[10]所述的标准评分。最终评分≥1分者为蛋白阳性表达。
1.2.3 肝癌细胞培养及转染[4]Hep3B细胞培养于含FBS的1×DMEM细胞培养液中,37℃、50ml/L CO2培养箱中培养。传代稳定2~3代后,取对数生长期Hep3B细胞接种于6孔板中,每个孔里加入含FBS的1×DMEM细胞培养液培养,使细胞至汇合度达70%。实验组每孔加入5μlLipofectamineTM2000及150pmol/LPTENsiRNA;对照组每孔加入 5μl LipofectamineTM2000及 150pmol/L Control siRNA。再加入不含血清的DMEM培养基调整终体积至2ml,置于37℃、50ml/L CO2的培养箱中培养6h,更换完全培养基继续培养[4]。
1.2.4 细胞侵袭能力检测 将TranswellTM小室放入24孔板中,上室加入300μl预温的无血清DMEM培养基,室温静置20min后吸去剩余培养液。消化后的Hep3B细胞调整细胞数至1×105~10×105个/ml,取细胞悬液150μl加入TranswellTM小室,常规培养48h后,用刀片沿小室边缘将膜切下,膜片倒置于24孔板的孔中,甲醇:冰醋酸(浓度比例3∶1)固定8min,Giemsa染色,镜下检测细胞数,每个样本独立重复实验3次[4]。
1.2.5 Western blot法检测 PTEN、E-cadherin及 vimentin的表达[4]收集转染72h后的Hep3B细胞,RIPA裂解液置冰上裂解 10min后 4℃、12 000r/min离心10min取上清液,BCA法测定上清液中总蛋白浓度。每孔加入40μg蛋白样品,采用100g/L垂直SDS-PAGE分离蛋白,Bio-Rad半干转印系统,25V转膜1.5h,BSA室温封闭1.5h;加入兔抗人PTEN抗体(1∶1 000)、兔抗人E-cadherin抗体(1∶1 000)、小鼠抗人β-actin抗体(1∶2 000)及小鼠抗人vimentin(1∶500)抗体,4℃孵育8h;PBS洗去抗体,分别加入相对应的二抗(1∶4 000),室温孵育2h;PBS洗涤3次,每次5min,滴加ECL溶液暗室曝光,全自动洗片机进行洗片。
1.3 统计学处理 应用SPSS16.0统计软件,计量资料以表示,组间比较采用t检验,采用Pearson χ2检验分析miR-616表达与临床病理资料间关系,Spearman相关分析miR-616与PTEN、vimentin及E-cadherin相关性。
2 结果
2.1 miR-616肝癌组织及对应癌旁组织、肝癌细胞系中的表达 qRT-PCR结果显示miR-616在肝癌组织中的表达量明显高于对应的癌旁组织(P<0.05),见图1a;miR-616在侵袭性HCC组织中的表达量显著高于非侵袭性HCC组织(P<0.05),见图1b;miR-616在HepG2、SMMC-7721、Hep3B、Hu7肝癌细胞系中的表达量均明显高于LO2细胞(均P<0.05),见图1c。

图1 miR-616在肝癌组织、癌旁组织及肝癌细胞系中的表达量[a:miR-616在HCC组织(n=60)和癌旁组织(n=60)中表达量;b:miR-616在侵袭性HCC组织(n=60)及非侵袭性HCC组织(n=60)中的表达量;c:miR-616在4种肝癌细胞系和LO2细胞种的表达量;*P<0.05]
2.2 miR-616表达与肝癌患者临床病理特征的关系 以miR-616在组织中的中位表达水平(0.47±0.012)%作为分割线,将60例HCC组织划分为miR-616高表达组30例与miR-616低表达组30例。结果提示miR-616高表达与低表达在血管侵袭、高TNM分期(Ⅲ期和Ⅳ期)和高Edmondson-Steiner分级(Ⅲ期和Ⅳ期)等方面比较差异均有统计学意义(均P<0.05),见表1。
2.3 miR-616与PTEN、E-cadherin及vimentin表达的相关性 结果显示,miR-616低表达组中E-cadherin及PTEN表达强度明显高于miR-616高表达组(P<0.05),见图2a-b;而vimentin表达强度明显低于miR-616高表达组(P<0.05),见图2c。Spearman相关分析结果显示,miR-616与PTEN呈负相关(r=-0.472,P=0.015),与E-cadherin呈负相关(r=-0.5120,P=0.014),与vimentin呈正相关(r=0.539,P=0.041)。
2.4 下调miR-616对肝癌Hep3B细胞侵袭转移能力的影响 结果发现,miR-616抑制剂组细胞较阴性对照组细胞侵袭能力明显下降(P<0.05),见图3。
2.5 miR-616与肝癌细胞中PTEN、E-cadherin、vimentin的关系 通过数据库(Target-Scan 6.2和MiRanDa)预测miR-616的靶基因,发现PTEN可能是miR-616靶基因,如图4a所示,PTEN的3′-UTR含有miR-616的互补序列。此外,为探讨miR-616在肝癌细胞中的可能作用机制,笔者使用miR-616抑制物、siRNA分别及同时转染Hep3B肝癌细胞后,应用Western blot检测其下游靶蛋白PTEN、E-cadherin及vimentin水平。结果显示下调肝癌细胞Hep3B中的miR-616表达水平后,PTEN及E-cadherin表达水平明显上调,而vimentin表达明显下降;相比较单独转染miR-616抑制物组,同时使用PTEN siRNA及miR-616抑制物转染Hep3B细胞后,PTEN及E-cadherin表达量明显增加,而vimentin表达量降低,见图4b。

表1 miR-616表达与HCC患者临床病理特征的关系(例)
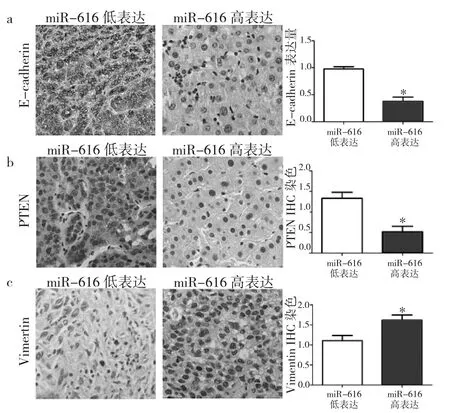
图2 PTEN、vimentin及E-cadherin在不同miR-616水平的肝癌组织表达情况(a:E-cadherin在不同miR-616水平的肝癌组织表达情况;b:PTEN在不同miR-616水平的肝癌组织表达情况;c:Vimentin在不同miR-616水平的肝癌组织表达情况,与miR-616低表达比较,*P<0.05)

图 3 miR-616转染后促进肝癌细胞 Hep3B侵袭转移(a:qRT-PCR法检测miR-616抑制剂转染Hep3B细胞后miR-616水平;b:TranswellTM法检测miR-616抑制物转染Hep3B细胞前后细胞侵袭能力变化;Giemsa染色,×200;与对照组比较,*P<0.05)

图4 miR-616在Hep3B细胞中调控PTEN、E-cadherin及vimentin的表达情况(a:miR-616与PTEN 3′-UTR的互补序列;b:miR-616抑制物及PTENsiRNA转染Hep3B细胞对PTEN、E-cadherin及vimentin的表达情况影响)
3 讨论
HCC发生、发展是一系列复杂的过程,涉及多个信号通路,其具有早期诊断困难、侵袭能力强和早期发生远处转移的特点[11]。流行病学显示,其病死率居于我国癌症病死率第2位[11]。因此,寻找新的有效HCC分子标志物及生物治疗靶点对肝癌的诊疗提供了重要的依据。
作为内源性的一类小RNA分子,miRNA可与其靶基因mRNA序列不完全互补结合,形成发卡样结构,进而抑制靶基因的翻译,从而调控下游靶基因的表达水平[4,12]。有研究发现miR-616在胃癌[13]、肺癌[8]、前列腺癌[9]中高表达。本研究通过对60例HCC及对应癌旁组织、肝癌细胞系进行检测,发现在HCC组织中miR-616的表达水平高于对应的癌旁组织,且侵袭性肝癌组织表达量更高。临床病理资料分析显示miR-616高表达与HCC血管侵犯、高TNM分期及高Edmondson分级恶性临床病理特征密切相关。此外通过对HCC细胞系及LO2的检测发现miR-616在LO2中的表达量也低于肝癌细胞系,在Hep3B细胞中抑制miR-616的表达后Hep3B细胞的侵袭、转移能力降低。以上结果提示miR-616可能在HCC的侵袭转移中发挥重要作用。
EMT是上皮细胞由上皮表型向间质表型转化的生物学过程,EMT在HCC细胞的侵袭和转移中已被报道起到重要作用[4,14]。另外,有研究发现在肿瘤中PTEN表达是降低或缺失的,因此PTEN被认为是一种抑癌基因[15]。在肝癌中,PTEN被证实是表达异常的,其缺失或低表达促进肝癌的进展[16]。然而,肝癌中PTEN表达异常的具体机制目前尚不清楚。有研究发现miR-21[16]、miR-216[17]、miR-221[18]、miR-29a[19]和miR-32[20-21]可以调控PTEN的表达。本研究通过数据库(Target-Scan 6.2和MiRanDa)预测miR-616的靶基因,发现PTEN可能是miR-616靶基因。
笔者在HCC组织中对同源性磷酸酶-张力蛋白PTEN、上皮标志物E-cadherin及间质标志物vimentin进行免疫组化染色,发现低表达miR-616的HCC组织中PTEN、E-cadherin的表达高于miR-616高表达组,而vimentin的表达低于miR-616高表达组。相关性分析结果提示miR-616与PTEN、E-cadherin呈负相关,而与vimentin呈正相关,以上结果提示miR-616可能与肝癌中PTEN表达及EMT有关。本研究使用miR-616抑制剂抑制Hep3B细胞中miR-616的表达后,发现PTEN和E-cadherin蛋白的表达是上调的,而vimentin的表达是降低的。此外,笔者发现在miR-616低表达的Hep3B细胞中转染PTEN siRNA可以抵消miR-616抑制物所带来的效果,即同时使用miR-616抑制物及PTEN siRNA转染Hep3B细胞,相比较单独转染miR-616抑制物组,实验组PTEN及E-cadherin蛋白的表达降低,而vimentin蛋白表达升高。
综上所述,笔者考虑miR-616可能通过靶向调控PTEN表达,从而使肝癌细胞发生EMT,进一步促进肝癌细胞侵袭转移,miR-616具有成为新的HCC分子标志物及生物治疗靶点的潜能,但有待进一步研究证实。
[1] Xu Q,Liu X,Zheng X,et al.The transcriptional activity of Gli1 is negatively regulatedby AMPK through Hedgehog partial agonism in hepatocellularcarcinoma[J].IntJ MolMed,2014,34(3):733-741. doi:10.3892/ijmm.2014.1847.
[2] Tu K,Wei Y,Zan X,et al.Fbxw7 is an independent prognostic marker an induces apoptosis and growth arrest by regulating YAP abundance in hepatocellular carcinoma[J].Mol Cancer,2014, 13:110.doi:10.1186/1476-4598-13-110.
[3] Wong C M,Kai A K,Tsang F H,et al.Regulation of hepatocarcinogenesis by microRNAs[J].Front Biosci(Elite Ed),2013,5:49-60. PMID:23276969.
[4] 许秋然,蔡文伟,张美齐,等.miR-130b在肝细胞癌中的表达及临床病理意义[J].细胞与分子免疫学杂志,2016,32(3):387-392.
[5]Yang X,Zhang XF,Lu X,et al.MicroRNA-26a suppresses angiogenesis inhumanhepatocellularcarcinoma bytargeting HGF-cMet pathway[J].Hepatology,2013,59(5):1874-1885.doi:10.1002/ hep.26941.
[6]Duan X,Hu J,Wang Y,et al.MicroRNA-145:a promising biomarker for hepatocellular carcinoma(HCC)[J].Gene,2014,541(1):67-68.doi:10.1016/j.gene.2014.03.018.
[7] Yao Y,Suo A L,Li Z F,et al.MicroRNA profiling of human gastric cancer[J].Molecular medicine reports,2009,2(6):963.doi:10. 3892/mmr_00000199.
[8] RaniS,Gately K,Crown J,et al.Globalanalysis ofserum microRNAs as potential biomarkers for lung adenocarcinoma[J].Cancer biology&therapy,2013,14(12):1104-1112.doi:10.4161/cbt.26370.
[9]Ma S,Chan YP,Kwan P S,et al.MicroRNA-616 induces androgen-independent growth of prostate cancer cells by suppressing expression of tissue factor pathway inhibitor TFPI-2[J].Cancer research,2011,71(2):583-592.doi:10.1158/0008-5472.
[10]拓航,郑鑫,涂康生,等.PCAF在肝细胞癌中的表达及临床意义[J].细胞与分子免疫学杂志,2013,29(3):297-300.PMID:23643089.
[11] Xu Q,Liu X,Zheng X,et al.PKM2 regulates Gli1 expression in hepatocellular carcinoma[J].Oncol lett,2014,8(5):1973-1979. doi:10.3892/ol.2014.2441.
[12] LiS,LiJ,FeiB Y,et al.MiR-27a Promotes Hepatocellular Carcinoma Cell Proliferation Through Suppression of its Target Gene Peroxisome Proliferator-activated Receptorγ[J].ChinMed J(Engl),2015,128(7):941-947.doi:10.4103/0366-6999.154302.
[13] Yao Y,Suo A L,LiZ F,et al.MicroRNA profiling of human gastric cancer[J].Molecular medicine reports,2009,2(6):963-970.doi: 10.3892/mmr_00000199.
[14]Yang MH,Chen C L,Chau G Y,et al.Comprehensive analysis of the independent effect oftwist and snailin promoting metastasis of hepatocellular carcinoma[J].Hepatology,2009,50(5):1464-1474.doi:10.1002/hep.23221.
[15] Song M S,Salmena L,Pandolfi P P.The functions and regulation of the PTEN tumour suppressor[J].Nature reviews Molecu-
[16] Wan X W,Jiang M,Cao H F,et al.The alteration of PTEN tumor suppressor expression and its association with the histopathological features of human primary hepatocellular carcinoma[J]. Journal of cancer research and clinical oncology,2003,129(2): 100-106.doi:10.1007/s00432-002-0410-x.
[17] Bao L,Yan Y,Xu C,et al.MicroRNA-21 suppresses PTEN and hSulf-1 expression and promotes hepatocellular carcinoma progression through AKT/ERK pathways[J].Cancer letters,2013, 337(2):226-236.doi:10.1016/j.canlet.2013.05.007.
[18]Xia H,Ooi L L,Hui K M.MicroRNA-216a/217-induced epithelial-mesenchymal transition targets PTEN and SMAD7 to promote drug resistance and recurrence ofliver cancer[J].Hepatology,2013,58(2):629-641.doi:10.1002/hep.26369.
[19] Garofalo M,Di Leva G,Romano G,et al,miR-221&222 regulate TRAILresistance and enhance tumorigenicity through PTEN and TIMP3 downregulation[J].Cancer cell,2013,58(2):629-641.doi: 10.1002/hep.26369.
[20] Kong G,Zhang J,Zhang S,et al.Upregulated microRNA-29a by hepatitis B virus Xprotein enhances hepatoma cell migration by targeting PTEN in cellculture model[J].PloS one,2011,6(5):e19 518.doi:10.1371/journal.pone.0019518.
[21] Wu W,Yang J,Feng X,et al.MicroRNA-32(miR-32)regulates phosphatase and tensin homologue(PTEN)expression and promotes growth,migration,and invasion in colorectal carcinoma cells[J].Molecular cancer,2013,23(12):30.doi:10.1186/1476-4598-12-30.
Expression of miR-616 in human hepatocellular carcinoma and its effect on tumor invasion and metastasis
cell biology,2012,13(5):283-296.
10.1038/nrm3330.
2017-03-06)
(本文编辑:严玮雯)
浙江省自然科学基金(LY16H160043);浙江省医药卫生科技计划一般项目(2016KYA022、2015KYB033)
