旱地和水田土壤DOC吸附-解吸对pH的响应
2017-06-24梁承明郑小东徐学池陈香碧胡亚军梁士楚苏以荣
梁承明,郑小东,徐学池,陈香碧,胡亚军,梁士楚,苏以荣*
(1. 广西师范大学生命科学学院,广西 桂林 541004;2. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125)
旱地和水田土壤DOC吸附-解吸对pH的响应
梁承明1, 2,郑小东2,徐学池2,陈香碧2,胡亚军2,梁士楚1,苏以荣2*
(1. 广西师范大学生命科学学院,广西 桂林 541004;2. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125)

为揭示pH对农田土壤DOC吸附-解吸的影响,以亚热带红壤区旱地和水田土壤为研究对象,采用室内模拟实验,对两种土壤添加不同DOC量后分别在pH 4、pH 6和pH 8条件处理下的吸附和解吸试验进行研究,分析不同pH反应条件下土壤对DOC的吸附和解吸过程,并计算土壤对DOC吸附和解吸的参数,探讨DOC吸附和解吸对pH的响应,初步探析吸附对DOC组成的影响。结果表明,同一土壤在pH 4、pH 6和pH 8条件下对DOC的吸附量差异显著(P<0.05)。随着DOC初始浓度的增加,在pH 4、pH 6和pH 8条件下旱地土壤对DOC的平均吸附量为4.90、2.98和8.86 mg/g,水田土壤对DOC的平均吸附量为4.12、3.10和8.90 mg/g。土壤DOC吸附方程的拟合效果受到pH的显著影响。吸附平衡后,DOC溶液的单位吸光度值E254、E260、E272和E280(芳香性、疏水性组分)的变化率随pH增加而降低。两种土壤对DOC芳香性、疏水性组分的吸附能力受土壤类型影响较小,但受土壤环境pH的影响显著。两种土壤对DOC的解吸量随pH升高而降低。酸性条件下(pH 4),DOC的净吸附量旱地土壤显著大于水田土壤,但在pH 6和pH 8时两种土壤的净吸附量差异不显著。由于红壤区两种土壤多呈酸性,这可能是造成红壤区旱地和水田土壤DOC含量差异的主要原因之一。
可溶性有机碳;吸附;解吸;pH;旱地土壤;水田土壤
可溶性有机碳(dissolved organic carbon,DOC)是指土壤经水溶液浸提后,能通过0.45 μm滤膜、结构不均一、分子大小不同的有机质的连续统一体,是土壤有机碳周转的重要中间产物[1]。它的周转和迁移将土壤中的矿物质、有机质与生物成分联系在一起,通过物理或化学作用改变其环境行为,调节温室气体的排放和土壤养分流失,指示土壤质量,并对成土过程、微生物的生长代谢过程、土壤有机质分解和转化过程有着重要作用[2-3]。旱地和水田是我国南方红壤区较为常见的两种土地利用方式,研究表明,这两种土壤的DOC含量有很大差异,并且旱地土壤DOC中的紫外吸光值E280(芳香性组分)高于水田土壤[4]。土壤DOC差异的产生与其来源和去向(如矿化、吸附等)密切相关,但其差异产生的机理尚未有统一的结论[5]。
目前,关于红壤区水田和旱地土壤DOC含量差异产生的研究报道主要集中在微生物作用和水分对DOC矿化的影响、土地利用方式和光照条件对DOC转化的影响等[6-9]。吸附作用是土壤DOC的重要去向,研究表明,最终被土壤吸附保存为土壤有机碳的DOC量约占DOC各去向总和的一半[10],并且土壤对DOC中各组分的吸附具有选择性[11],因此,吸附作用在土壤DOC周转过程中的作用不容忽视。水田和旱地土壤长期受到人为因素的强烈干扰,导致土壤性质产生分异,由此影响两种土壤对DOC的吸附。土壤DOC吸附与环境体系pH紧密相关,由于土壤类型不同,环境pH对DOC吸附的影响也不同。李太魁等[12]的研究表明,pH降低有利于土壤DOC的吸附,但Kaiser和Guggenberger[13]的研究认为pH对土壤DOC的吸附没有显著影响。为了明确pH对亚热带区域农田土壤DOC吸附-解吸的影响,本文拟选取红壤区旱地和水田土壤为研究对象,采用室内模拟实验,对两种土壤在酸性、偏中性和碱性条件下的DOC吸附和解吸进行研究,分析土壤对DOC的吸附量、解吸量和吸附平衡后DOC芳香性组分变化等相关指标,探讨DOC吸附和解吸对pH的响应,并初步探析吸附对DOC组成的影响,以完善红壤区农田生态系统土壤碳循环理论。
1 材料与方法
1.1 供试材料
供试土壤取自湖南省常德市桃源县,为第四纪红壤母质发育而成。于2015年3月,用多点混合法,采集旱地(29°15′49.7″N,111°31′57.5″E)和水田(29°15′22.0″N,111°31′38.1″E)表层(0-20 cm)土壤样品约2.0 kg,用塑料袋封装后带回实验室,去除其中可见的植物根系和石砾后混匀分成两部分:一部分过2 mm筛,再风干、碾磨,混匀备用;另一部分保存于4 ℃,混匀备用。
供试土壤的基本理化性质见表1,测定方法采用常规土壤分析方法[14]。
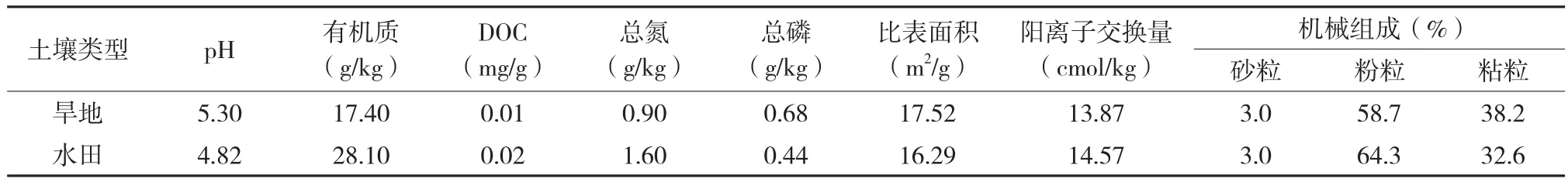
表1 供试土壤的基本理化性质Table 1 Physicochemical properties of the tested soils
1.2 DOC溶液及解吸溶液的制备
将收获新鲜玉米植株材料在60 ℃下烘干、粉碎,与新鲜的水田土壤混合,植株材料与土壤比为5∶1(烘干基)。然后将混合物的质量含水量调节至淹水条件后,置于20 L的封闭塑料桶中,桶底盛有2 L蒸馏水用以维持桶内空气的饱和湿度。整个装置置于25 ℃恒温培养室中,在黑暗条件下培养30 d。培养结束后,用超纯水浸提3次,每次振荡浸提1 h。合并浸提液后,过0.45 μm微孔滤膜即为DOC溶液[15];然后利用冷冻干燥机(FD5-3B)对浸提液进行浓缩。用岛津-总有机碳分析仪(TOC-VWP)测定DOC浓度,于-20 ℃冰箱中保存备用,加适量叠氮化钠抑制微生物活性[12]。
解吸溶液应与DOC溶液有相似的无机成分组成[16],配制方法为:每升去离子水中加入40.72 mg Ca(NO3)2·4H2O,4.40 mg NaNO3,17.06 mg MgCl2·6H2O和9.07 mg K2SO4。用HCl和NaOH调节pH值至4、6和8。
1.3 试验方案
选择亚热带红壤区2种典型农田土壤(旱地和水田),设置5个不同的DOC浓度(100、200、300、450和600 mg/L)和3种不同pH条件(4、6 和8),并设置空白对照实验(吸附试验中为土壤+去离子水;解吸试验中为土壤+解吸液),每处理4次重复,共有288个处理(吸附试验和解吸试验各有144个处理)。将40.00 mL的DOC溶液加入到0.400 0 g的土壤中,混合均匀后,在常温条件下振荡24 h,离心,过0.45 μm滤膜,测定滤液DOC浓度和吸光值。
试验过程:参考Feng等[17]的方法,采用批量吸附平衡法,将DOC溶液浓度用去离子水稀释至100、200、300、450和600 mg/L,用HCl和NaOH调节pH至4,DOC的浓度以实测值为准(分别为101、201、304、448和605 mg/L)。称取0.400 0 g 过30目筛的风干土样,置于50 mL离心管中,同时加入40.00 mL DOC溶液,拧紧盖子,在25 ℃,180 r/min条件下水平振荡24 h,振荡结束后将混合溶液离心,上清液过0.45 μm滤膜,得到吸附平衡后的待测DOC溶液。在50 mL离心管中,加入40.00 mL不含DOC的去离子水,同时加入0.400 0 g 过30目筛的风干土样,其他条件与上述实验一致,作为对照。在进行pH 6和pH 8条件处理时,试验操作中与上述过程不同的是用HCl和NaOH分别调节pH至6和8,其他试验操作和条件均与上述过程完全一致。根据DOC的添加量与吸附平衡后溶液中DOC的含量之差,扣除空白,计算土壤对DOC的吸附量。
所有解吸试验均在吸附试验结束后马上进行,移除上清液后,往离心管里加入解吸溶液40.00 mL,其他条件保持与吸附试验完全一致,在25 ℃,180 r/min条件下,振荡24 h,振荡结束后将混合溶液离心,上清液过0.45 μm滤膜后得到解吸平衡后的待测DOC溶液。根据解吸平衡后溶液中DOC的含量,扣除空白,计算土壤对DOC的解吸量。
1.4 DOC等温吸附-解吸量测定方法
初始DOC浓度及吸附平衡后DOC浓度的测定:由于DOC浓度偏高,超过标准碳工作曲线(0、20、40、60、80和100 mg/L),需稀释更高倍数,故取5 mL DOC溶液于40 mL的样品瓶中,加入25 mL 50 g/L的六偏磷酸钠溶液(已调节pH 2.0),用封口膜封口,颠倒混匀,上岛津-总有机碳分析仪(TOC-VWP)进行测定。
解吸平衡后DOC溶液浓度的测定:取15 mL DOC溶液于40 mL的样品瓶中,加入15 mL 50 g/L的六偏磷酸钠溶液,用封口膜封口,颠倒混匀,上岛津-总有机碳分析仪进行测定。
吸光度的测定:将DOC溶液浓度统一稀释至10 mg/L,使用紫外可见分光光度计(L6020060)在波长254 nm、260 nm、272 nm和280 nm处进行测定,用其单位吸光度值(吸光度值与DOC含量的比值)表征DOC芳香性和疏水性组分[18-22]。
1.5 数据处理与统计分析
土壤对DOC的吸附量的计算方法为:Qe=(C1-Ce+C0)·V/m式中:Qe为吸附量(mg/g);C1为DOC初始浓度(mg/L); Ce为吸附平衡时浓度(mg/L);C0为加入等体积去离子水(对照组)吸附平衡时浓度(mg/L);V为溶液体积(L);m为吸附剂烘干基质量(g)。
土壤对DOC的解吸量的计算方法为:

式中:Qd为解吸量(mg/g);Cd为解吸平衡时浓度(mg/L)。
常用的吸附平衡模型有IM isotherm方程(1)、Freundlich方程(2)、Langmuir方程(3)、Temkin方程(4)等[23-24]。因此,采用这4种数学模型对土壤的吸附等温线进行拟合:

式中:Qe为平衡时土壤吸附或释放DOC量(mg/g);k为回归系数(土-水体系中被土壤吸附DOC所占比例,该值常在0-1之间);C为土-水体系中以土壤质量为基础的DOC初始浓度(mg/g);b为截距(无DOC加入时土壤释放的DOC量,mg/g)。

式中:kF为与吸附容量和吸附强度有关的常数;n 为Freundlich平衡参数,表示吸附强度。

式中:Qm为最大吸附容量(mg/g);kL为Langmuir平衡参数。

式中:A、B为拟合常数。
DOC单位吸光度值的变化率的计算公式为:
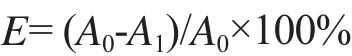
式中:E为单位吸光度值的变化率(%);A0为吸附前单位吸光度值;A1为吸附后单位吸光度值。
利用SPSS 18.0和origin 8.5软件对各处理之间相关指标的差异显著性进行统计分析、作图。
2 结果与分析
2.1 DOC的等温吸附特征
在25 ℃条件下,随着DOC初始浓度的增加,旱地土壤在pH4、pH6和pH8条件处理下对DOC的平均吸附量分别为4.90、2.98和8.86 mg/g,水田土壤在pH4、pH6和pH8条件处理下对DOC的平均吸附量分别为4.12、3.10和8.90 mg/g(图1),表明初始浓度明显影响着DOC在土壤上的吸附反应。在各反应条件下,土壤对DOC的吸附量的增加趋势虽然逐渐趋于平缓,但仍处于上升阶段,说明土壤的吸附位点尚未达到饱和。两种土壤中DOC的吸附对pH的响应趋势一致,均为pH8>pH4>pH6。不同土壤在相同pH条件下,吸附量差异不显著(P>0.05);但同一土壤在不同pH条件下,吸附量差异显著(P<0.05)。
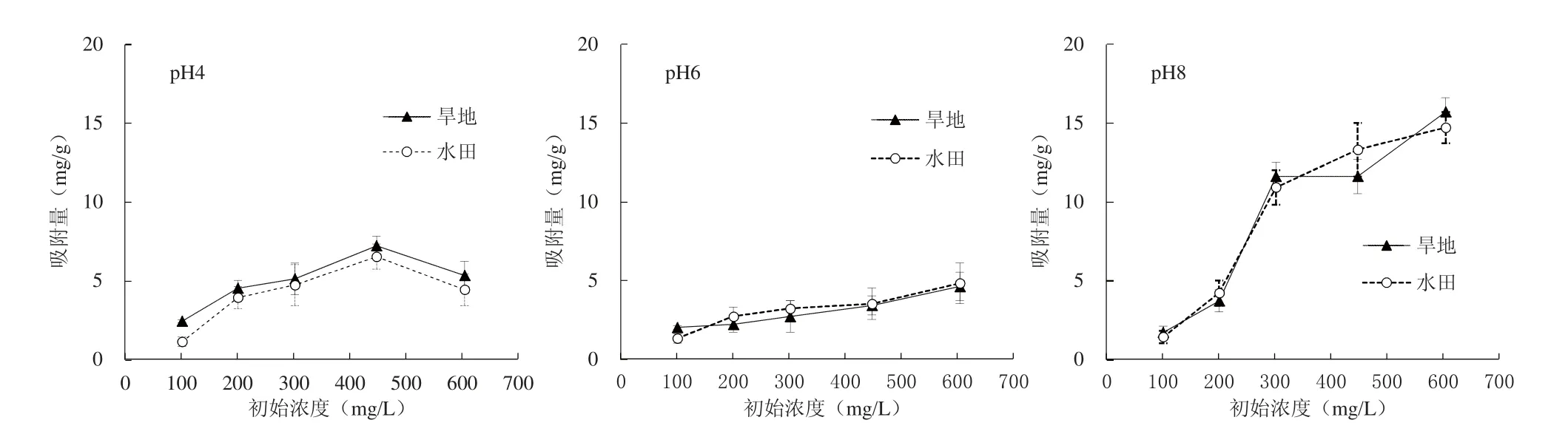
图1 不同pH条件下DOC的等温吸附线Fig. 1 The adsorption isotherm of DOC under defferent pH
为进一步探究土壤对DOC的吸附特征,故分别利用IM isotherm方程、Freundlich方程、Langmuir方程和Temkin方程对试验结果进行拟合。在pH4条件下,Langmuir方程对旱地土壤和水田土壤DOC吸附的拟合效果较好,决定系数R2分别为0.641 和0.478,IM isotherm方程拟合结果最差(表2)。在pH6和pH8条件下,IM isotherm方程对旱地土壤和水田土壤吸附DOC的拟合效果较好,决定系数R2在0.652-0.862之间。用Temkin方程预测的吸附量小于实际测量值,低估了土壤对DOC的吸附量;选择Freundlich方程和IM isotherm方程预测的吸附量随初始浓度增大而增加,不会出现吸附饱和情况;用Langmuir方程预测的吸附量先线性增加后趋于饱和,能预测土壤对DOC的最大吸附容量。据此可推测,在pH4条件下,旱地和水田土壤对DOC的最大吸附容量分别为8.214和7.080 mg/g。
2.2 DOC的等温解吸特征
pH4条件下,旱地和水田土壤对DOC的解吸量显著高于pH6和pH8(图2,P<0.05),随pH升高,两种土壤对DOC的解吸量均有降低趋势。在pH4条件下,水田土壤的解吸量显著大于旱地土壤(P<0.05)。在pH6条件下,初始浓度低于450 mg/L时,两种土壤的解吸量差异不显著(P>0.05);但初始DOC浓度更高时,水田土壤的解吸量显著大于旱地土壤(P<0.05)。在pH8条件下,两种土壤的解吸量差异不显著,变化趋势基本一致。

表2 DOC等温吸附方程参数和相关系数Table 2 Parameters and correlation coeff cients of adsorption isotherm equations of DOC

图2 不同pH条件下DOC的等温解吸量Fig. 2 The quantities of isothermal desorption of DOC under defferent pH
DOC的吸附量和解吸量、净吸附量(即吸附量减去解吸量)之间的关系见表3。吸附量与净吸附量呈线性正相关关系,决定系数R2在0.988-0.999之间,与解吸量的线性关系较差。在吸附量与净吸附量的线性回归方程中,斜率表示DOC被土壤净吸附的能力,同等条件下,斜率越大,土壤对DOC的净吸附能力越强,两种土壤对DOC的净吸附能力均为pH4<pH6<pH8。此外,本次试验还进一步对旱地和水田土壤在相同pH条件下的净吸附量的数据(未列出)进行了单因素统计分析,发现在pH4时旱地土壤对DOC的净吸附量显著大于水田土壤(F=4.379,P=0.045),两种土壤在pH6时(F=0.513,P=0.479)和pH8时(F=0.017,P=0.897)的净吸附量差异不显著。
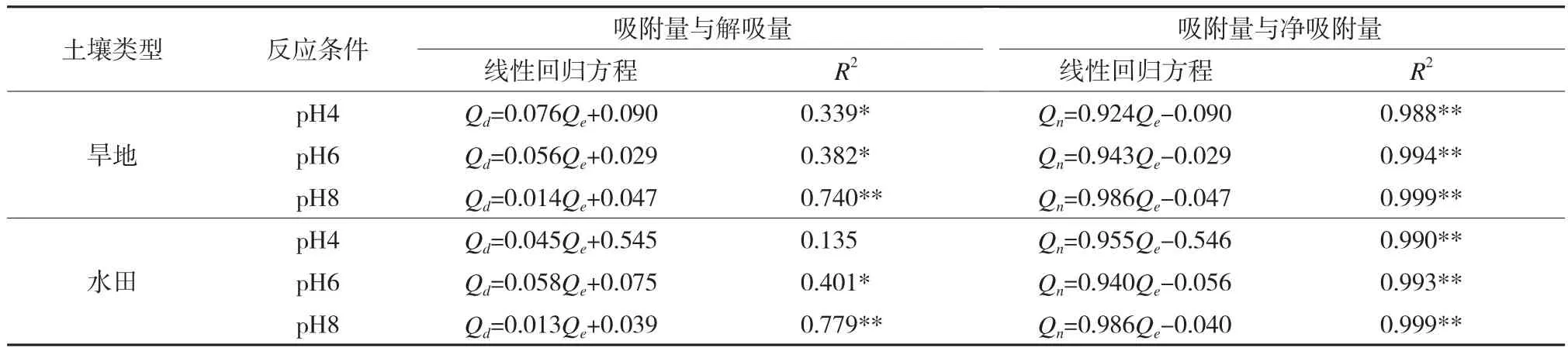
表3 DOC吸附量与解吸量、净吸附量间的关系Table 3 Relationship between the quantity of DOC adsorption and desorption or net adsorption
2.3 吸附对DOC芳香性、疏水性组分的影响
土壤吸附平衡后,DOC溶液在4个波长下的单位吸光度值:E254、E260、E272和E280的变化情况见表4。结果显示,吸附平衡后DOC的E254、E260、E272和E280值与初始值比较均有减小。在同一DOC浓度下,单位吸光度值的减少基本上随pH升高而降低。统计分析表明,旱地土壤吸附后,DOC在同一波长下的单位吸光度值的变化率在pH4和pH6时均显著大于pH8(P<0.05),并且在pH4时的变化率大于pH6(P>0.05)。水田土壤吸附后,DOC在同一波长下的单位吸光度值的变化率在3个pH之间均有显著差异(P<0.05),并且随pH增加而降低。在同一pH条件下,旱地和水田土壤在相同波长下的单位吸光度值的变化率虽有差异,但均未达到显著水平。
研究表明,E254与可溶性有机质中芳香性部分所占比例成正比;E260与疏水性有机质所占比例成正比;E272与芳香性有机质所占比例和C/H比成正比;E280与芳香性有机质所占比例和平均分子量成正比,与可矿化分解部分成反比[18-22]。DOC的芳香性、C/H比及疏水性往往可以通过上述的光谱特征来表征,吸附平衡后,DOC溶液的E254、E260、E272和E280的变化率越大,表示其芳香性、疏水性和大分子组分在DOC平衡溶液中所占比例变化越大,被土壤吸附固定部分的比例越大。酸性条件有利于芳香性、疏水性和大分子组分在土壤上的吸附。
3 讨论
3.1 DOC等温吸附解吸过程的差异
pH是影响土壤 DOC吸附-解吸的主要因素之一[25]。本文研究发现,旱地和水田两种土壤在相同pH条件下对DOC吸附的差异不显著,但同一土壤在不同pH条件下对DOC的吸附有显著差异。对于来源于同一母质、且地理位置相近的水田和旱地土壤而言,DOC的吸附量受土壤类型的影响较小,但受到pH的影响强烈,这可能与两种土壤阳离子交换量(CEC)和比表面积(SSA)接近有关[16, 26]。
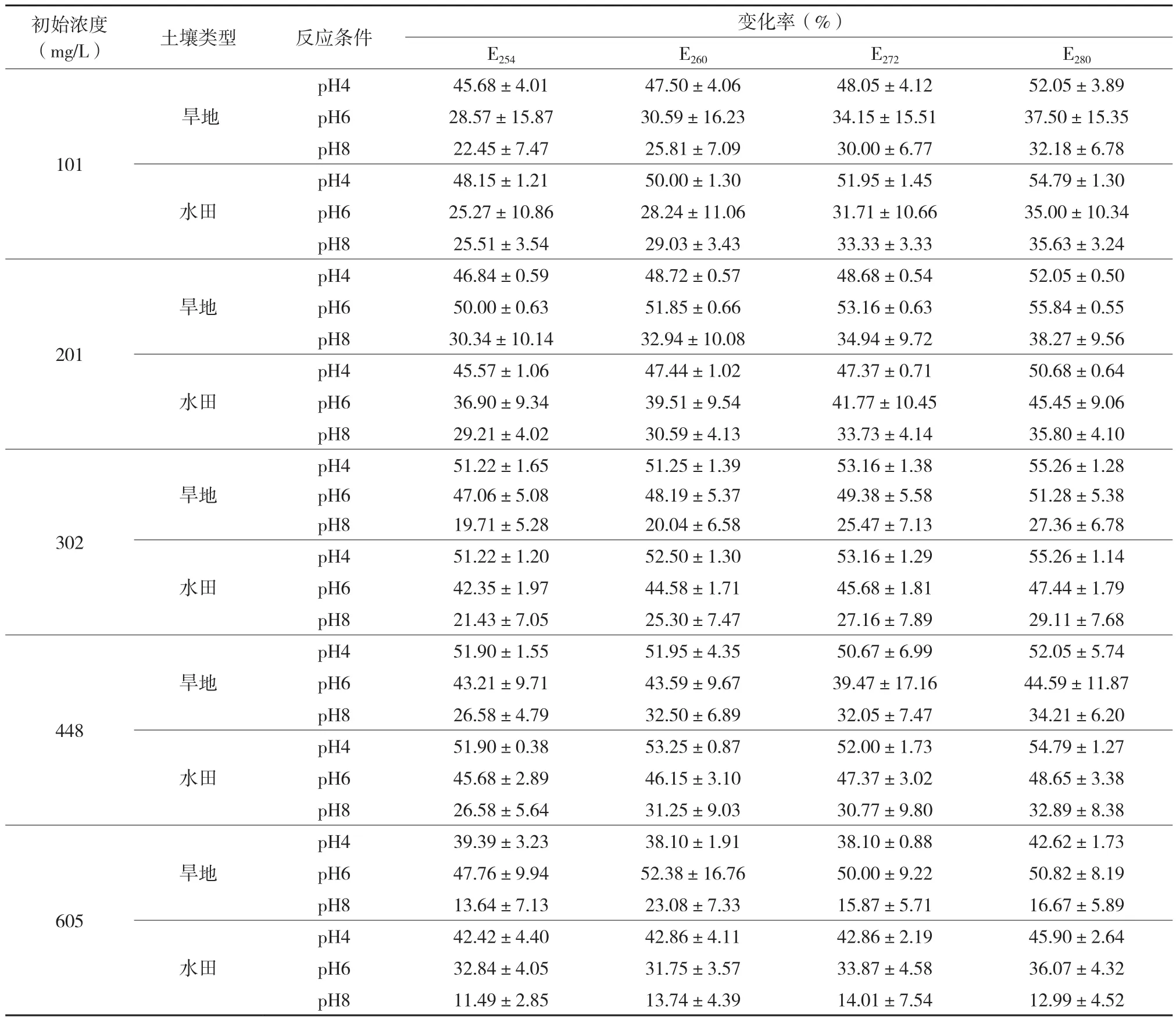
表4 吸附前后DOC溶液单位吸光度值的变化Table 4 The changes of unit absorbance values of DOC solution before and after adsorption
大部分红壤的pH一般在5.0左右,等电点在pH 3.04-3.72之间[27]。已有研究认为,在酸性条件下pH对DOC吸附的影响不显著[13];但也有研究表明,酸性条件下,DOC吸附量随pH增加而降低[28-29]。本文结果显示,酸性条件下,两种土壤对DOC的吸附量pH4显著高于pH6。这可能是因为较低pH条件下,红壤的可变电荷增加,促使了极性DOC的吸附,但这种静电引力吸附并不稳定,容易发生解吸[30];另一种可能是在DOC-土壤体系中,DOC分子官能团上离子化的羧基和质子化的酚基与粘土矿物表面羟基通过配位交换与土壤表面结合,结果有利于吸附[31]。
碱性条件下,DOC的有机物官能团去质子化,DOC与土壤中稳定性多价阳离子结合位点的可利用性增加[32]。研究表明,在低pH 条件下大分子量组分会优先被部分土壤矿物表面吸附,高pH条件下中等分子量组分被吸附[33]。本文结果表明,碱性条件下的DOC吸附量大于酸性条件,其芳香性、疏水性和大分子组分的变化率却是小于酸性条件。这说明吸附平衡后,DOC含量与组成的改变可能是由土壤吸附非芳香性、亲水性和中小分子组分引起的。
DOC在土壤上的解吸量与吸附量变化规律不一致,解吸量随pH升高而降低。结合吸附量和解吸量分析表明,在pH4时土壤对DOC的净吸附量旱地显著大于水田,在pH6和pH8时两种土壤对DOC的净吸附量差异均不显著。红壤区旱地和水田土壤多呈酸性,这可能是造成红壤区旱地和水田土壤DOC含量差异的主要原因之一。在pH4时,经Langmuir方程预测得到的最大吸附容量均显著大于两种土壤DOC实测值,说明田间条件下可能存在DOC不饱和现象,这种不饱和现象是否与土壤固持有机碳的机制有关,可能是今后关注的重点。
3.2 吸附对DOC组成的影响
研究表明,DOC的芳香族化合物、疏水性化合物及复杂大分子等一系列化学性质稳定的有机物优先被土壤吸附,不易解吸[34-35]。本试验中两种土壤对DOC中芳香性组分、疏水性组分的吸附能力随pH增加而降低,这可能与DOC分子的组成、结构及官能团的种类、数量等性质密切相关。在DOC-土壤体系中,pH降低,DOC中分子的酸性官能团质子化程度越高,疏水性增强,DOC与土壤粘土矿物的静电排斥作用也随之减弱,有利于离子化的羧基和质子化的酚基与土壤表面羟基通过配位交换与土壤表面结合;且少部分的非离子化的官能团(R-COOH,酚羟基或烯醇R-OH)也可与土壤表面通过疏水作用及氢键结合[30]。同一pH条件下,两种土壤在同一紫外波长下单位吸光度值的变化率虽有差异,但均未达到显著水平。两种土壤对DOC中芳香性、疏水性组分的吸附能力受土壤类型的影响较小,这可能与两种土壤的CEC和SSA差异较小有关。DOC分子与土壤粘土矿物的吸附包括物理吸附和化学吸附两种机制,化学吸附又包含氢键结合、阳离子架桥、离子结合、配位体交换表面络合等,是土壤固定有机碳的最主要方式,被固定的有机碳生物降解性大大降低,利于有机碳的贮存[36]。
4 结论
研究表明,DOC的吸附量受到两种土壤类型的影响较小,但受到pH的影响强烈,旱地和水田土壤对DOC的吸附量均为pH8>pH4>pH6。土壤对DOC吸附方程拟合效果受pH影响显著。在pH4条件下,Langmuir方程对旱地和水田土壤吸附DOC的拟合效果较好;在pH6和pH8条件下,IM isotherm方程对旱地土壤和水田土壤吸附DOC的拟合效果较好。
根据两种土壤吸附平衡后DOC溶液的单位吸光度值判断,两种土壤对DOC中芳香性、疏水性组分的吸附能力受土壤类型的影响较小,但随pH增加而降低。酸性条件下(pH4),旱地土壤净吸附量显著大于水田土壤,更有利于DOC的吸附,但在pH6和pH8时两种土壤间的净吸附量差异不显著。红壤区旱地和水田土壤多呈酸性,这可能是造成红壤区旱地和水田土壤DOC含量差异的重要原因之一。
[1] Kaiser K, Zech W. Competitive sorption of dissolved organic matter fractions to soils and related mineral phases[J]. Soil Science Society of America Journal, 1997, 61(1): 64-69.
[2] Kalbitz K, Solinger S, Park J H, et al. Controls on the dynamics of dissolved organic matter in soils: A review[J]. Soil Science, 2000, 165(4): 277-304.
[3] 李睿, 屈明. 土壤溶解性有机质的生态环境效应[J]. 生态环境, 2004, 13(2): 271-275. Li R, Qu M. Effects of dissolved organic matter on environment[J]. Ecology and Environment, 2004, 13(2): 271-275.
[4] 陈香碧, 王嫒华, 胡乐宁, 等. 红壤丘陵区水田和旱地土壤可溶性有机碳矿化对水分的响应[J]. 应用生态学报, 2014, 25(3): 752-758. Chen X B, Wang A H, Hu L N, et al. Response of mineralization of dissolved organic carbon to soil moisture in paddy and upland soils in hilly red soil region[J]. Chinese Journal of Applied Ecology, 2014, 25(3): 752-758.
[5] 王美丽, 李军, 朱兆洲, 等. 土壤溶解性有机质的研究进展[J].矿物岩石地球化学通报, 2010(3): 304-310. Wang M L, Li J, Zhu Z Z, et al. Advances in research on dissolved organic matter in soils[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2010(3): 304-310.
[6] 简燕, 葛体达, 吴小红, 等. 稻田与旱地土壤自养微生物同化碳在土壤中的矿化与转化特征[J]. 应用生态学报, 2014, 25(6): 1708-1714. Jian Y, Ge T D, Wu X H, et al. Characteristics of the mineralization and transformation of autotrophic microbes-assimilated carbon in upland and paddy soils[J]. Chinese Journal of Applied Ecology, 2014, 25(6): 1708-1714.
[7] 刘长红, 袁野, 杨君, 等. 稻田改为旱地后土壤有机碳矿化及微生物群落结构的变化[J]. 应用与环境生物学报, 2015, 21(5): 960-966. Liu C H, Yuan Y, Yang J, et al. Variation in soil organic carbon mineralization and microbial community structure induced by the conversion from double rice fields to drained fields[J]. Chinese Journal of Applied and Environmental Biology, 2015, 21(5): 960-966.
[8] 李太魁, 朱波, 王小国, 等. 土地利用方式对土壤活性有机碳含量影响的初步研究[J]. 土壤通报, 2013, 44(1): 46-51. Li T K, Zhu B, Wang X G, et al. Effects of land use on the contents of soil active organic carbon[J]. Chinese Journal of Soil Science, 2013, 44(1): 46-51.
[9] 聂三安, 葛体达, 肖和艾, 等. 光照与黑暗培养对亚热带区稻田及旱地土壤有机碳及其活性组分的影响[J]. 土壤通报, 2012, 43(1): 93-97. Nie S A, Ge T D, Xiao H A, et al. Influences of illumination and unillumination incubation on soil organic carbon and active organic carbon content from paddy and upland soil of subtropical regions[J]. Chinese Journal of Soil Science, 2012, 43(1): 93-97.
[10] Oren A, Chefetz B. Sorptive and desorptive fractionation of dissolved organic matter by mineral soil matrices[J]. Journal of Environmental Quality, 2012, 41(2): 526-533.
[11] Kothawala D N, Roehm C, Blodau C, et al. Selective adsorption of dissolved organic matter to mineral soils[J]. Geoderma, 2012, 189: 334-342.
[12] 李太魁, 王小国, 朱波, 等. 紫色土可溶性有机碳的吸附-解吸特征[J]. 农业环境科学学报, 2012, 31(4): 721-727. Li T K, Wang X G, Zhu B, et al. Adsorption and desorption characteristics of dissolved organic carbon (DOC) on the purple soils[J]. Journal of Agro-Environment Science, 2012, 31(4): 721-727.
[13] Kaiser K, Guggenberger G. The role of DOM sorption to mineral surfaces in the preservation of organic matter in soils[J]. Organic Geochemistry, 2000, 31(7/8): 711-725.
[14] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. Bao S D. Soil Agricultural Chemistry Analysis[M]. Beijing: China Agriculture Press, 2000.
[15] Chen X B, Wang A H, Li Y, et al. Fate of14C-labeled dissolved organic matter in paddy and upland soils in responding to moisture[J]. Science of the Total Environment, 2014, 488: 268-274.
[16] Kahle M, Kleber M, Jahn R. Retention of dissolved organic matter by phyllosilicate and soil clay fractions in relation to mineral properties[J]. Organic Geochemistry, 2004, 35(3): 269-276.
[17] Feng W T, Plante A F, Aufdenkampe A K, et al. Soil organic matter stability in organo-mineral complexes as a function of increasing C loading[J]. Soil Biology and Biochemistry, 2014, 69: 398-405.
[18] Traina S J, Novak J, Smeck N E. An ultraviolet absorbance method of estimating the percent aromatic carbon content of humic acids[J]. Journal of Environmental Quality, 1990, 19(1): 151-153.
[19] Peuravuori J, Pihlaja K. Molecular size distribution and spectroscopic properties of aquatic humic substances[J]. Analytica Chimica Acta, 1997, 337(2): 133-149.
[20] Dilling J, Kaiser K. Estimation of the hydrophobic fraction of dissolved organic matter in water samples using UV photometry[J]. Water Research, 2002, 36(20): 5037-5044.
[21] Croué J P, Benedetti M F, Violleau D, et al. Characterization and copper binding of humic and nonhumic organic matter isolated from the south Platte River: Evidence for the presence of nitrogenous binding site[J]. Environmental Science and Technology, 2003, 37(2): 328-336.
[22] Kalbitz K, Schmerwitz J, Schwesig D, et al. Biodegradation of soil-derived dissolved organic matter as related to its properties[J]. Geoderma, 2003, 113(3/4): 273-291.
[23] Vandenbruwane J, De Neve S, Qualls R G, et al. Comparison of different isotherm models for dissolved organic carbon (DOC) and nitrogen (DON) sorption to mineral soil[J]. Geoderma, 2007, 139(1): 144-153.
[24] 赵满兴, 周建斌, 延志莲. 不同土层土壤对可溶性有机氮, 碳的吸附特性研究[J]. 土壤通报, 2010, 41(6): 1328-1332. Zhao M X, Zhou J B, Yan Z L. Adsorption characteristics of soluble organic carbon and nitrogen in different layer of cultivated soils[J]. Chinese Journal of Soil Science, 2010, 41(6): 1328-1332.
[25] Mari M S, Sanderman J, Chittleborough D J, et al. Sorption of dissolved organic matter in salt-affected soils: Effect of salinity, sodicity and texture[J]. Science of the Total Environment, 2012, 435: 337-344.
[26] Kaiser K, Guggenberger G, Zech W. Sorption of DOM and DOM fractions to forest soils[J]. Geoderma, 1996, 74(3/4): 281-303.
[27] 陈铭, 刘更另. 湘南第四纪红壤的粘粒矿物组成, 肥力特点与表面化学性质[J]. 中国农业科学, 1994, 27(2): 24-30. Chen M, Liu G L. Clay mineral composition, soil fertility and surface chemistry characteristics of quaternary red soils in southern Hunan Province[J]. Scientia Agricultural Sinica, 1994, 27(2): 24-30.
[28] Mayes M A, Heal K R, Brandt C C, et al. Relation between soil order and sorption of dissolved organic carbon in temperate subsoils[J]. Soil Science Society of America Journal, 2012, 76(3): 1027-1037.
[29] 俞元春, 何晟, 李炳凯, 等. 杉林土壤溶解有机碳吸附及影响因素分析[J]. 南京林业大学学报(自然科学版), 2005, 129(2): 15-18. Yu Y C, He S, Li B K, et al. The dissolved organic carbon (DOC) adsorption and its influence factor on the soil of Chinese fir plantation[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2005, 129(2): 15-18.
[30] Andersson S, Nilsson S I, Saetre P. Leaching of dissolved organic carbon (DOC) and dissolved organic nitrogen (DON) in mor humus as affected by temperature and pH[J]. Soil Biology and Biochemistry, 2000, 32(1): 1-10.
[31] 李爱民, 冉炜, 代静玉. 天然有机质与矿物间的吸附及其环境效应的研究进展[J]. 岩石矿物学杂志, 2005, 24(6): 671-680. Li A M, Ran W, Dai J Y. Advances in the study of adsorption of natural organic material on minerals and its environmental effects[J]. Acta Petrologica Et Mineralogica, 2005, 24(6): 671-680.
[32] Whittinghill K A, Hobbie S E. Effects of pH and calcium on soil organic matter dynamics in Alaskan tundra[J]. Biogeochemistry, 2012, 111(1): 569-581.
[33] Zhou Q, Maurice P A, Cabaniss S E. Size fractionation upon adsorption of fulvic acid on goethite: Equilibrium and kinetic studies[J]. Geochimica et Cosmochimica Acta, 2001, 65(5): 803-812.
[34] Jagadamma S, Maye M A, Zinn Y L. Sorption of organic carbon compounds to the fi ne fraction of surface and subsurface soils[J]. Geoderma, 2014, 213: 79-86.
[35] Scott E E, Rothstein D E. The dynamic exchange of dissolved organic matter percolating through six diverse soils[J]. Soil Biology and Biochemistry, 2014, 69: 83-92.
[36] 黄倩, 吴靖霆, 陈杰, 等. 土壤吸附可溶性有机碳研究进展[J].土壤, 2015, 47(3): 446-452. Huang Q, Wu J T, Chen J, et al. Adsorption of dissolved organic carbon (DOC) on soil: A review[J]. Soils, 2015, 47(3): 446-452.
(责任编辑:童成立)
Response of adsorption and desorption between upland and paddy soils and dissolved organic carbon to pH
LIANG Cheng-ming1, 2,ZHENG Xiao-dong2,XU Xue-chi2,CHEN Xiang-bi2,HU Ya-jun2,LIANG Shi-chu1,SU Yi-rong2
(1. College of Life Science, Guangxi Normal University, Guilin, Guangxi, 541004, China; 2. Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha, Hunan 410125, China)
In order to reveal the infl uence of pH on DOC adsorption and desorption in farmland soil, the upland soil and paddy soil in subtropical red soil region was investigated in this paper. The experiment of DOC adsorption and desorption of two soils was investigated at pH 4, pH 6 and pH 8 treatments. The parameters of DOC adsorption and desorption in soils under different pH were calculated. The response of DOC adsorption and desorption to pH and the change of the components of DOC were explain after adsorption. The results showed that the adsorption capacity of DOC in the same soil was signifi cantly different (P<0.05) under the conditions of pH 4, pH 6 and pH 8. With the increase of the initial concentration of DOC, the average amounts of DOC adsorption were 4.90, 2.98 and 8.86 mg/g respectively at pH 4, pH 6 and pH 8 in upland soil, and were 4.12, 3.10 and 8.90 mg/g respectively in paddy soil. The fi tting effect of equation of DOC adsorption was signifi cantly affected by the pH. The change rate of unit absorbance value of E254, E260, E272and E280of DOC which express aromatic, hydrophobic component of DOC decreased with the increase of pH in adsorption equilibrium solution. The adsorption capacity of aromatic and hydrophobic components of DOC was slightly affected by soil type and strongly affected by the pH. The desorption capacity of DOC decreased with the increase of pH in two types of soil. The net adsorption amount of DOC on upland soil was signifi cantly higher than that on paddy soil in acidic condition (pH 4), but no signifi cant difference between the two types of soil at pH 6 and pH 8.The upland and paddy soils of red soil region were mostly acidic, which may be one of the primary causes for DOC content discrepancy in two types of farmland soil of red soil region.
dissolved organic carbon; adsorption; desorption; pH; upland soil; paddy soil
S153
A
1000-0275(2017)03-0536-08
10.13872/j.1000-0275.2017.0024
梁承明, 郑小东, 徐学池, 陈香碧, 胡亚军, 梁士楚, 苏以荣. 旱地和水田土壤DOC吸附-解吸对pH的响应[J]. 农业现代化研究, 2017, 38(3): 536-543.
Liang C M, Zheng X D, Xu X C, Chen X B, Hu Y J, Liang S C, Su Y R. Response of adsorption and desorption between upland and paddy soils and dissolved organic carbon to pH[J]. Research of Agricultural Modernization, 2017, 38(3): 536-543.
国家自然科学基金项目(41471199);国家重点研发计划项目(2016YFD0200106-5)。
梁承明(1990- ),男,硕士研究生,主要从事土壤养分循环与环境生态研究,E-mail: liangchengmingisa@163.com;通讯作者:苏以荣(1962-),男,研究员,主要从事土壤生态与植物营养调控研究,E-mail: yrsu@isa.ac.cn。
2017-02-13,接受日期:2017-03-23
Foundation itteemm:: National Natural Science Foundation of China (41471199); National Key Basic Research Program of China (2016YFD0200106-5).
Corresponding authhoorr:: SU Yi-rong, E-mail: yrsu@isa.ac.cn.
Receeiivveedd 13 February, 2017; Acceepptteedd 23 March, 2017
