大麻制剂HU210对实验性急性胰腺炎的干预作用及其与Toll样受体4信号通路的可能关系*
2017-06-24张瑞琴林思思李永渝
张瑞琴, 林思思, 李 敏, 沈 利, 李 琨, 李永渝△
(1同济大学医学院病理生理教研室,消化系统疾病研究所,上海 200092; 2山西医科大学第二医院西院病理科,山西 太原 030053; 3遵义医药高等专科学校生理教研室,贵州 遵义 563000; 4同济大学医学院病原生物教研室,上海 200092)
大麻制剂HU210对实验性急性胰腺炎的干预作用及其与Toll样受体4信号通路的可能关系*
张瑞琴1,2, 林思思1, 李 敏3, 沈 利4, 李 琨1, 李永渝1△
(1同济大学医学院病理生理教研室,消化系统疾病研究所,上海 200092;2山西医科大学第二医院西院病理科,山西 太原 030053;3遵义医药高等专科学校生理教研室,贵州 遵义 563000;4同济大学医学院病原生物教研室,上海 200092)
目的: 研究大麻类制剂HU210对雨蛙肽(caerulein,CAE)诱导的野生型(wild-type,WT)和Toll样受体4基因敲除(tlr4-/-)小鼠急性胰腺炎(acute pancreatitis,AP)的干预作用,并探讨其作用机制。方法: 将成年C57BL/10J小鼠及相同背景的tlr4-/-小鼠各随机分成3组: AP组、AP+HU210组及正常对照组。小鼠腹腔注射CAE(50 μg·kg-1·h-1)6次及脂多糖(10 mg/kg)1次复制AP模型;AP+HU210组在造模前及造模后各腹腔注射1次HU210(50 μg/kg);对照组注射生理盐水替代CAE和脂多糖。造模处理后3 h,取血处死小鼠,取胰腺、肺组织及肠道Peyer’s结。结果: 与对照组相比,无论在WT或tlr4-/-小鼠,AP造模后胰腺病理评分,血浆淀粉酶活性,血浆IL-6、TNF-α及MCP-1水平,以及肺MPO活性均明显升高(P<0.05),P38蛋白表达明显上调(P<0.05)。同时,AP造模后,与WT小鼠相比,tlr4-/-小鼠血浆IL-6、TNF-α及MCP-1水平,以及胰腺P38及p-P38蛋白表达均明显降低(P<0.05),Peyer’s结CD3+、CD4+T淋巴细胞百分比及CD4+/CD8+比值明显降低(P<0.05)。 HU210干预使2种小鼠AP模型的胰腺病理学评分和肺MPO活性的升高明显得到改善(P<0.05);在WT小鼠,而非tlr4-/-小鼠,AP引起的血浆淀粉酶活性和胰腺P38及p-P38蛋白表达的变化在HU210干预后明显逆转(P<0.05)。结论: TLR4主要参与AP全身炎症反应,其机制可能依赖TLR4-P38 MAPK信号通路;大麻制剂HU210对AP的干预主要通过抑制炎症细胞的浸润发挥组织保护作用,与TLR4信号通路的关系似乎不明显。
急性胰腺炎; 大麻素类; Toll样受体4; 炎症介质
急性胰腺炎(acute pancreatitis,AP)是发生在胰腺的一种常见的炎症性疾病,多数患者的病变局限于胰腺及胰腺周围组织,约20%的患者由于并发全身性炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),导致该疾病死亡率高达30%[1]。AP的发病机制涉及到多因素、多环节,已有的学说包括“胰酶自身消化学说”、“炎症因子学说”、“氧化应激学说”、“肠道细菌移位学说”等等[2]。其中,大量研究关注到疾病发病过程中多种炎症因子的作用,有大量研究表明,白细胞介素6(interleukin 6, IL-6)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)及单核细胞趋化蛋白1(monocyte chemotactic protein-1, MCP-1)等炎症因子参与AP发生发展,与AP引起的并发症有着密切的联系[3]。研究还揭示,多条细胞信号通路涉及AP的炎症反应,其中包括Toll样受体4(Toll-like receptor 4, TLR4)信号通路,这些通路的激活参与了AP时促炎细胞因子的产生和释放以及炎症的扩布[4-5]。
大麻类物质用于治疗炎症性疾病已有上千年的历史,由于中枢神经的副作用使其应用受到限制。近20年来,随着内源性大麻系统被发现、人工合成大麻制剂的问世及对AP发病机制认识的不断深入,使得人们将目光关注到此类制剂在临床治疗上的可能性和有效性。本实验在课题组前期研究的基础上,选用人工合成的大麻制剂HU210,用野生型(wild-type, WT)和tlr4基因敲除(tlr4-/-)小鼠,通过对胰腺组织病理评分、胰酶活性、炎症细胞因子和趋化因子水平以及肠道Peyer’s 结T淋巴细胞亚群的检测,进一步探讨AP的发病机制和HU210对AP的作用及其机制。
材 料 和 方 法
1 材料
1.1 动物 成年tlr4-/-小鼠及其相同背景的C57BL/10J野生型小鼠各24只,体重25~30 g,雌雄各半,购自南京大学实验动物中心。动物处于温度(23±2)℃、湿度(50~60)%环境中,给予标准饮食、自由饮水喂养。
1.2 主要试剂及药物 雨蛙肽(caerulein, CAE)及脂多糖(lipopolysaccharide, LPS)购自Sigma;HU210购自Tocris Bioscience,使用时溶于溶剂(无水乙醇∶Tween 80∶生理盐水=1∶1∶18);淀粉酶和髓过氧化物酶(myeloperoxidase, MPO)试剂盒购自南京建成生物工程研究所;TNF-α和IL-6试剂盒购自R&D Systems;MCP-1试剂盒购自深圳达科为生物技术公司;免疫组化抗体(P38α多克隆抗体和p-P38多克隆抗体)购自CST;流式抗体(CD3-PerCP、CD4-FITC和CD8-PE抗体)购自BioLegend。
2 方法
2.1 AP模型构建及分组 实验前小鼠禁食不禁水12 h,参照Ding等[6]的方法复制AP模型。WT和tlr4-/-小鼠随机各分为3组,每组8只:(1)AP组,小鼠腹腔注射雨蛙肽50 μg/kg,每小时1次,连续注射6次,末次加注脂多糖10 mg/kg;(2)AP+HU210组,AP造模方法同前,在造模前及造模后用HU210(50 μg/kg)腹腔注射各1次(AP组注射溶剂);(3)对照(control,CON)组使用相同次数和剂量的生理盐水替代雨蛙肽和脂多糖。末次腹腔注射后3 h将小鼠处死,收集血浆、胰腺、肺及肠道Peyer’s结。
2.2 胰腺组织病理学评估 将胰腺组织置入4%甲醛固定液过夜,再进行常规脱水、石蜡包埋、组织切片、HE染色。光学显微镜下观察胰腺组织病理改变,请专业病理医师阅片及评分(标准参照文献[7])。简言之,水肿评分如下:0,无水肿;1,小叶间水肿;2,腺泡肿胀,小叶间隙增大;3,明显小叶分隔。炎细胞浸润评分:0,无浸润;1,炎细胞浸润导管内;2,炎细胞浸润<50%;3,炎细胞浸润>50%。坏死评分:0,无坏死;1,点状坏死<5%;2,灶状坏死5%~20%;3,弥漫性坏死>20%。最后病理评分分值范围0~9。
2.3 血浆淀粉酶活性及炎症介质水平检测 放入抗凝管的血液离心取上清液。血浆淀粉酶按照生化试剂盒说明书操作。TNF-α、IL-6及MCP-1按照ELISA试剂盒产品说明书操作进行检测。
2.4 肺组织MPO活性检测 按照试剂盒说明书配成5%的肺组织匀浆,静置后取上清液按要求进行操作,计算单位组织湿重的MPO活性。
2.5 胰腺组织中P38及p-P38的蛋白表达 采用免疫组织化学法检测,石蜡切片脱蜡至水,使用染色试剂盒(Bioss)按要求操作,加P38α多克隆抗体(1∶40稀释)或p-P38多克隆抗体(1∶25稀释)4 ℃过夜,生物素标记山羊抗兔IgG抗体37 ℃孵育1 h,滴加辣根酶标记链霉卵白素工作液37 ℃孵育1 h,DAB(Boster)显色,20 min后苏木素复染,常规封片。使用Image-Pro Plus 6.0软件进行数据获取,结果以对照组的值为100%,AP组和AP+HU210组的值分别以相应对照组的百分比表示。
2.6 小肠Peyer’s结的T淋巴细胞亚群检测 参照李敏等[8]介绍的方法机械分离取小肠Peyer’s结,加入1 mL磷酸缓冲盐溶液(phosphate-buffered saline, PBS)碾磨后收集细胞悬液进行细胞计数。取10 μL 1×109/L细胞悬液血清封闭后加入100 μL荧光活化细胞分选缓冲液(fluorescence-activated cell sorting buffer, FACS buffer;由PBS、5%小牛血清和1%叠氮钠按照18∶1∶1配成)和0.5 μL CD3-PerCP、0.25 μL CD4-FITC、0.5 μL CD8-PE抗体混合液,剩余的细胞悬液混合后等量分装,血清封闭后分别单独加入FACS buffer及上述3种抗体之一,避光4 ℃孵育30 min。离心机设置1 500 r/min离心5 min,弃上清加200 μL PBS,转移至流式细胞管,流式细胞仪进行检测后使用FlowJo 7.6采集数据,结果以测得的细胞数占T淋巴细胞百分比表示。
3 统计学处理
数据用均数±标准差(mean±SD)或者均数±标准误(mean±SEM)表示,用SPSS 20.0软件进行统计分析。tlr4-/-或WT小鼠各组间分别进行单因素方差分析,若方差齐,用LSD法两两比较,若方差不齐,采用Kruskal-Wallis检验。观察两种小鼠AP组之间和AP+HU210组之间的差异,采用双因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 胰腺组织病理学的变化
光镜下,WT和tlr4-/-小鼠的正常胰腺组织腺泡细胞及导管排列紧密,AP造模后胰腺腺泡细胞坏死,间质明显水肿、出血及炎细胞浸润,病理学评分较对照组明显升高(P<0.01)。HU210干预使2种AP小鼠的胰腺组织水肿和炎细胞浸润程度明显减轻,病理学评分较各自AP组明显降低(P<0.01)。AP时胰腺组织病理学变化及HU210的干预效果在WT和tlr4-/-小鼠之间无明显差异,见图1A、B。
2 血浆淀粉酶活性的变化
如图1C所示,与对照组相比,AP组WT和tlr4-/-小鼠血浆淀粉酶活性显著升高(P<0.01);HU210干预后,WT小鼠血浆淀粉酶活性明显下降(P<0.05),tlr4-/-小鼠的变化不显著。
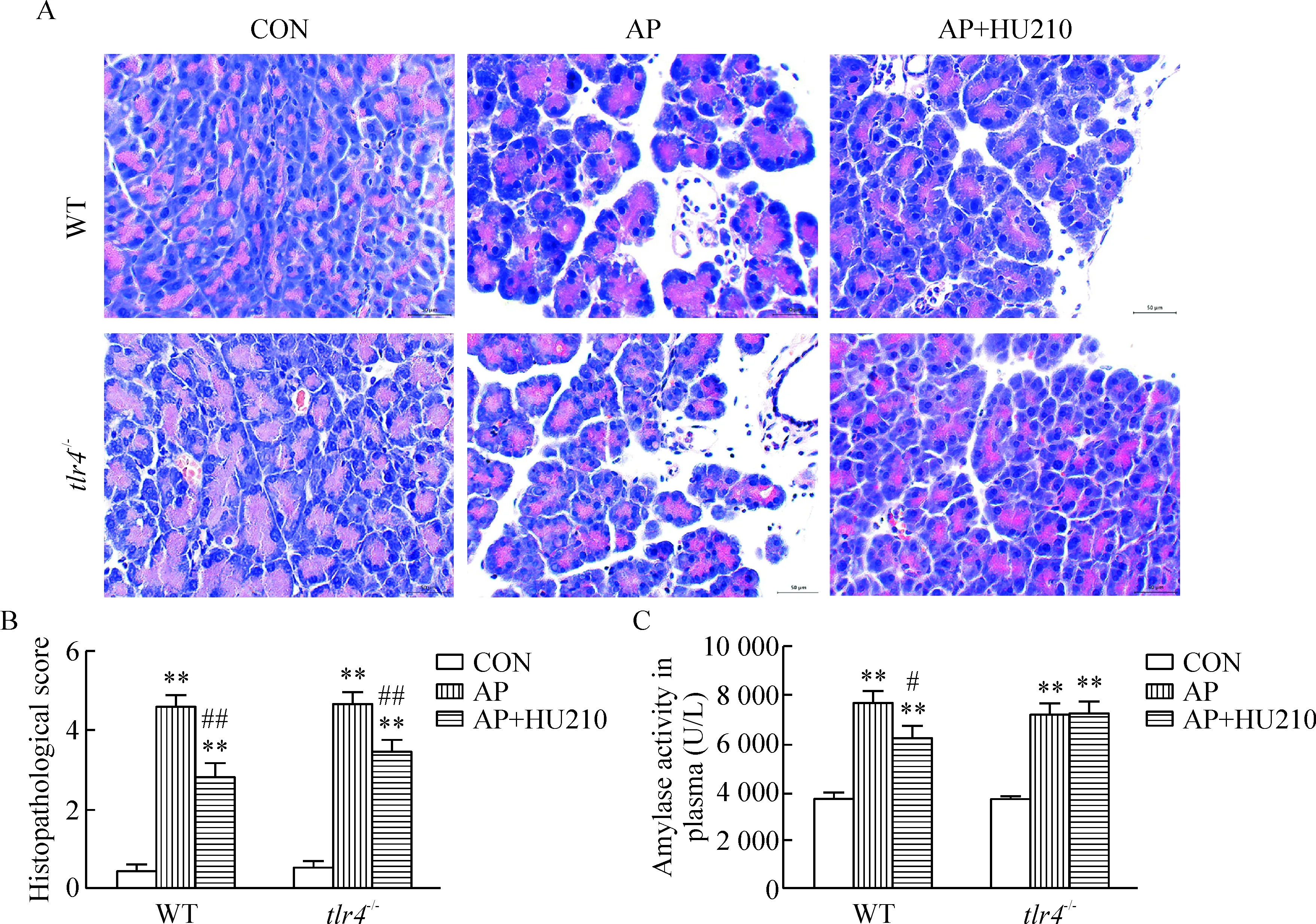
Figure 1.Effects of HU210 treatment on the severity of AP in WT andtlr4-/-mice. A: the pathological images of pancreas (HE staining, ×400); B: the pathological scores of pancreas; C: the amylase activity in plasma. Mean±SEM.n=6.**P<0.01vscontrol (CON) group;#P<0.05,##P<0.01vsAP group.
图1 HU210对急性胰腺炎WT和tlr4-/-小鼠胰腺病理及血浆淀粉酶活性的影响
3 血浆IL-6、TNF-α及MCP-1水平的变化
AP组WT和tlr4-/-小鼠血浆IL-6、TNF-α和MCP-1水平均较各自对照组显著升高(P<0.01),HU210干预未见明显降低作用。然而,值得注意的是,与WT小鼠相同处理组比较,tlr4-/-小鼠AP组或AP+HU210组,其血浆IL-6、TNF-α和MCP-1水平均明显降低(P<0.01),见图2。
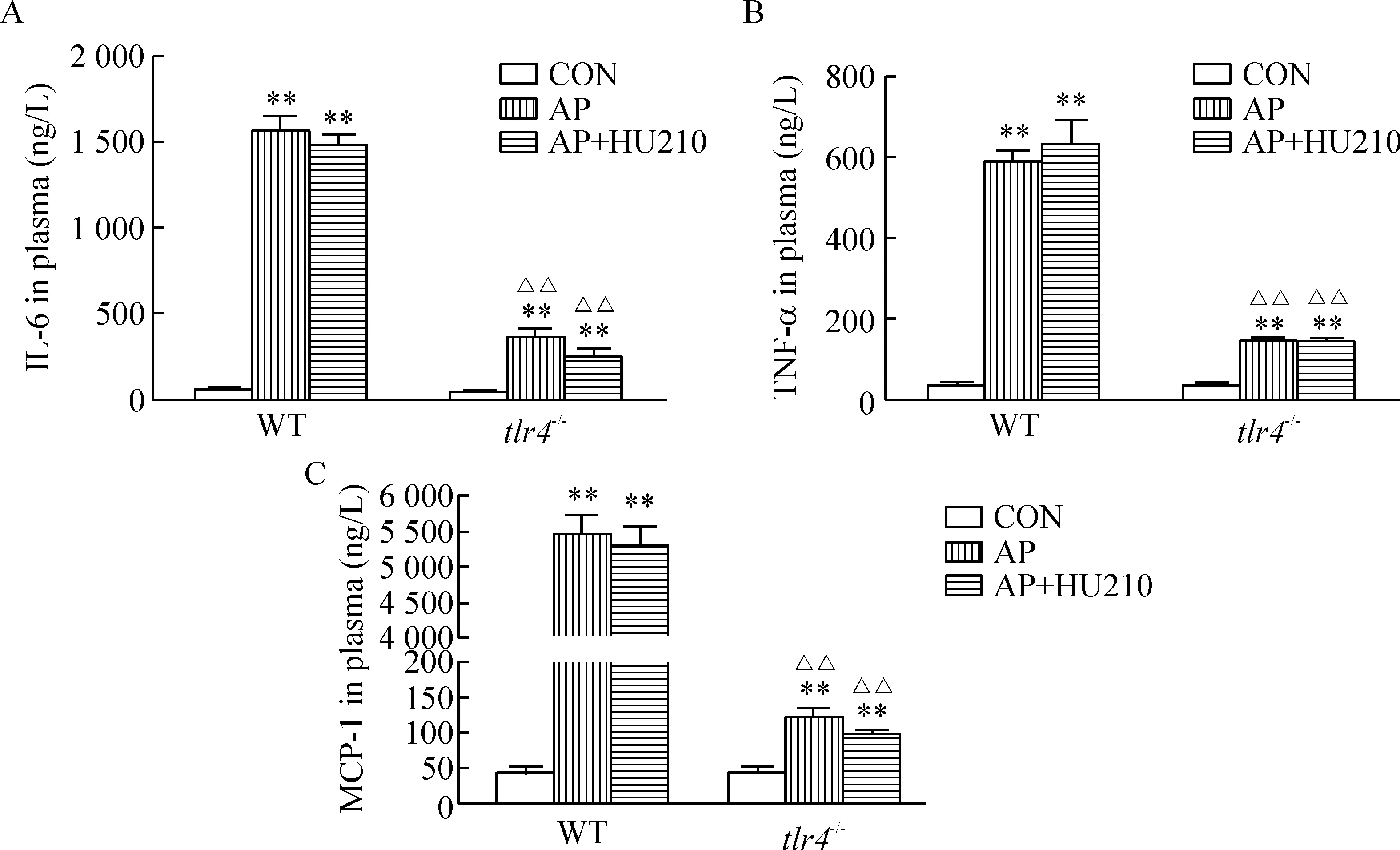
Figure 2.Effects of HU210 treatment on IL-6 (A), TNF-α (B) and MCP-1 (C) levels in plasma in WT andtlr4-/-mice with AP. Mean±SEM.n=6.**P<0.01vscontrol (CON) group;△△P<0.01vsWT.
图2 HU210对急性胰腺炎WT和tlr4-/-小鼠血浆炎症介质水平的影响
4 肺组织髓过氧化物酶活性的变化
如图3所示,无论WT或tlr4-/-小鼠,AP造模后其肺组织MPO活性较对照组明显增高(P<0.01)。HU210干预明显降低肺MPO活性(P<0.05),表明HU210减轻AP时肺内中性粒细胞的浸润。AP组tlr4-/-小鼠肺MPO活性较WT小鼠有所降低,但差异无统计学意义。
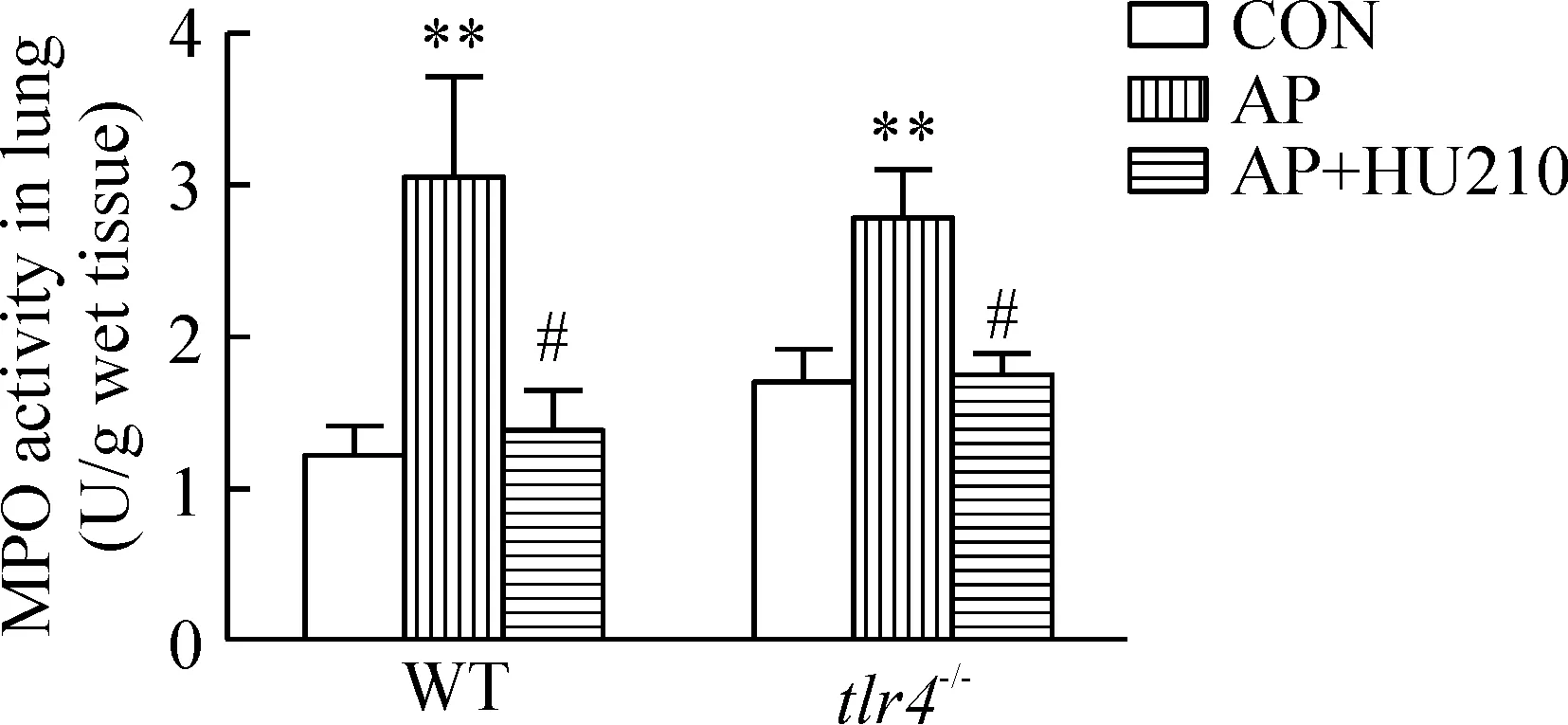
Figure 3.Effect of HU210 treatment on lung MPO activity in WT andtlr4-/-mice with AP. Mean±SEM.n=6.**P<0.01vscontrol (CON) group;#P<0.05vsAP group.
图3 HU210对急性胰腺炎WT和tlr4-/-小鼠肺MPO活性的影响
5 胰腺组织中P38及p-P38蛋白表达的变化
与对照组相比,AP造模后,在WT小鼠,胰腺P38和p-P38蛋白表达明显升高(P<0.01),大麻制剂HU210明显降低这些变化(P<0.05);而在tlr4-/-小鼠,AP组胰腺P38蛋白、而非p-P38蛋白表达较对照组有所增高(P<0.05),HU210对此无明显影响。有趣的是,与AP组WT小鼠相比,AP组tlr4-/-小鼠胰腺P38和p-P38蛋白表达水平明显降低(P<0.05),见图4。
6 小肠Peyer’s结T淋巴细胞亚群的变化
在WT小鼠,与对照组相比,AP组小肠Peyer’s结中CD3+T淋巴细胞和CD4+T淋巴细胞比例有所减少,CD4+/CD8+比值明显降低(P<0.01);在tlr4-/-小鼠,AP组的小肠Peyer’s结中淋巴细胞变化不大,与WT小鼠AP组的变化比较,差异显著(P<0.05)。HU210干预对WT或tlr4-/-小鼠小肠Peyer’s结中淋巴细胞的影响均不明显,见图5。
讨 论
AP的发病机制复杂,涉及机体调控因素众多。本实验采用雨蛙肽,一种胆囊收缩素(cholecystokinin, CCK)的类似物,当大剂量注射时可通过促进胰酶过度分泌而诱导AP发生。LPS为革兰氏阴性细菌细胞壁的主要成分,是TLR4的配体,通过TLR4信号通路,引起体内巨噬细胞、中性粒细胞及内皮细胞等活化,促进释放白细胞介素1、6、8和TNF-α、组胺等生物活性物质,使小血管损伤、管壁扩张,导致微循环障碍,进而加重胰腺病变。我们参照Ding等[6]的方法,对小鼠腹腔注射CAE+LPS来复制AP模型,观察到胰腺组织水肿、出血、炎细胞浸润及点状腺泡细胞坏死,血浆淀粉酶活性增加,增多的促炎细胞因子释放入血,肺组织炎细胞浸润,均为重型AP的表现。
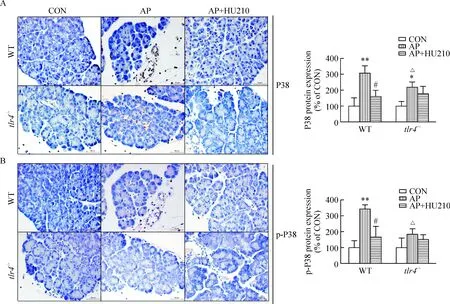
Figure 4.Effects of HU210 on pancreatic P38 (A) and p-P38 (B) protein expression in WT andtlr4-/-mice with AP (immunohistochemical staining,×400). Mean±SEM.n=3.*P<0.05,**P<0.01vscontrol (CON) group;#P<0.05vsAP group;△P<0.05vsWT.
图4 HU210对WT和tlr4-/-小鼠急性胰腺炎胰腺P38和p-P38蛋白表达的影响
已知,炎症反应本质上是一种机体对抗致病因子的一系列抗损伤过程,涉及多因素、多系统的参与。然而过度的炎症反应会加重组织细胞的损伤。Toll样受体(Toll-like receptors, TLRs)是生物进化过程中一种古老的天然免疫受体,也是哺乳动物体内唯一将细胞外抗原识别信息向细胞内传递并引发炎症反应的跨膜蛋白[9]。TLR4是TLR家族的一员,主要识别革兰氏阴性细菌细胞壁成分LPS,通过细胞内信号活化P38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)以及核因子κB(nuclear factor κB, NF-κB),促使促炎细胞因子的合成和释放。目前,TLR4在AP的发病机制的作用仍存在争议。一些研究认为TLR4除分布于免疫相关细胞,还分布于胰腺导管上皮细胞、血管内皮细胞及胰岛细胞的细胞膜上,CAE诱导的AP胰腺TLR4mRNA表达上调,TNF-α、IL-6和IL-2水平升高[10],而通过抑制TLR4可以降低炎症介质[11]。另有研究表明TLR4在CAE诱导的AP中对胰腺组织损伤及AP相关肺损伤无明显作用[12]。Sawa等[13]认为TLR4缺陷对十二指肠闭合术诱导的AP胰腺组织无影响,但可减轻AP相关的肝和肾损伤。在本课题组的前期实验中,我们发现AP时,TLR4的下游信号分子P38 MAPK及其磷酸化形式在胰腺组织表达增加,而使用P38 MAPK抑制剂SB203580抑制其活化,可明显降低炎症反应和细胞因子水平[14]。本实验我们选用tlr4基因敲除小鼠探讨TLR4在AP发病机制的作用,看到AP WT小鼠血浆IL-6和TNF-α水平约为tlr4基因缺陷小鼠的4倍,MCP-1的水平约为tlr4基因缺陷小鼠的45倍。同时P38 MAPK作为TLR4的下游信号分子,tlr4基因的缺陷使得P38及其磷酸化形式p-P38蛋白表达相应地下降,结果表明TLR4-P38 MAPK信号通路参与AP,尤其是伴有内毒素血症时的全身炎症反应。
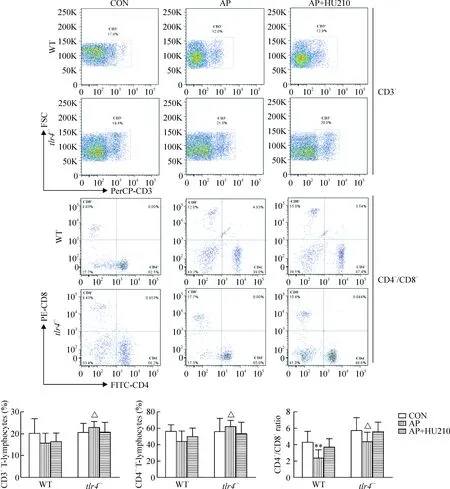
Figure 5.Changes of T-lymphocyte subsets in the intestinal Peyer’s patches of WT andtlr4-/-mice with AP after HU210 treatment detected by flow cytometry. Mean±SD.n=6.**P<0.01vscontrol group;△P<0.05vsWT.
图5 WT和tlr4-/-小鼠各组肠道Peyer’s结中CD3+、CD4+T淋巴细胞百分比及CD4+/CD8+比值的变化
机体的炎症反应调控涉及多系统、多器官。20世纪90年代,Marzo等[15]首次提出内源性大麻素系统(endocannabinoid system, ECS),该系统由内源性大麻素物质、大麻素受体[主要包括大麻素受体1(cannabinoid receptor 1, CB1)和大麻素受体2(cannabinoid receptor 2, CB2)],以及参与内源性大麻素物质合成、转运及降解的酶类组成。最近大量研究显示,ECS广泛参与机体炎症反应、包括AP以及其它胃肠道炎症疾病的调控[16-18]。CB2主要通过调控P38 MAPK信号通路及NF-κB信号通路调节炎症因子的合成和释放,该受体的激活具有抗炎作用[19]。Michalski等[16]发现AP患者胰腺组织CB受体表达上调,内源性大麻素物质水平升高;此外,人工合成的CB1/CB2受体激动剂HU210治疗小鼠实验性AP,减缓AP相关性疼痛,减轻炎症反应和胰腺病理损伤,而不伴有中枢神经系统副作用。Michler等[20]研究证实,HU210主要是通过活化CB2减轻AP的胰腺组织损伤和肺组织MPO活性。本课题组之前的研究证实HU210通过减轻炎症反应及减少胃泌素和胃蛋白酶分泌,可以保护胃组织抵抗AP引起的急性胃肠黏膜病变[17]。本实验结果显示,HU210干预AP小鼠,使其胰腺组织损伤减轻,血浆淀粉酶活性及肺组织MPO活性降低,胰腺组织P38和p-P38的表达下调。大麻制剂HU210作为CB受体激动剂,参与激活ECS而发挥对AP的干预作用,其作用机制是否与其抑制TLR4-P38 MAPK信号通路有关?从实验结果看到,无论对WT或tlr4基因敲除小鼠,HU210均可明显改善AP胰腺组织病理改变、降低肺部炎细胞浸润;而对于AP时的高胰淀粉酶血症及上调的P38和p-P38,HU210的对抗作用仅在WT鼠明显表现出来,对tlr4基因敲除鼠无影响,说明HU210改善 AP组织病理和功能损伤的作用主要是通过抑制组织炎症细胞的浸润,而不依赖TLR4-P38 MAPK信号通路。另外,无论WT或tlr4基因敲除小鼠,HU210对CAE+LPS引起的小鼠重症AP其显著升高的血浆炎症介质水平无明显逆转,提示HU210对AP全身炎症因子的表达无明显作用,说明合并内毒素血症的重症AP其机体炎症反应的严重性和复杂性,其中涉及多因素、多系统的参与。
综上所述,本实验结果揭示TLR4-P38 MAPK信号通路参与AP,尤其是伴有内毒素血症时的全身炎症反应。大麻制剂HU210对AP组织的保护作用,可能主要是通过抑制炎症细胞,尤其是抑制中性粒细胞的浸润,对 TLR4信号通路的依赖不明显。
[1] Peery AF, Dellon ES, Lund J, et al. Burden of gastrointestinal disease in the United States: 2012 update[J]. Gastroenterology, 2012, 143(5): 1179-1187.e3.
[2] 林旭红, 李永渝. 急性胰腺炎发病机制及相关治疗的研究进展[J]. 中国病理生理杂志, 2010, 26(5): 1029-1032, 1040.
[3] 李海军, 彭淑牖, 刘颖斌, 等. 甘氨酸对急性坏死性胰腺炎鼠血和胰腺组织中TNF-α、IL-1β、IL-6、IL-8和IL-10的影响[J]. 中国病理生理杂志, 2006, 22(2): 239-243.
[4] Zhang X, Zhu C, Wu D, et al. Possible role of toll-like receptor 4 in acute pancreatitis[J]. Pancreas, 2010, 39(6): 819-824.
[5] Vaz J, Akbarshahi H, Andersson R. Controversial role of toll-like receptors in acute pancreatitis[J]. World J Gastroenterol, 2013, 19(5): 616-630.
[6] Ding SP, Li JC, Jin C. A mouse model of severe acute pancreatitis induced with caerulein and lipopolysaccharide[J]. World J Gastroenterol, 2003, 9(3): 584-589.
[7] Ding JL, Li Y, Zhou XY, et al. Potential role of the TLR4/IRAK-4 signaling pathway in the pathophysiology of acute pancreatitis in mice[J]. Inflamm Res, 2009, 58(11): 783-790.
[8] 李 敏, 林思思, 沈 利, 等. 清胰汤Ⅱ号冲剂对急性胰腺炎小鼠的保护作用及机制[J]. 中国病理生理杂志, 2015, 31(7): 1282-1287.
[9] Gordon S. Pattern recognition receptors: doubling up for the innate immune response[J]. Cell, 2002, 111(7): 927-930.
[10]Li Y, Zhou ZG, Xia QJ, et al. Toll-like receptor 4 detected in exocrine pancreas and the change of expression in cerulein-induced pancreatitis[J]. Pancreas, 2005, 30(4): 375-381.
[11]Gorsky VA, Agapov MA, Khoreva MV, et al. The effect of lornoxicam on TLR2 and TLR4 messenger RNA expression and tumor necrosis factor-alpha, interleukin-6, and interleukin-8 secretion in patients with systemic complications of acute pancreatitis[J]. Pancreas, 2015, 44(5): 824-830.
[12]Pastor CM, Pugin J, Kwak B, et al. Role of Toll-like receptor 4 on pancreatic and pulmonary injury in a mice model of acute pancreatitis associated with endotoxemia[J]. Crit Care Med, 2004, 32(8): 1759-1763.
[13]Sawa H, Ueda T, Takeyama Y, et al. Role of toll-like receptor 4 in the pathophysiology of severe acute pancreatitis in mice[J]. Surg Today, 2007, 37(10): 867-873.
[14]Cao MH, Xu J, Cai HD, et al. p38 MAPK inhibition alleviates experimental acute pancreatitis in mice[J]. Hepatobiliary Pancreat Dis Int, 2015, 14(1): 101-106.
[15]Di Marzo V, Fontana A. Anandamide, an endogenous cannabinomimetic eicosanoid: ‘Killing two birds with one stone’[J]. Prostaglandins Leukot Essent Fatty Acids, 1995, 53(1): 1-11.
[16]Michalski CW, Laukert T, Sauliunaite D, et al. Cannabinoids ameliorate pain and reduce disease pathology in ce-rulein-induced acute pancreatitis[J]. Gastroenterology, 2007, 132(5): 1968-1978.
[17]Cao MH, Li YY, Xu J, et al. Cannabinoid HU210 protects isolated rat stomach against impairment caused by serum of rats with experimental acute pancreatitis[J]. PLos One, 2012, 7(12):e52921.
[18]Li YY, Yuece B, Cao HM, et al. Inhibition of p38/Mk2 signaling pathway improves the anti-inflammatory effect of WIN55 on mouse experimental colitis[J]. Lab Invest, 2013, 93(3): 322-333.
[19]林思思, 杨莉芝, 李永渝. 大麻素受体2与消化系统炎症性疾病[J]. 生理科学进展, 2014, 45(6): 453-457.
[20]Michler T, Storr M, Kramer J, et al. Activation of cannabinoid receptor 2 reduces inflammation in acute experimental pancreatitis via intra-acinar activation of p38 and MK2-dependent mechanisms[J]. Am J Physiol Gastrointest Li-ver Physiol, 2013, 304(2): G181-G192.
(责任编辑: 林白霜, 罗 森)
Effects of cannabinoid HU210 on experimental acute pancreatitis and possible relationship with Toll-like receptor 4 signaling pathway
ZHANG Rui-qin1, 2, LIN Si-si1, LI Min3, SHEN Li4, LI Kun1, LI Yong-yu1
(1DepartmentofPathophysiology,InstituteofDigestiveDisease,TongjiUniversitySchoolofMedicine,Shanghai200092,China;2DepartmentofPathology,WestBranchofTheSecondHospital,ShanxiMedicalUniversity,Taiyuan030053,China;3DepartmentofPhysiology,ZunyiMedicalandPharmaceuticalCollege,Zunyi563000,China;4DepartmentofPathogenBiology,TongjiUniversitySchoolofMedicine,Shanghai200092,China.E-mail:liyongyu@tongji.edu.cn)
AIM: Using Toll-like receptor 4 gene knockout (tlr4-/-) mice and the wild-type (WT) mice with the same C57BL/10J genetic background, the effects of HU210, a cannabis preparation, on caerulein (CAE)-induced acute pancreatitis (AP) and the potential mechanisms were investigated. METHODS: WT ortlr4-/-mice were randomly divided into AP group, AP+HU210 group and control group. AP was induced by intraperitoneal injection of CAE (50 μg·kg-1·h-1) for a total of 6 times and lipopolysaccharide (LPS) at 10 mg/kg 6 h after the first injection of CAE. HU210 (50 μg/kg) was given 30 min before and 4 h after the first injection of CAE in AP+HU210 group. The animals in control group were given normal saline instead of CAE and LPS in the same way. The mice were sacrificed 3 h after the last injection. The blood, the pancreas, the lungs and the intestinal Peyer’s patches were harvested. RESULTS: Compared with control group, the pancreatic pathological score and P38 protein expression, plasma amylase activity and inflammatory mediator levels, and lung MPO activity were significant increased (P<0.05) in both WT andtlr4-/-mice with AP. Compared with the WT mice with AP, thetlr4-/-mice with AP showed significantly low levels of IL-6, TNF-α and MCP-1 in the plasma, low expression levels of pancreatic P38 and p-P38 protein (P<0.05), and mild alterations of CD3+T-lymphocytes, CD4+T-lymphocytes and the ratio of CD4+/CD8+(P<0.05). The administration of HU210 attenuated the pancreatic pathological changes and the lung MPO activity in both stains of mice with AP (P<0.05). However, the inhi-bitory effects of HU210 on the increased amylase activity in the plasma and the increased protein levels of pancreatic P38 and p-P38 were remarkable (P<0.05) in WT mice instead of intlr4-/-mice. CONCLUSION: TLR4 is mainly involved in AP-related systemic inflammatory response and its mechanism may be dependent on TLR4-P38 MAPK signaling pathway. The intervention of HU210 in AP plays a protective role mainly by inhibiting the infiltration of inflammatory cells, and the relationship with TLR4 signaling pathway is not obvious.
Acute pancreatitis; Cannabinoids; Toll-like receptor 4; Inflammatory mediators
1000- 4718(2017)06- 1112- 07
2016- 11- 28
2017- 03- 15
国家自然科学基金资助项目(No. 81270477; No.31571181)
R363.2
A
10.3969/j.issn.1000- 4718.2017.06.025
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 021-65981021; E-mail: liyongyu@tongji.edu.cn
