氧化应激拮抗剂对1型糖尿病大鼠肾脏皮质血管紧张素原表达的影响
2017-06-23郑伟平梁翔邹原方刘玉峰苏晓燕
郑伟平 梁翔 邹原方 刘玉峰 苏晓燕
·实验研究·
氧化应激拮抗剂对1型糖尿病大鼠肾脏皮质血管紧张素原表达的影响
郑伟平 梁翔 邹原方 刘玉峰 苏晓燕
目的 研究1型糖尿病大鼠早期肾脏皮质血管紧张素原(angiotensinogen,AGT)表达的改变以及抗氧化应激干预对其表达的影响,分析肾素-血管紧张素系统(renin-angiotensin system,RAS)与氧化应激作用的关系。方法 将正常雄性SD大鼠随机分为两组,糖尿病(diabetes mellitus,DM)大鼠组腹腔注射链脲佐菌素(streptozotocin,STZ)造1型糖尿病大鼠模型,需鉴定其成模,非糖尿病(Non-DM)大鼠组腹腔注射同等剂量的载体溶剂(1 ml/100 g),观察至4周末;对比2组大鼠体质量、血糖水平、血压水平及肾脏皮质AGT的表达水平。分别选用氯沙坦、肼屈嗪以及氧化应激反应拮抗剂作为干预手段,对成模后的DM大鼠进行干预,持续至4周末,与阳性对照组相比,对比各干预组糖尿病大鼠体质量、血糖水平、血压水平及肾脏皮质AGT的表达水平。结果 与Non-DM组大鼠比较,4周末DM大鼠体质量、血糖水平均有显著性差异(P<0.05),而血压水平无显著性差异(P>0.05);肾脏皮质AGT表达水平显著升高(P<0.05);与阳性对照组比较,4周末各干预组大鼠体质量、血糖水平、血压水平均无显著性差异(P>0.05);氯沙坦和氯化应激反应拮抗剂组肾脏皮质AGT的表达有所下调(P<0.05),肼屈嗪组AGT表达没有显著改变(P>0.05)。结论 1型糖尿病大鼠早期肾脏皮质AGT表达有所上调,抗氧化应激干预与RAS受体阻断剂干预均能降低AGT的表达水平,这说明RAS和氧化应激作用有一定的关联性。
糖尿病;慢性肾脏病;肾素-血管紧张素系统;血管紧张素原;氧化应激
随着社会经济的发展,人们的生活质量普遍提高,但随之而来的健康问题也日益凸显。糖尿病(diabetes mellitus,DM)作为一类代谢性疾病已经对人类健康构成了极大的威胁。在DM患者中,将有1/3的人有机会并发糖尿病肾病(diabetic nephropathy,DN)[1]。DN作为一种慢性肾脏病,不仅具有DM的疾病特点,更重要的是其最终结果会导致慢性肾衰竭。
慢性肾脏病的发生和发展与肾素-血管紧张素系统(renin angiotensin system,RAS)功能异常密切相关[2]。RAS作为一个完整的神经内分泌调节轴宏观存在于整个机体,同时机体的各器官组织内都几乎分布着RAS的组分[3]。研究发现,因糖基化终产物蓄积导致的氧化应激损伤是糖尿病并发症产生的关键[4]。RAS与氧化应激损伤共同参与介导了疾病的发生和发展过程,并且大量研究表明RAS与氧化应激作用有着密切的关系[5]。
肾素、血管紧张素原(angiotensinogen,AGT)、血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)、Ⅰ型血管紧张素Ⅱ受体(type Ⅰangiotensin Ⅱreceptor,AT1)等都是RAS的主要组成部分,其中AngⅡ与AT1结合产生生物学效应。AGT作为AngⅡ生成的重要前体分子,其本身不具有发挥RAS功能的作用,但其表达水平的高低可间接反映RAS水平活化的程度。本实验拟用AGT作为监测指标,用以研究在1型DM大鼠模型中,氧化应激作用对肾脏皮质RAS的活化水平的影响。
材料与方法
一、动物模型的制备及分组
本研究选用经典1型DM大鼠模型[6]的制作方法进行造模。实验大鼠购自南方医科大学实验动物中心;第一部分实验:雄性SD大鼠体质量250~300 g,12只随机均分为2组即非糖尿病(Non-DM)组和DM组。对DM组大鼠进行腹腔注射链脲佐菌素(STZ约100 g/ml,溶于pH值4.2的柠檬酸钠溶液中),剂量为60 mg/kg。Non-DM组大鼠腹腔注射pH值4.2的柠檬酸钠溶液,剂量为1 ml/100 g。造模后,整个实验过程所有大鼠均在SPF级环境、室温、45%相对湿度环境下自由进食和饮水饲养4周。随后在注射STZ后的第3 d、第5 d、第7 d时间点分别对DM组大鼠进行鼠尾静脉采血检测血糖值,3次随机血糖含量均值>16.8 mol/ml即可认为造模成功,未达标的则弃之不用。之后所有大鼠继续饲养4周,然后处死取肾组织。第二部分实验:24只雄性 SD大鼠体质量250~300 g,按第一部分DM大鼠造模方法,将所有大鼠造模,待鉴定成模后,随机将所有大鼠均分为4组,每组6只,分别命名为阳性对照组、氯沙坦组、氧化应激反应拮抗剂组以及肼屈嗉组。根据文献报道剂量,所有大鼠均予口服灌胃方法处理,各组分别以双蒸水每日灌胃一次、氯沙坦、氧化应激反应拮抗剂[7]、肼屈嗪。阳性对照组即造模组,饲料及饮水同其他组大鼠相同。由于本实验的研究目的是探讨氧化应激对RAS活性的影响,而氯沙坦的降压效果势必会对实验的严谨性产生影响,故设计肼屈嗪组DM大鼠目的在于为了排除血压变化对最终结果产生的影响。
二、动物标本和实验数据采集
1.体质量、血压、血糖值的测定 所有大鼠体质量用电子分析天平(Meilte公司,德国)测量;血压值用大鼠无创血压计(softron BP-98A,Japan)进行尾动脉血压测量,血糖值用血糖试纸测定。
2.大鼠肾脏皮质新鲜组织及固定组织的留取 大鼠用3%戊巴比妥钠腹腔注射麻醉(0.15 ml/100 g),随后开腹,从腹主动脉穿刺采血后迅速打开胸腔,用16#灌胃针从左心室穿刺入主动脉弓,同时剪开右心耳,4 ℃预冷的生理盐水(含肝素20 U/ml)200 ml快速灌注,可看到肝脏、肺皮肤和肌肉等快速变苍白,右心耳流出液体无色清亮则认定灌注结束。用外科剪将大鼠肾脏取下,冠状切面切开,取皮质层组织,一部分组织于液氮中保存;另一部分肾皮质组织浸入4%多聚甲醛溶液中24 h,后予继续脱水、透明、浸蜡等处理,做成石蜡块后切0.4 μm厚组织片待染色。
3.采用Western blot及免疫组化方法检测肾脏皮质AGT的表达情况
(1)肾脏皮质WB检测:提取肾皮质蛋白,随后进行电泳、转膜、封闭,AGT一抗(abclonal,美国)孵育,洗膜,二抗(武汉博士德,中国)孵育,显影,拍片,图像分析,通过半定量计算测量肾脏皮质AGT的表达情况。
(2)肾脏皮质免疫组化检测:固定肾皮质组织,随后脱水,透明、浸蜡、包埋、切片、脱蜡、水化、封闭,AGT一抗(abclonal,美国)孵育,洗膜,二抗(武汉博士德,中国)孵育,洗片,二抗孵育,DAB染色,封片,排片。通过软件经行半定量计算肾脏皮质AGT的表达情况。
三、统计学处理
采用SPSS 13.0统计软件包进行统计分析,使用Image-Pro Plus 7.0软件处理分析免疫组化图像,使用Image J软件处理分析蛋白表达水平,数据以均数±标准差表示,2组大鼠组间均数采用两样本独立t检验;多组间样本均数采用单因素方差分析并进行方差齐性检验,方差不齐时采用 welch校正。组间比较采用LSD法(方差齐)或Tamhane’s T3 法(方差不齐),P<0.05为差异有统计学意义。
结 果
一、Non-DM组和DM组大鼠体质量、血糖、血压的比较
2组大鼠在造模4周后,DM组大鼠体质量显著低于Non-DM组大鼠(P<0.05),DM组大鼠血糖显著高于Non-DM组(P<0.05),而在血压方面,2组大鼠则没有显著性差异(P>0.05)。(表1)
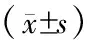
表1 Non-DM组和DM组大鼠体质量、血糖、血压比较
注:与Non-DM组比较,aP<0.05,bP>0.05
二、Non-DM组和DM组大鼠肾脏皮质AGT的表达情况的比较
与Non-DM大鼠比较,DM组大鼠肾脏皮质AGT表达均显著高于Non-DM组(P<0.05)。(图1~2)
三、不同干预组DM大鼠的比较
各个干预组之间,大鼠体质量、血糖水平、血压均没有显著性差异(P>0.05)。(表2)
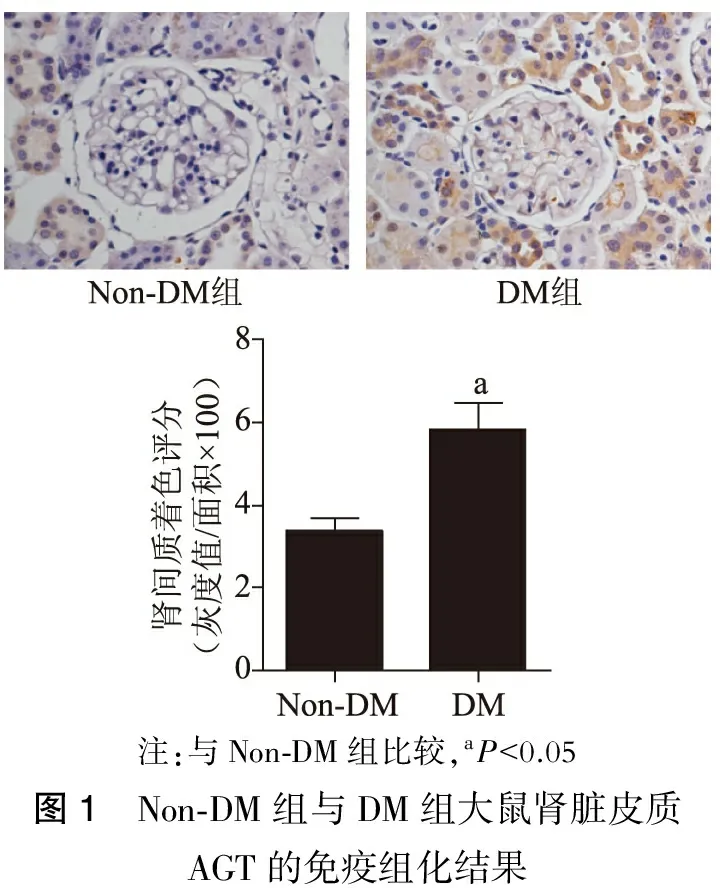
注:与Non⁃DM组比较,aP<0.05图1 Non⁃DM组与DM组大鼠肾脏皮质AGT的免疫组化结果

注:与Non⁃DM组比较,aP<0.05图2 Non⁃DM组与DM组大鼠肾脏皮质AGT的Westernblot结果
表2 不同干预组大鼠体质量、血糖、血压情况比较±s)
四、不同干预组大鼠肾脏皮质AGT的表达情况比较
氯沙坦和氧化应激反应拮抗剂组肾脏皮质AGT的表达有所下调,阳性对照组与肼屈嗪组AGT表达没有显著改变。(图3~4)

注:与阳性对照组比较,aP<0.05图3 各组大鼠肾脏皮质AGT的免疫组化结果

注:与阳性对照组比较,aP<0.05图4 不同组大鼠肾脏皮质AGT的表达情况
讨 论
在DM疾病过程中,体内会蓄积大量糖基化终产物(advanced glycation end products,AGEs),这类物质不仅可以直接对肾实质各类细胞有毒性伤害作用,而且可以提高组织器官内的氧化应激反应,而氧化应激反应又与交感兴奋性和RAS的活化有着密切的联系,这无疑又间接或直接地促进了肾脏损伤的进程。氧化应激作用在DM的肾脏损伤进程中起到了关键作用。DM患者体内会产生大量的活性氧或活性氮簇物质,这些物质远远超过了体内清除的速率。因此,这些活性氧化物在体内不断蓄积,最终对体内各组织器官产生损伤作用[8]。在DM疾病过程中,血液和组织器官中会蓄积大量AGEs,这类物质不仅可以直接对肾实质各类细胞有毒性伤害作用,而且还可以提高组织器官内的氧化应激反应[9]。
研究发现,在 DM患者人群中,心血管交感神经兴奋性普遍增高[10]。在DM大鼠模型中,大鼠血液内的血管紧张素II含量也会显著升高。在DM状态下,机体排尿量的增加导致全身体液平衡发生变化,刺激体内压力和容量感受器,RAS活性显著升高[11],肾脏RAS活性的持续升高可促进肾脏纤维化的发生、发展,损伤肾功能[12]。高糖内环境可以蓄积大量糖基化终产物导致氧化应激反应增高[13],同时还升高了体内肾素、血管紧张素等RAS成分的含量[14-15],这无疑进一步加速了糖尿病肾病的发生和发展。在动物研究中,人为提高大鼠体内血管紧张素Ⅱ水平可以促进氧化应激指标Nox的水平[16-17]。临床研究报道Tempol可以有效拮抗氧化应激作用,从而下调RAS活性,从而达到改变血管内血流动力学的目的[18],进而达到改善肾功能的目的。对早期糖尿病患者使用RAS阻断剂可以有效延缓慢性肾脏病的进程[19]。在盐敏感性高血压大鼠模型中,在大鼠血压升高之前氧化应激指标就有所升高,氧化应激作用先于RAS的活化,促进了血压升高[20]。种种研究结果表明,RAS的活化与氧化应激作用二者有着密不可分的联系。我们观察了所有DM大鼠发现其血糖值虽然有所升高,但血压水平却并未因肾脏RAS的活性增高而升高,这与文献报道一致[21]。肾小管上皮细胞RAS的过度活化可以加速细胞凋亡,而氧化应激反应也参与到这一过程中[22-23]。这一点也可以解释1型糖尿病患者虽然血压不高,但DN发病率高的现象。
DN作为DM的主要并发症之一,往往是DM患者致死、致残的主要原因。DM治疗的一个重要目标就是预防和延缓其并发症的发生和发展,提高生存质量。因此,明确DN发病机制有利于发现探索新的治疗方案和治疗靶点,为临床治疗提供更加可靠的理论基础。
致谢 诚挚地感谢中山大学高血压病研究所实验室的实验员对本研究的支持和帮助。
[1] Gallagher H, Suckling RJ. Diabetic nephropathy-where are we on the journey from pathophysiology to treatment?[J]. Diabetes Obes Metab, 2016 , 18(7): 641-647.
[2] Klein IH, Ligtenberg G, Neumann J, et al. Sympathetic nerve activity is inappropriately increased in chronic renal disease[J]. J Am Soc Nephrol, 2003, 14: 3239-3244.
[3] De Mello WC. Local renin angiotensin aldosterone systems and cardiovascular diseases[J]. Med Clin North Am, 2017, 101: 117-127.
[4] Rochette L, Zeller M, Cottin Y, et al. Diabetes, oxidative stress and therapeutic strategies[J]. Biochim Biophys Acta, 2014, 1840: 2709-2729.
[5] Peng T, Wang J, Zhen J, et al. Effect of benazepril on the transdifferentiation of renal tubular epithelial cells from diabetic rats[J]. Biomed Rep, 2014, 2: 490-494.
[6] Inada A, Kanamori H, Arai H, et al. A model for diabetic nephropathy: advantages of the inducible cAMP early repressor transgenic mouse over the streptozotocin-induced diabetic mouse[J]. J Cell Physiol, 2008, 215: 383-391.
[7] Cao W, Li A, Wang L, et al. A salt-induced reno-cerebral reflex activates renin-angiotensin systems and promotes CKD progression[J]. J Am Soc Nephrol, 2015, 26: 1619-1633.
[8] Piwkowska A, Rogacka D, Audzeyenka I, et al. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes[J]. J Cell Biochem, 2011, 112: 1661-1672.
[9] Wu J, Mei C, Vlassara H, et al. Oxidative stress-induced JNK activation contributes to proinflammatory phenotype of aging diabetic mesangial cells[J]. Am J Physiol Renal Physiol, 2009, 297: F1622-1631.
[10]Thackeray JT, DeKemp RA, Beanlands RS, et al. Early diabetes treatment does not prevent sympathetic dysinnervation in the streptozotocin diabetic rat heart[J]. J Nucl Cardiol, 2014, 21: 829-841.
[11]Patel KP, Mayhan WG, Bidasee KR, et al. Enhanced angiotensin II-mediated central sympathoexcitation in streptozotocin-induced diabetes: role of superoxide anion[J]. Am J Physiol Regul Integr Comp Physiol, 2011, 300: R311-320.
[12]Stock J, Kuenanz J, Glonke N, et al. Prospective study on the potential of RAAS blockade to halt renal disease in Alport syndrome patients with heterozygous mutations[J]. Pediatr Nephrol, 2017, 32: 131-137.
[13]Brezniceanu ML, Liu F, Wei CC, et al. Catalase over expression attenuates angiotensinogen expression and apoptosis in diabetic mice[J]. Kidney Int, 2007, 71: 912-923.
[14]Minuz P, Patrignani P, Gaino S, et al. Increased oxidative stress and platelet activation in patients with hypertension and renovascular disease[J]. Circulation, 2002, 106: 2800-2805.
[15]Matz R. Renovascular hypertension, endothelial function, and oxidative stress[J]. N Engl J Med , 2002, 347: 1528-1530.
[16]Wingler K, Wunsch S, Kreutz R, et al. Up regulation of the vascular NAD(P)H-oxidase isoforms Nox1 and Nox4 by the renin-angiotensin system in vitro and in vivo[J]. Free Radic Biol Med, 2001, 31: 1456-1464.
[17]Wang HD, Johns DG, Xu S, et al. Role of superoxide anion in regulating pressor and vascular hypertrophic response to angiotensin II[J]. Am J Physiol Heart Circ Physiol, 2002, 282: H1697-1702.
[18]Wang D, Chen Y, Chabrashvili T, et al. Role of oxidative stress in endothelial dysfunction and enhanced responses to angiotensin II of afferent arterioles from rabbits infused with angiotensin II[J]. J Am Soc Nephrol, 2003, 14: 2783-2789.
[19]Schievink B, Kropelin T, Mulder S, et al. Early renin-angiotensin system intervention is more beneficial than late intervention in delaying end-stage renal disease in patients with type 2 diabetes[J]. Diabetes Obes Metab, 2016, 18: 64-71.
[20]Chabrashvili T, Tojo A, Onozato ML, et al. Expression and cellular localization of classic NADPH oxidase subunits in the spontaneously hypertensive rat kidney[J]. Hypertension, 2002, 39: 269-274.
[21]Shi XY, Hou FF, Niu HX, et al. Advanced oxidation protein products promote inflammation in diabetic kidney through activation of renal nicotinamide adenine dinucleotide phosphate oxidase[J]. Endocrinology, 2008, 149: 1829-1839.
[22]Lodha S, Dani D, Mehta R, et al. Angiotensin II-induced mesangial cell apoptosis: role of oxidative stress[J]. Mol Med, 2002, 8: 830-840.
[23]Bhaskaran M, Reddy K, Radhakrishanan N, et al. Angiotensin II induces apoptosis in renal proximal tubular cells[J]. Am J Physiol Renal Physiol, 2003, 284: F955-965.
Effect of oxidative stress on kidney cortex angiotensinogen expression in rate type 1 diabetes model
ZHENGWei-ping,LIANGXiang,ZOUYuan-fang,LIUYu-feng,SUXiao-yan.
DonghuaHospital,SunYat-senUniversity,Dongguan523110,ChinaCorrespondingauthor:SUXiao-yan,E-mail:suxiaoyan769@hotmail.com
Objective To observe the changes of kidney cortex angiotensinogen (AGT) expression in rate type Ⅰ diabetes model, and the effect of the anti-oxidative stress induction on the kidney cortex AGT expression in order to infer indirectly that there is some relationship between renin-angiotensin system (RAS) and oxidative stress. Methods First part of the experiment: Male Sprague Dawley (SD) rats were randomly divided into two groups: diabetic mellitus (DM) group and non-DM group. Rats in DM group were injected with streptozotocin (STZ) intraperitoneally, and those in non-DM group were given the same dosage of vehicle. The body weight, blood glucose, blood pressure and AGT expression in both groups were measured at the end of 4 weeks. Second part of the experiment: All type Ⅰ diabetes rats were randomly divided into four groups, and administrated with distilled water, Losartan, hydralazine and Tempol respectively. The body weight, blood glucose, blood pressure and AGT expression in all groups were detected after 4 weeks since the type Ⅰ diabetes model was established. Results There were significant differences in body weight, blood glucose and blood pressure between non-DM group and DM group after 4 weeks (P<0.05). The cortex AGT expression was up-regulated in DM group. There was no significant difference in body weight, blood glucose and blood pressure among the four groups. The cortex AGT expression in Losartan group and Tempol group was reduced significantly, and that in hydralazine group had no changes as compared with the distilled water group. Conclusions The cortex AGT expression was up-regulated in DM group. Both anti oxidative stress and Losartan can reduce the AGT expression, suggesting some relationships between the activity of RAS and oxidative stress.
Diabetes mellitus; Chronic kidney disease; Renin angiotensin system; Angiotensinogen; Oxidative stress
10.3969/j.issn.1671-2390.2017.05.010
广东省医学科学技术研究基金面上项目(No.20161122099434)
523110 东莞,中山大学附属东华医院肾病风湿科
苏晓燕,E-mail:suxiaoyan769@hotmail.com
2017-02-06
2017-03-25)
