神经纤维瘤病2型基因及其表达产物在听神经瘤发病机制中的研究进展△
2017-06-23许建辉张天宇
许建辉 张天宇
·综 述·
神经纤维瘤病2型基因及其表达产物在听神经瘤发病机制中的研究进展△
许建辉 张天宇
听神经瘤的发病有上升趋势,而传统的手术治疗方式仍存在较多的并发症。研究人员开始把重心放到听神经瘤的分子生物学研究上来,特别是神经纤维瘤病2型基因及其表达产物Merlin蛋白在听神经瘤发病机制中的作用,得到越来越多学者的重视。(中国眼耳鼻喉科杂志,2017,17:205-207)
神经纤维瘤病2型基因;Merlin蛋白;听神经瘤
听神经瘤(acoustic neuroma,AN)又称前庭神经鞘瘤(vestibular schwannoma,VS),由第8对脑神经前庭神经膜细胞(施旺细胞)过度增殖所致的一种肿瘤。临床症状包括感音神经性聋、耳鸣、平衡障碍、眩晕、面神经麻痹、脑水肿、失明,甚至死亡。AN多分为散发的单侧型和神经纤维瘤病2型(neurofibromatosis 2, NF2),其中以单侧散发的AN最为常见,约占AN的95%[1]。NF2多为双侧AN,为NF2抑癌基因发生点突变所引起的常染色体显性遗传病[2],单侧AN中也存在NF2基因的突变,但要明显低于NF2。近年来,AN每年的发病率接近2/10万[3],且有上升的趋势。磁共振成像(magnetic resonance imaging,MRI)、CT等影像学诊断技术的发展促进了AN的早期发现与诊疗。治疗手段的多元化以及显微外科手术、影像学随访观察、放疗等的相继出现,使不同程度、阶段的肿瘤得到早期诊断和治疗,让AN的治疗策略有了更多的应用和选择。虽然取得了一定的进步,对于体积增大且有症状的AN来说,手术和放疗仍为治疗AN的最佳选择,较多的并发症以及放疗可能引起肿瘤生长甚至细胞恶变仍是需要面对的问题。因此,阐明AN的发病机制和生物学行为,从细胞和基因水平探索出具有可行性的靶向治疗,拓宽诊疗视野,为AN的研究奠定良好的基础。本文就NF2基因及其表达产物与AN发病机制的最新进展予以综述。
1 NF2基因与AN
NF2基因位于22q12.2,长1 785个碱基,含有17个外显子,16和17外显子为可变化的剪切外显子。近年来研究发现,NF2基因具备抑癌功能,其失活与AN的发生密切相关[4]。NF2失活的基因主要方式为基因的插入、缺失和点突变,由此造成的移码突变可致蛋白切断和异常。另外发生在剪切位点的突变则引起外显子跳跃或终止密码子提前成熟。Zhang等[5]在对145例AN患者进行研究时发现,NF2基因的突变率为34.5%,其中散发性AN的突变率为34.2%,囊性AN的突变率为35.5%,指出NF2基因的突变与囊性AN的发生无明显相关性。张治华等[6]对国内30例散发性AN患者进行检测发现,NF2基因突变率为39.3%,且其突变类型以片段缺失为主。Welling等[7]通过cDNA微阵列来分析AN患者的基因表达情况,发现NF2基因的第1 460核苷酸位点发生错义突变,甲亮氨酸变成异亮氨酸,从而导致NF2基因的表型发生变化。这种表型趋向于良性。在对NF2的研究中发现可能存在2个突变点,一个是CpG二核苷酸多发生G-A或C-T的转换,另一个由5个CGA密码子的C-T转换引起的高频无义突变。大部分突变常见于外显子中,但体细胞的镶嵌现象也常见于家族性AN中[8]。NF2转录体可以选择性剪切为多个亚型,而只有I型具有抑制细胞生长的功能。Su等[9]在对AN细胞系HEI-193研究中发现,虽然NF2选择性剪切异构体不具有抑制细胞生长的功能,但与AN的形成和发展密切相关。
2 NF2基因的DNA甲基化与AN
DNA甲基化由DNA甲基化转移酶催化,以S-腺苷甲硫氨酸作为甲基供体,将胞嘧啶核苷酸嘧啶环的第5位碳原子甲基化,并与其3′端的鸟嘌呤形成甲基化的CpG。CpG岛的启动子高甲基化与抑癌基因沉默、转录抑制相关,特别是涉及细胞增殖、细胞分化、DNA修复、细胞代谢、细胞黏附和转移等。基因组低甲基化可导致癌基因异常活化、印迹丢失、基因组不稳定的重复DNA序列激活和转位,诱发肿瘤的发生。在AN的研究中,研究人员设想是否存在NF2基因DNA启动子区域的过度甲基化或者低甲基化,进而引起AN的发生?Torres-Martin等[10]对39例AN患者进行甲基化分析,发现存在多种基因的甲基化异常,其中启动子区域PMEPA1基因的低甲基化,其mRNA在AN组织中高表达,并可以调控雄激素受体(androgen receptor, AR),而AR在AN的表达则是下调的。Lee等[11]对30例AN进行研究也发现不存在NF2基因的甲基化。然而Kino等[12]发现23例AN患者中有14例存在NF2基因甲基化,并认为是其引起NF2基因的失活。Gonzalez-Gomez等[13]发现31例AN患者中有6例存在NF2的高度甲基化,认为NF2基因的甲基化异常是AN可能的发生机制。Kullar等[14]在40例散发性AN患者中发现4例NF2的异常甲基化。这些研究结果的差异不能为NF2基因甲基化在AN发生机制中发挥作用提供足够的依据,仍需要进一步探索。
3 Merlin蛋白与AN
Merlin(或称Schwannomin)蛋白由NF2基因编码,含595个氨基酸,分子量为66 kD。Merlin氨基酸序列与细胞骨架连接蛋白4.1超蛋白家族中的ERM家族蛋白具有高度同源性,两者合称为MERM。Merlin和ERM蛋白都是在极化细胞中连接肌动蛋白和细胞膜表面结构相互作用的关键调节因子,参与信号转导通路以抑制细胞生长,但Merlin缺乏ERM蛋白结构中的肌动蛋白结合域。作为细胞骨架和跨膜蛋白的连接者,Merlin蛋白可以获取周围微环境中的信息而调控细胞分裂。细胞分裂的接触抑制对于维持组织稳态不可或缺,它的功能丧失是细胞转化的一个标志,并且会导致肿瘤细胞的分裂、迁移和侵袭。有研究[15]认为,钙黏素的参与或者有丝分裂信号的丧失可激活PAK信号通路,进一步导致Merlin闭合结构增多而引起Merlin活化。在细胞高密度时,Merlin处于超磷酸化状态而抑制细胞生长;在细胞低密度时,Merlin磷酸化并与ezrin,Moesin及CD44形成复合物,促进细胞生长,而Merlin的失活导致细胞间接触抑制丧失并加速了细胞周期进程[16]。CD44通过与Merlin相互作用调节接触抑制-依赖性细胞生长,被认为是控制细胞生长停滞和增殖的节点。它是一种跨膜透明质酸受体,涉及细胞的侵袭、黏附和迁移[17]。
另外,利用免疫荧光和激光共聚焦显微镜同步呈现正常神经鞘膜细胞和AN细胞中Merlin蛋白的亚细胞定位,结果发现Merlin蛋白在正常神经鞘膜细胞和肿瘤细胞的细胞核、核周和细胞质间均存在穿梭运动,且在细胞核内的抑瘤作用比在胞质内更为明显[18]。Schulz等[19]通过对坐骨神经受损的小鼠研究发现,Merlin敲除后小鼠的运动和感觉功能恢复比对照组更为缓慢,而RhoA信号通路的活性也随Merlin的敲除而降低。AN中Merlin蛋白虽处于低水平,但更容易聚集在核周或进入细胞核,并代偿性地发挥抑瘤活性,这可能是临床上观察到AN出现生长停滞的一个原因。除了细胞内穿梭这一特性外,在持续生长的AN中大部分会出现Merlin第518位丝氨酸残基(MerlinSer518)高水平的磷酸化修饰,且MerlinSer518的磷酸化与Ras/PAK(p2l-actived kinase,PAK)增殖信号通路、p-JNK的磷酸化激活具有一致性,提示AN的持续发展可能与Merlin的磷酸化修饰直接相关[20]。PAK在调节第518位丝氨酸磷酸化的同时也调节第10位丝氨酸磷酸化,进而导致肌动蛋白细胞骨架的改变[21]。
4 Merlin蛋白介导的信号转导与AN
研究发现,Merlin蛋白可通过调节细胞外信号而起到抑制生长的作用,且其功能部位大多是细胞膜。Ras-Raf-MEK1/2-细胞外信号调节激酶(ERK)-丝裂原活化蛋白激酶(MAPK)通路偶联丝裂信号促使细胞增殖[22]。Merlin蛋白可以钝化ERK的活性,并且和MLK3(MAP3K混合谱系酶3)在原位相互作用,通过减少Erbin表达改变细胞之间的相互作用,使上皮细胞钙黏蛋白分离,增加细胞增殖,提高ERK磷酸化水平。Erbin表达的减少还能使Merlin蛋白和粘连蛋白分离,并增加磷酸化Merlin蛋白的水平。抑制ERK激酶后,这些表现可以复原。Merlin蛋白的生长抑制与携带生长信号的CD44胞质尾区相互作用,CD44与ERM蛋白及Merlin蛋白的相互作用可将生长信号从细胞膜传入细胞核[23]。Merlin还可以通过抑制受体酪氨酸激酶来限制细胞的增殖,包括ErbB、PDGFR、IGF1R、VEGF等受体。这些来自于受体酪酸激酶下游的Ras/Raf/MEK/ERK和PI3K/AKT致癌通路的靶蛋白,在Merlin蛋白缺陷的神经鞘瘤模型中能活跃表达[24]。
mTORC1为一种能调节细胞生长、增殖、运动以及生存的激酶复合物,受到Merlin蛋白的负调节,且在Merlin蛋白缺陷的神经鞘瘤中活化。这与Lopez-Lago等[25]对间皮瘤细胞系中mTORC1激活与Merlin蛋白缺失相关的结果一致。mTORC1作为Merlin蛋白的效应器,其抑制剂Torin1能够有效阻断Merlin缺陷的脑膜瘤细胞系中mTORC1和AKT通路。Agnihotri等[26]通过对49例AN组织进行微阵列分析,发现PI3K/AKT/mTORC1信号通路明显激活,并存在Merlin蛋白的缺失。通过应用这一通路的抑制剂BEZ235和PKI-587能够明显抑制AN细胞系HEI-193细胞的增殖活性,证实Merlin蛋白的缺失能激活PI3K/AKT/mTORC1信号通路,进而促进AN的发生。
5 问题与展望
近年来,有关AN的分子生物学机制的研究取得一些令人瞩目的成果,针对NF2基因和Merlin蛋白的靶向治疗也是目前基础研究的热点,但对这些分子水平的检测从理论到临床应用尚存在相当的难度。随着基础研究的不断深入,各种新的检测技术不断涌现,以及新型针对NF2基因及其表达产物特异性靶向药物的出现,将为AN的早期诊断和治疗提供科学依据。AN发生的分子机制见图1。
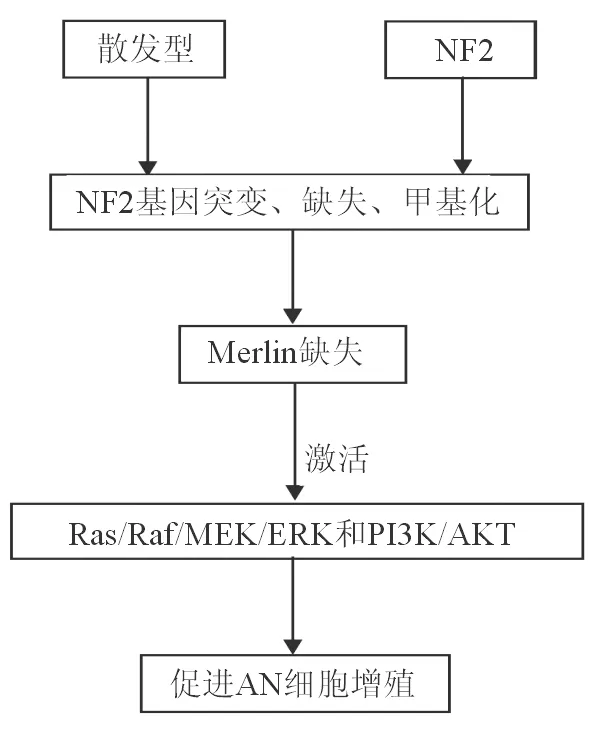
图1. AN发生的分子机制示意图
[ 1 ] Torres-Martin M, Lassaletta L, San-Roman-Montero J, et al. Microarray analysis of gene expression in vestibular schwannomas reveals SPP1/MET signaling pathway and androgen receptor deregulation[J]. Int J Oncol,2013,42(3):848-862.
[ 2 ] Rouleau GA, Merel P, Lutchman M, et al. Alteration in a new gene encoding a putative membrane-organizing protein causes neuro-fibromatosis type 2[J]. Nature,1993,363(6429):515-521.
[ 3 ] Stangerup SE, Tos M, Thomsen J, et al. True incidence of vestibular schwannoma?[J]. Neurosurgery,2010,67(5):1335-1340, 1340.
[ 4 ] Farschtschi S, Kollmann P, Dalchow C, et al. Reduced dosage of bevacizumab in treatment of vestibular schwannomas in patients with neurofibromatosis type 2[J]. Eur Arch Otorhinolaryngol,2015,272(12):3857-3860.
[ 5 ] Zhang Z, Wang Z, Sun L, et al. Mutation spectrum and differential gene expression in cystic and solid vestibular schwannoma[J]. Genet Med,2014,16(3):264-270.
[ 6 ] 张治华,孙莲花,陈洪赛,等. 听神经瘤中NF2基因突变分析[J]. 中华耳科学杂志,2013,11(1):14-18.
[ 7 ] Welling DB, Lasak JM, Akhmametyeva E, et al. cDNA microarray analysis of vestibular schwannomas[J]. Otol Neurotol,2002,23(5):736-748.
[ 8 ] Hilton DA, Hanemann CO. Schwannomas and their pathogenesis[J]. Brain Pathol,2014,24(3):205-220.
[ 9 ] Su F, Zhou Z, Su W, et al. A novel alternative splicing isoform of NF2 identified in human Schwann cells[J]. Oncol Lett,2016,12(2):977-982.
[10] Torres-Martin M, Lassaletta L, de Campos JM, et al. Genome-wide methylation analysis in vestibular schwannomas shows putative mechanisms of gene expression modulation and global hypomethylation at the HOX gene cluster[J]. Genes Chromosomes Cancer,2015,54(4):197-209.
[11] Lee JD, Kwon TJ, Kim UK, et al. Genetic and epigenetic alterations of the NF2 gene in sporadic vestibular schwannomas[J]. PLoS One,2012,7(1):e30418.
[12] Kino T, Takeshima H, Nakao M, et al. Identification of the cis-acting region in the NF2 gene promoter as a potential target for mutation and methylation-dependent silencing in schwannoma[J]. Genes Cells,2001,6(5):441-454.
[13] Gonzalez-Gomez P, Bello MJ, Alonso ME, et al. CpG island methylation in sporadic and neurofibromatis type 2-associated schwannomas[J]. Clin Cancer Res,2003,9(15):5601-5606.
[14] Kullar PJ, Pearson DM, Malley DS, et al. CpG island hypermethylation of the neurofibromatosis type 2 (NF2) gene is rare in sporadic vestibular schwannomas[J]. Neuropathol Appl Neurobiol,2010,36(6):505-514.
[15] Laulajainen M, Muranen T, Carpen O, et al. Protein kinase A—mediated phosphorylation of the NF2 tumor suppressor protein merlin at serine 10 affects the actin cytoskeleton[J]. Oncogene,2008,27(23):3233-3243.
[16] Lallemand D, Manent J, Couvelard A, et al. Merlin regulates transmembrane receptor accumulation and signaling at the plasma membrane in primary mouse Schwann cells and in human schwannomas[J]. Oncogene,2009,28(6):854-865.
[17] Xu H, Tian Y, Yuan X, et al. The role of CD44 in epithelial-mesenchymal transition and cancer development[J]. Onco Targets Ther,2015,8:3783-3792.
[18] Mori T, Gotoh S, Shirakawa M, et al. Structural basis of DDB1- and-Cullin 4-associated Factor 1 (DCAF1) recognition by merlin/NF2 and its implication in tumorigenesis by CD44-mediated inhibition of merlin suppression of DCAF1 function[J]. Genes Cells,2014,19(8):603-619.
[19] Schulz A, Buttner R, Toledo A, et al. Neuron-specific deletion of the Nf2 tumor suppressor impairs functional nerve regeneration[J]. PLoS One,2016,11(7):e159718.
[20] 汪照炎,杨军,吴皓. 听神经瘤不同生物学行为的分子机制研究进展[J]. 中华耳鼻咽喉头颈外科杂志,2016,51(6):473-475.
[21] Li W, Cooper J, Karajannis MA, et al. Merlin: a tumour suppressor with functions at the cell cortex and in the nucleus[J]. EMBO Rep,2012,13(3):204-215.
[22] Chadee DN, Xu D, Hung G, et al. Mixed-lineage kinase 3 regulates B-Raf through maintenance of the B-Raf/Raf-1 complex and inhibition by the NF2 tumor suppressor protein[J]. Proc Natl AcadSci U S A,2006,103(12):4463-4468.
[23] Sun CX, Robb VA, Gutmann DH. Protein 4.1 tumor suppressors: getting a FERM grip on growth regulation[J]. J Cell Sci,2002,115(Pt 21):3991-4000.
[24] Neff BA, Voss SG, Schmitt WR, et al. Inhibition of MEK pathway in vestibular schwannoma cell culture[J]. Laryngoscope,2012,122(10):2269-2278.
[25] Lopez-Lago MA, Okada T, Murillo MM, et al. Loss of the tumor suppressor gene NF2, encoding merlin, constitutively activates integrin-dependent mTORC1 signaling[J]. Mol Cell Biol,2009,29(15):4235-4249.
[26] Agnihotri S, Gugel I, Remke M, et al. Gene-expression profiling elucidates molecular signaling networks that can be therapeutically targeted in vestibular schwannoma[J]. J Neurosurg,2014,121(6):1434-1445.
(本文编辑 杨美琴)
Progress of neurofibromatosis 2 gene and its expression product in the pathogenesis of acoustic neuroma
XUJian-hui,ZHANGTian-yu.
DepartmentofOtolaryngology,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,China
ZHANG Tian-yu, Email: ty.zhang2006@aliyun.com
The incidence of acoustic neuroma (AN) has an increasing trend, and there are still many complications in the traditional surgical treatment. Researchers have begun to focus on the molecular biology of AN, the role of neurofibromatosis 2 gene and Merlin protein in the pathogenesis of AN. (Chin J Ophthalmol and Otorhinolaryngol,2017,17:205-207)
Neurofibromatosis 2 gene;Merlin protein;Acoustic neuroma
国家自然科学基金(81570934)
复旦大学附属眼耳鼻喉科医院耳鼻喉科 上海 200031
张天宇(Email:ty.zhang2006@aliyun.com)
10.14166/j.issn.1671-2420.2017.03.017
2016-11-25)
