双齿围沙蚕多肽的制备及其抗肺癌A549细胞活性
2017-06-22贾盈露丁国芳杨最素余方苗郑媛媛吴宗泽
贾盈露,丁国芳,2,*,杨最素,余方苗,郑媛媛,吴宗泽,陈 锐
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022;2.浙江省海洋水产研究所,浙江 舟山 316021)
双齿围沙蚕多肽的制备及其抗肺癌A549细胞活性
贾盈露1,丁国芳1,2,*,杨最素1,余方苗1,郑媛媛1,吴宗泽1,陈 锐1
(1.浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022;2.浙江省海洋水产研究所,浙江 舟山 316021)
探讨双齿围沙蚕酶解多肽制备的关键技术及其对肺癌A549细胞的作用。以增殖抑制率为指标,确定最佳酶种并根据单因素试验和正交试验确定其最佳酶解工艺。经超滤获得1~3 ku的酶解液,通过阴离子色谱、凝胶过滤色谱和制备色谱对其进行进一步的分离纯化。采用四甲基偶氮唑蓝法测定沙蚕多肽PAP对肺癌A549细胞的增殖抑制率并通过倒置显微镜、吖啶橙/溴化乙锭荧光染色及Hoechst荧光染色观察其细胞形态的变化。实验结果表明最佳酶种是碱性蛋白酶,其最佳酶解条件为:酶解温度50 ℃、pH 11、料液比1∶1(g/mL)、酶解时间6 h、加酶量300 U/ g。经纯化获得的多肽命名为PAP,其氨基酸序列为Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe,且PAP对A549细胞的作用呈时间与剂量依赖关系,作用后细胞出现了凋亡的形态学特征。因此,PAP能明显抑制肺癌细胞A549增殖,可以诱导其发生凋亡而发挥抗肿瘤作用。
双齿围沙蚕;多肽;抗肿瘤;A549细胞;细胞凋亡
肺癌是全球范围内发病率最高的恶性肿瘤,近年来发病率、死亡率逐年上升,已成为肿瘤相关死亡的首要病因[1]。肺癌约80%是非小细胞肺癌,在晚期肺癌中的比例达到总数的40%~50%[2]。目前对于非小细胞肺癌的治疗早期是手术切除,晚期主要是化疗,但化疗的毒副作用及产生的耐药性,影响治疗的有效性,因此寻找精准治疗是热门话题。海洋是一个巨大的药物宝库,从海洋中寻找活性物质已成为热点,从中分离获得的多种活性物质,如肽类、多糖、生物碱、萜类、大环内酯等,有望开发成新型的抗肿瘤药物[3],如从海兔获得的dolastatin 10已进入临床实验[4]。
沙蚕(Nereis)属于环节动物门(Annelida)多毛纲(Polychaeta)沙蚕科(Nereididae),又称为海虫、海蜈蚣、海蚂蟥等,其生物资源丰富,广泛分布在我国沿海地区,近年来人工养殖用于钩鱼的诱饵。沙蚕是一种传统的海洋中药,有清热解毒、消肿止痛、敛疮生肌、治疗痈疮肿毒等功效[7]。学者们从沙蚕体内获得了具有良好药理活性的物质。已有研究[8-11]从日本刺沙蚕体内分离出一种沙蚕丝氨酸蛋白酶,该蛋白酶抑制血小板聚集,改变血液流变学特性,可作为降纤和溶栓药物,预防和治疗心、脑梗塞,脑动脉、肺动脉血栓形成等疾病;同时沙蚕蛋白酶ASP表现出对白血病细胞、肺癌SPC-A-1细胞较强的抗肿瘤活性[12-16]。然而沙蚕酶解多肽的研究较少,对非小细胞肺癌A549细胞的抑制活性目前鲜见报道,本实验以沙蚕为实验材料,探讨酶解多肽的制备及体外抗A549细胞的增殖活性,为开发沙蚕的药用价值提供实验依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与试剂
沙蚕购于舟山市水产养殖场,经浙江海洋大学赵盛龙教授鉴定为双齿围沙蚕(Perinereies aibuhitensis),鲜活购买后待用。
胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、胃蛋白酶 北京亚太恒信生物科技有限公司;胎牛血清 杭州四季青生物工程有限公司;1640粉末培养基 美国Gibco公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Sigma公司;其他试剂均为分析纯。
1.1.2 细胞
人肺癌A549细胞株购自中科院上海细胞库,由本实验室传代培养。
1.2 仪器与设备
DS-1组织捣碎机 上海标准模型厂;GF16RXII高速低温离心机 日本Hitachi公司;ALPHA 1-4/LDplus型冷冻干燥机 德国Christ公司;WRO-70型超纯水仪 美国Millipore公司;BSA124S型电子天平 德国Satorius AG公司;ZHJH-C1209C型超净工作台 上海智诚分析仪器制造公司;Forma3111型CO2培养箱 美国Thermo公司;酶标仪 美国Bio-Rad公司;BX2-FLB3荧光显微镜、CCD-NC6051显微摄像 日本Olympus公司。
1.3 方法
1.3.1 沙蚕酶解液制备工艺优化及多肽分离纯化
1.3.1.1 最佳酶种的选择
将沙蚕洗净后匀浆,分别取10.0 g匀浆样品参照文献[17-20]确定胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胃蛋白酶这5 种酶的酶解温度及pH值进行酶解(酶解条件见表1),固定条件为:加酶量300 U/g、料液比1∶1(g/mL)、酶解时间4 h。结束后在100 ℃水浴中灭活10 min,12 000 r/min冷冻离心15 min后得上清液,采用MTT法测定对A549细胞的增殖抑制率(inhibition rate,IR),获得最佳酶种。
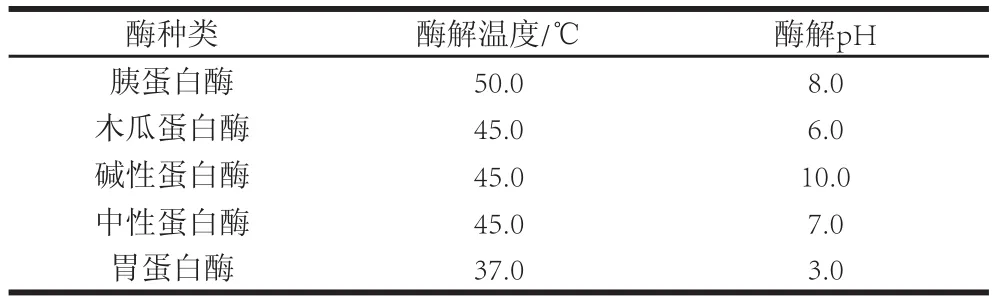
表1 蛋白酶的最适酶解温度和pH值Table1 Optimum temperature and pH for the enzymes
1.3.1.2 酶解条件优化
选用最佳蛋白酶进行酶解实验,通过单因素试验考察酶解温度、酶解pH值、料液比、酶解时间和加酶量5 个因素对水解度[21-23]的影响,单因素试验设计见表2,固定条件为酶解温度45.0 ℃、pH 10、料液比1∶1、酶解时间4 h、加酶量300 U/g。氨基氮含量(amino nitrogen content,ANN)与水解度成正相关,采用甲醛电位滴定法测定氨基氮含量。
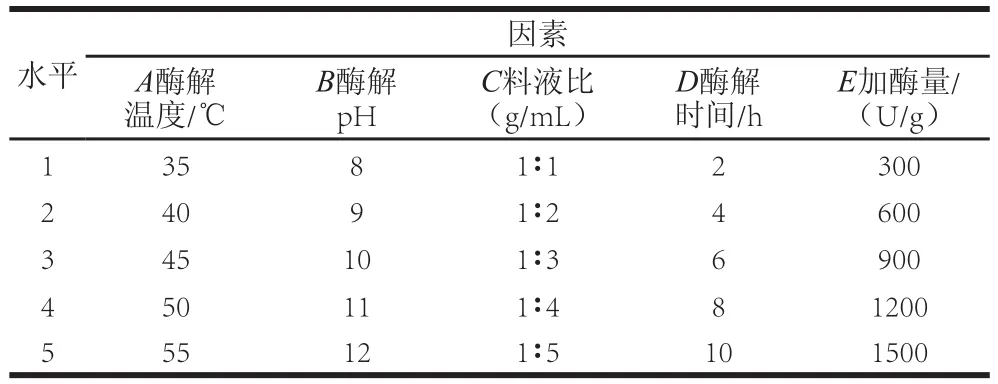
表2 单因素试验因素与水平设计Table2 Factors and their coded levels and actual values used in one-factor-atatime experiments
根据单因素试验结果,采用正交试验以酶解温度、酶解pH值、料液比、酶解时间和加酶量5 个因素,以IR值为指标,确定最佳的酶解条件。
1.3.1.3 沙蚕多肽的超滤分离
酶解上清液用超滤膜进行分离,得到小于1、1~3、3~5、5~8、大于8 ku的酶解液,分别命名为PAP-1、PAP-2、PAP-3、PAP-4和PAP-5。将以上组分收集冷冻干燥后,以MTT法检测当组分质量浓度分别为2 000 mg/L和4 000 mg/L时,作用于A549细胞24 h后的IR,得到活性最高的组分,进行下一步的分离。
1.3.1.4 沙蚕多肽DEAE Sepharose Fast Flow层析分离
将超滤组分通过DEAE Sepharose Fast Flow进一步分离,样品质量浓度为0.25 g/mL,离心取上清液,过0.22 μm滤膜滤后进行洗脱。分离条件:柱尺寸3.6 cm×15 cm;填料为琼脂糖凝胶DEAE Sepharose FF;柱料颗粒直径45~165 µm;上样量2 mL;洗脱液为0~1 mol/L NaCl溶液;洗脱方式为梯度洗脱,每个浓度洗脱一个柱体积;流速5 mL/min;检测波长280 nm;收集体积为5 mL/管。收集各峰,浓缩冷冻干燥,通过MTT法选出活性较好峰组分进一步分离。
1.3.1.5 沙蚕多肽葡聚糖凝胶Sephadex G-25层析分离
将上步中收集到的IR最高的组分通过Sephadex G-25柱进一步分离纯化,样品质量浓度为0.2 g/mL,离心取上清液,过0.22 μm滤膜滤后进行洗脱。分离条件:柱尺寸2.6 cm×60 cm;填料为葡聚糖凝胶G-25;柱料颗粒直径50~150 µm;上样量2 mL;洗脱液为蒸馏水;流速1.1 mL/min;检测波长280 nm;收集体积为3.5 mL/管。收集各峰,浓缩冷冻干燥,通过MTT法选出活性较好峰组分进一步分离。
1.3.1.6 高效液相分离纯化
将抑制A549细胞增殖最强的收集峰分进一步的分离纯化,色谱条件:色谱柱为ZORBAX SB-C18分析型色谱柱(9.6 mm×250 mm,5 μm);检测波长280 nm;流速0.5 mL/min;流动相A为乙腈(含0.05%三氟乙酸),流动相B为超纯水(含0.05%三氟乙酸),采用梯度洗脱方式(20%~100% A洗脱5~20 min);柱温25 ℃;自动进样,进样量100 μL。收集活性最高组分,冷冻干燥,测定氨基酸序列。
1.3.1.7 目标肽的N端测序
由北京亿谱生物技术有限公司完成蛋白质的N端序列检测工作,测序仪器为PPSQ-31A蛋白自动测序仪。最终以PAP命名该活性多肽。
1.3.2 细胞培养
将A549细胞在含有双抗溶液(青霉素G 100 IU/mL、链霉素100 IU/mL)以及10%胎牛血清的1640培养液中培养。置于37 ℃、5% CO2的培养箱中孵育,待长满80%以上时用0.25%胰蛋白酶进行消化传代,取处于对数生长期的细胞进行实验。
1.3.3 抗肺癌A549细胞活性检测
1.3.3.1 MTT法测定细胞增殖抑制活性
将A549细胞以1×105个/mL细胞数接种于96 孔培养板中,每孔培养液200 μL常规条件下培养24 h后,去培养液后,设空白对照组和用药组(PAP质量浓度为1 000、2 000、4 000 mg/L),作用规定时间后弃液,加含有10% MTT的磷酸盐缓冲液(phosphate buffered solution,PBS),孵育4 h后,实验毕弃液,加入150 μL的DMSO充分振荡。酶标仪在490 nm波长处测定吸光度,按以下公式计算细胞IR值,并用SPSS计算半数抑制浓度(half maximal inhibitory concentration,IC50)。

式中:A1为空白对照组的吸光度;A2为用药组的吸光度。
1.3.3.2 倒置显微镜下观察细胞形态
将泡酸处理的盖玻片放入96 孔板中,接种密度为1×105个/mL的A549细胞,常规培养24 h,去除培养液,设空白对照组和药物组(药物质量浓度分别为1 000、2 000、4 000 mg/L),培养24 h后,在倒置显微镜下观察并拍照。
1.3.3.3 AO/EB荧光染色观察细胞形态
细胞接种与实验分组同1.3.3.2节。24 h后,取盖玻片,PBS(pH 7.2)洗2~3 次,用95%乙醇溶液固定30 min,进行吖啶橙/溴化乙锭(acridine orange/ethidium bromide,AO/EB)染色观察。观察前于载玻片上滴加50 µL PBS和6 µL AO/EB混合液,有细胞的一面朝下,荧光显微镜下观察并拍照。
1.3.3.4 Hoechst 33258染色观察细胞形态
细胞接种与实验分组同1.3.3.2节。24 h后,取盖玻片,用4%多聚甲醛固定20 min,PBS冲洗2 次,用Hoechst33258荧光染液(0.5~10 μg/mL)常温染色15 min,PBS清洗2 次后在荧 光显微镜下观察并拍照。
1.4 数据处理
2 结果与分析
2.1 沙蚕多肽酶解工艺优化
2.1.15 种酶的酶解结果

图1 5 种蛋白酶解物对A549细胞的IR值Fig.1 Inhibitory percentages against A549 cells of hydrolysates with five different enzymes
从图1可知,胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、胃蛋白酶5 种蛋白酶解物对A549细胞IR值分别为56.67%、46.29%、62.07%、47.78%、60.51%,其活性大小顺序为:碱性蛋白酶>胃蛋白酶>胰蛋白酶>中性蛋白酶>木瓜蛋白酶。根据细胞IR大小选定碱性蛋白酶进行下一步的筛选实验。
2.1.2 单因素试验结果
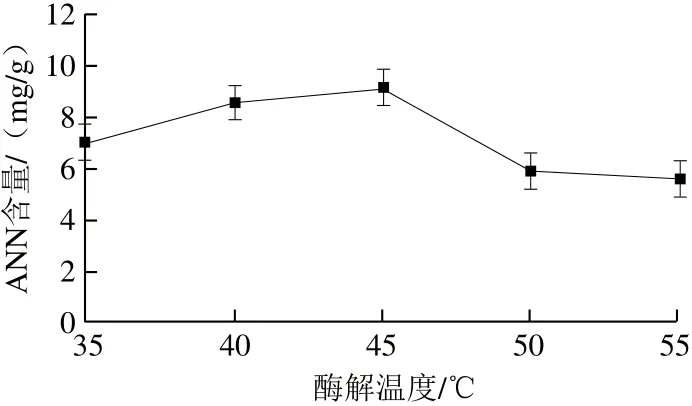
图2 酶解温度对ANN含量的影响Fig.2 Influence of temperature on ANN
由图2可知,温度35~45 ℃范围内,ANN含量随温度升高而增加,当达到酶最佳酶解温度45 ℃时达到最大,达到9.20 mg/g。当温度继续升高,酶活性下降明显,ANN含量下降到5.95 mg/g。故温度45 ℃为最佳。
由图3可知,ANN含量随pH值升高而增加,当达到碱性蛋白酶最佳酶解pH值时达到最大,pH 12时,ANN含量开始下降。因此选择pH值为11。

图3 pH值对ANN含量的影响Fig.3 Influence of pH on ANN
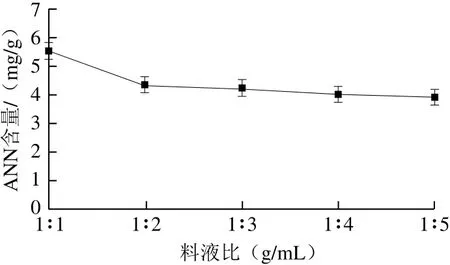
图4 料液比对ANN含量的影响Fig.4 Influence of solid-to-liquid ratio on ANN
由图4可知,随酶解液溶剂用量的增加,ANN含量随之下降。沙蚕体内含水量较大,当料液比为1∶1时,碱性蛋白酶即达到最佳酶解效果,而随溶剂用量增加,ANN含量下降,因此选择料液比为1∶1。

图5 酶解时间对ANN含量的影响Fig.5 Influence of hydrolysis time on ANN
由图5可知,随酶解时间的延长,ANN含量随之增加,到8 h时达到6.83 mg/g,酶解时间继续增加,ANN增加趋于平稳,因此,选择酶解时间为8 h。
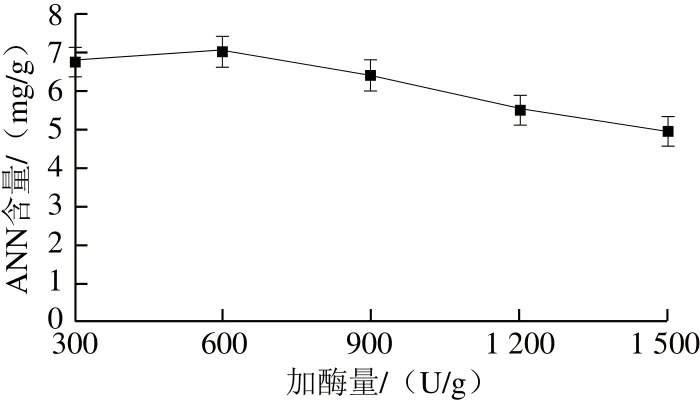
图6 加酶量对ANN含量的影响Fig.6 Influence of enzyme dosage on ANN
由图6可知,加酶量由300 U/g增加至600 U/g时,ANN含量略有增加,之后加酶量增加,ANN含量则下降,因此选择600 U/g。
2.1.3 正交试验结果

表3 正交试验设计及结果Table3 Orthogonal array design in terms of experimental and coded data with response values
以酶解温度、酶解pH值、料液比、酶解时间和加酶量为因素,在不同酶解条件下检测IR,其结果如表3所示。利用极差法分析得到影响IR的各因素主次关系为:C>E>A>B>D。对于IR影响最大的因素是C(料液比);此时的最佳酶解条件为A4B4C1D3E1,即酶解温度50 ℃、酶解pH 11、料液比1∶1、酶解时间6 h、加酶量300 U/g。每个试验重复3 次,得到的结果均为此组合效果最好。在此条件下进行验证实验,8 000 mg/L酶解产物对A549的IR为(97.42±0.83)%,为最优实验结果。
2.2 沙蚕多肽的分离纯化
2.2.1 沙蚕多肽的超滤截留
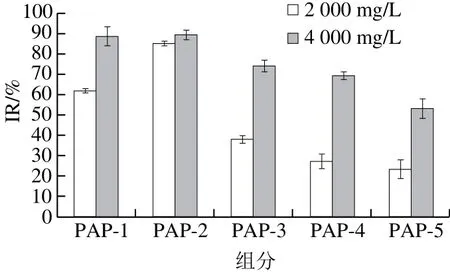
图7 不同分子质量的沙蚕多肽对A549细胞增殖的影响Fig.7 Effects of hydrolates with different molecular weights on the growth of A549 cells
将碱性蛋白酶解获得的沙蚕多肽经超滤得到5 个组分PAP-1、PAP-2、PAP-3、PAP-4和PAP-5,得率分别为0.36%、1.76%、1.24%、0.72%和0.6%。采用MTT法得到对A549细胞的IR值,结果如图7所示,PAP-2组分的IR值最高。
2.2.2 DEAE Sepharose Fast Flow分离结果
将上述步骤得到的PAP-2经DEAE分离得到PAP-2-1、PAP-2-2、PAP-2-3和PAP-2-4四个洗脱峰如图8所示。
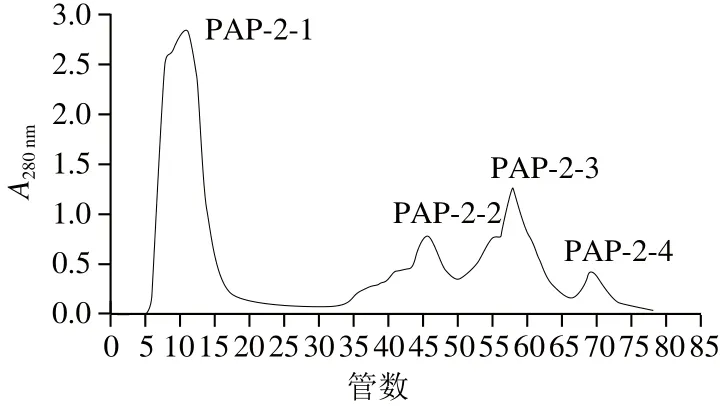
图8 阴离子DEAE Sepharose Fast Flow洗脱峰Fig.8 Elution peaks on DEAE Sepharose Fast Flow
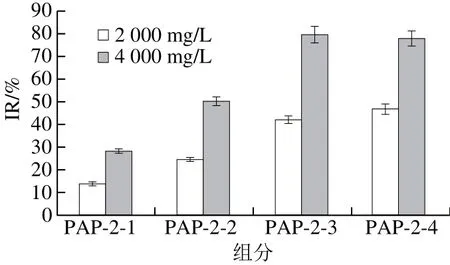
图9 阴离子分离组分对A549细胞增殖的作用Fig.9 Effects of different fractions from DEAE Sepharose Fast Flow chromatography on the growth of A549 cells
由图9可知,以2 000 mg/L的质量浓度作用于A549细胞24 h后的IR分别为(14.1±2.7)%、(24.3±3.0)%、(41.9±1.5)%和(46.7±5.0)%;4 000 mg/L时对A549细胞的IR值则为(28.0±3.0)%、(49.6±2.2)%、(79.3±4.1)%、(77.3±1.8)%。综合故选定PAP-2-3进行进一步分离纯化。
2.2.3 Sephadex G-25分离结果

图10 葡聚糖凝胶柱洗脱峰Fig.10 Elution peaks on Sephadex G-25
由图10可知,将上述步骤得到的PAP-2-3经Sephadex G-25分离得到PAP-2-3-1、PAP-2-3-2两个洗脱峰。
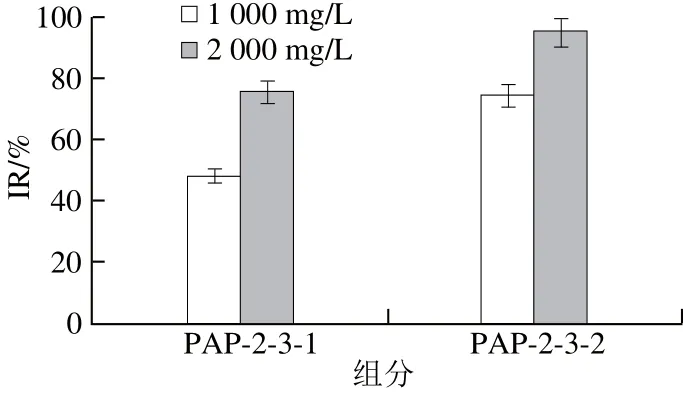
图11 凝胶柱分离组分对A549细胞增殖的作用Fig.11 Effects of different fractions from Sephadex G-25 chromatography on the growth of A549 cells
由图11可知,当质量浓度为1 000 mg/L时,PAP-2-3-1和AP-2-3-2对细胞的IR值分别是(48.2±3.3)%、(74.4±2.4)%;2 000 mg/L时,IR值分别为(75.9±2.1)%、(95.1±1.8)%。PAP-2-3-2的活性最高,故用高效液相色谱仪将峰PAP-2-3-2进一步分离纯化。
2.2.4 活性肽的纯化及其N端氨基酸检测结果
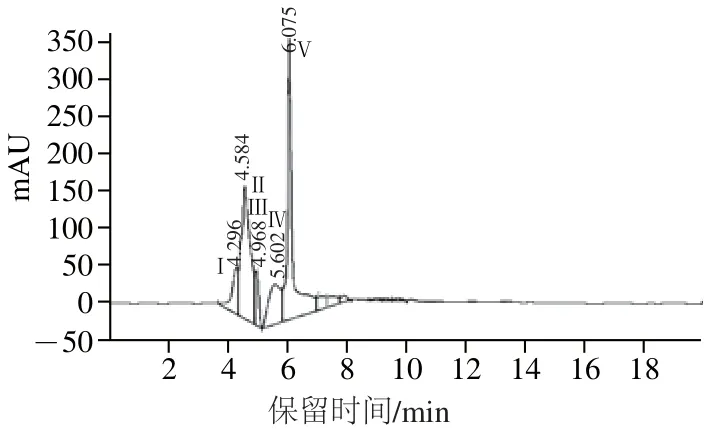
图12 高效液相色谱柱洗脱峰Fig.12 RP-HPLC elution peaks
PAP-2-3-2经高效液相色谱洗脱纯化,当洗脱时间分别为:4.296、4.584、4.968、5.602、6.075 min时,出现如图12所示的5 个洗脱峰(Ⅰ~Ⅴ)。由于峰Ⅰ、Ⅱ、Ⅲ和Ⅳ产率不高,多次收集后仍然很少,因此未进行进一步的收集;峰V产率较高,收集并进行冻干,命名为PAPH。测定800 mg/L PAPH作用于A549细胞24 h后的IR值为(78.3±1.5)%。
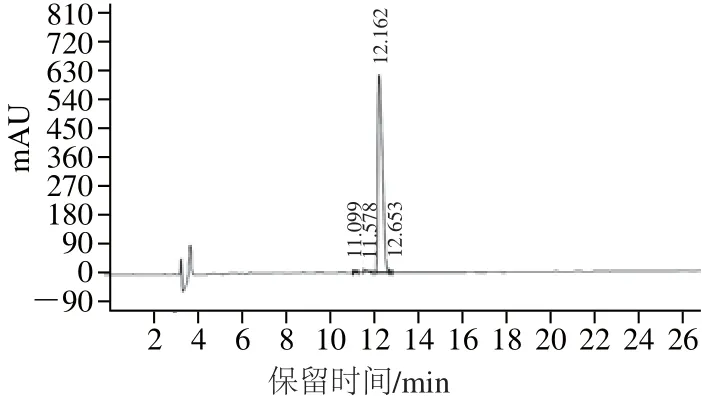
图13 PAP经高效液相色谱洗脱图Fig.13 Elution peaks of PAP by HPLC
由图13可知,在280 nm检测波长处,保留时间为12.16 min时出现主要单一峰,对其收集并进行冻干,命名为PAP。

图14 PAP的质谱图Fig.14 Mass spectrum of PAP
由图14可知,经氨基酸测序确定其氨基酸序列为Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe。经质谱鉴定,其分子质量为1 081.20 D,与氨基酸测序获得的多肽的分子质量一致。
2.3 抗肺癌A549细胞活性
2.3.1 PAP对A549细胞增殖活性的影响
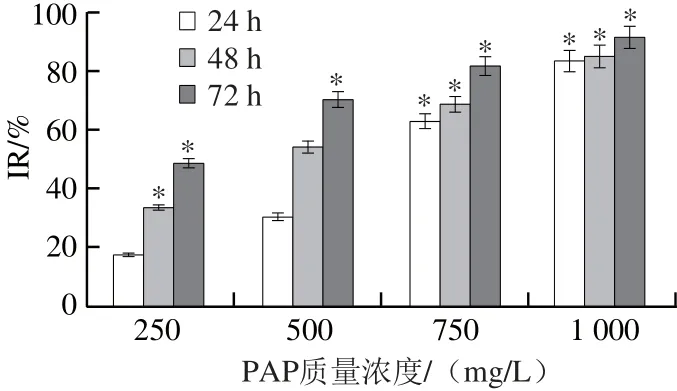
图15 PAP对A549细胞活性的影响Fig.15 Effect of PAP on the proliferation of A549 cells
由图15可知,当250 mg/L PAP作用细胞24 h时,对A549的IR为17.02%,当PAP质量浓度增加至1 000 mg/L时,IR达到83.44%,IC50为662 mg/L;随着作用时间的延长,作用48 h时,IC50为571 mg/L;作用72 h时,IC50为487 mg/L。随着PAP质量浓度的增加和作用时间的延长,抑制指数明显上升,与对照组相比有显著性差异(P<0.05)。
2.3.2 倒置显微镜观察结果

图16 倒置显微镜下的A549细胞(×200)Fig.16 Morphological changes of A549 cells under an inverted microscope (× 200)
如图16所示,空白对照组的A549细胞生长良好,细胞间排列紧密,形态饱满。PAP作用24 h后,如250 mg/L组A549细胞出现细胞间隙增大,轮廓模糊,形态不规则;1 000 mg/L组细胞变圆变亮,形态和正常细胞有明显的区别,同时可见在培养液中悬浮着较多的死细胞。

图17 AO/EB染色后的A549细胞形态(×200)Fig.17 Morphological changes of A549 cells treated with PAP analyzed by AO/EB staining (× 200)
2.3.3 AO/EB荧光染色检测结果PAP作用于A549细胞24 h后,经过AO/EB染色,出现了明显的早期凋亡的形态学特征。实验结果如图17所示,空白对照组无明显凋亡细胞出现,细胞大小均匀,细胞核形态规则,胞核呈现绿色荧光;250 mg/L组细胞出现早期凋亡的现象,胞质出现空泡,核呈现强黄绿色荧光。随着用药质量浓度的增加,1 000 mg/L组早期凋亡的细胞和晚期凋亡的细胞明显增多,细胞核呈固缩状,呈现橘红色荧光。
2.3.4 Hoechst 33258染色检测结果
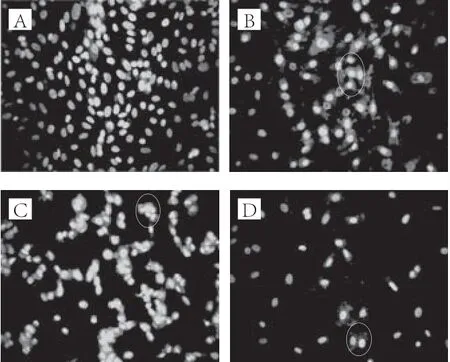
图18 Hoechst 33258染色后的A549细胞形态(×200)Fig.18 Morphological changes of A549 cells treated with PAP analyzed by Hoechst 33258 staining (× 200)
如图18所示,当不同质量浓度的沙蚕多肽作用于A549细胞24 h后,空白对照组呈现均匀的蓝色荧光,PAP作用后,细胞的染色质聚集及边集化明显,且蓝色的荧光变亮,细胞核断裂皱缩呈现出块状或点状的蓝色荧光,视野中细胞数明显减少,细胞形态学的变化随着药物质量浓度的增加也显得越明显。
3 讨 论
生物活性多肽是一类由多个氨基酸通过肽键相连形成的化合物,具有调节人体多种生理功能如抗肿痛、提高免疫、抗病毒和降血压等作用[24]。目前生物活性肽提取方法主要有3 种:直接提取法、合成法和水解法。直接提取法只适合于动植物中存在的一些含量少结构复杂的天然生物活性肽实验室提取;合成法较易获得生物活性肽纯品,但限制于试剂、仪器成本高、副反应多等原因难以实现大规模生产;水解法分为化学水解和生物酶水解,酶解法是通过适当蛋白酶水解蛋白制备生物活性肽的一种方法[25-26],具有条件温和、过程可控、肽得率高和安全的优势。众多学者从海洋生物中提取多肽采用了酶解的方法且表现出较好的抗肿瘤活性,如周军明[27]复合酶解法提取褐藻糖胶,使用Sevag法脱蛋白,经DEAESepharose FF离子交换柱和Sephadex-G150葡聚糖凝胶柱层析获得了具有还原能力和淬灭脂质过氧化能力的均一组分。朱森君等[28]采用木瓜蛋白酶和胰蛋白酶两步酶解获得单环刺螠多糖,得率为6.2%。单环刺螠内脏多糖分子质量约为4.1×103u,为类糖胺聚糖。经过初步体外抗氧化活性研究后发现其具有显著的脂质过氧化物清除活性,半数清除质量浓度为2.47 mg/mL。黄芳芳等[29-30]采用酶解法从乌贼墨中提取获得乌贼多肽,研究结果表明其可以抑制前列腺癌细胞DU-145、PC-3、LNCaP,且具有时间与剂量依赖性。因此本实验使用了胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胃蛋白酶5 种酶,以细胞IR为指标,确定沙蚕多肽的最佳蛋白酶是碱性蛋白酶。为确定碱性蛋白酶的适宜酶解条件范围,以酶解物ANN含量为指标,对每个因素分别进行试验,根据单因素试验结果设计正交试验。通过L16(45)正交试验优化酶解工艺,得到沙蚕多肽的关键技术为:酶解温度50 ℃、酶解pH 11、料液比1∶1、酶解时间6 h、氨基酸序列Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe。
MTT法是一种测定细胞存活和增殖能力的比色法,其原理是黄色的MTT能被活细胞线粒体脱氢酶还原成蓝紫色的甲瓒,而死细胞无这种能力[31]。细胞增殖抑制活性检测中常常会采用MTT法。马艳春等[32]采用MTT法检测不同浓度地龙有效成分对人肾小球系膜细胞(HMC细胞)增殖的影响。结果显示中剂量组40 μg/mL效果最佳。陈美珍等[33]采用MTT法检测发现龙须菜藻红蛋白(phycoerythrin,PE)对人宫颈癌细胞Hela有抑制作用并呈剂量-效应关系,流式细胞术结果显示PE通过阻滞Hela细胞从G2/M期进入S期发挥抑制作用。本实验采用MTT法对PAP对A549细胞的增殖抑制活性进行了检测,实验结果表明,沙蚕多肽对于A549细胞的抑制活性具有时间和剂量依赖关系,即随着PAP质量浓度的增加和时间的延长,细胞的抑制率明显上升。从海洋生物中寻找新型抗癌药物是目前抗癌药物研究的新领域,包括肽类,糖胺聚糖类、大环内脂类等。其中,海洋多肽分子质量小、活性高、毒性低等优点,成为国内外学者研究热点。1987年,Pettit[34]和曹王丽[35]等从海兔(Dolabella auricu-laria)体内分离得到一个线性小肽Dolastatin-10。经Ⅱ期临床实验研究,与其他抗癌药物联合使用可发挥较好的抗癌效果。其衍生物如TZT-1027(auristatin PE)和auristatin PYE在临床也显示出显著的治疗效果。Chi Changfeng等[36]从泥蚶中分离获得了2 种多肽BCP-A(Trp-Pro-Pro)和BCP-B(Gln-Pro),其中BCP-A对PC-3、DU-145、H-1299和HeLa细胞具有很好的增殖抑制活性,且具有时间与剂量依赖性。15 mg/mL的BCP-A作用后,PC-3的早期凋亡率从11.22%增至22.78%。姚如永等[37]提取了一种泥蚶多肽,对A549和Ketr-3细胞具有明显的抑制作用,对A549和Ketr-3的周期阻滞分别为G2/M期和G0/G1期,体内对小鼠移植性肿瘤具有显著的抑制作用。王翠翠等[38-39]通过离子交换、凝胶过滤等方法从文蛤中提取分离获得了一种多肽Mere15,研究发现Mere15可抑制A549细胞生长,抑制率呈剂量和时间依赖性;随着处理时间的增加,使A549细胞的细胞周期阻滞在G2/M期,其作用机制与抑制微管蛋白聚合相关。本实验研究发现当质量浓度为250 mg/L的PAP作用于A549细胞24 h,A549细胞出现凋亡特征。当质量浓度为1 000 mg/L的PAP作用于A549细胞72 h后,IR值达到95.08%,IC50为487 mg/L。
细胞在形态学上的特征性改变是证明其发生凋亡的有力证据[40-41]。通过倒置显微镜、荧光染色实验的变化可以很直观地看到细胞早期凋亡的形态学上变化。在本实验中,通过细胞形态学实验,观察到PAP作用后,A549细胞表现出明显的细胞形态学变化,如细胞间隙变大、形态不规则、体积变小、部分细胞出现空泡及凋亡小体等,随浓度增加效果更加显著。
总之,经碱性蛋白酶提取的沙蚕多肽PAP在体外可以有效抑制A549细胞的增殖,作用24 h后A549细胞即表现出明显的细胞凋亡特征。
4 结 论
本实验采用碱性蛋白酶,在酶解温度50 ℃、酶解pH 11、料液比1∶1、酶解时间6 h、加酶量300 U/g条件下对沙蚕匀浆液进行酶解,经超滤、离子交换色谱、凝胶过滤色谱和制备色谱分离纯化,获得沙蚕酶解多肽PAP,经氨基酸测序发现其氨基酸序列为Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe。研究结果表明,PAP对A549细胞具有增殖抑制活性且具有剂量和时间依赖性。PAP作用后,A549细胞出现凋亡特征,但PAP导致A549细胞凋亡的途径还需通过进一步的实验进行验证。
[1] JEMAL A, SIEGEL R, WARD E, et al. Cancer statistics, 2009[J]. A Cancer Journal for Clinicians, 2009, 59(4): 225-249. DOI:10.3322/ caac.20006.
[2] WINTER E, GRALOW J, DILLER L, et al. Clinical cancer advances 2008: major research advances in cancer treatment, prevention, and screening-a report from the American Society of Clinical Oncology[J]. Journal of Clinical Oncology, 2009, 27(5): 812-826. DOI:10.1200/ JCO.2008.21.2134.
[3] 王淑媛, 王素英. 海洋抗肿瘤活性物质的研究进展[J]. 食品与药品, 2007, 9(3): 55-59. DOI:10.3969/j.issn.1672-979X.2007.03.019.
[4] MARGOLIN K, LONGMATE J, SYNOLD T W, et al. Dolastatin-l0 in melanoma: a phase and pharmokinetic trial of the California cancer consortium[J]. Invest New Drwgs, 2001, 19(4): 335. DOI:10.1002/ cncr.21265.
[5] 王晓琴. 小球藻抗肿瘤多肤的分离及其微囊化研究[D]. 广州: 华南理工大学, 2012.
[6] 张玉艳. 文蛤抗肿瘤多肽的分离纯化及抗肿瘤机理的研究[D].青岛: 中国科学院海洋研究所, 2009.
[7] 管华诗. 中华海洋本草[M]. 上海: 上海科学技术出版社, 2009: 68.
[8] 张云龙. 沙蚕纤溶蛋白酶的生化与分子生物学研究[D]. 长春: 吉林大学, 2007.
[9] 李奇. 沙蚕蛋白酶及同工酶的分离纯化、性质及药用生物活性研究[D]. 长春: 吉林大学, 2008.
[10] 王少华. 日本刺沙蚕蛋白酶的纯化、鉴定及日本刺沙蚕纤溶酶的部分药效学研究[D]. 长春: 吉林大学, 2011.
[11] 白若伦, 李奇, 刘佳, 等. 沙蚕蛋白酶对血小板聚集及血液流变学的影响[J]. 中国新药杂志, 2009, 18(10): 930-933.
[12] 薄其青, 葛鑫, 崔佳乐, 等. 酸性丝氨酸蛋白酶ASPNJ对K562白血病细胞的抑制与损伤作用研究[J]. 中国生化药物杂志, 2012, 33(6):736-739.
[13] 李春花. 酸性丝氨酸蛋白酶对淋巴细胞白血病Jurkat细胞的抑制作用及可能的机制[D]. 长春: 吉林大学, 2015.
[14] GE Xin, BO Qiqing, HONG Xinyu, et al. A novel acidic serine protease, ASPNJ inhibits proliferation, induces apoptosis and enhances chemosusceptibility of acute promyelocytic leukemia cell[J]. Leukemia Research, 2013, 37(12): 1697-1703.
[15] 薄其青. 酸性丝氨酸蛋白酶对人慢性髓性粒细胞株K562细胞作用的初步研究[D]. 长春: 吉林大学, 2012 .
[16] 张国梅, 杨最素, 丁国芳, 等. 沙蚕活性蛋白酶诱导人肺癌SPC-A-1细胞凋亡的机制研究[J]. 现代食品科技, 2015, 31(3): 6-11. DOI:10.13982/j.mfst.1673-9078.2015.3.002.
[17] 蒋霞敏, 林少珍, 王春琳. 双齿围沙蚕营养成分分析[C]//全国首届海洋生物化学与分子生物学学术会议暨全国第五届海洋生命活性物质与天然生化药物学术研讨会. 宜昌: 中国生物化学与分子生物学会, 2004: 250-254.
[18] 曹启猛. 养殖双齿围沙蚕营养成分分析及其纤溶酶的分离纯化[D].青岛: 青岛科技大学, 2016.
[19] 邓志会, 孙贺, 林岩, 等. 一种新型具有纤溶活性的沙蚕金属蛋白酶的分离纯化及鉴定[J]. 中国生物化学与分子生物学报, 2011(8): 768-774.
[20] 宋淑梅, 马睿霄, 金枫清, 等. 双齿围沙蚕化学成分及其浸膏抗肿瘤活性的研究[J]. 河北渔业, 2015(11): 4-7.
[21] 曹荣, 刘淇, 殷邦忠. 响应面法优化海参性腺酶解工艺[J]. 食品科学, 2012, 33(2): 29-33.
[22] 曹艳萍, 杨秀利, 薛成虎, 等. 马铃薯蛋白质酶解制备多肽工艺优化[J].食品科学, 2010, 31(20): 246-250.
[23] 刘丽莉, 王焕, 李丹, 等. 鸡蛋清卵白蛋白酶解工艺优化及其结构性质[J]. 食品科学, 2016, 37(10): 54-61.
[24] KITTS D D, WEILER K. Bioactive proteins and peptides from food sources. Applications of bioprocesses used in isolation and recovery[J]. Current Pharmaceutical Design, 2003, 9(16): 1309-1323. DOI:10.2174/1381612033454883.
[25] 张岩, 吴燕燕, 李来好, 等. 酶法制备海洋活性肽及其功能活性研究进展[C]//广东省食品学会第六次会员大会暨学术研讨会. 广州: 广东省食品学会, 2012: 42-48.
[26] 赵谋明. 酶法制备生物活性肽[C]//中国工业生物技术发展高峰论坛. 天津: 中国生物工程学会, 2013: 51.
[27] 周军明. 褐藻糖胶提取纯化、结构分析及抗氧化研究[D]. 杭州: 浙江大学, 2006.
[28] 朱森君, 陈米娜, 牛庆凤, 等. 单环刺螠内脏多糖结构的分析及其对脂质过氧化物的清除作用[J]. 食品科学, 2015, 36(5): 67-71. DOI:10.7506/spkx1002-6630-201505013.
[29] HUANG F F, YANG Z S, YU D, et al. Sepia ink oligopeptide induces apoptosis in prostate cancer cell lines via caspase-3 activation and elevation of Bax/Bcl-2 ratio[J]. Marine Drugs, 2012, 10(10): 2153-2165. DOI:10.3390/md10102153.
[30] 丁国芳, 黄芳芳, 杨最素, 等. 乌贼墨酶解肽提取方法及其抗肿瘤活性[J]. Chinese Journal of Natural Medicines, 2011, 9(2): 151-155. DOI:10.3724/SP.J.1009.2011.00151.
[31] 卜书红, 李方, 田怀平. MTT比色法进行体外肿瘤药敏实验的影响因素[J]. 北京医学, 2002, 24(5): 349. DOI:10.3969/ j.issn.0253-9713.2002.05.021.
[32] 马艳春, 周波, 孙许涛, 等. MTT法检测地龙有效成分对肾小球系膜细胞增殖的影响[J]. 中医药信息, 2010, 27(1): 34-36. DOI:10.3969/ j.issn.1002-2406.2010.01.013.
[33] 陈美珍, 葛安山, 崔鹏举, 等. 龙须菜藻红蛋白对Hela细胞增殖抑制及其机制的研究[J]. 食品科学, 2007, 28(9): 549-552. DOI:10.3321/ j.issn:1002-6630.2007.09.136.
[34] PETTIT G R, KAMANO Y, HERALD C L, et al. The isolation and structure of a remarkable marine animal antineoplastic constituent, dolastatin 10[J]. Journal of the American Chemical Society, 1987, 109(22): 6883-6885. DOI:10.1021/ja00256a070.
[35] 曹王丽, 宋佳希. 海洋生物抗肿瘤多肽海兔毒素10及其衍生物的研究进展[J]. 医学研究生学报, 2011, 24(11): 1208-1211. DOI:10.3969/ j.issn.1008-8199.2011.11.023.
[36] CHI C F, HU F Y, WANG B, et al. Antioxidant and anticancer peptides from the protein hydrolysate of blood clam (Tegillarca granosa) muscle[J]. Journal of Functional Foods, 2015, 15: 301-313. DOI:10.1016/ j.jff.2015.03.045.
[37] 姚如永, 初晓, 陈守国, 等. 海洋泥蚶多肽抗肿瘤作用的实验研究[J]. 中国药学杂志, 2006, 41(11): 868-870. DOI:10.3321/ j.issn:1001-2494.2006.11.021.
[38] 王翠翠. 文蛤多肽的分离纯化及抗肿瘤机制研究[D]. 青岛: 中国科学院海洋研究所, 2011.
[39] 王翠翠, 刘明, 王凤霞, 等. 文蛤多肽抑制肿瘤细胞微管蛋白聚合[J].中国生化药物杂志, 2012, 33(3): 225-228.
[40] 杨连君, 司晓辉, 王文亮, 等. 六种染色后光镜观察法检测肝癌细胞凋亡[J]. 实用医技杂志, 2006, 13(1): 8-10. DOI:10.3969/ j.issn.1671-5098.2006.01.004.
[41] 朱秀敏. 细胞凋亡的形态特征与分子机制研究进展[J].中国老年学杂志, 2011, 31(13): 2595-2597. DOI:10.3969/ j.issn.1005-9202.2011.13.105.
Anticancer Activity of a Novel Peptide Derived from Hydrolysates of Perinereies aibuhitensis against Lung Cancer A549 Cells
JIA Yinglu1, DING Guofang1,2,*, YANG Zuisu1, YU Fangmiao1, ZHENG Yuanyuan1, WU Zongze1, CHEN Rui1
(1. Key Engineering Research Centers of Marineorganisms Medical Products, School of Food Science and Medical, Zhejiang Ocean University, Zhoushan 316022, China; 2. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316021, China)
The key steps for preparing antitumor peptide from enzymatic hydrolysates of Perinereies aibuhitensis were investigated in the present work. The most suitable enzyme preparation was selected and the optimal hydrolysis conditions allowing high inhibition of cancer cell proliferation were determined using one-factor-at-a-time method and orthogonal array design. A fraction containing peptides with molecular weights of1 3 ku was obtained by ultrafilation of hydrolysates, and it was further purified by sequential ion exchange chromatography, gel filtration chromatography and preparative chromatography. Then, lung cancer A549 cells were used to test the anticaner effect of the purified peptide PAP by methylthiazolyldiphenyltetrazolium bromide (MTT) assay. The morphological changes were observed through an inverted microscope, dual acridine orange/ethidium bromide (AO/EB) fluorescent staining and Hoechst fluorescent staining. The results showed that alcalase was found to be the optimal enzyme for the production of anticancer peptide and that the optimal hydrolysis conditions were determined as follows: temperature, 50 ℃; pH value, 11; solid-to-liquid ratio, 1:1; hydrolysis time,6 h; and enzyme dosage, 300 U/g. The peptide PAP was identified as Ile-Glu-Pro-Gly-Thr-Val-Gly-Met-Met-Phe. Moreover, our results demonstrated that PAP suppressed the proliferation of A549 cells in a time- and dose-dependent manner with morphological features of apoptosis being observed. Therefore, our findings suggest that PAP could inhibit the proliferation of lung cancer A549 cells and induced apoptosis.
Perinereies aibuhitensis; polypeptide; anti-cancer; A549 cell lines; cell apoptosis
10.7506/spkx1002-6630-201712005
R734.2
A
1002-6630(2017)12-0027-09
2016-08-31
国家自然科学基金青年科学基金项目(81001393);2015年度国家星火计划项目(2015GA700044);国家海洋重大计划项目(2015862);浙江省科技厅重大专项(2013C03036);浙江省自然科学基金项目(LS15H30001);浙江省自然科学基金青年资金项目(LQ16H300001);舟山市科技计划项目(2015C31012)
贾盈露(1992—),女,硕士研究生,研究方向为海洋药物、海洋功能食品。E-mail:m18768013696@163.com
*通信作者:丁国芳(1958—),男,教授,本科,研究方向为海洋药物、海洋功能食品。E-mail:dinggf2007@163.com
贾盈露, 丁国芳, 杨最素, 等. 双齿围沙蚕多肽的制备及其抗肺癌A549细胞活性[J]. 食品科学, 2017, 38(12): 27-35.
10.7506/spkx1002-6630-201712005. http://www.spkx.net.cn
JIA Yinglu, DING Guofang, YANG Zuisu, et al. Anticancer activity of a novel peptide derived from hydrolysates of Perinereies aibuhitensis against lung cancer A549 cells[J]. Food Science, 2017, 38(12): 27-35. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201712005. http://www.spkx.net.cn
