野生嗜杀白假丝酵母LFA418的产毒条件优化及其毒素粗提物特性
2017-06-22叶冬青宋育阳刘延琳
李 丽,冯 莉,秦 义,2,叶冬青,宋育阳,2,*,刘延琳,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程 技术研究中心,陕西 杨凌 712100)
野生嗜杀白假丝酵母LFA418的产毒条件优化及其毒素粗提物特性
李 丽1,冯 莉1,秦 义1,2,叶冬青1,宋育阳1,2,*,刘延琳1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程 技术研究中心,陕西 杨凌 712100)
对1 株分离自新疆楼兰葡萄酒厂野生白假丝酵母(Candida albicans)LFA418的嗜杀特征及其粗毒素特性进行研究。结果显示,C. albicans LFA418具有致死克鲁维毕赤酵母(Pichia kluyveri)、贝酵母(Saccharomyces bayanus)、Lachancea thermotolerans和葡萄牙假丝酵母(Candida lusitaniae)的嗜杀性。接种体积分数7% C. albicans LFA418到YEPD液体培养基中,25 ℃培养32 h,可以获得最大产量的嗜杀毒素;利用截留分子质量为8 000 D的透析袋制备的粗毒素,在温度分别-20、4 ℃ 时pH 4.2~4.6和pH 4.2时温度4~20 ℃具有嗜杀活性的稳定性。
嗜杀酵母;嗜杀毒素;白假丝酵母
1963年,Woods等[1]首次在发现啤酒厂发现酿酒酵母(Saccharomyces cerevisiae)具有嗜杀现象。自此,已报道20多个酵母属的90多种酵母具有嗜杀活性,如黑粉菌属(Ustilago)、克鲁维酵母属(Kluyveromyces)、毕赤酵母属(Pichia)、汉逊酵母属(Hansenula)、德巴利酵母属(Debaryomyces)、假丝酵母菌属(Candida)、球拟酵母属(Torulopsis)、隐球酵母属(Cryptococcus)、梅奇酵母属(Metschnikowia)、拟威尔酵母属(Williopsis)和接合酵母属(Zygosaccharomyces)等[2-6]。嗜杀酵母可以分泌毒素(通常是蛋白或外毒素),杀死同种或亲缘关系 比较近的敏感酵母,而无细胞与细胞的接触。嗜杀酵母对自己产生的嗜杀毒素免疫,但是可能对部分酵母产生的嗜杀毒素敏感[7-9]。一种嗜杀毒素特异性地作用于一种或者多种敏感菌[10-11]。自然环境中,嗜杀酵母产生嗜杀毒素与敏感菌株相比可能更有利于竞争有限营养和空间。21世纪早期,研究人员对嗜杀酵母的抗菌机制展开了广泛的研究,嗜杀毒素作为酵母分泌的抗菌复合物[12],存 在于发酵工业、食品工业以及海洋、临床等各种环境中,并且已经被用于抵抗环境中的腐败微生物[4,6,9,12-13]。
研究人员已经发现并筛选出多株葡萄酒酵母中具有嗜杀性的酵母菌株,并对其在自然发酵中的嗜杀特性进行了研究[14-16]。开发利用这种性质,选择性接种嗜杀酵母可以抑制不良的野生酵母,对净化发酵体系,保证发酵的正常进行,保证葡萄酒的品质具有重要意义[6,14,16-19]。嗜杀酵母还可以考虑用来防治水果的腐烂、抵抗对葡萄有害的霉菌感染等[18-19]。但是野生嗜杀酵母的存在,也可能对葡萄酒的发酵造成负面的影响,例如在发酵过程中由于一些特殊的优势群体被少量的嗜杀菌株替代而导致葡萄酒营养缺陷或发酵停滞和减缓[16],会降低葡萄酒品质,这种负面影响也需要进行研究控制。
非酿酒酵母嗜杀毒素相比S. cerevisiae具有较宽的嗜杀谱[20-21],最早在1975年Philliskirk等[22]报道的非酿酒酵母中,包括6 种酵母属:Debaryomyces、Hansenula、Kluyveromyces、Pichia、Candida和Torulopsis。Kluyveromyces wickerhamii、异常毕赤酵母(Pichia anomala)、膜璞毕赤酵母(Pichia membranifaciensand)[20,23]和丝状真菌Ustilago maydis分泌的嗜杀毒素KwKt、PiKt、PMKT2和KP6表现出对酒香酵母和德克酵母的抑制性[6]。另有报道表明,Tetrapisispora phaff i i和P. membranifaciens非S. cerevisiae产生的嗜杀毒素分别能致死Hanseniaspora uvarum[24]和白假丝酵母(C. albicans)[25];Pichia产生的嗜杀毒素能致死Rhodotorula graminis、Rhodotorula mucilaginosa和Schizosaccharomyces pombe[11];Torulaspora delbrueckii产生一种新的嗜杀毒素Kbarr-1,不仅可以致死所有已知的S. cerevisiae,还可以致死Hanseniaspora sp.、Kluyveromyceslactis、Schizosaccharomycespombe、C. albicans、C. tropicalis、C. dubliniensis、C. kefir、C. glabrata、C. parasilopsis、C. krusei、Yarrowia lipolytica和Hansenula mrakii[18]。因此,利用嗜杀毒素来抑制葡萄酒中的不良微生物已进入应用研究阶段。培养条件如培养基、培养时间、培养基pH值、接种量和培养温度对菌株的嗜杀活性具有一定的影响[26]。
本研究利用分离自新疆楼兰葡萄酒厂赤霞珠、品丽珠、蛇龙珠混合发酵的嗜杀性野生C. albicans LFA418,进行嗜杀菌株的产毒条件及其粗毒素的特性研究,以期为采用生物控制葡萄酒不良酵母的抑制提供一定的参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
C. albicans LFA418分离自新疆楼兰葡萄酒厂,赤霞珠、品丽珠、蛇龙珠的混合发酵;敏感菌株S. cerevisiae 1296为西北农林科技大学食品学院罗安伟副教授馈赠。敏感菌株酒酒球菌(Oenococcus oeni)SD-2a为西北农林科技大学葡萄酒学院李华教授实验室馈赠。其他29 株敏感菌株均来自本实验室,见表1。
1.1.2 培养基与试剂
酵母基础培养基(yeast extract protein dextrose,YEPD)[27]:2%葡萄糖、2%蛋白胨、1%酵母浸粉,蒸馏水配制,121 ℃高压灭菌20 min。YEPD-亚甲基蓝(methylene blue,MB)培养基:YEPD培养基用0.2 mol/L磷酸柠檬酸缓冲溶液调pH 4.6,加2%琼脂、0.003% MB,121 ℃高压灭菌20 min。
YNBGS培养基[28]:0.2%葡萄糖、0.67%无氮源酵母浸粉、0.5% (NH4)2SO4、0.25% MgSO4•7H2O,121 ℃高压灭菌20 min。
磷酸-柠檬酸缓冲液:0.2 mol/L磷酸氢二钠和0.1 mol/L柠檬酸溶液按不同体积混合。
牛血清白蛋白(bovine serum albumin,BSA)美国Sigma公司;葡萄糖、酵母浸粉、蛋白胨等均为国产分析纯。
1.2 仪器与设备
MJX型智能霉菌培养箱 宁波江南仪器厂;SW-CJ-1F净化工作台 苏净集团苏州安泰空气技术有限公司;UV-2450紫外分光光度计 日本Shimadzu公司;pHS-3C型精密pH计 上海雷磁仪器厂;Bradford蛋白浓度测定试剂盒 北京索莱宝科技有限公司。
1.3 方法
1.3.1 菌株培养
将-20 ℃保藏的纯种菌株接种20 μL于灭菌冷却后的YEPD培养基中,培养箱28 ℃培养24~48 h,待用。
1.3.2 透析袋使用处理
剪透析袋为小段(10~20 cm),用2%碳酸氢钠和1 mmol/L EDTA(pH 8.0)混合液袋煮沸10 min,蒸馏水清洗。再用1 mmol/L EDTA(pH 8.0)煮沸10 min。冷却后,4 ℃保存。
1.3.3 C. albicans LFA418嗜杀活性的测定及广谱性实验
嗜杀活性的测试采用牛津杯法[29]:将100 μL敏感菌株S. cerevisiae 1296接种至YEPD-MB培养基,均匀涂布(涂布浓度106CFU/mL)。30 min后,YEPD-MB琼脂平板上放置牛津杯(10 mm×8 mm外径),吸取200 μL待测菌液上清液或嗜杀毒素加入到牛津杯中,25 ℃培养48 h。若待测菌为嗜杀菌株,则嗜杀性菌株被一个明确的区域包围,其周围会形成抑菌圈和蓝色的死菌带,用游标卡尺测量抑制圈直径的大小。菌株的广谱性实验采用点样法[30],共30 种不同的敏感菌株。嗜杀毒素的活性用抑菌圈(抑菌圈最外面的直径减去牛津杯的直径)表示,10 mm的抑菌圈相当于嗜杀毒素产生的活性为10 U[31]。
1.3.4 C. albicans LFA418培养条件
1.3.4.1 培养基和培养时间对C. albicans LFA418嗜杀活性的影响
分别接种C. albicans LFA418(菌体浓度106CFU/mL)至100 mL的YEPD液体培养基和100 mL YNBGS液体培养基中,25 ℃培养箱中培养64 h,每隔8 h取样一次,测定OD560nm值,并在YEPD-MB培养基上涂布1296敏感菌株,在平板上放置牛津杯,加入200 μL培养液到牛津杯中,25 ℃培养箱中培养48 h,用游标卡尺测量抑制圈直径的大小,测定C. albicans LFA418的嗜杀活性。
1.3.4.2 接种量对C. albicans LFA418嗜杀性的影响
接种C. albicans LFA418到YEPD液体培养基中,接种量分别为5%、6%、7%、8%、9%和10%,25 ℃培养24 h,牛津杯法测定C. albicans LFA418嗜杀活性。
1.3.4.3 培养基pH值对C. albicans LFA418嗜杀活性的影响
配制不同pH值(3.6、4.0、4.4、4.8、5.2)的YEPD液体培养基,接种C. albicans LFA418,25 ℃培养48 h,牛津杯法测定C. albicans LFA418嗜杀活性。
1.3.4.4 温度对菌株嗜杀活性的影响
将28 ℃培养箱培养的纯化菌株接种8 μL到YEPD-MB鉴定培养基中,分别于18、22、25 ℃和28 ℃培养箱中培养48 h,牛津杯法测定C. albicans LFA418的嗜杀活性。
1.3.5 粗毒素的制备和提取[32]
1.3.5.1 粗毒素制备
供试嗜杀酵母菌株按最佳接种量接种到YEPD液体培养基,柠檬酸-磷酸缓冲溶液调节至最适pH值,放置于25 ℃培养箱中培养32 h,4 ℃、5 000 r/min离心10 min除去酵母细胞,获得无细胞上清液。
1.3.5.2 粗毒素的提取
用0.22 μm滤膜4 ℃过滤上清液,再经80%过饱和的硫酸铵溶液沉淀过夜,4 ℃、8 000 r/min离心20 min得沉淀物。用20 mmol/L柠檬酸-磷酸缓冲液2 mL溶解沉淀,4 ℃用透析袋(分子质量为8 000 D)进行透析。无菌条件下,0.45 μm滤膜过滤,得嗜杀粗毒素,保存在-20 ℃冰箱备用。
1.3.5.3 嗜杀毒素含量测定
采用Bradford法,将待测嗜杀毒素稀释5 倍,经考马斯亮蓝G-250染色,反应3 min,测OD595nm值。利用标准蛋白BSA测OD595nm制得标准曲线(y=2.040 5x,R2= 0.990 3),其中x表示蛋白质量浓度,y表示OD595nm。
1.3.6 粗毒素的稳定性[29]
1.3.6.1 粗毒素的pH值稳定性
将200 μL嗜杀毒素用20 mmol/L柠檬酸-磷酸缓冲溶液(pH 4.0)稀释至2 mL,用20 mmol/L柠檬酸-磷酸缓冲溶液(pH 2.2、8.0)调pH值分别为3.0、3.4、3.8、4.2、4.6、5.0、5.4、6.0、7.0,分别在-20、4、30 ℃条件下放置,24 h后,调pH 4.2,牛津杯法测嗜杀毒素的活性,测得的粗毒素嗜杀活性与处理前的百分比为相对嗜杀活性。
1.3.6.2 粗毒素的温度稳定性
将1 mL嗜杀毒素用20 mmol/L柠檬酸-磷酸缓冲溶液稀释至2 mL,调pH 4.2,分别在4、20、30、40 ℃温度条件下培养4 h,每隔30 min取样1 次,测定嗜杀毒素的活性,0 min的粗蛋白活性作为对照。
1.4 数据处理
2 结果与分析
2.1 C. albicans LFA418的嗜杀特征
2.1.1 C. albicans LFA418的嗜杀性
C. albicans LFA418培养液在YEPD-MB琼脂平板上培养48 h,嗜杀敏感菌株1296在菌落的周围出现明显抑菌圈,见图1。

图1 C. albicans LFA418在YEPD-MB琼脂板上的抑菌圈Fig.1 Inhibition zone caused by C. albicans LFA418 in YEPD-MB agar
2.1.2 菌株C. albicans LFA418的广谱性
利用27 株不同种的酵母菌、1 株霉菌、1 株乳酸菌(酒酒球菌)和1 株大肠杆菌进行了C. albicans LFA418的嗜杀广谱性实验(表1),结果表明,其可以致死P. kluyveri、S. bayanus、L. thermotolerans和C. lusitaniae共4 种敏感菌株。

表1 菌株LFA418对30 种敏感菌株的嗜杀谱Table1 Broad-spectrumof killing activities of LFA418 against 30 kinds of sensitive strains
2.2 培养条件对C. albicans LFA418嗜杀活性的影响
2.2.1 培养基对C. albicans LFA418生长的影响

图2 菌株LFA418在YEPD和YNBGS培养基中的生长曲线(a)和pH值变化曲线(bb)Fig.2 Growth curves and pH changes of C. albicans LFA418 cultivated in YEPD and YNBGS media
C. albicans LFA418在YEPD和YNBGS培养基中均可生长,生长趋势大致相同(图2a),8 h之前为延滞期,8~16 h处于菌体生长的调整期,16~32 h为菌体生长对数期,32~48 h处于稳定期,48 h后为菌体生长的衰亡期。但在32 h后菌株在YEPD培养基中的生长情况明显优于YNBGS培养基。由此可见,YEPD培养基较适于C. albicans LFA418的培养。C. albicans LFA418的发酵过程中,YEPD培养基pH值从5.46到4.68有极少的减少,而YNBGS培养基的pH值从4.41到2.61减少幅度较大,在24 h后进入平稳期(图2b)。
2.2.2 C. albicans LFA418培养时间对嗜杀活性的影响

图3 培养时间对嗜杀活性的影响Fig.3 Effect on the killer activities of killer strains for different growing times
由图3可知,随着C. albicans LFA418培养时间的延长,其嗜杀活性增强。当培养时间达到24 h时,嗜杀活性呈现最大,在随后24~48 h内,嗜杀活性相对稳定,48 h后嗜杀活性快速降低。C. albicans LFA418经YEPD培养比经YNBGS培养所获得的嗜杀活性更强,说明YEPD培养基更适于制备嗜杀毒素。
2.2.3 接种量、pH值和温度对嗜杀活性的影响

表2 不同接种量酵母菌株LFA418的嗜杀活性Table2 Killer toxin activity on the killer yeast at different inoculums
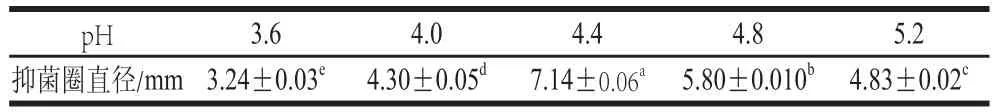
表3 在不同pH值条件下酵母菌株LFA418的嗜杀活性Table3 Killer toxin activity on the killer yeast at different pH values

表4 在不同温度条件下酵母菌株LFA418的抑菌圈的大小Table4 Killer toxin activity on the killer yeast at different temperatures
分别将接种量为5%、6%、7%、8%、9%和10%的C. albicans LFA418培养液,装入置于检测平板的牛津杯中,检测其嗜杀活性,结果显示在接种量为7%时,抑菌圈直径最大,嗜杀活性最强(表2)。C. albicansLFA418的嗜杀活性在pH值为4.4最强(表3)。C. albicans LFA418在温度分别为15~30 ℃培养条件下,25 ℃时抑菌圈直径最大,即其嗜杀活性最强(表4)。
2.3 嗜杀毒素的特性
2.3.1 嗜杀毒素的嗜杀性

图4 C. albicans LFA418嗜杀毒素在YEPD-MB琼脂板上的抑菌圈Fig.4 Inhibition zone caused by C. albicans LFA418 killer toxin in YEPDMB agar
利用Bradford法测定蛋白测得C. albicans LFA418粗毒素的蛋白质量浓度为1.345 mg/mL。由图4可知,C. albicans LFA418嗜杀粗毒素对敏感菌株1296具有嗜杀活性。
2.3.2 嗜杀粗毒素的稳定性
2.3.2.1 pH值对粗毒素嗜杀活性的影响

图5 pH值对C. albicans LFA418嗜杀粗毒素的稳定性Fig.5 Effect of pH values on stability of C. albicans LFA418 killer crude toxin
由图5可知,pH 3.0 时,在-20 ℃和30 ℃条件下,相对嗜杀活性分别为7.2%和8.0%,而在4 ℃条件下,相对嗜杀活性为23.7%;随着pH值升高,3 个温度条件下的相对嗜杀活性也逐渐增加。pH 4.2时,-20 ℃和30 ℃条件下的相对嗜杀活性达到最大,分别为97.9%和55.5%,随后随着pH值的进一步升高,相对嗜杀活性快速下降。pH 4.6时,4 ℃条件下的相对嗜杀活性最大,达到100%。另外发现,在4 ℃、pH 7.0时,虽然粗毒素活性相对极弱,但仍具有活性。
2.3.2.2 温度对粗毒素嗜杀活性的影响

图6 温度对C. albicans LFA418嗜杀粗毒素的稳定性Fig.6 Effects of temperatures on stability of C. albicans LFA418 killer crude toxin
由图6可知,在4 ℃和20 ℃条件下放置3 h后,C. albicans LFA418粗毒素具有嗜杀活性的稳定性。粗毒素在30 ℃条件下放置0.5 h后,嗜杀活性开始减弱,2 h后减弱到70%,3 h后急剧减少到30%。40 ℃时随着时间的变化,嗜杀活性一直在减弱,3.0 h后粗毒素失活。
3 讨 论
对C. albicans LFA418发酵的培养基进行实验,发现在YEPD液体培养中,菌株的嗜杀活性比在YNBGS液体培养基中强,与Mehlomakulu等[23]报道C. pyralidae嗜杀毒素在YEPD中或葡萄汁中添加1%酵母浸粉,嗜杀活性强的结果相同。据报道,由于存在大量的细胞壁β-D-葡聚糖嗜杀毒素受体和抑制嗜杀活性的蛋白,酵母浸粉具有增强嗜杀活性的能力[33]。YEPD中含1%的酵母浸粉,而YNBGS培养基中的酵母浸粉为0.67%无氮源的酵母浸粉,这证实了以前的结果。
研究发现一个有趣的现象,C. albicans LFA418的发酵过程中,2 种培养基中pH值均出现较大幅度的降低,YEPD培养基pH值从5.46降低到4.68,YNBGS培养基的pH值从4.41降低到2.61(图2b)。目前市面上已经有增酸的商业酵母,可以在葡萄酒生产过程中减少酒石酸的添加而来提高葡萄酒的酸度。因此,C. albicans LFA418在发酵过程中引起酸度的增加,具有进一步研究利用的价值。Park等[34]研究表明培养基pH值的改变主要取决于培养基中酵母浸粉与葡萄糖的比例。Ahmad等[35]发现培养基pH值的改变受氮源的影响比碳源的影响大,当将硫酸铵作为氮源时,所有的豇豆根瘤菌菌株产酸。当酵母浸粉作为氮源,发现异源型的酸/碱产物。YNBGS培养基中氮源与碳源的比例大于YEPD培养基,因此可能是菌株引起YNBGS培养基pH值的降低幅度比在YEPD中大的一个原因。本研究中C. albicans LFA418产生嗜杀毒素使得酵母发酵底液的pH值发生大的变化,这可能与菌株发酵过程中碳源和氮源的消耗有关,也可能与菌株细胞或嗜杀机制有关。
嗜杀活性与pH值之间具有相互关系[1],大多研究表明嗜杀酵母产生的嗜杀毒素在一个比较窄的pH值范围,嗜杀毒素最适的嗜杀pH值一般在4.1~4.7[36]。从D. hansenii产生的毒素最适pH值为4.5,Kluyveromyces phaffi和Pichia都有相似的结果[37]。而其他一些研究发现嗜杀毒素具有一个广泛的pH值范围2.0~11.0[38-39]。C. albicans LFA418分泌的粗毒素在pH 4.6时嗜杀活性最强,与Buzzini等[2]报道Candida maltosa产生的粗毒素在pH 4.5具有良好的嗜杀活性相似。
4 结 论
本研究通过对嗜杀性的野生酵母 C.albicans LFA418进行广谱性实验,发现菌株LFA418具有致死葡萄酒败坏酵母克鲁维毕赤酵母P. kluyveri、贝酵母S. uvarum、L. thermotolerans和葡萄牙假丝酵母C. lusitaniae的嗜杀性。
对C. albicans LFA418分泌嗜杀毒素的发酵条件进行优化,结果表明,选用YEPD为发酵C. albicans LFA418制备毒素的培养基,接种7%的嗜杀酵母到YEPD液体培养基中,25 ℃培养32 h,得到最大产量的嗜杀毒素。
研究C. albicans LFA418粗毒素的特性,结果表明,C. albicans LFA418分泌的粗毒素在温度分别-20、4℃时pH 4.2~4.6和pH 4.2时温度4~20 ℃具有嗜杀活性的稳定性。所有酵母的嗜杀毒素本质都是蛋白质,在pH 3~6的酸性条件下具有嗜杀活性,在温度高于25 ℃失活。
目前国内外虽然有报道假丝酵母属具有嗜杀活性,但极少关于葡萄酒中分离的C. albicans嗜杀活性及嗜杀粗蛋白性质的报道。本研究在国内报道了C. albicans LFA418的嗜杀广谱性、产毒条件及其嗜杀毒素的特性。综合来看,C. albicans LFA418菌株是一株新的具有潜力的生物抗菌剂来源菌株。
[1] WOODS D R, BEVAN E A. Studies on the nature of the killer factor produced by Saccharomyces cerevisiae[J]. Journal of General Microbiology, 1968, 51(1): 115-126. DOI:10.1099/00221287-51-1-115.
[2] BUZZINI P, MARTINI A. Large-scale screening of selected Candida maltosa, Debaryomyces hansenii and Pichia anomala killer toxin activity against pathogenic yeasts[J]. Medical Mycology, 2001, 39(6):479-482. DOI:10.1080/mmy.39.6.479.482.
[3] YOUNG T W, YAGIU M. A comparison of the killer character in different yeasts and its classification[J]. Antonie van Leeuwenhoek, 1978, 44(1): 59-77. DOI:10.1007/BF00400077.
[4] LABBANI F Z K, TURCHETTI B, BENNAMOUN L, et al. A novel killer protein from Pichia kluyveri isolated from an Algerian soil:purif i cation and characterization of its in vitro activity against food and beverage spoilage yeasts[J]. Antonie van Leeuwenhoek, 2015, 107(4):961-970. DOI:10.1007/s10482-015-0388-4.
[5] PFEIFFER I, GOLUBEV W I, FARKAS Z, et al. Mycocin production in Cryptococcus aquaticus[J]. Antonie van Leeuwenhoek, 2004, 86(4):369-375. DOI:10.1007/s10482-004-0888-0.
[6] SANTOS A, NAVASCUES E, BRAVO E, et al. Ustilago maydis killer toxin as a new tool for the biocontrol of the wine spoilage yeast Brettanomyces bruxellensis[J]. International Journal of Food Microbiology, 2011, 145(1): 147-154. DOI:10.1016/ j.ijfoodmicro.2010.12.005.
[7] BUSSEY H. Effects of yeast killer factor on sensitive cells[J]. Nature New Biology, 1972, 235(55): 73-75. DOI:10.1038/10.1038/ newbio235073a0.
[8] SELITRENNIKOFF C P. Antifungal proteins[J]. Applied Environmental Microbiology, 2001, 67(7): 2883-2894. DOI:10.2174/22 115528112019990007.
[9] WANG X H, CHI Z M, YUE L X, et al. A marine killer yeast against the pathogenic yeast strain in crab (Portunus trituberculatus) and an optimization of the toxin production[J]. Microbial Research, 2007, 162(1): 77-85. DOI:10.1016/j.micres.2006.09.002.
[10] PFEIFFER P, RADLER F. Comparison of the killer toxin of several yeasts and the purification of a toxin of type K2[J]. Archives of Microbiology, 1984, 137(4): 357-361. DOI:10.1007/BF00410734.
[11] URSZULA B, PAWEL S. The influence of Pichia killer toxins on the wine spoilage yeasts[J]. Potravinarstvo, 2015, 9(1): 284-287. DOI:10.5219/481.
[12] LOWES K F, SHEARMAN C A, PAYNE J, et al. Prevention of yeast spoilage in feed and food by the yeast mycocin HMK[J]. Applied & Environmental Microbiology, 2000, 66(3): 1066-1076. DOI:10.1128/ AEM.66.3.1066-1076.2000.
[13] LIU S Q, TSAO M. Inhibition of spoilage yeasts in cheese by killer yeast Williopsis saturnus var. saturnus[J]. International Journal of Food Microbiology, 2009, 131(2/3): 280-282. DOI:10.1016/ j.ijfoodmicro.2009.03.009.
[14] LOMBARDI S J, LEONARDIS A D, LUSTRATO G, et al. Yeast autolysis in sparkling wine aging: use of killer and sensitive Saccharomyces cerevisiae strains in co-culture[J]. Recent Patents on Biotechnology, 2015, 9(3): 223-230. DOI:10.2174/18722083106661604 14102015.
[15] VADASZ A S, FRANKEN D B, GOVENDER B L, et al. Properties of a wine yeast antagonist, Saccharomyces cerevisiae T206[J]. South African Journal for Enology & Viticulture, 2002, 23: 39-47.
[16] MAQUEDA M, ZAMORA E, ALVAREZ M L, et al. Characterization, ecological distribution, and population dynamics of Saccharomyces sensu stricto killer yeasts in the spontaneous grape must fermentations of southwestern Spain[J]. Applied and Environmental Microbiology, 2012, 78(3): 735-743. DOI:10.1128/AEM.06518-11.
[17] NABARAJ B K W, NICKERSON K W, MALLORY J S, et al. Killer toxin from several food-derived Debaryomyces hansenii strains effective against pathogenic Candida yeasts[J]. International Journal of Food Microbiology, 2016, 222: 23-29. DOI:10.1016/ j.ijfoodmicro.2016.01.016.
[18] RAMÍREZ M, VELÁZQUEZ R, MAQUEDA M, et al. A new wine Torulaspora delbrueckii killer strain with broad antifungal activity and its toxin-encoding double-stranded RNA virus[J]. Frontiers in Microbiology, 2015, 6: 983. DOI:10.3389/fmicb.2015.00983.
[19] RAMÍREZ M, VELÁZQUEZ R, MAQUEDA M, et al. Inf l uence of the dominance of must fermentation by Torulaspora delbrueckii on the malolactic fermentation and organoleptic quality of red table wine[J]. International Journal of Food Microbiology, 2016, 238: 311-319. DOI:10.1016/j.ijfoodmicro.2016.09.029.
[20] COMITINI F, de INGENIIS J, PEPE L, et al. Pichia anomala and Kluyveromyces wickerhamii killer toxins as new tools against Dekkera/Brettanomyces spoilage yeasts[J]. FEMS Microbiology Letters, 2004, 238(1): 235-240. DOI:10.1111/j.1574-6968.2004.tb09761.x.
[21] SANTOS A, MAURO M S, BRAVO E, et al. PMKT2, a new killer toxin from Pichia membranifaciens, and its promising biotechnological properties for control of the spoilage yeast Brettanomyces bruxellensis[J]. Microbiology, 2009, 155(2): 624-634. DOI:10.1099/ mic.0.023663-0.
[22] PHILLISKIRK G, YOUNG T W. The occurrence of killer character in yeasts of various genera[J]. Antonie van Leeuwenhoek, 1975, 41(2):147-151. DOI:10.1007/BF02565046.
[23] MEHLOMAKULU N N, SETATI M E, DIVOL B. Characterization of novel killer toxins secreted by wine-related non-Saccharomyces yeasts and their action on Brettanomyces spp.[J]. International Journal of Food Microbiology, 2014, 188: 83-91. DOI:10.1016/j.ijfoodmicro.2014.07.015.
[24] COMITINI F, CIANI M. The zymocidial activity of Tetrapisispora phaff i i in the control of Hanseniaspora uvarum during the early stages of winemaking[J]. Letters in Applied Microbiology, 2010, 50(1): 50-56. DOI:10.1111/j.1472-765X.2009.02754.x.
[25] SANTOS A, MARQUINA D. Killer toxin of Pichia membranifaciens and its possible use as a biocontrol agent against grey mould disease of grapevine[J]. Microbiology, 2004, 150(8): 2527-2534. DOI:10.1099/ mic.0.27071-0.
[26] CESAR M, JOSE M P, GLORIA F, et al. Improvement of enzyme activity, stability and selectivity via immobilization techniques[J]. Enzyme and Microbial Technology, 2007, 40(6): 1451-1463. DOI:10.1016/j.enzmictec.2007.01.018.
[27] PAYNE W E, GARRELS J I. Yeast Protein database (YPD): a database for the complete proteome of Saccharomyces cerevisiae[J]. Nucleic Acids Research, 1997, 25(1): 57-62. DOI:10.1093/nar/25.1.57.
[28] ELISABETH F, ULRIKA D, MARIANNE E B, et al. Physiological characteristics of the biocontrol yeast Pichia anomala J121[J]. FEMS Yeast Research, 2002, 2(3): 395-402. DOI:10.1111/j.1567-1364.2002. tb00109.x.
[29] SOARES G A M, SATO H H. Characterization of the Saccharomyces cerevisae Y500-4L killer toxin[J]. Brazilian Journal of Microbiology, 2000, 31(4): 291-297. DOI:10.1590/S1517-83822000000400010.
[30] MIGUEL F. Killer phenotype of indigenous yeasts isolated from Argentinian wine cellars and their potential starter cultures for winemaking[J]. Biotechnology Letters, 2011, 33(11): 2177-2183. DOI:10.1007/ s10529-011-0674-9.
[31] RADLER F, SCHMITT M J, MEYER B. Killer toxin of Hanseniaspora uvarum[J]. Archives of Microbiology, 1990, 154(2): 175-178. DOI:10.1007/BF00423329.
[32] CHISE S, SAYUKI N. Purif i cation and properties of the killer toxin produced by a halotolerant yeast, Pichia farinosa[J]. Agricultural and Biological Chemistry, 1989, 53(10): 2599-2604. DOI:10.1271/ bbb1961.53.2599.
[33] YAP N A, LOPES M B, LANGRIDGE P. The incidence of killer activity of non-Saccharomyces yeasts towards indigenous yeast species of grape must: potential application in wine fermentation[J]. Journal of Applied Microbiology, 2000, 89(3): 381-389. DOI:10.1046/j.1365-2672.2000.01124.x.
[34] PARK C B, LEE S B. Ammonia production from yeast extract and its effect growth of the hyperthermophilic archaeon Sulfolobus solfataricus[J]. Biotechnology and Bioprocess Engineering, 1998, 3(2): 115-118. DOI:10.1007/BF02932514.
[35] AHMAD M H, SMITH E. Utilization of carbon and nitrogen sources and acid/alkali production by cowpea rhizobia[J]. Plant and Soil, 1985, 86(2): 279-282. DOI:10.1007/BF02182904.
[36] CHEN W B, HAN Y F, JONG S C, et al. Isolation, purif i cation and characterization of a killer protein from Schwanniomyces occidentalis[J]. Applied and Environmental Microbiology, 2001, 66(12): 5348-5352. DOI:10.1128/AEM.66.12.5348-5352.2000.
[37] CECCATO-ANTONINI S R, TOSTA C D, da SILVA A C. Determination of yeast killer activity in fermenting sugarcane juice using selected ethanol making strains[J]. Brazilian Archives of Biology & Technology, 2004, 47(1): 13-23. DOI:10.1590/S1516-89132004000100003.
[38] KOMIYAMA T, OHTA T, FURUICHI Y, et al. Structure and activity of HYI killer toxin from Hansenula saturnus[J]. Biological & Pharmaceutical Bulletin, 1995, 18(8): 1057-1059. DOI:10.1248/bpb.18.1057.
[39] 高晓航, 李雪雁, 孙春丽. 贺兰山东麓葡萄酒产区酿酒酵母的分离及其主要特性研究[J]. 食品与发酵工程, 2016, 342(6): 62-66. DOI:10.13995/j.cnki.11-1802/ts.201606011.
Optimization of Culture Conditions for Toxin Production by Wild Killer Yeast Candida albicans LFA418
LI Li1, FENG Li1, QIN Yi1,2, YE Dongqing1, SONG Yuyang1,2,*, LIU Yanlin1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Wine and Viticulture, Yangling 712100, China)
The killer property Candida albicans LFA418, a wild strain isolated from a winery in Loulan of Northwest China’s Xinjiang region. The killer feature and crude killer toxin characteristics of a wild yeast strain Candida albicans isolated from Loulan winery of Xinjiang were studied. The results indicated that Candida albicans LFA418 had a wide spectrum of killering activity against Pichia kluyveri, Saccharomyces bayanus, Lachancea thermotolerans and Candida lusitaniae. The optimal culture conditions to obtain the maximum yield of killer toxins were as follows: inoculums of C. albicans LFA418, 7% (V/ V); temperature, 25 ℃, and culture time, 32 h. The activity of crude killer toxins was stable at pH 4.2-4.6 when temperature was -20 ℃ and4 ℃ and temperature 4-20 ℃ at pH 4.2.
killer yeast; killer toxin; Candida albicans
10.7506/spkx1002-6630-201712008
TS261.1
A
1002-6630(2017)12-0050-07
李丽, 冯莉, 秦义, 等. 野生嗜杀白假丝酵母LFA418的产毒条件优化及其毒素粗提物特性[J]. 食品科学, 2017, 38(12): 50-56.
10.7506/spkx1002-6630-201712008. http://www.spkx.net.cn
LI Li, FENG Li, QIN Yi, et al. Optimization of culture conditions for toxin production by wild killer yeast Candida albicans LFA418[J]. Food Science, 2017, 38(12): 50-56. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712008. http://www.spkx.net.cn
2016-12-18
国家现代农业(葡萄)产业技术体系建设专项(CARS-30-jg-3);国家自然科学基金面上项目(31571812)
李丽(1984—)女,博士研究生,研究方向为酿酒微生物。E-mail:286928693@qq.com
*通信作者:宋育阳(1983—),女,讲师,博士,研究方向为葡萄酒微生物学。E-mail:308573616@qq.com刘延琳(1966—),女,教授,博士,研究方向为葡萄酒及酿酒微生物。E-mail:yanlinliu@nwsuaf.edu.cn
