双齿围沙蚕β-1,3-葡萄糖苷酶分离纯化及其酶学性质
2017-06-22于海慧宋淑梅佟长青
于海慧,宋淑梅,佟长青,李 伟
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
双齿围沙蚕β-1,3-葡萄糖苷酶分离纯化及其酶学性质
于海慧,宋淑梅,佟长青*,李 伟*
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
从双齿围沙蚕中提取、分离纯化β-1,3-葡萄糖苷酶,并研究其酶学性质。通过80%饱和度(NH4)2SO4沉淀从双齿围沙蚕中得到粗β-1,3-葡萄糖苷酶,粗酶依次经DEAE-52离子交换层析、Sephadex G-100凝胶过滤层析进行分离纯化。酶纯化倍数为35.74,回收率为39.49%。SDS-PAGE检测表明其分子量为28.7 kDa。该酶最适温度为50 ℃,最适pH为7,Km为8.2×10-4mol/L,Vmax为3.2×10-4μmol/h。金属离子K+、Mg2+、Fe2+、Ba2+、Ca2+对β-1,3-葡萄糖苷酶酶活力影响较小,Al3+、Cu2+、Zn2+、Ag+对β-1,3-葡萄糖苷酶酶活力抑制较大,其中Zn2+抑制作用最强。双齿围沙蚕可作为β-1,3-葡萄糖苷酶的潜在来源。
双齿围沙蚕,β-1,3-葡萄糖苷酶,分离纯化,酶学性质,Km
双齿围沙蚕(Perinereisaibuhitensis)是滩涂养殖的优势品种,具有很高的生态和经济价值。研究表明,沙蚕具有较高的营养价值,含有丰富的粗脂肪、粗蛋白、不饱和脂肪酸、人体必需的八种氨基酸以及多种矿物质和维生素[1-2]。邹文秀等[3]对双齿围沙蚕的营养成分进行分析,发现双齿围沙蚕的主要成分依次为蛋白质、碳水化合物、灰分、粗脂肪,含量占干重的比例分别为66.75%、11.27%、8.65%、13.30%。刘向辉等[4]研究发现沙蚕组织内含有丰富的氨基酸(67.43%)、不饱和脂肪酸(14.24%,其中EPA为6.53%)以及Sn、Hg、Cu、Se、Zn、Cd等微量元素。
人们对沙蚕中生物活性物质进行了大量研究。如邓志会等从沙蚕体内分离纯化得到一种新型金属蛋白酶(NVMP,28~32 kDa),并对这种沙蚕金属蛋白酶对家兔新鲜血液的抗凝血和血栓溶解作用进行了研究[5-6]。张云龙等[7]分离纯化得到一种等电点为3.0,相对分子质量为3.0×105Da左右的沙蚕蛋白酶(溶栓素)。潘卫东等[8]从双齿围沙蚕中发现一种新的碱性蛋白,该碱性蛋白具有显著抗菌活性及抗癌作用。然而到目前为止,从双齿围沙蚕中提取、纯化出β-1,3-葡萄糖苷酶方面的研究还未见报道。
β-1,3-葡萄糖苷酶(EC3.2.1.21)首次在苦杏仁中被发现,后来发现它还广泛存在于其他植物、动物肠道以及细菌、真菌、酵母、霉菌等微生物中[9-12]。它属于纤维素酶类,能水解结合在末端的非还原性β-D-葡萄糖苷键,释放出β-D-葡萄糖和相应的配基。β-1,3-葡萄糖苷酶在食品领域有着广泛的应用。它可以水解以糖苷形式存在的香气成分,为果酒增香,提高果酒品质。β-1,3-葡萄糖苷酶还具有改良果汁风味的作用。目前,微生物源β-1,3-葡萄糖苷酶研究较多[13-17],而无脊椎动物源β-1,3-葡萄糖苷酶研究较少。双齿围沙蚕生活于高盐环境中,其参与代谢的酶具有特殊性。本文以双齿围沙蚕为材料提取其中的β-1,3-葡萄糖苷酶,并对其性质进行初步探讨,以期为利用双齿围沙蚕资源提供基础数据。
1 材料与方法
1.1 材料与仪器
双齿围沙蚕 购于大连市兴工街水产品批发市场;对硝基苯-β-D-葡萄糖苷(p-Nitrophenylβ-D-glucopyranoside) 购于Sigma公司;DEAE-52纤维素阴离子交换剂、Sephadex G-100、低分子量标准蛋白 均购于北京索莱宝科技有限公司;三(羟甲基)氨基甲烷 国药集团化学试剂有限公司。
GL21M型低温冷冻离心机 长沙湘仪离心机仪器有限公司;B-2A型组织捣碎机 天津市泰斯特仪器有限公司;PHS-3C型精密pH计 上海精密科学仪器股份有限公司;BT100-1J型蠕动泵 保定兰格恒流泵有限公司;FD-1型冷冻干燥机 上海博通经贸有限公司;SBS-100型数控计滴自动部分收集器 上海沪西分析仪器厂有限公司;85-1型磁力搅拌器 江苏省金坛市医疗仪器厂;UV-1750型紫外分光光度计 岛津仪器(苏州)有限公司;DK-98-Ⅱ型电热恒温水浴锅 天津市泰斯特仪器有限公司;酶标仪 德国Thermo公司。
1.2 实验方法
1.2.1β-1,3-葡萄糖苷酶的提取分离 将新鲜的1 kg双齿围沙蚕清洗晾干后匀浆,加入3000 mL 0.9% NaCl溶液,4 ℃抽提过夜。然后9000 r/min、4 ℃条件下离心20 min,取上清液。加(NH4)2SO4至80%饱和度,沉淀过夜。然后9000 r/min、4 ℃条件下离心20 min,取沉淀。将沉淀溶于一定量去离子水中,透析后冻干,得到β-1,3-葡萄糖苷酶粗品,冷冻保藏备用。
取适量粗酶溶解于Tris-HCl缓冲液,于10000 r/min、4 ℃离心10 min,取上清液加到平衡好的DEAE-52层析柱(2.5 cm×13 cm)中,待上清液全部吸附好后,先用Tris-HCl缓冲液洗脱除去未吸附的物质,然后用1 mol/L的NaCl的Tris-HCl缓冲液进行梯度洗脱,流速为0.75 mL/min,每管收集3 mL。检测各管OD280和β-1,3-葡萄糖苷酶活力,收集有酶活力的层析组分进行透析冻干。
将经DEAE-52分离后收集的具有糖苷酶活力组分,以Tris-HCl缓冲液配成10 mg/mL样液,上样于Sephadex G-100层析柱(2.5 cm×100 cm)中,然后用Tris-HCl缓冲液洗脱,流速为0.3 mL/min,每管收集3 mL。检测各管OD280和糖苷酶活力,收集有活力的层析组分进行透析冻干。
1.2.2β-1,3-葡萄糖苷酶相对分子质量测定 采用SDS-PAGE,以低分子量标准蛋白为标准,测定β-1,3-葡萄糖苷酶相对分子质量。分离胶为15%聚丙烯酰胺,浓缩胶为5%聚丙烯酰胺。
1.2.3β-1,3-葡萄糖苷酶活力测定 分别取0、20、40、60、80、100、120、125 μL 0.1 mmol/L的对硝基苯酚溶液,125、105、85、65、45、25、5、0 μL H2O及100 μL HAc-NaAc缓冲液(pH5.4、0.05 mol/L)置于96孔板中,在37 ℃水浴中反应2 h,加入50 μL 0.5 mol/L Na2CO3溶液以终止反应,用酶标仪在405 nm波长下测其吸光值的变化。以OD值为纵坐标(y),对硝基苯酚量(×10-10mol)为横坐标(x),得标准曲线为y=0.4905x+0.0166,R2=0.9996。
分别取50 μL 0.01 mg/mLβ-1,3-葡萄糖苷酶液,100 μL HAc-NaAc缓冲液(0.05 mol/L,pH5.4)以及100 μL对硝基苯-β-D-葡萄糖苷溶液(5 mg/mL)置于96孔板中,37 ℃水浴2 h,加入50 μL 0.5 mol/L的Na2CO3溶液终止反应,用酶标仪在405 nm处测定吸光值。
在一定温度和pH下,将每分钟生成1 μmol对硝基苯酚所消耗的酶的量定义为1个酶活力单位。根据对硝基苯酚浓度吸光度标准曲线,计算酶活力。
1.2.4β-1,3-葡萄糖苷酶的理化性质
1.2.4.1 温度对β-1,3-葡萄糖苷酶活性的影响 分别取50 μL 0.01 mg/mLβ-1,3-葡萄糖苷酶溶液,100 μL HAc-NaAc缓冲液(0.05 mol/L,pH5.4)以及100 μL对硝基苯-β-D-葡萄糖苷溶液(10 mg/mL)置于96孔板中,分别放置在20、30、37、40、50、60、70、80 ℃的水浴锅中,反应2 h后,加入50 μL 0.5 mol/L的Na2CO3溶液终止反应,在405 nm处测定吸光值,以考察温度对β-1,3-葡萄糖苷酶活力的影响。以pH5.4、37 ℃反应2 h的酶活力(设为100%)为对照,考察不同温度对酶活力影响,确定β-1,3-葡萄糖苷酶的最适反应温度。
1.2.4.2 pH对β-1,3-葡萄糖苷酶活性的影响 分别取50 μLβ-1,3-葡萄糖苷酶样品溶液,100 μL对硝基苯-β-D-葡萄糖苷溶液(10 mg/mL)以及100 μL pH分别为3、4、5、5.4、6、7、8、9、10的HAc-NaAc缓冲液(0.05 mol/L)置于96孔板中,37 ℃水浴2 h,然后加入50 μL 0.5 mol/L的Na2CO3溶液终止反应,用酶标仪在405 nm处测定吸光值,以考察pH对β-1,3-葡萄糖苷酶活力的影响。以pH5.4、37 ℃反应2 h的酶活力(设为100%)为对照,考察不同pH对酶活力的影响,确定糖苷酶的最适pH。
1.2.4.3 金属离子对β-1,3-葡萄糖苷酶的影响 研究金属离子K+、Mg2+、Fe2+、Ba2+、Ca2+、Al3+、Cu2+、Zn2+、Ag+对β-1,3-葡萄糖苷酶酶活力的影响,用HAc-NaAc缓冲液(0.05 mol/L,pH5.4)分别将KCl、MgCl2、FeSO4、BaCl2、CaCl2、Al(OH)3、CuSO4、Zn(CH3COO)2、AgNO3配制成浓度为0.1 g/mL的金属离子溶液。分别取50 μL糖苷酶样品溶液,100 μL对硝基苯-β-D-葡萄糖苷溶液(10 mg/mL)以及100 μL含不同金属离子的HAc-NaAc缓冲液(0.05 mol/L,pH5.4)置于0.5 mL的离心管中,37 ℃水浴2 h,然后加入50 μL 0.5 mol/L的Na2CO3溶液终止反应。4 ℃,10000 r/min离心6 min,取上清于96孔板中,然后用酶标仪在405 nm处测定吸光值,用以考察金属离子对糖苷酶活力的影响。以未加金属离子的糖苷酶为对照,其相对酶活力为100%。
1.2.5β-1,3-葡萄糖苷酶动力学 分别取50 μL糖苷酶样品溶液、100 μL HAc-NaAc缓冲液(0.05 mol/L,pH5.4)以及100 μL浓度分别为0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mg/mL的对硝基苯-β-D-葡萄糖苷溶液,置于96孔板中,37 ℃水浴2 h,然后加入50 μL 0.5 mol/L的Na2CO3溶液终止反应,然后用酶标仪在405 nm处测定吸光值。
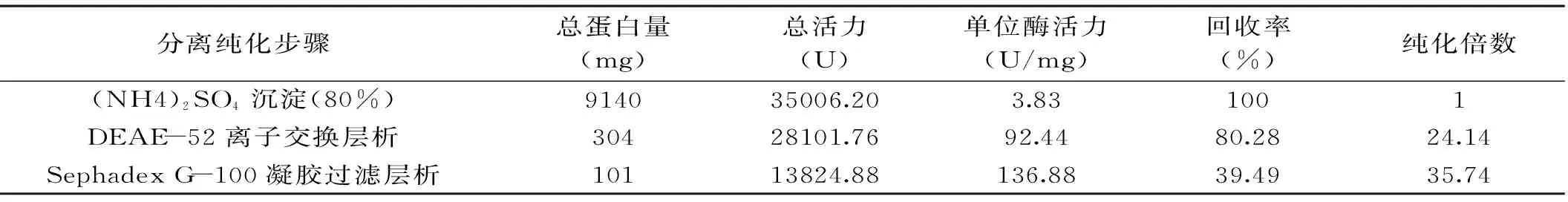
表1 β-1,3-葡萄糖苷酶分离纯化各步的结果Table 1 Summary of the purification for β-1,3-glucosidase
以单位时间内产物生成量表示反应速率v,采用Lineweaver-Burk作图法作图,以1/v为纵坐标,1/[S]为横坐标,绘制双倒数曲线,横截距即为-1/Km,纵截距即为1/Vmax,进而得到糖苷酶动力学方程,求出Km和Vmax值。
1.3 数据处理
所有实验数据均以平均值±标准差表示,用SPSS 13.0软件进行单因素方差分析,用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与讨论
2.1 糖苷酶的分离纯化
采用80%饱和度(NH4)2SO4沉淀法从双齿围沙蚕中得到粗β-1,3-葡萄糖苷酶6 mL(50 mg/mL)通过DEAE-52离子交换层析进行分离。用Tris-HCl缓冲液进行洗脱,当OD280不再变化后,再用1 mol/L NaCl的Tris-HCl缓冲液进行梯度洗脱,检测各管洗脱液的OD280值和酶活力值(OD405),得层析图如图1。如图1所示,经DEAE-52层析后得到两个主要蛋白(OD280)峰,第二个蛋白峰组具有β-1,3-葡萄糖苷酶活力。收集具有酶活力的组分,冷冻干燥。

图1 粗酶经DEAE-52离子交换层析分离纯化Fig.1 Ion exchange chromatography of crude enzyme on DEAE-52
将上述收集的具有糖苷酶活力的样品继续经Sephadex G-100凝胶过滤层析进一步分离纯化。同时检测OD280和酶活力值(OD405),结果如图2。经Sephadex G-100凝胶过滤层析后得到一个蛋白峰,且该层析峰具有β-1,3-葡萄糖苷酶活力。收集具有糖苷酶活力的组分,冷冻干燥。
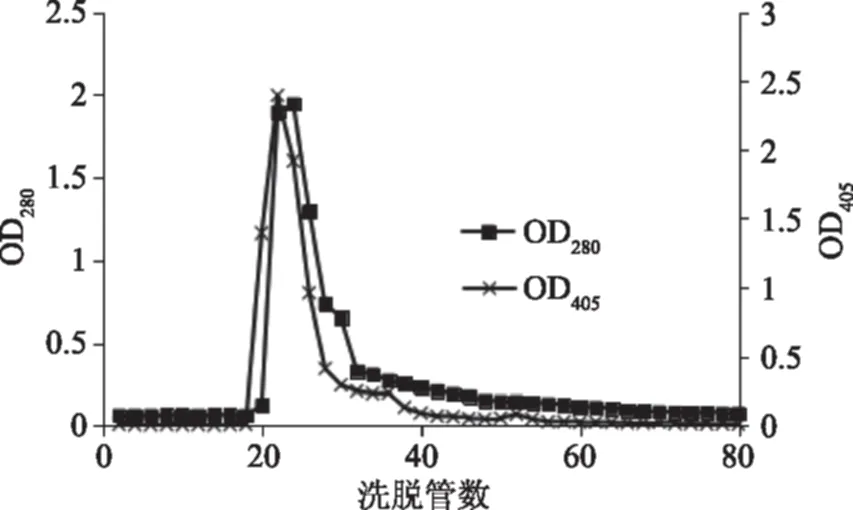
图2 Sephadex G-100分子筛层析Fig.2 Gel filtration chromatography on Sephadex G-100
通过(NH4)2SO4沉淀、DEAE-52离子交换层析、Sephadex G-100层析得到的β-1,3-葡萄糖苷酶进行SDS-PAGE电泳,结果如图3所示。由图3可知,β-1,3-葡萄糖苷酶分子量约为28.7 kDa。
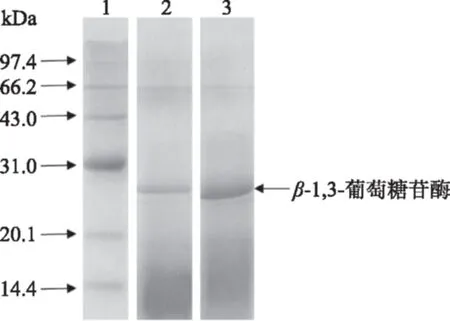
图3 β-1.3-葡萄糖苷酶的SDS-PAGE结果Fig.3 SDS-PAGE of β-1,3-glucosidase注:1.标准蛋白;2.DEAE-52分离得到的β-1,3-葡萄糖苷酶;3.Sephadex G-100分离得到的β-1,3-葡萄糖苷酶。
由表1可知,随着分离纯化步骤的进行,β-1,3-葡萄糖苷酶的单位酶活力迅速增强,由最初的3.83 U/mg增加到136.88 U/mg,尤其经过DEAE-52离子交换层析单位酶活力达到92.44 U/mg。但是在β-1,3-葡萄糖苷酶单位酶活力增强的同时,总活力因为蛋白量的损失整体呈逐渐下降的趋势,在经过Sephadex G-100凝胶过滤层析分离后,回收率为39.49%,纯化倍数为35.74。
2.2 温度对酶活力的影响
温度对酶活力的影响结果如图4所示。当温度小于50 ℃时,β-1,3-葡萄糖苷酶的酶活力随着温度的升高而急剧升高,当温度大于50 ℃时,酶活力随着温度的升高而下降。即β-1,3-葡萄糖苷酶的最适反应温度为50 ℃。Çelik[13]和Kengen[14]实验结果表明,β-1,3-葡萄糖苷酶的最适温度35~110 ℃之间都有分布。本研究从双齿围沙蚕中提取的糖苷酶的最适反应温度为50 ℃,较高,可能是因为要适应极端的海洋生存环境。

图4 温度对β-1,3-葡萄糖苷酶的影响Fig.4 Effect of temperature on the enzyme activity of β-1,3-glucosidase
2.3 pH对酶活力的影响
pH对酶活力的影响结果如图5所示。随pH的升高,β-1,3-葡萄糖苷酶的酶活力先升高后下降,最适pH为7。
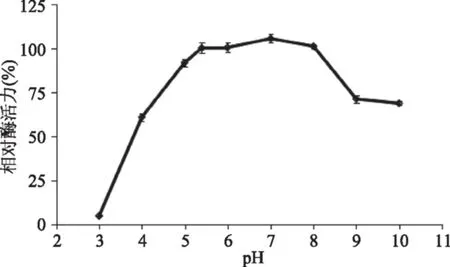
图5 pH对β-1,3-葡萄糖苷酶的影响Fig.5 Effect of pH on the enzyme activity of β-1,3-glucosidase
2.4 金属离子对酶活力的影响
金属离子对酶活力的影响结果如图6所示。在K+、Mg2+、Fe2+、Ba2+、Ca2+等存在时,β-1,3-葡萄糖苷酶酶活力受影响较小;而添加Al3+、Cu2+、Zn2+、Ag+时β-1,3-葡萄糖苷酶酶活力较低;且添加Zn2+时,相对酶活力仅达15.33%。
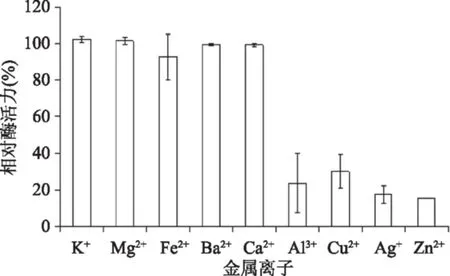
图6 金属离子对β-1,3-葡萄糖苷酶的影响Fig.6 The effect of metal ions on enzyme activity of β-1,3-glucosidase
2.5 糖苷酶的动力学
通过不同底物浓度[S]得到相应反应速率v,采用Lineweaver-Burk作图法作图,以1/v为纵坐标,1/[S]为横坐标,绘制双倒数曲线,结果如图7所示。根据双倒数曲线方程,计算出β-1,3-葡萄糖苷酶催化对硝基苯-β-D-葡萄糖苷的最大反应速度Vmax为3.2×10-4μmol/h,Km为8.2×10-4mol/L。
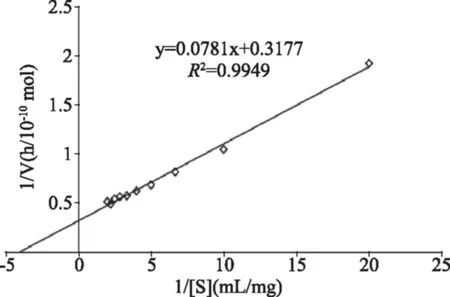
图7 β-1,3-葡萄糖苷酶的Lineweaver-Burk图Fig.7 Lineweaver-Burk of β-1,3-glucosidase
3 结论
本研究从双齿围沙蚕中通过DEAE-52离子交换层析、Sephadex G-100凝胶过滤层析提取出分子量为28.7 kDa的β-1.3-葡萄糖苷酶,提取回收率为39.49%。双齿围沙蚕β-1.3-葡萄糖苷酶最适温度为50 ℃,最适pH为7,以对硝基苯-β-D-葡萄糖苷为底物时Vmax和Km分别为3.2×10-4μmol/h和8.2×10-4mol/L。金属离子K+、Mg2+、Fe2+、Ba2+、Ca2+对β-1,3-葡萄糖苷酶酶活力影响较小,Al3+、Cu2+、Zn2+、Ag+对β-1,3-葡萄糖苷酶酶活力抑制较大,其中Zn2+抑制作用最强。研究结果可为双齿围沙蚕的利用及糖苷酶药物开发利用提供了基础数据。
[1]蒋霞敏,柳敏海. 沙蚕科的研究进展[J]. 海洋科学,2008,32(4):82-86.
[2]杨士平,刘慧玲,邱德全. 天然和养殖沙蚕营养成分分析[J]. 饲料工业,2013,34(10):53-55.
[3]邹文秀,赵清良,归鸿,等. 双齿围沙蚕应开发利用[J]. 饲料研究,1992(1):22-23.
[4]刘向辉,戈峰,潘卫东. 沙蚕组织内几种营养成分的分析[J]. 中国海洋药物,2002,90(2):35-41.
[5]邓志会,孙贺,林岩,等. 一种新型具有纤溶活性的沙蚕金属蛋白酶的分离及性质研究[J]. 中国生物化学与分子生物学报,2011,27(8):768-774.
[6]邓志会,孙东升,李波,等. 沙蚕金属蛋白酶体外抗凝血与溶栓作用[J]. 中国老年学杂志,2012,11(32):4709-4710.
[7]张云龙,崔佳乐,付海英,等. 溶栓素的分离纯化及特性测定[J]. 中国生化药物杂志,2005,26(1):18-21.
[8]潘卫东,戈峰. 一种从双齿围沙蚕中提取的蛋白质及其制备方法和用途.中国发明专利:03102033.X[P].
[9]王馨莹,冯丽,许春春,等. 嗜热β-葡萄糖苷酶的原核表达、纯化及其活性[J]. 中国生物制品学杂志,2014,27(11):1404-1407.
[10]GuoY,Yan Q,YangY,et al. Expression and characterization of a novelβ-glucosidase,with transglycosylation and exo-β-1,3-glucanase activities,fromRhizomucormiehei[J]. Food Chemistry,2015,175:431-438.
[11]王婧,张莉,张宏海,等. 产β-葡萄糖苷酶酿酒酵母菌株的化学诱变选育及产酶条件优化[J]. 食品工业科技,2016,37(9):139-146.
[12]刘德海,解复红,贾彬,等. 一株产β-葡萄糖苷酶黑曲霉菌株的分离筛选[J]. 中国酿造,2013,32(9):64-67.
[13]周汉琛,雷攀登,丁勇. 茶树β-葡萄糖苷酶研究进展[J]. 茶叶科学,2016,36(2):111-118.
[14]华承伟,于江傲,李兰,等. 拟青霉FLH30β-葡萄糖苷酶动力学、激活抑制及其转糖苷[J]. 食品工业科技,2016,37(16):130-135.
[15]田长城,任茂生.β-葡萄糖苷酶的制备及其在食品工业中的应用[J]. 中国酿造,2012,31(1):9-12.
[16]Çelik A,Dinçer A,Aydemir T. Characterization ofβ-glucosidase immobilized on chitosan-multiwalled carbon nanotubes(MWCNTS)and their application on tea extracts for aroma enhancement[J]. International Journal of Biological Macromolecules,2016,89:406-414.
[17]Kengen SW,Luesink EJ,Stams AJ M,et al. Purification and characterization of an extremely thermostableβ-glucosidase from the hyperthermophilic archaeonPyrococcusfuriosus[J]. European Journal of Biochemistry,1993,213:305-312.
Purification and characterization ofβ-1,3-glucosidase fromPerinereisaibuhitensis
YU Hai-hui,SONG Shu-mei,TONG Chang-qing*,LI Wei*
(College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China)
To isolate and purifyβ-1,3-glucosidase fromPerinereisaibuhitensisand study its properties,the crudeβ-1,3-glucosidase was obtained from theP.aibuhitensisby ammonium sulfate precipitation,which was purified using ion-exchange chromatography on DEAE-52 and gel filtration chromatography on Sephadex G-100. Finally theβ-1,3-glucosidase was purified 35.74-fold and 39.49% recovery yield. Theβ-1,3-glucosidase was estimated to be 28.7 kDa with SDS-PAGE. The optimal temperature for theβ-1,3-glucosidase was 50 ℃. The optimum pH was 7. The Kmand Vmaxofβ-1,3-glucosidase were 8.2×10-4mol/L and 3.2×10-4μmol/h,respectively.The enzyme activity was not affected by K+,Mg2+,Fe2+,Ba2+and Ca2+,while inactivated by Al3+,Cu2+,Zn2+and Ag+,and especially strongly inactivated by Zn2+.P.aibuhitensismight be a candidate resource in producingβ-1,3-glucosidase.
Perinereisaibuhitensis;β-1,3-glucosidase;isolation and purification;enzymatic properties;Km
2016-10-18
于海慧(1991-),女,硕士研究生,研究方向:食品科学,E-mail:597215153@qq.com。
*通讯作者:佟长青(1976-),男,博士,副教授,研究方向:海洋生物活性物质,E-mail:changqingtong@dlou.edu.cn。 李伟(1964-),男,博士,教授,研究方向:食品生物技术,E-mail:aisingioro@hotmail.com。
国家海洋公益性行业专项(201205022-7);项目国家自然基金(31571916)。
TS201.1
A
1002-0306(2017)10-0227-05
10.13386/j.issn1002-0306.2017.10.035
