干燥方式对核桃青皮胡桃醌含量与抑菌性能的影响
2017-06-22张立华
张立华,李 妍,张 沛,陈 青,王 欢
(枣庄学院生命科学学院,山东枣庄 277160)
干燥方式对核桃青皮胡桃醌含量与抑菌性能的影响
张立华,李 妍,张 沛,陈 青,王 欢
(枣庄学院生命科学学院,山东枣庄 277160)
为考察核桃青皮抑菌活性与干燥方式的关系,以大肠杆菌、金黄色葡萄球菌和石榴干腐病菌为供试菌,评价了自然干燥(P1)、烘干(P2)及真空冷冻干燥(P3)核桃青皮的抑菌活性。结果显示,3种样品对3种供试菌均有较强的抑制作用,并呈现剂量依赖效应,即M1>M2>M3(M1,M2,M3浓度分别为100、80和60 mg/mL的核桃青皮萃取液),3种干燥方式间比较均表现为P3>P2>P1;P1、P2和P3对大肠杆菌和石榴干腐病菌的最小抑菌浓度(MIC)结果一致,分别为20、15和10 mg/mL,对金黄色葡萄球菌的MIC分别是15、10 和5 mg/mL;P1、P2和P3样品中胡桃醌的含量分别是8.04、9.46和11.84 mg/g,与其抑菌活性呈极显著正相关(p<0.01)。表明干燥方式会影响核桃青皮中胡桃醌含量及抑菌活性,其中真空冷冻干燥是一种理想的干燥方式。
核桃青皮,干燥方式,胡桃醌,抑菌活性
核桃(JuglansregiaLinn.),又名核桃楸、胡桃,是一种传统经济树种,在我国栽培历史悠久、分布广泛,全国24个省(区)都有栽培和分布,其面积和产量均居世界首位[1]。核桃的青果皮,中药称青龙衣,用于治疗泄泻、痢疾、白带、目赤及胃炎等症,外用于疥癣、疣等皮肤病[2-4],在农业领域还可以用作环境友好型农药[5-6]。大量研究表明,核桃青皮含有酚酸、萘醌及其苷类、黄酮类、二芳基庚烷类、甾体等多种活性物质[7-9],而其中的醌类物质受到国内外学者的更多关注。林君阳等[10]从山核桃外果皮分离鉴定出5-羟基-2-甲氧基-1,4-萘醌,该物质对番茄灰霉病菌和小麦赤霉病的孢子萌发均有一定抑制作用,在供试浓度为0.5 g/L时,对2种供试菌孢子萌发抑制率均超过70%。许绍惠等[11]从核桃楸(Mandshuricamaxim)的新鲜根皮、枝皮和青果皮中分离出抑菌活性成分—3′3-双胡桃醌和3,6′-双胡桃醌。还有研究表明胡桃醌对红蜘蛛及蚜虫也有毒杀作用[12]。此外,胡桃醌还具有一定的抗肿瘤作用[13-14]。为便于提取核桃青皮中的胡桃醌,多将原料进行烘干处理,但这些醌类物质稳定性差,易受高温、光照等因素影响而被降解[15],季宇彬等[16]发现核桃青皮中胡桃醌的含量60 ℃烘干处理显著低于阴干或40 ℃烘干的样品。因此,对核桃青皮的干燥处理方式可能会对其中的活性成分及抑菌活性产生影响,但目前鲜见相关报道。本文即探究不同干燥方式对核桃青皮中胡桃醌含量及抑菌活性的影响,为更高效利用核桃青皮资源提供参考。
1 材料与方法
1.1 材料与仪器
核桃 为枣庄市山亭区店子镇产青皮核桃,剥取核桃青皮备用;供试菌种 大肠杆菌(Escherichiacoli)ATCC25922、金黄色葡萄球菌(Staphylococcusaureus)ATCC25923、石榴干腐病菌(ZythiaversonianaSacc.)Zy06,来源于枣庄学院生命科学学院微生物实验室;无水乙醇、氢氧化钠、无水硫酸铜、无水甲醇等 国产分析纯,胡桃醌标准品(≥98%) 购自上海源叶生物科技有限公司。
UV/VIS-2600型紫外可见分光光度计 尤尼柯上海仪器有限公司;SPX-300B型生化培养箱 广州市海辉实验仪器有限公司;YXQ-LS-100Sò型立式压力蒸汽灭菌器 广州东南科仪有限公司;AIR TECH型超净工作台 苏净集团安泰公司制造;旋转蒸发仪 上海亚荣生化仪器厂;TOFFLON真空冷冻干燥机 上海东富龙科技股份有限公司;电热鼓风干燥箱 精宏XMTD-8222;离心机 飞鸽ANKE TDL-40B。
1.2 实验方法
1.2.1 样品干燥处理 剥取的新鲜核桃青皮采取不同方式干燥处理,自然干燥:放在室外晾晒3~5 d,令其自然干燥,含水率为2.87%,该处理标记为样品P1;热风干燥:在105 ℃下快速杀青5 min,然后在65 ℃下烘干,含水率为2.32%,该处理标记为样品P2;冷冻干燥:冷冻室压力10 Pa,温度-45 ℃,含水率为2.58%,该处理样品标记为P3。充分干燥后使用粉碎机将样品粉碎并过40目筛,备用。
1.2.2 核桃青皮萃取液的制取 各称取P1、P2和P3样品粉末10.00 g加入150 mL 95%乙醇溶液,65 ℃下回流提取2 h[17],过滤,滤液减压浓缩,最后用水定容至50 mL,相当生药含量为200 mg/mL,作为实验母液。各取母液10 mL,用蒸馏水稀释至生药含量为100、80和60 mg/mL,并依次标记为M1、M2和M3,用于抑菌实验。
1.2.3 样品中胡桃醌含量测定 采用分光光度法测定3种样品中胡桃醌的含量[18],分别取1.2.2中制取的母液1.0 mL加入无水甲醇定容至25 mL萃取,经4000 r·min-1离心10 min,取上清液在426 nm下测定其吸光值。以胡桃醌为标准品计算各样品中胡桃醌的含量。
标准曲线的建立:称取胡桃醌标准品溶解于甲醇中,配制成质量浓度分别为0.6、1.2、2.4、4.8 mg/L的标准溶液。在426 nm下测定其吸光值,以吸光度值对样品质量浓度绘制标准曲线。
1.2.4 抑菌实验
1.2.4.1 大肠杆菌和金黄色葡萄球菌抑菌实验 采用平皿打孔法[19]测定核桃青皮对大肠杆菌和金黄色葡萄球菌的抑菌活性。分别将配制好并已灭菌的各固体培养基熔化倒入无菌培养皿(规格9 cm)中,每皿15 mL,冷却凝固后,用移液枪取0.1 mL充分混合的107~109cfu/mL供试菌悬液于培养皿中,用涂布棒均匀涂开。用口径5 mm的无菌打孔器在平板上等距离打孔,每皿5孔,并在不同孔中加入50 μL 3种处理样品(P1、P2和P3)不同稀释倍数的提取液(M1、M2和M3)和对照样液,做好标记,放入培养箱中,37 ℃倒置培养24 h。5 mg/mL的克林霉素作为阳性对照,无菌水作为空白对照。用十字交叉法测量抑菌圈直径,结果取三次重复的平均值。抑菌能力的强弱用抑菌圈直径或抑菌率表示。抑菌率的计算公式见式(1)。
抑菌率(%)=(实验组抑菌圈直径-空白对照抑菌圈直径)/实验组抑菌圈直径×100
式(1)
1.2.4.2 石榴干腐病菌抑菌实验 采用菌丝生长速率抑制法[20]测定核桃青皮对石榴干腐病菌的抑菌活性。将PDA培养基熔化冷却至50 ℃倒入培养皿(规格为6 cm),每皿9 mL,冷却凝固后,用移液枪取50 μL 3种处理样品(P1、P2和P3)不同稀释倍数的提取液(M1、M2和M3)和对照样液于不同的培养皿中,用涂布棒均匀涂开。用灭菌打孔器取直径5 mm的圆形菌片,移到涂有样液的平板上,做好标记,每个处理重复3次,将各皿放入28 ℃培养箱培养72 h,测量其菌落直径,抑菌率的计算公式见式(2)。
抑菌率(%)=(空白对照组菌落直径-实验组菌落直径)/空白对照组菌落直径
式(2)
1.2.4.3 最小抑菌浓度测定 将3种样品的母液用10%吐温-80稀释至生药含量25、50、75、100、125和150 mg/mL 6个梯度,然后吸取2 mL加入8 mL马铃薯葡萄糖琼脂培养基中,充分振荡混匀,倒平板,使培养基中核桃青皮最终生药含量5、10、15、20、25和30 mg/mL。待培养基冷却后,用预先培养好的菌悬液划线接种,分别按前述条件培养,每一浓度均做3组平行实验。观察结果,从无菌生长的培养皿中找出最小抑菌浓度(Minimal Inhibitory Concentration,MIC)的培养皿,即为提取液的最小抑菌浓度(MIC)。以10%吐温-80作为对照[21]。
1.3 数据处理
实验均设3个以上重复,数据为多个重复的平均值,使用Excel软件做各处理样品(P1、P2、P3)、各稀释倍数(M1、M2、M3)的差异显著性及相关性分析,M1、M2、M3于表中标注,P1、P2、P3未标注。
2 结果与分析
2.1 不同干燥方式的核桃青皮对大肠杆菌的抑制效果
各样品对大肠杆菌的抑菌圈直径和抑菌率见表1。不同干燥方式的核桃青皮对大肠杆菌的抑制作用有差别,P3的抑菌圈直径和抑菌率大于相应体积分数的P2,P2又大于P1,且差异明显(p<0.05),表明干燥方式对核桃青皮的抑菌活性有明显影响。同一处理的核桃青皮随用量的减少,其抑菌圈直径和抑菌率减小,即M1>M2>M3,且差异显著(p<0.05)。其中P1的抑菌活性M1略低于5 mg/mL的克林霉素,而P2和P3均高于阳性对照,表明核桃青皮有较强的抑制大肠杆菌作用,并呈现剂量依赖效应。醌类物质由于不饱和键的存在稳定性差,易受高温、光照等因素影响而降解,P1为自然晾晒干燥,处理时间较长,核桃青皮中的有效成分被氧化分解较多,从而使其抑菌活性降低;P2为热风干燥,加热处理时间相对较短,有效成分的损失相对较少;而P3为真空低温条件下冷冻干燥,有效成分的损失最少,因此抑菌活性最强。

表1 不同干燥方式的核桃青皮对大肠杆菌的抑制效果Table 1 Antibacterial effect of different drying on E. coli

表2 不同干燥的核桃青皮对金黄色葡萄球菌的抑制效果Table 2 Antibacterial effect of different drying on Staphylococcus aureus
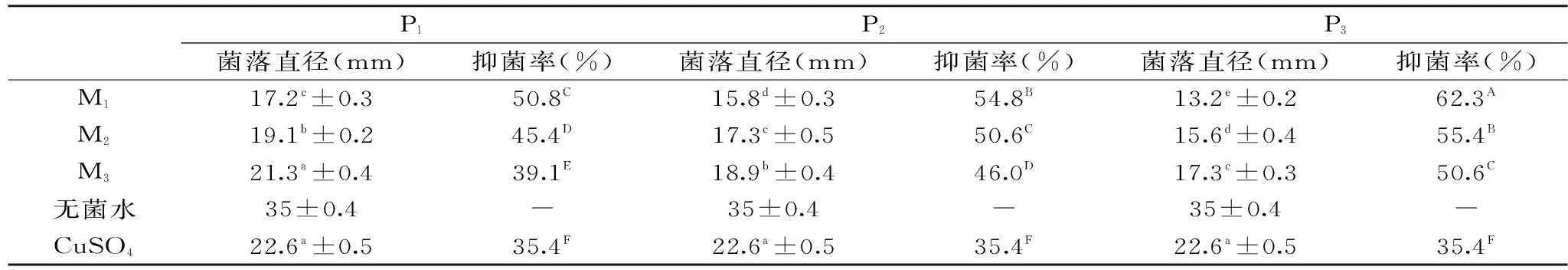
表3 不同干燥方式的核桃青皮对石榴干腐病菌的抑制效果Table 3 Antibacterial effect of different drying on Zythia versoniana Sacc.
2.2 不同干燥方式的核桃青皮对金黄色葡萄球菌的抑制效果
各样品对金黄色葡萄球菌的抑菌圈直径和抑菌率见表2。不同干燥方式的核桃青皮对金黄色葡萄球菌的抑制作用有差别,P3的抑菌圈直径和抑菌率大于相应体积分数P2,P2又大于P1,且差异明显(p<0.05),表明干燥方式对核桃青皮的抑菌活性有明显影响。同一处理的核桃青皮随用量的减少,其抑菌圈直径和抑菌率减小,即M1>M2>M3,且差异显著(p<0.05)。虽然各样品对金黄色葡萄球菌的抑制效果均低于5 mg/mL的克林霉素,但抑菌率均在60%以上,表明核桃青皮对金黄色葡萄球菌有较强的抑菌活性,并呈现剂量依赖效应。
2.3 不同干燥方式的核桃青皮对石榴干腐病菌的抑制效果
石榴干腐病菌在含各样品培养基上生长的菌落直径和抑菌率见表3。3种干燥方式的核桃青皮对石榴干腐病菌的抑制效果存在差别,P3的菌落直径小于P2的,P2又小于P1,且差异明显(p<0.05),表明干燥方式对核桃青皮的抑菌活性有明显影响。同一处理的核桃青皮随用量的减少,其菌落直径增大,即M1 2.4 最小抑菌浓度测定 3种不同处理样品对3种供试菌的最小抑菌浓度(MIC)见图1,P1、P2和P3对大肠杆菌和石榴干腐病菌的MIC一致,分别是20、15和10 mg/mL;对金黄色葡萄球菌的MIC分别是15、10和5 mg/mL,均低于另2种供试菌,说明金黄色葡萄球菌对核桃青皮更敏感。P1、P2和P3相比,不同的干燥处理方式对核桃青皮中胡桃醌的含量会有明显影响,这一结果表明处理方式可能是影响了核桃青皮中的胡桃醌的含量从而影响了抑菌效果。 表4 胡桃醌含量与MIC的相关性分析Table 4 The correlation of MIC and juglone 注:**在0.01水平(双侧)上显著相关,n=3。仍然是P3的MIC最低,其次P2,最高的是P1。 图1 不同干燥方式核桃青皮的最小抑菌浓度Fig.1 MIC of different drying methods of green walnut husk 2.5 样品中胡桃醌含量及其与抑菌活性的关系 经测定和计算知,P1、P2和P3样品中胡桃醌的含量分别是8.04、9.46和11.84 mg/g。不同干燥方式使核桃青皮样品中胡桃醌的含量是有较大差别的。核桃青皮中胡桃醌等成分由于结构中含有不饱和键不稳定,易受外界因素的影响而发生降解[15]。P1为自然晾晒干燥,经过3~5 d的风吹日晒,核桃青皮中的有效成分胡桃醌被氧化分解较多;P2为快速烘干,加热处理时间相对较短,胡桃醌的损失相对较少;而P3为真空低温条件下冷冻干燥,胡桃醌的损失最少。经分析3种样品中胡桃醌的含量,P1、P2和P3样品中胡桃醌的含量分别是8.04、9.46和11.84 mg/g,也证实了这一点,说明干燥处理的方式会对胡桃醌的含量产生影响。因此,为更好地保持核桃青皮中有效成分的含量,要选择适宜的加工方式。 供试的3种菌中大肠杆菌为革兰氏阴性细菌,金黄色葡萄球菌为革兰氏阳性细菌,石榴干腐病菌为真菌,3种类型的样品对这3种供试菌的抑制作用虽然有一定的差别,但与阳性对照相比均表现较强的抑菌活性。乔永刚等[22]发现核桃青皮提取物对多种植物枯萎病菌也有抑制作用,表明核桃青皮具有广谱的抑菌作用。普遍认为胡桃醌是核桃青皮中的主要有效成分[23-25],本文对样品中胡桃醌含量与其MIC数据做了相关性分析,结果见表4。胡桃醌含量与对3种供试菌的抑菌活性之间的相关系数均为0.981,胡桃醌含量与抑菌活性之间呈极显著正相关(p<0.01),也再一次印证胡桃醌是核桃青皮抑菌的主要有效成分,表明胡桃醌是核桃青皮抑菌的主要有效成分。 自然干燥(P1)、65 ℃烘干(P2)及真空冷冻干燥(P3)核桃青皮的抑菌活性均表现为P3>P2>P1;P1、P2和P3对大肠杆菌和石榴干腐病菌的最小抑菌浓度(MIC)结果一致,分别为20、15和10 mg/mL,对金黄色葡萄球菌的MIC分别是15、10和5 mg/mL;P1、P2和P3样品中胡桃醌的含量分别是8.04、9.46和11.84 mg/g,与其抑菌活性呈极显著正相关(p<0.01)。因此,干燥方式对核桃青皮中胡桃醌含量有显著影响,进而影响了核桃青皮的抑菌活性。低温真空冷冻干燥能较好保持核桃青皮中胡桃醌含量,是一种理想的干燥方式。 [1]高海生,朱凤妹,李润丰. 我国核桃加工产业的生产现状与发展趋势[J]. 经济林研究,2008,26(3):119-126. [2]孙桂君,苑淑莉. 青龙衣糖膏治疗浅表性胃炎疗效观察[J]. 中医药学报,2002,30(3):16. [3]赵岩,刘淑萍,吕朝霞. 核桃青皮的化学成分与综合利用[J]. 农产品加工,2008,7(11):66-68. [4]潘富赟,张培正. 核桃青皮的综合应用及开发前景[J]. 中国食物与营养,2010,135(12):21-24. [5]景炳年. 核桃次生物质抗烟草花叶病毒活性的研究[D]. 杨陵:西北农林科技大学,2007. [6]黄支权,任建军,成军,等. 核桃青皮抑真菌物质的分离鉴定与抑菌活性[J]. 北京农学院学报,2016,31(1):23-27. [7]Li C,Liu J X,Zhao L,et al. Capillary zone electrophoresis for separation and analysis of four diarylheptanoids and an alphatetralone derivation in the green walnut husks(JuglansregiaL.)[J]. Journal of Pharmaceutical and Biomedical Analysis,2008,48(3):749-753. [8]Nour V,Trandafir I,Cosmulescu S. HPLC determination of phenolic acids,flavonoids ang juglone in walnut leaves[J]. Journal of Chromatographic Science,2013,51:883-890. [9]田平平,李仁宙,简永健,等. 核桃青皮的强抗氧化活性成分及其抗氧化稳定性[J]. 中国农业科学,2016,49(3):543-553. [10]林君阳,马良进,陈安良,等. 山核桃外果皮化学成分及抑菌活性初步研究[J].浙江林学院学报,2009,26(1):100-104. [11]许绍惠,唐婉屏,韩忠环. 核桃楸毒性成分研究[J]. 沈阳农业大学学报,1986,17(2):34-39. [12]Yasmin A,Murray B I,Lee C H,et al. Toxicity of quinones against two-spotted spider mite and three species of aphids in laboratory and greenhouse conditions[J]. Industrial Crops and Products,2012,37:536-541. [13]欧阳瑾,曹志友,王爽,等. 核桃青皮提取物抑小鼠Lewis肺癌生长的实验研究[J]. 时珍国医药,2009,20(11):2749-2750. [14]张巍,吕士杰. 胡桃醌诱导肿瘤细胞凋亡机制[J]. 解剖学报,2015,46(5):641-645. [15]孙墨珑,王艳梅,宋湛谦,等. 核桃楸乙醇提取物的稳定性[J]. 东北林业大学学报,2008,36(5):53-54. [16]季宇彬,陆婉,曲中原,等. 不同干燥方法、贮藏年限及采收时间对青龙衣中胡桃醌的影响[J]. 现代药物与临床,2009,24(2):110-112. [17]张卫星,何开泽,蒲蔷. 核桃青皮提取物的抗菌和抗氧化活性[J]. 应用与环境生物学报,2014,20(1):87-92. [18]孙墨珑,袁海舰,宋湛谦. 分光光度法测定核桃楸树皮中胡桃醌的含量[J]. 东北林业大学学报,2007,6(6):37-38. [19]程丽娟,薛泉宏. 微生物学实验技术[M]. 西安:世界图书出版公司,2000. [20]丁存宝,吴尚卓,李桂秋. 核桃青皮提取物的抑真菌活性研究[J]. 现代食品科技,2013,29(4):722-724. [21]党珍,周涛. 几种植物提取液的抑真菌特性及复配研究[J]. 食品科学,2009,30(23):88-91. [22]乔永刚,牛颜冰,乔木,等. 核桃青皮提取物对4种植物枯萎病菌的抑菌作用研究[J]. 农学学报,2011,1(7):9-12. [23]吴朝霞,张敏,金楠. 胡桃醌对大肠杆菌呼吸及能量代谢的影响[J]. 食品与机械,2011,7(6):131-134. [24]李钧,曲中原,邹翔,等. 青龙衣中胡桃醌的分离与鉴定[J]. 哈尔滨商业大学学报:自然科学版,2011,27(5):641-644. [25]王红萍,尹江艳. 核桃青皮的有效成分及综合利用[J].安徽农业科学2013,41(24):10129-10131. Effects of drying methods on the juglone content and antibacterial activity of green walnut husk ZHANG Li-hua,LI Yan,ZHANG Pei,CHEN Qing,WANG Huan (College of Life Science,Zaozhuang University,Zaozhuang 277160,China) To explore the relationship between dry method and antibacterial activity of green walnut husk,the antibacterial activities of natural drying(P1),hot-air drying(P2)and vacuum freeze drying(P3)of green walnut husk were evaluated,usingEscherichiacoli,StaphylococcusaureusandZythiaversonianaSacc. as test microorganisms in this paper. Results showed that the three samples all had strong inhibition,and presented a dose-response relationship,namely M1>M2>M3(dose of walnut green husk extract were respectively 100(M1),80(M2),and 60(M3) mg/mL). The drying methods were characterized by P3>P2>P1. For P1,P2and P3,the minimum inhibition concentration(MIC)ofE.coliandZythiaversonianaSacc. were consistent. The doses were 20,15 and 10 mg/mL respectively. The MIC ofStaphylococcusaureuswere 15,10,and 5 mg/mL. The juglone content of samples were respectively 8.04(P1),9.46(P2),and 11.84(P3) mg/g,significant positive correlation with antibacterial activity(p<0.01). In conclusion,the drying methods could affect the juglone content and antibacterial activity of green walnut husk,vacuum freeze drying was an ideal way. green walnut husk;drying method;juglone;antibacterial activity 2016-09-02 张立华(1968-),男,博士,教授,研究方向:植物资源开发,E-mail:chinazhanglh@163.com。 山东省自然科学基金项目(ZR2013BL018)。 TS261.4 A 1002-0306(2017)10-0141-05 10.13386/j.issn1002-0306.2017.10.019

3 结论
