甘肃甘草多糖的提取、纯化及其生物活性
2017-06-22田艳花杨兆艳刘林凤刘娜丽
田艳花,杨兆艳,刘林凤,刘娜丽,郭 芸
(山西药科职业学院食品工程系,山西太原 030031)
甘肃甘草多糖的提取、纯化及其生物活性
田艳花,杨兆艳,刘林凤,刘娜丽,郭 芸
(山西药科职业学院食品工程系,山西太原 030031)
以甘肃道地甘草为原料,采用响应面设计法优化超声波辅助热水法提取甘草粗多糖的工艺条件,粗多糖经DEAE-52阴离子交换柱和Sephadex G100凝胶柱纯化获得甘草多糖(GCP2),利用气相色谱、高效液相色谱联用多角度激光散射技术(HPSEC-LLS)和红外光谱技术对GCP2的单糖组成、分子量分布和光谱特性进行了分析;并评价了GCP2的体外抗氧化性能和对6种供试细菌的抑制活性。结果表明,甘草多糖提取最佳工艺条件:温度为70 ℃、时间为85 min、液料比为13∶1、超声功率600 W,多糖平均提取得率为4.23%;GCP2是以α-糖苷键为主的还原性多糖,浅黄白色粉末,易溶于水;主要由阿拉伯糖、葡萄糖和半乳糖组成,摩尔比为0.166∶5.56∶1.60。HPSEC-LLS分析结果表明GCP2是由3种不同组分组成的聚合物构成,其中主要组分的重均分子量为1.378×105g/mol,红外光谱显示GCP2具有明显的多糖特征吸收峰,具有α-吡喃糖苷键。甘草多糖对羟自由基和超氧阴离子具有较好的清除能力,活性大小与多糖的浓度呈明显的线性关系,IC50值分别为3.48 mg/mL和3.43 mg/mL,同时还具有一定的还原能力和抑菌作用。实验结果显示,GP2对6种细菌均具有较好的抑制作用,尤其是大肠杆菌和肺炎克雷伯菌。
乌拉尔甘草,多糖,超声提取,响应面分析法,纯化,抗氧化与抑菌活性
甘草(G.uralensisFisch.)系豆科(Leguminosae)、蝶形花亚科(Papiliantae Taub.)、甘草属多年生草本植物,主要分布于甘肃、新疆、内蒙古等干旱、半干旱荒漠地区,具有很强的耐旱、耐盐碱和耐寒特性,是我国常见的传统药用植物之一[1]。现代药理实验证明甘草具有健脾益气、清热解毒、祛痰止咳、解毒镇痛、抗肿瘤和抗病毒等药理活性[2-4],其有效成分主要为甘草皂苷(甘草酸)和甘草黄酮类化合物[5]。目前对甘草的研究主要集中在甘草酸、黄酮类化合物的分离、纯化和药理活性的研究[6-10]。诸多研究表明多糖具有多方面的生理活性和功能,甘草的生物学活性亦与多糖有密切关系[11-12]。因此对甘草多糖的研究已经逐渐成为深入挖掘甘草药理活性成分的另一热点。
目前关于甘草多糖(Glycyrrhiza polysaccharide,GPS)的研究主要集中在提取工艺[13-15]、纯化技术[16-17]和活性方面[18]的研究。甘草多糖作为甘草重要的活性成分之一,已被发现具有抗肿瘤、抗炎、抗病毒、免疫调节、抗氧化和抑菌等生理活性[19-20]。多糖作为一种单糖组成的聚合糖高分子碳水化合物,不同的提取和纯化工艺对多糖的提取得率、结构以及活性有一定的影响。本研究以甘肃道地甘草为研究对象,对多糖的提取工艺、分离纯化、抗氧化活性及抑菌活性进行了探究,以期为甘肃道地甘草多糖的开发利用提供依据。
1 材料与方法
1.1 材料与仪器
甘草(GlycyrrhizauralensisFisch.)、青霉素钠(国药准字H23021440,100 万U)、链霉素(国药准字H32025954,50万U) 购自甘肃德生堂医药有限公司;DPPH(1,1-二苯基-2-三硝基苯肼,2-Diphenyl-1-picrylhydrazyl) Aladdin chemistry公司;纤维素DEAE-52和Sephadex G100 美国法玛西亚公司;α-Glucosidase(I型)、4-硝基苯-α-D-吡喃葡萄糖苷(PNPG) Sigma公司;鼠李糖、阿拉伯糖、D-木糖、甘露糖、葡萄糖、半乳糖等标准品 上海生物工程有限公司;其余试剂均为分析纯;大肠埃希氏菌(Escherichiacoli,E.coli)、金黄色葡萄球菌(Staphylococcusaureus,S.aureus)、绿脓杆菌(Pseudomonasaeruginosa,P.aeruginosa)、肺炎克雷伯菌(Streptococcuspneumoniae,S.pneumoniae)、地衣芽孢杆菌(Bacilluslicheniformis,B.licheniformis)、乳链球菌(Streptococcuslactis,S.lactis)等菌株 由兰州理工大学生命科学与工程学院实验中心提供。
FD-1型冷冻干燥机 北京博医康实验仪器;KQ-250DB型超声波清洗器 昆山市超声波仪器有限公司;Cary50紫外分光光度计 美国瓦里安公司;GC/6890-MS/5973气相色谱-质谱联用仪(DB-5色谱柱0.2 mm×35 m×0.25 μm) 美国安捷伦;DAWN EOS多角度激光散射仪 Wyatt Technology公司。
1.2 实验方法
1.2.1 提取、纯化工艺流程 称取一定量过40目筛甘草粉→石油醚脱脂→超声波辅助热水浸提→Sevag法去除蛋白→分离上清液、真空浓缩→4 ℃乙醇过夜沉淀→收集沉淀→丙酮脱色→真空冷冻干燥→获得甘草粗多糖(命名为GCP)。
取一定量的甘草粗多糖溶解于去离子水中,配制成浓度为20 mg/mL的多糖溶液,上样1.0 mL于DEAE-52纤维素柱,分别用去离子水、0.1 mol/L NaCl溶液洗脱,苯酚硫酸法测定多糖含量,绘制洗脱曲线,合并主峰多糖,冷冻干燥后,溶于1.0 mL去离子水中,全部上样于Sephadex G100凝胶柱进一步纯化,用去离子水进行洗脱,按照1.0 mL/min流速进行收集洗脱液,每支试管收集5 mL,苯酚硫酸法测定多糖含量,绘制洗脱曲线。。
1.2.2 多糖的提取工艺优化 依据1.2.1方法,以多糖提取得率Y(%)为评价指标,结合刘文玉[15]研究内容,选取温度、时间、液料比和超声功率4个因素进行单因素预实验(单因素实验数据略),确定了后续响应面实验水平,设计了4因素3水平响应面优化实验,如表1。
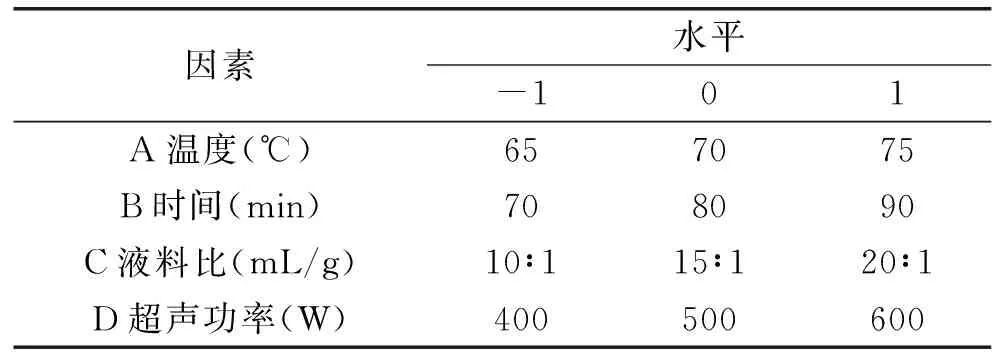
表1 4因素3水平响应面实验设计Table 1 Experiment design of four factors and three levels of response surface method
1.2.3 多糖含量测定和提取率的计算 采用苯酚-硫酸法绘制葡萄糖标准曲线,以葡萄糖浓度x为横坐标(μg/mL),光吸收值Y为纵坐标,在485 nm处测定葡萄糖和硫酸苯酚溶液反应后的吸光度,拟合回归方程为Y=0.0082x+0.0074,R2=0.9983,在0~50 μg/mL范围内线性良好。取一定体积的甘草多糖提取液或纯化收集液按照苯酚-硫酸法测定吸光值,利用公式(1)计算多糖的提取得率。
式(1)
其中,C表示标准曲线计算出的多糖浓度(mg/mL);N为稀释因子;V为提取液总体积(mL);W是原料质量(g)。
1.2.4 多糖理化性质 配制浓度为1%的甘草多糖水溶液,分别进行硫酸-苯酚、碘-碘化钾、茚三酮试剂和斐林试剂反应,同时将多糖溶液置于10 cm旋光管中,用自动旋光仪测定20 ℃下多糖的旋光度,初步分析甘草多糖的理化性质[21]。
1.2.5 单糖组分分析 称取10 mg多糖样品置于安瓿瓶中,经三氟乙酸(TFA)水解,中和,洗涤干燥以及乙酰化等过程,制备乙酰化的单糖溶液,单糖溶液经三氯甲烷稀释后进行气相色谱联用分析。色谱条件:高纯氮气载气,流量15 mL/min;进样口温度210 ℃;升温程序:初始温度120 ℃,保留1 min,按30 ℃/min升温至210 ℃保留5 min。精密称取葡萄糖、半乳糖和阿拉伯糖各2 mg,配制成1 mg/mL标准样品混合液,经衍生化后,三氯甲烷稀释成浓度为0.2、0.4、0.6、0.8和1.0 mg/mL,分别取1 μL进样,以积分面积(Y)与糖浓度(X)进行线性回归,线性范围0.2~1.0 mg/mL,其中葡萄糖的标准曲线方程为Y=1.102x+0.1272,R2=0.9905,半乳糖标准曲线方程为Y=1.112x+0.0132,R2=0.9991,阿拉伯糖标准曲线方程为Y=1.402X+0.0042,R2=0.9990。根据标准曲线计算多糖水解液中各组分的含量,推算摩尔比。
1.2.6 分子量测定 采用高效液相色谱联用多角度激光散射技术(HPSEC-LLS)对多糖进行分子量测定[22],配制浓度为2.0 mg/mL的多糖溶液,以0.9%的NaCl溶液作流动相,流速0.5 mL/min,进样量为50 μL,所有溶液用0.2 μm过滤器过滤后超声脱气,于25 ℃进行HPSEC-LLS测定。用Astm软件进行数据的采集和分析。折光指数增量(dn/dc)在25 ℃下通过Optilab折光仪于690 nm处测定,调节至0.135 mL/g。
1.2.7 红外光谱分析 称取1 mg干燥的多糖样品于玛瑙研钵中,KBr压片,在波数4000~400 cm-1范围内进行光谱扫描。
1.2.8 抗氧化活性的测定 分别配制浓度为0.25、0.5、0.75、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL的多糖溶液作为供试液进行体外抗氧化性能的测定。参照刘建利等[23]方法测定多糖清除超氧阴离子自由基的能力,参考Liu等方法[24]计算多糖对羟自由基的清除率,并采用韩雅慧[7]方法分析多糖的总还原力。
1.2.9 抑菌活性测定 参照张百刚等[25]方法进行操作,分别以大肠埃希氏菌(Escherichiacoli,E.coli)、金黄色葡萄球菌(Staphylococcusaureus,S.aureus)、绿脓杆菌(Pseudomonasaeruginosa,P.aeruginosa)、肺炎克雷伯菌(Streptococcuspneumoniae,S.pneumoniae)、地衣芽孢杆菌(Bacilluslicheniformis,B.licheniformis)、乳链球菌(Streptococcuslactis,S.lactis)为供试菌株,采用滤纸片扩散法测定不同浓度甘草多糖溶液的抑菌效果。每个菌种设3个平行组,分别以25 U/mL青霉素钠和链霉素为阳性对照,在37 ℃倒置培养16 h,测量抑菌圈的直径,实验结果取平均值。
1.2.10 数据处理 测定样品设置3个平行,结果以平均值±标准偏差表示。并用Origin Pro 8.5进行统计学分析。利用Design Expert 8.0.5软件中的中心组合实验Central composite design(CCD)设计进行参数优化。
2 结果与讨论
2.1 甘草多糖提取工艺响应面分析
2.1.1 回归模型的建立及方差分析 响应面实验设计结果如表2所示,对所得数据进行回归方差分析结果见表3,二次多项式拟合方程为:
Y=-26.72+1.06A-9.26×10-3B+1.81×10-2C-1.91×10-3D+1.16×10-4AB-1.0×10-4AC+4.17×10-5AD+1.025×10-3BC+4.9125×10-4BD+4.75×10-5CD-7.72×10-3A2-1.09×10-3B2-8.57×10-3C2-2.19×10-5D2
模型F值约为135.7391,p值远小于0.01,说明二次方程模型极显著,模型决定系数R2为0.9969,说明模型能解释99.69%的实验数据,失拟项(p>0.05)不显著,所以该模型可以用于预测甘草多糖提取的工艺优化。从表3中可以看出,模型一次项A、C、D和二次项A2、C2、D2对响应值Y影响极显著(p<0.01);二次项B2对响应值Y影响显著(p<0.05);交互项BD对响应值Y影响极显著(p<0.01),交互项BC对响应值Y影响显著(p<0.05),说明超声波功率与提取时间的交互作用对多糖提取得率具有极显著影响,提取时间与液料比的交互作用对多糖提取得率的影响显著,其余交互因素的影响不显著。由于F值越大,说明该因素对响应值的影响越大,根据表3中各项的F值大小,可知影响超声波提取甘草多糖的4个因素影响程度从大到小依次为提取温度、液料比、超声波功率、提取时间。
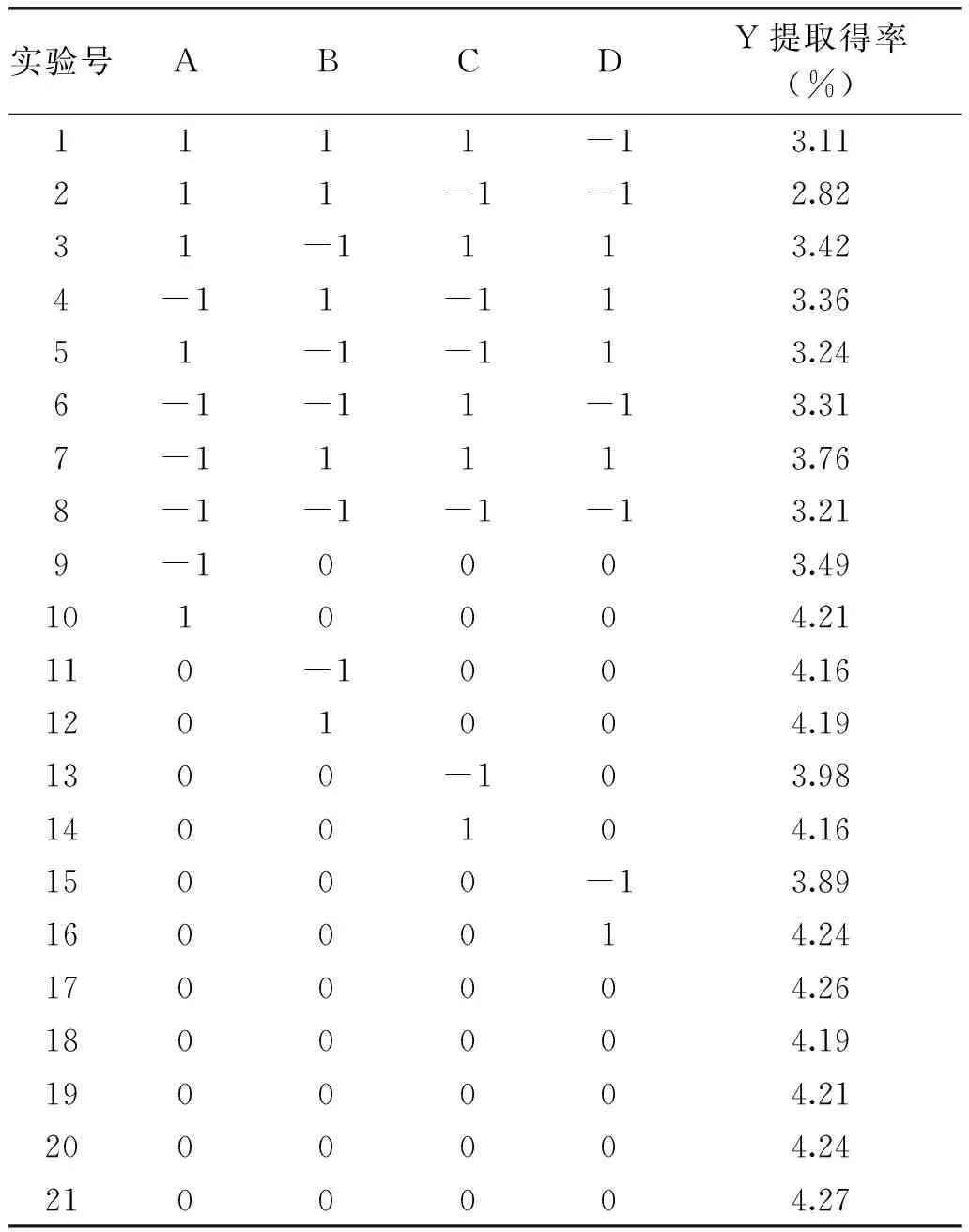
表2 响应面设计及结果Table 2 Design and results of RSM
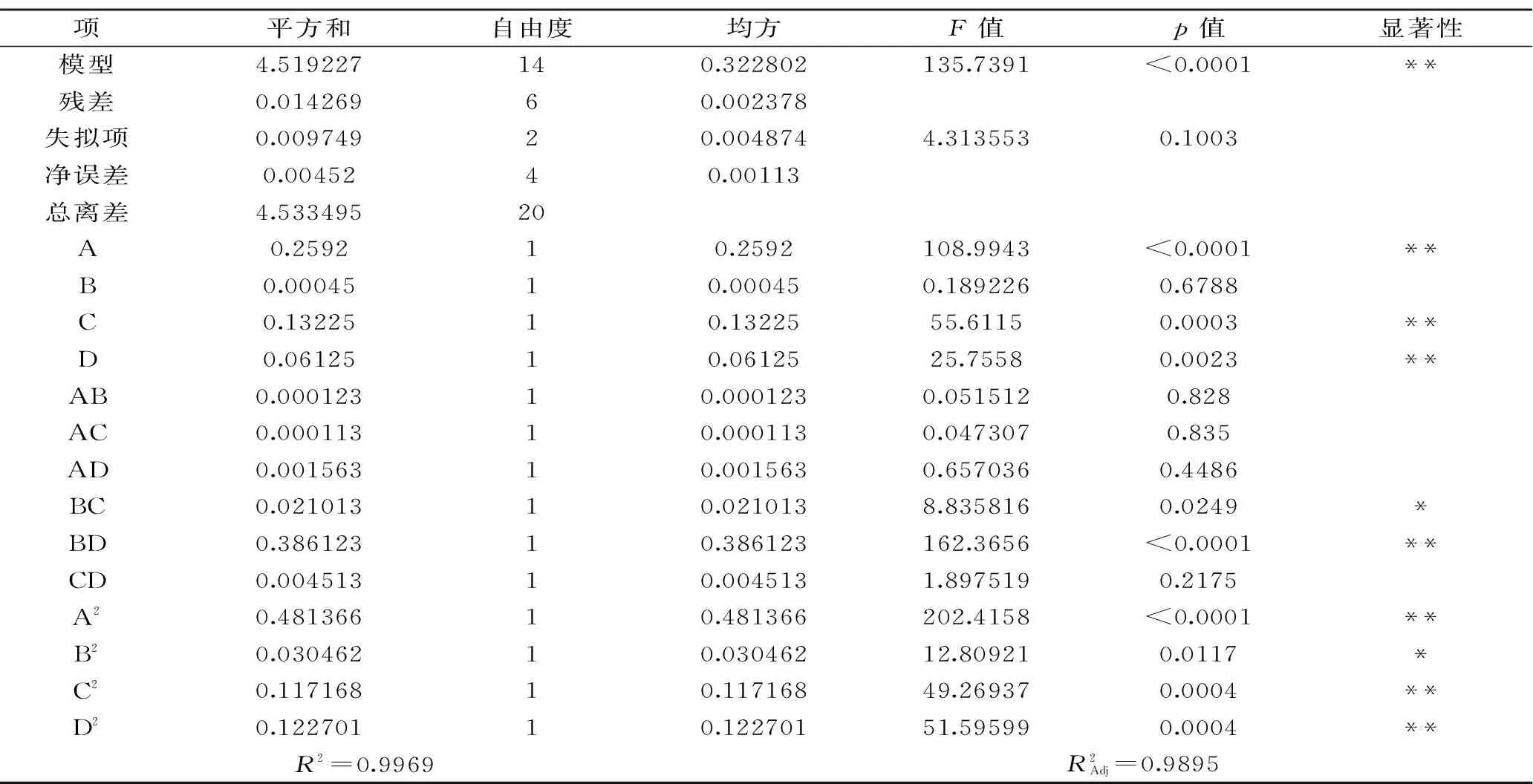
表3 回归模型方差分析Table 3 Analysis of variance for fitted quadratic polynomial model
注:**表示极显著(p<0.01),*表示显著(p<0.05)。2.1.2 回归模型交互作用分析 为了更直观的观察因素间的交互作用对甘草多糖提取得率的影响,进行降维分析。各因素对甘草提取得率的影响以及各因素间的交互作用如图1,由图1可知,响应面开口向下,随着每个因素的增大,响应值增大,当响应值增大到极值后,随着因素的增大,响应值逐渐减小,该模型有稳定点,且稳定点是最大值。此外等高线越接近于圆形表示因素间交互作用不显著,排列越疏松交互作用越显著。通过分析表3中各因素对提取得率的显著性差异和图1中等高线可以看出,超声波功率(D)与提取时间(B)的交互作用对多糖提取得率极显著影响,提取时间(B)和液料比(C)的交互作用对多糖提取得率呈显著影响,说明随着超声波功率和时间的增加,提取得率会显著提高,可能是由于超声波空化作用增强,伴随时间的增加,在一定液料比条件下,多糖的溶出率会显著增加。

图1 各因素及交互作用对甘草多糖提取率的影响Fig.1 Response surface of factors and interactions on the yield of polysaccharide
2.1.3 最佳工艺条件及其验证实验 在模型范围内,使用快速上升法进行优化获得甘草多糖提取的最佳工艺条件为:温度为69.45 ℃、时间为85.53 min、液料比为12.85∶1 mL/g、超声功率564.08 W,在此条件下多糖提取得率4.40%。考虑到实际操作的便利,将提取工艺参数修正为温度为70 ℃、时间为85 min、液料比为13∶1 mL/g、超声功率600 W,重复3次测得的多糖平均提取得率为4.23%±0.01%。与理论预测值相比,其相对误差约为3.86%。表明响应面法优化得到的提取工艺参数准确可靠,具有实用价值。
2.2 甘草多糖的纯化及性质研究
2.2.1 甘草多糖的分离纯化 采用硫酸苯酚法测定多糖含量,绘制洗脱曲线如图2A,共得到3个主峰,其中位于11~15管和16~19管的为去离子水洗脱峰(水相),位于43~48管的为0.1%NaCl溶液洗脱峰(盐相)。三个洗脱峰中位于11~15管的多糖含量相对最高,被作为后期进一步纯化的主要对象,合并11~15管的水相洗脱多糖溶液,命名为GCP1。GCP1再经Sephedex G-100柱层析,以去离子水进行洗脱,苯酚硫酸法示踪,洗脱曲线如图2B。从图2B可以看出GCP1经去离子水洗脱后,在9~19管中呈现单一峰形,因此初步判定GCP1为同一组分,收集洗脱峰,真空冷冻干燥,命名为GCP2。GCP2进一步经理化性质测定,结果显示GCP2经茚三酮反应、碘-碘化钾反应为阴性、双缩脲反应全为阴性,表明GCP2中确已无淀粉和蛋白,而硫酸—苯酚反应和斐林试剂反应呈阳性,则说明GCP2是还原性多糖。GCP2溶液在20 ℃下测定比旋光度为+121.18 °,具有较大的比旋正数,说明多糖中糖残基间苷键类型为α-糖苷键[21]。
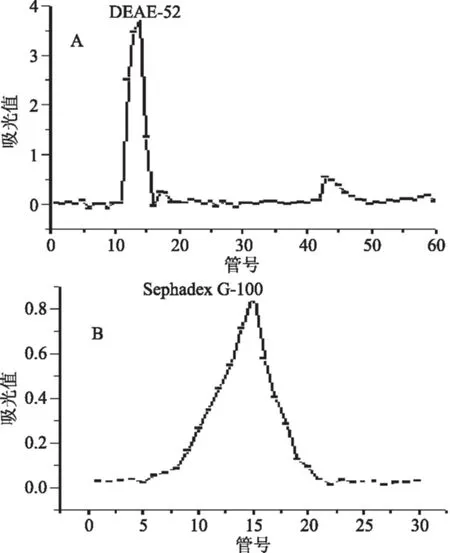
图2 DEAE-52纤维素柱和Sephadex G-100对甘草多糖的洗脱曲线Fig.2 Elution curve of GCP by DEAE-52 and Sephadex G-100 column chromatography
2.2.2 GCP2单糖组分分析 标准单糖的GC色谱分析,鼠李糖、阿拉伯糖、D-木糖、甘聚糖、葡萄糖和半乳糖的保留时间分别为8.79、9.23、9.63、16.7、17.14和18.02 min。GCP2经水解、柱前衍生化后进样,GC-MS分析结果如图3,从图3中可以看出,GCP2色谱组分比较复杂。根据不同单糖的保留时间初步判定GCP2主要由阿拉伯糖、葡萄糖和半乳糖组成,其摩尔比为0.166∶5.56∶1.60。热娜·卡斯木等[21]利用气相色谱法研究了胀果甘草多糖纯化后的单糖组成,得出纯化后多糖主要由阿拉伯糖、葡萄糖和半乳糖组成,摩尔比为11.7∶3.3∶1.0;孙润广等[26]对甘草多糖分离纯化后,分析表明甘草多糖由葡萄糖、阿拉伯糖和半乳糖组成,并以葡萄糖或半乳糖为主链;而周蓉等[27]和艾则孜[28]分别对甘草多糖分离纯化后,经高效毛细管电泳和HPLC-ELSD法分析表明,甘草多糖组分由鼠李糖、葡聚糖、阿拉伯糖和半乳糖组成,并以葡聚糖为主链。由此可以认为阿拉伯糖、葡萄糖和半乳糖是甘草多糖的主要单糖组成。
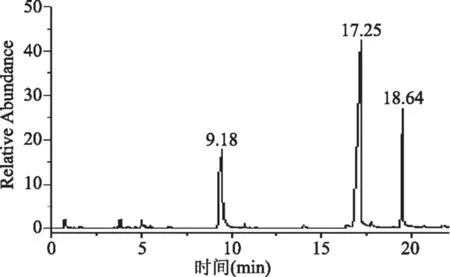
图3 GCP2 GC色谱图Fig.3 GC chromatogram of GCP2
2.2.3 GCP2分子量分布 通过凝胶渗透色谱(HPSEC)、多角度激光光散射(MALLS)与示差折光检测仪(RI)联用色谱分析GCP2的分子量及其分布,各组分的数均分子量(Mn)、重均分子量(Mw)、分布宽度指数PD(Mw/Mn)如表3。从表3中可以看出GCP2是由3种不同组分组成的聚合物构成,其中主要组分为Peak1,其重均分子量为1.378×105g/mol。糖的分子量分布形态受聚合方式和聚合因素的影响而不同,分子量分布主要由分布宽度指数PD(Mw/Mn)表示,分子量分布越宽,分散度就越大,对于窄的分子量分布,其Mw/Mn比值越接近1。因此,从表3中的PD值可以看出GCP2主要由3种不同分子量分布的聚合物组成,其中Peak1和Peak3两组分摩尔质量分布较Peak2均一。
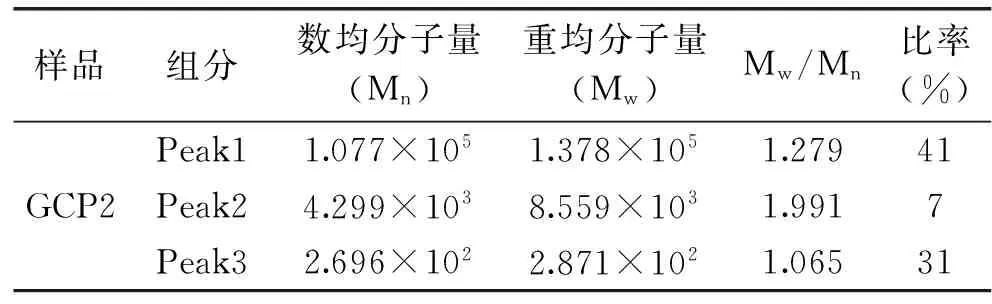
表3 GCP2的分子量分布特性Table 3 Molecular characterization of GCP2 by HPSEC-LLS
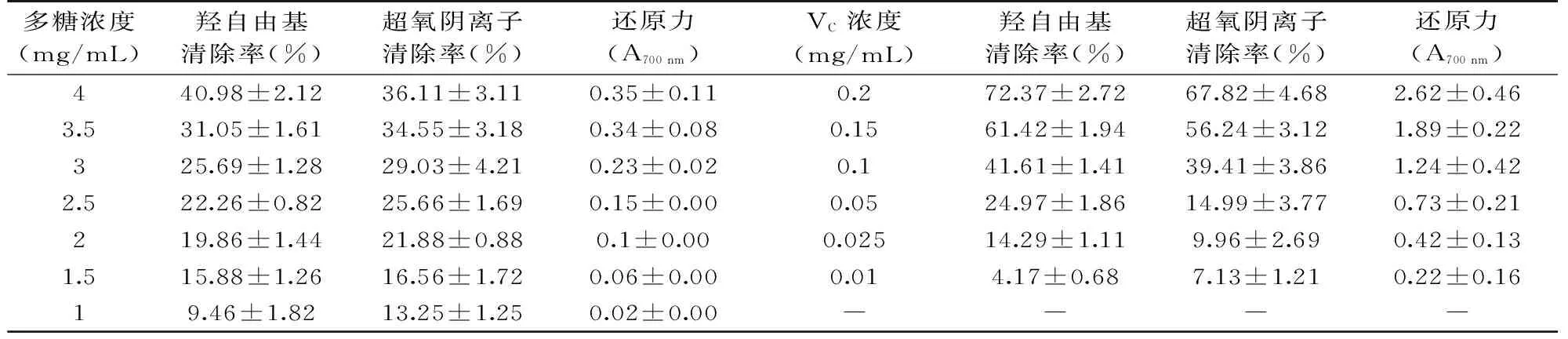
表4 GCP的抗氧化特性Table 4 Antioxidant activities of GCP

表5 GCP对6种菌株的抑菌圈直径(mm)Table 5 Inhibition zone diameter of the effect of GCP on the 6 strains(mm)
2.2.4 GCP2红外光谱特性 参考张惟杰[29]关于多糖红外光谱的描述,认为3000~2800 cm-1波数范围内出现的吸收峰是糖类C-H伸缩振动引起的,1400~1200 cm-1范围内的吸收峰是糖类C-H变角振动造成的,在这两个区域的吸收峰是糖类的特征峰。GCP2红外分析结果如图4,在2896 cm-1有一个弱吸收峰,正是C-H伸缩振动峰,3406 cm-1处的宽峰是由O-H伸缩振动引起的,1026 cm-1处的吸收峰可能是由O-H变角振动引起的,表明GCP2中含有-OH基团;而在1648 cm-1处的吸收峰主要是由CO-基团的C=O非对称伸缩振动引起的,1414 cm-1吸收峰是由-COOH的C-O伸缩振动引起的,1026 cm-1处的吸收峰是由-COOH的O-H变角振动引起的,说明GPS1中含有-COOH基团;835 cm-1处吸收峰表明GCP2中有α-吡喃糖苷键的存在。
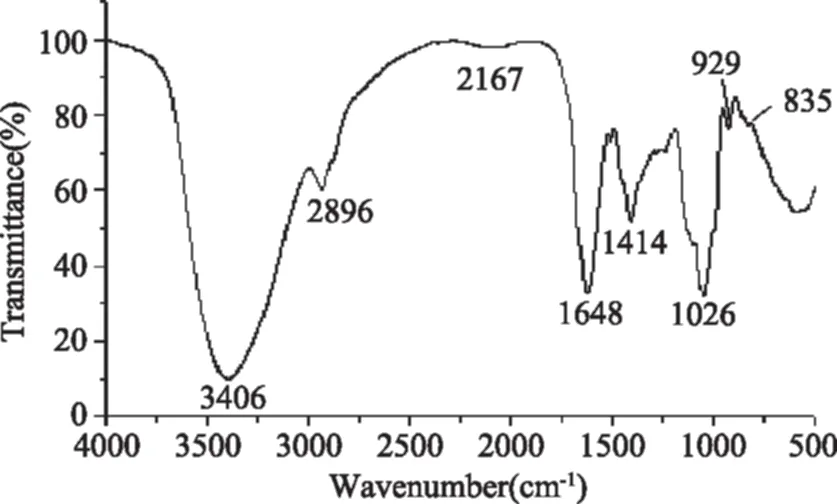
图4 GCP2红外光谱扫描图Fig.4 Infrared absorption spectrum of GCP2
2.3 GCP2抗氧化活性的测定
2.3.1 羟自由基的清除作用 分别研究了不同浓度下甘草多糖和VC对·OH的清除作用,结果如表4,供试样液对·OH的清除率随着浓度的增加而增大,VC在0.2 mg/mL时清除率达到72.37%,其IC50为0.125 mg/mL;而甘草多糖在4.0 mg/mL时达到40.98%,IC50值约为3.48 mg/mL。
通过补充必要的基础知识之后,开始进入分组项目开发阶段。导师先根据选题,布置学生进行文献检索。让学生充分了解项目的研究背景以及当前研究的进展。文献检索要求学生查阅一定数量的文献,整理要点,提交相关文档。这样一来,学生增加了阅读量,同时提高写作水平和表达能力,为后面阶段撰写论文和专利打下基础。
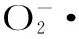
2.3.3 总还原力的测定 生物活性化合物的还原能力与其抗氧化能力之间存在一定关系,还原能力越强其抗氧化活性也越高,各个样品反应后生成物在700 nm处吸光值的大小即反映了其抗氧化能力的大小,吸光值越大则样品的还原能力越强。甘草多糖与VC还原能力如表4所示。由表4可知,VC和甘草多糖都随着浓度的增大吸光度也逐渐增大,样品液浓度1.0~3.0 mg/mL时的吸光度值小于VC浓度在0. 01~0.2 mg/mL时吸光度,还原能力较弱。
2.4 GCP2抑菌活性测定
采用滤纸片法测定了不同浓度GCP2对多种细菌的抑制活性,结果如表5,可以看出GCP2对革兰氏阳性菌(金黄色葡萄球菌、地衣芽孢杆菌、乳链球菌)和革兰氏阴性菌(大肠杆菌、绿脓杆菌、肺炎克雷伯菌)均有一定的抑制作用,尤其是3.0 mg/mL和4.0 mg/mL GCP2溶液对大肠杆菌和肺炎克雷伯菌效果最好,抑菌圈直径达到11 mm,阳性对照抑菌圈大小分别为7.5 mm和11 mm。有研究表明甘草根、茎和叶片中都含有抑菌活性成分,尤其是黄酮类化合物,具有很好的抑菌和抗肿瘤活性[16-19]。
3 结论
采用响应面分析法优化了甘草多糖最佳提取的工艺参数,即温度为70 ℃、时间为85 min、液料比为13∶1 mL/g、超声功率600 W,多糖平均提取得率为4.23%。
分别采用DEAE-52纤维素和Sephadex G100凝胶柱纯化对甘草多糖进行了纯化,并对主要组分GCP2的单糖组成和分子量分布进行了研究,得出GCP2主要由阿拉伯糖、葡萄糖和半乳糖组成,摩尔比为0.166∶5.56∶1.60;GCP2由3种不同组分组成的聚合物构成,主要组分重均分子量为1.378×105g/mol。光谱分析和多糖理化性质综合判定GCP2存在α-吡喃糖苷键。
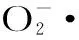
甘草多糖溶液对6种供试菌株具有一定的抑菌作用,尤其是对大肠杆菌和肺炎克雷伯菌抑制效果显著,在样品浓度为4 mg/mL时,抑菌圈均可达到11 mm。
[1]王巧娥,任虹,曹学丽. 甘草研究开发与利用现状[J]. 中国农学通报,2011,27(4):290-295.
[2]Vivek K Gupta,Atiya Fatima,Uzma Faridi,et al. Antimicrobial potential ofGlycyrrhizaglabraroots[J]. Journal of Ethnopharmacology,2008,116(2):377-380.
[3]D M Biondi,C Rocco,G Ruberto. New dihydrostibene derivatives from the leaves ofGlycyrrhizaglabraand evaluation of their antioxidant activity[J]. Journal of Natural Products,2003,66(4):477-480.
[4]S Demizu,K Kajiyama,K Takahashi,et al. Antioxidant and anti-microbial constituents of licorice:isolation and structure elucidation of a new benzofuran derivative[J]. Chemical and Pharmaceutical Bulletin,1988,36:3474-3479.
[5]孙明谦. 甘草中化学成分的研究[D]. 长春:吉林大学,2006.
[6]常婧. 甘草中黄酮类有效成分的提取、含量测定和抗氧化性研究[D].太原:中北大学,2014.
[7]韩雅慧,顾赛麒,陶宁萍,等. 甘草总黄酮提取工艺及总抗氧化活性研究[J]. 食品工业科技,2012(2):239-242.
[8]张波,官月平,田庆来,等. 乌拉尔甘草中黄酮类化学成分的研究进展[J]. 中成药,2006,28(9):1362-1365.
[9]T Fukai,M Ali,K Kaitou,et al. Anti-Helicobacter pylori flavonoids from licorice extract[J]. Life Sciences,2002,71(12):1449-1463.
[10]T Fukai,A Marumo,K Kaitou,et al. Antimicrobial activity of licorice flavonoids against methicillin-resistantStaphylococcusaureus[J]. Fitoterapia,2002,73(6):536-539.
[11]田庆来,官月平,张波,等. 甘草有效成分的药理作用研究进展[J]. 天然产物研究与开发,2006,18(2):343-347.
[12]聂小华,尹光耀,史宝军,等. 甘草有效成分体外抗肿瘤活性和免疫活性的研究[J]. 中药材,2003,26(7):507-509.
[13]H Ying Kai,W Hua Tao,M Tao,et al. Effects ofGlycyrrhizaglabrapolysaccharides on immune and antioxidant activities in high-fat mice[J]. International Journal of Biological Macromolecules,2009,45(1):61-64.
[14]张泽生,史珅,白鑫,等. 新疆产甘草品质评价及甘草多糖提取工艺研究[J]. 现代食品科技,2008,24(2):143-146.
[15]刘文玉,颜雪琴,林祥群,等. 响应面法优化新疆胀果甘草多糖的提取工艺[J]. 食品工业科技,2012,33(23):288-291.
[16]代巧玉,康丁,张洪斌. 水溶性甘草多糖的分离纯化、结构及生物活性研究进展[J]. 天然产物研究与开发,2013,25(9):1292-1296.
[17]张琳,樊金玲,朱文学,等. 响应面法优化超声波辅助提取甘草多糖工艺[J]. 食品科学,2010,16:67-71.
[18]王忱,谢广茹,史玉荣,等. 甘草多糖的体内抑瘤作用及其机制的研究[J]. 临床肿瘤学杂志,2003,8(2):85-87.
[19]张泽生,史珅,杨超慧,等. 甘草多糖免疫调节作用的研究[J]. 现代生物医学进展,2008,8(10):1835-1837.
[20]王忱. 甘草多糖抑瘤的体内实验及其分子机制的研究[D].天津:天津医科大学,2002.
[21]热娜·卡斯木,丛媛媛,屠鹏飞. 胀果甘草多糖的分离纯化及其理化性质[J]. 华西药学杂志,2008,23(4):448-450.
[22]刘晓风,刘琳,王永刚,等. 啤特果多糖分离纯化及抗氧化活性研究[J]. 现代食品科技,2014,30(7):179-186.
[23]刘建利. 宁夏乌拉尔甘草多糖的提取及其体外抗氧化活性的测定[J]. 食品与发酵工业,2011,37(7):210-213.
[24]L Wei,W Heng Yu,P Xiu Bing,et al. Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies of Ganoderma lucidum[J]. International Journal of Biological Macromolecules,2010,46(4):451-457.
[25]张百刚,钟旭美,刘晓风,等. 甘草多糖的提取及其抑菌实验的研究[J]. 粮油加工,2010(8):137-140.
[26]孙润广,张静. 甘草多糖螺旋结构的原子力显微镜研究[J]. 化学学报,2006,24(64):2467-2472.
[27]周蓉,齐莉,王雅芬,等. 甘草多糖的分离纯化及高效毛细管电泳分析[J]. 分析化学,1999,27(2):245.
[28]艾则孜,马小春. HPLC-ELSD法分析甘草多糖中单糖的组成[J]. 新疆大学学报(自然科学版),2007,24:236-238.
[29]张惟杰. 糖复合物生化研究技术[M]. 浙江:浙江大学出版社,1999.
Extraction,purification and biological activity of polysaccharide fromGlycyrrhizauralcnsisin Gansu
TIAN Yan-hua,YANG Zhao-yan,LIU Lin-feng,LIU Na-li,GUO Yun
(Food Engineering Department of Shanxi Pharmaceutical Vocational College,Taiyuan 030031,China)
GlycyrrhizauralensisFisch.;polysaccharide;ultrasonic extraction;response surface methodology;purification;antioxidant and antibacteria activity
2016-08-12
田艳花(1981-),女,硕士,讲师,研究方向:食品生物技术,E-mail:58952954@qq.com。
TS201.1
B
1002-0306(2017)10-0296-07
10.13386/j.issn1002-0306.2017.10.048
