玻璃和不锈钢容器发酵水豆豉的乙醇提取物对结肠癌细胞的体外凋亡诱导效果比较
2017-06-22易若琨
赵 欣,易若琨,骞 宇,*
(1.重庆第二师范学院,重庆市功能性食品协同创新中心,重庆 400067;2.重庆第二师范学院,重庆市功能性食品工程技术研究中心,重庆 400067;3.重庆第二师范学院,功能性食品研发重庆市工程实验室,重庆 400067;4.重庆第二师范学院,生物与化学工程系,重庆 400067)
玻璃和不锈钢容器发酵水豆豉的乙醇提取物对结肠癌细胞的体外凋亡诱导效果比较
赵 欣1,2,3,4,易若琨1,2,3,4,骞 宇1,2,3,4,*
(1.重庆第二师范学院,重庆市功能性食品协同创新中心,重庆 400067;2.重庆第二师范学院,重庆市功能性食品工程技术研究中心,重庆 400067;3.重庆第二师范学院,功能性食品研发重庆市工程实验室,重庆 400067;4.重庆第二师范学院,生物与化学工程系,重庆 400067)
对玻璃和不锈钢容器发酵水豆豉的体外结肠癌抑制效果进行了研究。两种水豆豉乙醇提取物中的染料木素和棉籽糖含量高于原料大豆乙醇提取物(RS),玻璃容器发酵水豆豉乙醇提取物(GVFS)中的染料木素和棉籽糖含量高于不锈钢容器发酵水豆豉乙醇提取物(SSVFS)。通过对体外培养的HT-29和HCT-116结肠癌细胞进行实验,得出GVFS具有最强的结肠癌细胞生长抑制效果,同时SSVFS对结肠癌细胞的生长抑制效果高于RS。进一步的RT-PCR实验也显示GVFS、SSVFS和RS均可以上调结肠癌细胞的Bax、Caspase-3、Caspase-8、Caspase-9 mRNA表达,同时下调Bcl-2、Bcl-xL表达,且GVFS的作用强于SSVFS和RS。实验结果显示,GVFS具有最高的染料木素和棉籽糖含量,同时具有最高的癌细胞增殖抑制效果和凋亡诱导效果,玻璃容器可以用来发酵具有高生理活性作用的水豆豉。
水豆豉,容器,结肠癌,凋亡,表达
水豆豉(Shuidouchi)是川渝地区一种酿造调味食品,可以直接食用,亦可用于烹饪[1]。水豆豉是由大豆发酵制成的一种营养丰富的豆制品,其生产工艺简单,除了家庭可直接制作外,企业也根据标准化工艺可进行快速生产[2]。水豆豉除了口味鲜美,生产简单等优点外,还具有包括抗氧化效果等多种功效[3];同时,我国传统医学还认为,水豆豉可缓解风热头痛、胸闷烦呕、痰多虚烦的多种病症[4]。水豆豉中含有丰富的营养成分,包括蛋白质、多种维生素和矿物质;同时,水豆豉中还含有大豆低聚糖类物质,除了大豆原料中的低聚糖,也含有大豆经发酵后新产生的几种低聚糖,豆豉中的大豆低聚糖类物质能提高消化功能,提高机体免疫力,降低肠道内产生的有毒物质,从而起到预防肠道肿瘤的效果[5]。大豆中含有丰富大豆异黄酮,研究表明大豆有效提取物中有近35%为大豆异黄酮,大豆中最主要的抗癌成分为大豆异黄酮[6]。经过发酵后,大豆中的大豆异黄酮可转化为具有更好生理活性的活性异黄酮,从而更好地预防机体氧化和肿瘤的发生[7]。李里特研究表明,亚洲人(中国、日本)的乳腺癌、结肠癌、前列腺癌的低发病率与食用大豆制品摄入大量染料木素有直接关系,染料木素可以抑制内皮细胞增生和血管生成,从而起到抑制癌症的作用[8]。大豆低聚糖中重要的活性成分包括棉籽糖,可抑制致癌物质生成的有害酶,起到抗癌作用[9]。大豆发酵为水豆豉的过程中,蛋白质、脂肪、灰分和粗纤维的变化不大,但是风味物质、大豆异黄酮和大豆低聚糖的含量变化较大,发酵后的水豆豉含有更多的风味物质、大豆异黄酮和大豆低聚糖[10],大豆异黄酮和大豆低聚糖变化可能是水豆豉抗癌作用差异的关键活性物质。同时,不同的发酵条件对水豆豉中功效成分的含量都会有一定的影响,影响的因素包括发酵时间、浸泡水量、发酵温度、后发酵时间等[11];功效成分的含量差异也造成不同加工工艺的水豆豉生理活性产生差异,最新的研究还显示,不同容器对水豆豉的生理活性也有显著影响[3]。
结肠癌是一种发生于结肠部位的消化道恶性肿瘤,结肠癌发病与饮食有直接关系,健康的饮食能够避免肠炎的发生,从而避免结肠炎诱发结肠癌[12],临床数据显示,慢性结肠炎患者的结肠癌的发生率比一般人群高[13]。实验证明水豆豉有一定体外癌细胞抑制效果[14],本研究针对水豆豉生产中最常用的玻璃容器和不锈钢容器发酵水豆豉的体外癌细胞诱导作用进行初步研究,通过细胞增殖的测定和癌细胞凋亡相关基因的变化测定比较玻璃容器和不锈钢容器发酵水豆豉对结肠癌细胞的抑制作用,结合生理活性物质大豆低聚糖和大豆异黄酮的含量分析容器对水豆豉生理活性作用的影响,结果对水豆豉的标准化生产将起到一定的指导作用。
1 材料与方法
1.1 材料与仪器
大豆(黄豆) 兰西县汇源植物油有限公司;染料木素对照品 上海源叶生物科技有限公司;棉子糖对照品 合肥博美生物科技有限公司;MTT试剂 上海伊卡生物技术有限公司;RPMI-1640液体培养基 美国Hyclone公司;CycleTESTTM PLUS DNA染色试剂盒 德国Becton Dickinson公司;Trizol试剂、OligodT18、RNase、dNTP 和MLV 美国Invitrogen公司;RT-PCR引物Bax、Bcl-2、Bcl-xL、Caspase-3、Caspase-8和Caspase-9 天根生化科技有限公司;其余试剂 均为国产分析纯;HT-29和HCT-116结肠癌细胞 中国科学院典型培养物保藏委员会细胞库。
Biomate3S紫外可见光分光光度仪、3111二氧化碳培养箱、A200PCR仪、LUX多功能性酶标仪 美国Thermo Fisher Scientific公司;Tancon2500PCR凝胶成像仪 上海天能科技有限公司;ICEN-24R高速冷冻离心机 杭州奥盛仪器有限公司;BI-150A生化培养箱 施都凯仪器设备有限公司;Scientz-10冷冻干燥机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 水豆豉的发酵和提取 参照文献[3]将大豆与蒸馏水按重量比1∶2浸泡12 h,然后在105 ℃下蒸煮大豆60 min。大豆冷却到36 ℃后均匀放入同容积的开口玻璃容器和不锈钢容器中在36 ℃的生化培养箱中保温发酵72 h。将发酵好的水豆豉冷冻干燥,然后将冻干后的水豆豉打碎成粉末,加入20倍量的80%乙醇(v/v)提取12 h,重复提取3次并合并提取液,减压蒸干溶剂得到水豆豉的乙醇提取物待用[14]。
1.2.2 染料木素计含量测定 称取5 mg的染料木素标准品置于25 mL容量瓶中,用80%乙醇(v/v)定容。分别吸取不同量的此溶液用80%乙醇稀释成浓度分别是1、2、3、4和5 μg/mL的染料木素标准液,在271 nm处测吸光度,通过吸光度和棉籽糖含量绘制标准曲线。
将水豆豉乙醇提取物1 g置于100 mL容量瓶中用80%乙醇定容,在271 nm处测定吸光度对照标准曲线求得水豆豉乙醇提取物中大豆异黄酮(以染料木素计)的含量[15]。
1.2.3 棉籽糖含量测定 称取1 g的棉籽糖标准品置于10 mL容量瓶中,用80%乙醇(v/v)定容。分别吸取不同量的此溶液用80%乙醇稀释成浓度分别是20、40、60、80和100 mg/mL的棉籽糖标准液,分别取0.2 mL不同浓度的标准液,加入0.1 mL浓度为50 mg/mL的苯酚溶液,再加入5 mL 的浓硫酸,100 ℃水浴加热3 min后在490 nm处测定吸光度,通过吸光度和棉籽糖含量绘制标准曲线。
将水豆豉乙醇提取物1 g置于10 mL容量瓶中用混合展开剂(v/v/v,乙腈∶冰乙酸∶水=6∶3∶2)定容,取5 μL乙醇提取物溶液在薄层板(110 ℃活化1 h)上进行条带长为3 cm的点样。将此薄层板放置于层析缸中展开(25 ℃恒温,6 h),喷上显色剂(苯胺-二苯胺-磷酸)显色(85 ℃,15 min)。收集1.5 cm×4.0 cm的棉籽糖的条带区域加3 mL的80%乙醇(v/v),超声提取20 min后在4500 r/min转速下离心20 min,取上清液重复棉籽糖标准曲线测定方法测定吸光度值,计算棉籽糖含量[16]。
1.2.4 MTT法测定癌细胞增殖 将HT-29和HCT-116结肠癌细胞接种于RPMI1640液体培养液(含10%灭活小牛血清)中,在CO2培养箱中进行贴壁培养,每2 d更换一次培养基。培养一周后,用0.05% Trypsin-EDTA消化贴壁癌细胞,将收集到的癌细胞按浓度1×104个/mL接种于96孔培养板,每孔接种200 μL含癌细胞的液体培养基,继续在CO2培养箱中培养24 h后待细胞贴壁后弃去上层液体培养基,然后每孔加入200 μL浓度为2 mg/mL的原料大豆(RS)、玻璃容器发酵水豆豉(GVFS)和不锈钢容器发酵水豆豉(SSVFS)乙醇提取物的液体培养基再培养48 h。最后弃去上层液体培养基后每孔加入质量浓度为5 mg/mL的含MTT试剂的液体培养基200 μL培养培养4 h,弃去上层液体培养基后每孔加入200 μL的DMSO后振荡30 min,570 nm波长下用酶标仪测定各孔OD值并按公式计算细胞增殖抑制率。抑制率公式(%)=[(空白孔OD值-水豆豉乙醇提取物OD值)/空白孔OD值]×100[17]。
1.2.5 RT-PCR法测定癌细胞凋亡相关表达 用10 cm细胞培养皿按MTT法测定癌细胞增殖同样培养HT-29和HCT-116结肠癌细胞并用水豆豉乙醇提取物进行处理,培养完成后在4500 r/min下离心分离10 min,除去上层培养液后加入一定量PBS进行洗涤,再在4500 r/min下离心分离10 min后用RNAzol提取各组癌细胞的总RNA,然后将总RNA浓度稀释到1 μg/μL。在RNA 提取液(2 μL)中按次序分别加入1 μL的OligodT18、RNase、dNTP 、MLV酶和10 μL的5×Buffer,在条件37 ℃ 120 min,99 ℃ 4 min,4 ℃ 3 min合成cDNA。然后以反转录-聚合酶链反应法扩增Bax、Bcl-2、Bcl-xL、Caspase-3、Caspase-8和Caspase-9的mRNA表达,同时以持家基因GAPDH作为内参照按同样同样条件进行扩增。最后用含溴化乙锭琼脂(1%浓度)电泳检查PCR扩增产物,并用Image 1.44软件进行半定量分析[3]。
1.3 数据统计
将三组平行实验结果取平均值,然后使用SAS 9.1统计软件采用one-way ANOVA方法分析各组数据在p<0.05水平上相互是否具有显著差异。
2 结果与分析
2.1 玻璃和不锈钢容器发酵水豆豉中染料木素含量比较
通过标准品吸光度的测定绘制出染料木素的标准曲线为Y=7.478X+0.141(R2=0.997,Y为染料木素浓度,X为吸光度值)(图1),对照标准曲线可知未发酵的大豆(原料大豆)、玻璃容器和不锈钢容器发酵水豆豉乙醇提取物中染料木素的浓度分别为0.24、1.21和0.76 mg/g(图2),大豆原料和不同容器发酵水豆豉乙醇提取物含有染料木素的含量具有显著差异(p<0.05)。大豆异黄酮是大豆中重要的生理活性物质,大豆发酵食品的发酵过程可使大豆异黄酮转化成便于人体吸收的游离型大豆异黄酮[18]。染料木素是大豆发酵食品中重要的游离型大豆异黄酮,研究显示染料木素对非小细胞型肺癌A549[19]和人宫颈癌Siha细胞[20]具有明显的凋亡诱导效果,是一种具有较强癌细胞抑制作用的生物活性物质。本研究中发酵水豆豉乙醇提取物中的染料木素含量大大高于未发酵的RS,且GVFS乙醇提取物中含有的染料木素显著高于SSVFS乙醇提取物。由此可以推断玻璃容器有利于水豆豉发酵过程中产生更多的染料木素,提高水豆豉的生物活性作用。

图1 染料木素标准曲线Fig.1 The standard curve of genistein
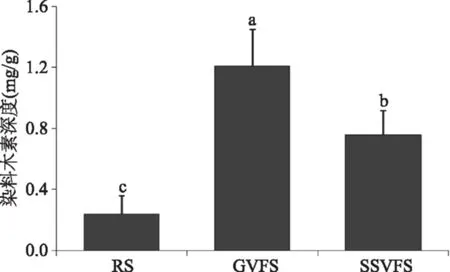
图2 水豆豉乙醇提取物中染料木素含量Fig.2 Genistein content of Shuidouchi ethanol extracts注:RS,2 mg/mL原料大豆乙醇提取物;GVFS,2 mg/mL玻璃容器发酵水豆豉乙醇提取物;SSVFS,2 mg/mL不锈钢容器发酵水豆豉乙醇提取物;不同字母表示各组数据平均值差异显著(p<0.05),图4同。
2.2 玻璃和不锈钢容器发酵水豆豉中棉籽糖含量比较
通过标准品吸光度的测定绘制出棉籽糖的标准曲线为Y=82.71X+2.163(R2=0.998,Y为棉籽糖浓度,X为吸光度值)(图3),对照标准曲线可知未发酵的大豆(原料大豆)、玻璃容器和不锈钢容器发酵水豆豉乙醇提取物中棉籽糖的浓度分别为126.4、202.3和177.6 mg/g(图4),各组棉籽糖的含量具有显著差异(p<0.05)。棉籽糖是优良的双歧杆菌增殖因子,具有很强的结肠保护作用,同时具有一定的癌细胞抑制功效[21]。棉籽糖是大豆低聚糖的重要组成部分,发酵过程中由于微生物的作用可使大豆发酵制品中的大豆低聚糖的含量大大提高[22],本研究也得到了相同的结果,发酵过程使水豆豉比原料大豆含有更多的棉籽糖,且玻璃容器更有利于棉籽糖的产生,使发酵的水豆豉具有更多的活性成分。
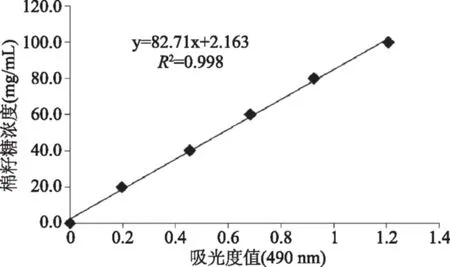
图3 棉籽糖标准曲线Fig.3 The standard curve of raffinose
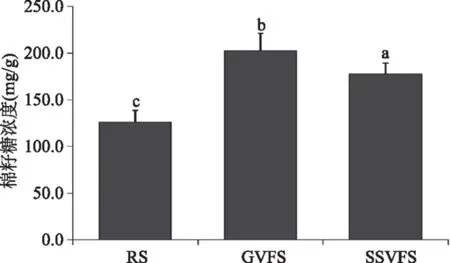
图4 水豆豉乙醇提取物中棉籽糖含量Fig.4 Raffinose content of Shuidouchi ethanol extracts
2.3 玻璃和不锈钢容器发酵水豆豉对结肠癌细胞增殖的影响比较
由表1可知,相同浓度染料木素、棉籽糖、RS、GVFS和SSVFS乙醇提取物处理HT-29和HCT-116结肠癌细胞后,癌细胞的OD570值较未处理的癌细胞显著下降(p<0.05),染料木素表现出最强对结肠癌体外增殖抑制效果,GVFS的癌细胞体外增殖抑制效果仅次于染料木素,显著高于棉籽糖、SSVFS和RS(p<0.05)。运用MTT法可以测定食品对癌细胞的增长抑制效果,从而判断食品的生物活性作用,是一种常用的检测方法[17],本研究也运用该方法得出发酵后的大豆制品(水豆豉)比原料大豆具有更好的结肠癌增殖抑制效果,玻璃容器发酵水豆豉(GVFS)比不锈钢容器发酵水豆豉(SSVFS)具有更强的结肠癌增殖抑制效果,且GVFS提取物的作用低于最主要的活性成分染料木素,高于活性成分棉籽糖,由此也证明水豆豉中的染料木素和棉籽糖均起到很强的抗癌作用。

表1 水豆豉乙醇提取物对HT-29和HCT-116结肠癌细胞的体外增殖抑制效果Table 1 In vitro proliferation inhibitory effects of Shuidouchi ethanol extracts in HT-29 and HCT-116 colon cancer cells
注:同列不同小写字母代表差异显著(p<0.05);表2、表3同。

图5 水豆豉乙醇提取物对结肠癌细胞Bax、Bcl-2和Bcl-xL mRNA表达的作用Fig.5 Effects of Bax,Bcl-2 and Bcl-xL mRNA of Shuidouchi ethanol extracts in colon cancer cells注:A:HT-29细胞;B:HCT-116细胞。
2.4 玻璃和不锈钢容器发酵水豆豉对结肠癌细胞Bcl-2家族mRNA表达的影响比较
通过RT-PCR分析可知,大豆和水豆豉处理HT-29和HCT-116结肠癌细胞相对未经处理的癌细胞均具有较高的Bax mRNA表达和较低的Bcl-2、Bcl-xL表达(图5、表2)。并且GVFS组癌细胞的Bax表达显著(p<0.05)强于其他组癌细胞,同时GVFS组癌细胞的Bcl-2、Bcl-xL表达则显著(p<0.05)弱于其他癌细胞。Bcl-2是一种重要的原癌基因,与恶性肿瘤的发生发展有重要的联系;同时Bcl-2可抑制癌细胞凋亡,促进肿瘤的发展,而Bcl-2蛋白家族中的Bcl-xL能起到和Bcl-2一样的抑制癌细胞凋亡的作用[15]。Bcl-2家族中另一类促进癌细胞凋亡的基因代表就是Bax,Bcl-2能与Bax形成二聚体,当Bax的量高于Bcl-2时,Bax与Bcl-2形成更多的二聚体,抑制Bcl-2作用,从而促进癌细胞凋亡,导致癌细胞死亡[23]。本研究的结果显示,玻璃容器发酵水豆豉比不锈钢容器发酵水豆豉更显著的上调Bax表达和下调Bcl-2、Bcl-xL,从而更好地起到诱导结肠癌细胞的作用,具有更好的体外抗癌功效。

表2 水豆豉乙醇提取物对HT-29和HCT-116结肠癌细胞Bax、Bcl-2和Bcl-xL mRNA表达的半定量分析Table 2 Semi-quantitative analysis of Bax,Bcl-2 and Bcl-xL mRNA of Shuidouchi ethanol extracts in HT-29 and HCT-116 colon cancer cells

表3 水豆豉乙醇提取物对HT-29和HCT-116结肠癌细胞Caspase-3、Caspase-8和Caspase-9 mRNA表达的半定量分析Table 3 Semi-quantitative analysis of Caspase-3,Caspase-8 and Caspase-9 mRNA of Shuidouchi ethanol extracts in HT-29 and HCT-116 colon cancer cells
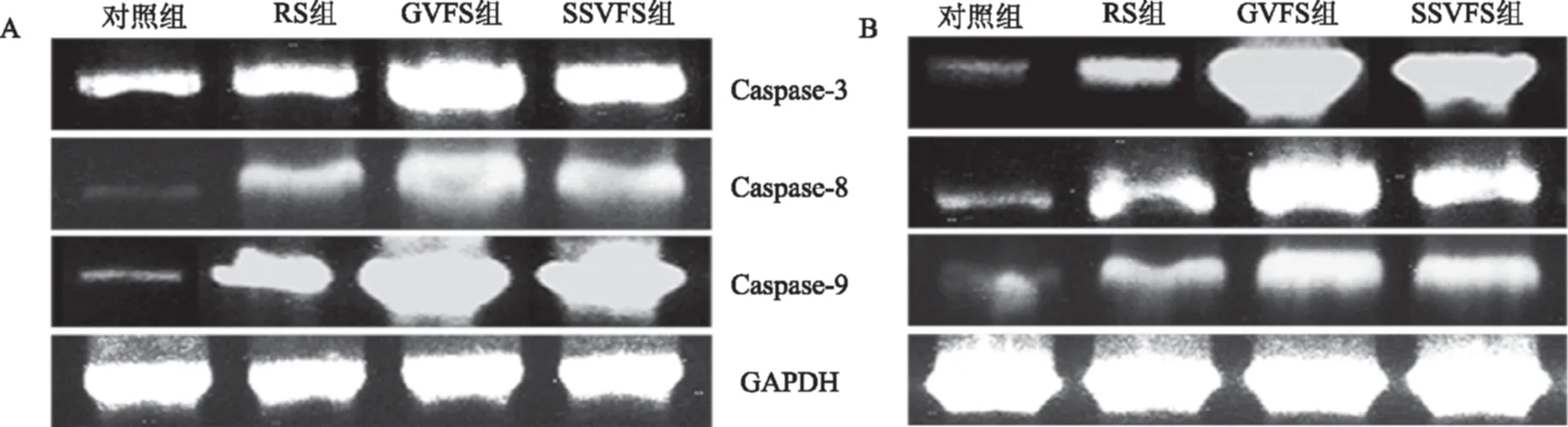
图6 水豆豉乙醇提取物对结肠癌细胞Caspase-3、Caspase-8和Caspase-9 mRNA表达的作用Fig.6 Effects of Caspase-3,Caspase-8 and Caspase-9 mRNA of Shuidouchi ethanol extracts in colon cancer cells 注:A:HT-29细胞;B:HCT-116细胞。
2.5 玻璃和不锈钢容器发酵水豆豉对结肠癌细胞Caspase家族mRNA表达的影响比较
由图6和表3可知,相对了未经样品处理的对照组HT-29和HCT-116结肠癌细胞,GVFS最大程度的上调了Caspase-3、Caspase-8和Caspase-9 mRNA表达,GVFS组癌细胞的以上表达显著强于SSVFS组和RS组HT-29和HCT-116结肠癌细胞(p<0.05)。Caspase家族基因可以对某些促癌蛋白质进行切割,促进癌细胞的凋亡,Caspase-9作为凋亡过程中的上游启动性半胱天冬酶,Caspase-9表达的加强能加强对下游 Caspase-3半胱天冬酶的刺激,从而使Caspase-3降解细胞内的结构和功能蛋白,诱导癌细胞凋亡的发生[24]。而Caspase-8作为外源性凋亡途径的执行者,能够促进癌细胞的凋亡,引发癌细胞死亡,起到抗癌的作用[25]。水豆豉乙醇提取物表现出上调癌细胞Caspase-3、Caspase-8和Caspase-9 mRNA表达的作用,而玻璃容器发酵的水豆豉起到了更强的上调作用,具有更好结肠癌体外抑制作用。
3 结论
对玻璃容器和不锈钢容器发酵水豆豉的体外结肠癌细胞凋亡诱导效果进行了比较。发现玻璃容器发酵水豆豉的染料木素和棉籽糖含量均高于不锈钢容器发酵水豆豉,两种水豆豉对HT-29和HCT-116结肠癌细胞的生长抑制效果均大大强于未发酵的原料大豆,且玻璃容器发酵水豆豉的癌细胞生长抑制效果高于不锈钢容器发酵水豆豉。进一步的实验结果证明玻璃容器发酵水豆豉能够上调结肠癌细胞的Bax、Caspase-3、Caspase-8、Caspase-9表达和下调Bcl-2、Bcl-xL表达,且效果强于不锈钢容器发酵水豆豉。由此可见,在水豆豉的发酵工艺中,选择玻璃容器进行发酵可更好地提高水豆豉中的胜利活性成分,起到更好的结肠癌抑制功效。
[1]赵欣. PBL教学法在提高水豆豉感官评价水平上的应用[J]. 中国调味品,2014,39(4):24-27.
[2]赵欣,李贵节. 浸泡水量对水豆豉理化特性的影响[J]. 食品工业科技,2013,34(22):217-220.
[3]冯霞,赵欣. 不同容器发酵水豆豉预防CCl4诱导肝损伤的研究[J]. 现代食品科技,2016,37(7):338-342.
[4]赵欣,王强. 不同后发酵时间的水豆豉理化特性比较研究[J]. 食品工业科技,2014,35(11):346-349,354.
[5]江和源,吕飞杰,邰建祥. 大豆中生物活性成分及其功能[J]. 大豆科学,2000,19(2):160-164.
[6]史桂玲,马欣,杨军,等. 豆制品中大豆异黄酮的含量比较[J]. 华西药学杂志,2006,21(3):305-306.
[7]赵欣,骞宇. 发酵时间对水豆豉理化特性和MCF-7人乳腺癌细胞体外抑制作用的影响[J]. 中国粮油学报,2015,30(1):27-32.
[8]李里特,王海. 功能性大豆食品[M]. 北京:中国轻工业出版社,2002.
[9]李疆. 大豆生物活性物质的综合开发[J]. 粮食与食品工业,2006,13(1):34-38.
[10]赵欣,骞宇. 发酵时间对水豆豉理化特性和 MCF-7人乳腺癌细胞体外抑制作用的影响[J]. 中国粮油学报,2015,30(1):27-32.
[11]冯霞,赵欣. 不同容器发酵水豆豉的理化特性比较研究[J]. 中国调味品,2016,41(1):77-81.
[12]王锡山,衣晓峰. 结肠癌与饮食结构有关[J]. 中国保健食品,2005(9):74.
[13]马高峰,刘江,张相安. 溃疡性结肠炎与大肠癌的关系[J]. 中国实用医刊,2001,28(2):10-11.
[14]赵欣,李贵节. 发酵时间和浸泡水量对水豆豉理化特性和体外抗癌效果的影响[J]. 食品工业科技,2013,34(23):344-348.
[15]黄芸,崔力剑,窦玉红,等. 紫外分光光度法测定大豆中异黄酮的含量[J]. 大豆科学,2007,26(2):273-275.
[16]廖春龙,邱奇琦,印遇龙,等. 薄层色谱-苯酚-硫酸法分析大豆低聚糖中棉籽糖含量[J]. 食品科学,2010,31(16):200-203.
[17]赵欣,王强,骞宇,等. 不同浓度苦丁茶对TCA8113人舌鳞癌细胞的体外抗癌效果[J]. 食品工业科技,2013,34(4):153-155,163.
[18]刘志胜,李里特,辰巳英三. 大豆异黄酮及其生理功能研究进展[J]. 食品工业科技,2000(1):78-80.
[19]任彦,陆红玲,宋永祥,等. 染料木素对非小细胞型肺癌A549/DDP细胞增殖和凋亡的影响[J]. 中国免疫学杂志,2014(5):669-672.
[20 李莉,王薇,廖书杰,等. 染料木素对人宫颈癌Siha细胞增殖凋亡和周期的影响[J]. 医药导报,2011,30(9):1147-1150.
[21]段雅婷,田苗,路锋,等. 棉籽糖药学研究现状[J]. 安徽农业科学,2010,38(13):7175-7176.
[22]刘玉兰,田原,鲍丹青. 大豆糖蜜发酵制备功能性大豆低聚糖的研究[J]. 河南工业大学学报:自然科学版,2010,31(2):1-5.
[24]冯霞,罗敏,赵欣. 虫茶对癌细胞生长和肿瘤转移抑制作用的研究[J]. 现代食品科技,2013,29(8):1898-1905.
[25]韩阳,官大威,侯震寰,等. Caspase-8及其研究进展[J]. 中国法医学杂志,2006,21(2):94-96.
Invitroapoptosis inducing effects comparison of ethanol extracts ofglass and stainless steel vessels fermented Shuidouchi in colon cancer cells
ZHAO Xin1,2,3,4,YI Ruo-kun1,2,3,4,QIAN Yu1,2,3,4,*
(1.Chongqing Collaborative Innovation Center for Functional Food,Chongqing University of Education,Chongqing 400067,China;2.Chongqing Engineering Research Center of Functional Food,Chongqing University of Education,Chongqing 400067,China;3.Chongqing Engineering Laboratory for Research and Development of Functional Food,Chongqing University of Education,Chongqing 400067,China;4.Department of Biological and Chemical Engineering,Chongqing University of Education,Chongqing 400067,China)
Theinvitrocolon cancer cells inhibitory effects of glass and stainless steel vessels fermented Shuidouchi were determined in this study. Two kinds of Shuidouchi ethanol extracts contained more genistein and raffinose than raw soybean ethanol extract(RS),genistein and raffinose contents of glass vessel fermented Shuidouchi ethanol extract(GVFS)were higher than stainless steel vessels fermented Shuidouchi ethanol extract(SSVFS). GVFS had the strongest colon cancer cells inhibitory effects,and the colon cancer cells inhibitory effects of SSVFS were higher than RS by the experiments ofinvitrocultured HT-29 and HCT-116 colon cancer cells. The results of further RT-PCR experiment also showed that GVFS,SSVFS and RS could raise Bax,Caspase-3,Caspase-8,Caspase-9 mRNA expressions of colon cancer,and reduce Bcl-2,Bcl-xL expressions,the effects of GVFS were stronger than SSVFS and RS. From the results,GVFS contained highest genistein and raffinose contents,and GVFS had highest cancer cells inhibitory effects and apoptosis inducing effects,glass vessel could be used for high physiological activities Shuidouchi fermentation.
Shuidouchi;vessel;colon cancer;apoptosis;expression
2016-11-28
赵欣(1981-),男,博士,教授,研究方向:食品营养和功能性食品,E-mail:zhaoxin@cque.edu.cn。
*通讯作者:骞宇(1976-),女,博士,副教授,研究方向:食品营养和功能性食品,E-mail:qianyubaby@126.com。
重庆高校创新团队建设计划资助项目(CXTD201601040);重庆市工程技术研究中心建设项目(cstc2015yfpt_gcjsyjzx0027)。
TS201.4
A
1002-0306(2017)10-0345-06
10.13386/j.issn1002-0306.2017.10.058
