冬小麦东农冬麦1号在不同温度下的代谢组学差异分析
2017-06-22包雨卓冯明芳彭瞰看王军虹
包雨卓,杨 宁,苍 晶,冯明芳,吕 岩,彭瞰看,田 宇,张 达,王军虹,孟 婧
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
冬小麦东农冬麦1号在不同温度下的代谢组学差异分析
包雨卓,杨 宁,苍 晶,冯明芳,吕 岩,彭瞰看,田 宇,张 达,王军虹,孟 婧
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
为明确东农冬麦1号耐寒越冬的生理机制,对不同温度条件下的东农冬麦1号幼苗分蘖节进行GC-TOF/MS代谢组学检测,并采用SIMCA软件对获得的代谢组学数据进行多元变量模式识别分析。结果表明,对温度变化反应明显的代谢产物有54个,对其进行KEGG分析发现,变化显著的代谢通路为:精氨酸和脯氨酸代谢;甘氨酸、丝氨酸和苏氨酸代谢;丙氨酸、天冬氨酸和谷氨酸盐代谢;丙酮酸代谢;糖酵解和糖异生以及肌醇磷酸盐代谢。分析不同温度下以上代谢通路中的差异化合物发现,室内培养组中,分蘖节中的γ-氨基丁酸、蔗糖-6-磷酸以及尿素等含量显著提高,使植株保持了较高的氮素含量,揭示了较高温度下(室内)小麦出现徒长的原因。研究结果可为进一步研究冬小麦越冬的生理特性提供新的研究思路。
东农冬麦1号;大田低温;室内恢复;代谢组学分析
小麦是全世界种植面积最大的粮食作物之一,是全世界约40%人口的主食。我国小麦种植面积仅次于玉米和水稻。在全球极端气候出现频率较高的背景下,小麦冻(寒)害发生的潜在危险逐年加大[1],因此,对其抗寒机制的研究十分重要。
代谢组学是Nicholson等[2]于1999年提出的概念,即对某一生物体组分或细胞在某一特定生理时期或条件下所有代谢产物同时进行定性和定量分析,以发现差异代谢物,进而明确某一时刻生物体组分或细胞的完整生理状态。用于代谢组学的分析技术主要有气相色谱(GC)、液相色谱(LC)、质谱(MS)、核磁共振(NMR)等[3]。根据色谱流动相的不同,可分为气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)技术。代谢组学在植物非生物胁迫方面的研究已有报道,Grimplet等[4]对酿酒葡萄的果实和种子分别在水分充足和干旱条件的代谢产物进行了组学分析;Rizhsky等[5]对植物干旱和热胁迫下的代谢组学进行了分析;Kempa等[6]利用GC-MS和芯片技术探讨了盐芥和拟南芥对盐胁迫时的代谢组学变化;Sung等[7]利用GC-MS、LC-MS对缺少氮、磷或钾条件下的番茄幼苗进行了代谢组学分析,发现某些代谢反应在各个矿物质缺乏条件下有很大不同,同时还发现氮、磷或钾缺乏时,根中棉子糖生物合成的代谢物急剧增加。
低温环境是幼苗期东农冬麦1号的正常生长环境,本研究拟利用代谢组学技术(GC-TOF/MS)分析东农冬麦1号在不同温度下的代谢变化,为后续深入探讨其越冬期的抗寒机制提供新的研究思路。
1 材料与方法
1.1 材料与设计
供试材料为冬小麦(Triticumaestivum)东农冬麦1号,为首例能在黑龙江省高寒地区安全越冬的冬小麦新品种,可耐受-30 ℃以下的低温,返青率大于85%[8]。于2015年9月8日播种于黑龙江省哈尔滨市东北农业大学试验田(45°7′N,126°6′E),完全区组设计,小区行长150 cm,行距25 cm,每行播种150粒,播深5 cm。常规田间管理。分蘖期将部分麦苗移栽到直径30 cm、深15 cm的花盆中,置于培养箱中(光暗16 h/8 h,温度20 ℃/10 ℃)培养(室内培养组)。同时监测室外田间温度,当连续10 d最低温度平均为5 ℃(白天最高温度仍可达到15 ℃左右,冬小麦可正常生长;本课题组前期试验证实,5 ℃是大田幼苗对于低温适应的一个温度节点,此时与抗寒相关的物质会开始积累)时进行样品的采集。两组材料随机选取长势一致的麦苗20株,蒸馏水洗净并吸干水分后,将分蘖节剪成0.5 cm小段,用锡箔纸包裹后液氮速冻,置-80 ℃冰箱保存备用。
1.2 方 法
1.2.1 代谢物萃取
取样品50 mg于2 mL EP管中,加0.4 mL提取液(甲醇∶水=3∶1),再加入20 μL核糖醇(内标);加入钢珠,40 Hz研磨仪(JXFSTPRP-24,上海净信科技有限公司)处理4 min,超声5 min(冰水浴);4 ℃、12 000 r·min-1离心15 min;取0.2 mL上清液于2 mL进样瓶(甲烷硅基化的)中。每个样本各取9 μL,作为控制样本。
1.2.2 代谢物衍生化
真空浓缩器干燥提取物后,加入60 μL甲氧胺盐(甲氧胺盐酸盐溶于吡啶,20 mg·mL-1),混匀后,放入烘箱,80 ℃孵育30 min;向每个样品中迅速加入70 μL BSTFA(含有1% TCMS,V/V)混合物,70 ℃孵育2 h;冷却至室温,向混样中加入7 μL FAMEs(饱和脂肪酸甲酯标准混合液);混匀后检测。
1.2.3 检测
Agilent 7890B气相色谱(USA)-飞行时间质谱(LECO Chroma TOF PEGASUS HT,USA)联用仪配有Agilent DB-5MS毛细管柱(30 m×250 μm×0.25 μm)。GC-TOF/MS具体分析条件如下:进样量1 μL,不分流模式;载气为氦气(99.996%);前进样口吹扫流速为3 mL·min-1;柱流速为1 mL·min-1;柱温50 ℃保持1 min,以10 ℃·min-1的速率上升至300 ℃,保持14 min;前进样口温度280 ℃;传输线温度270 ℃;离子源温度220 ℃;电离电压-70 eV;扫描方式50~500 m·z-1;扫描速率为20 spectra·s-1;溶剂延迟为460 s。
1.3 数据分析
采用LECO公司的Chroma TOF4.3X软件和LECO Fiehn Rtx5数据库进行峰提取、基线校正、峰对齐、解卷积、峰识别以及峰面积积分[9]。将缺失数据用最小值二分之一法填补,并用四分位数间距法滤除噪音数据,保留单组空值≤50%或所有组中空值≤50%的峰面积数据,用内标归一法对过滤后的数据进行标准化处理。使用SIMCA软件(V14)对归一化后的数据进行多元变量模式识别分析。采用主成分分析(principal components analysis,PCA)后,进行正交偏最小二乘法判别分析(OPLS-DA),继而对第一、第二主成分进行建模分析。模型的质量用7折交叉验证进行检验,并得到相应的Q2值;通过排列试验随机多次(n=200)改变分类变量y的排列顺序,得到相应的置换检验截距,对模型有效性做进一步检验。通过OPLS-DA分析,过滤掉不相关的正交信号,使获得的差异性代谢物更加可靠。在京都基因与基因组百科全书(KEGG)数据库中进行映射,找出对应的代谢通路并计算P值。通路富集分析通过Metabo Analyst 3.0进行。用OriginPro 2015作热图,其他作图用Office系列办公软件。
2 结果与分析
2.1 GC-TOF/MS检测结果
通过GC-TOF/MS检测,从冬小麦东农冬麦1号分蘖节提取物中共检测到400多个代谢产物的峰。由图1可看出,就代谢物种类而言,室内培养组的峰数量多于田间种植组。图中6种颜色的离子流表示6次生物学重复;纵坐标表示峰强度,每个峰代表一个或多个代谢物,峰强度越高表明该物质含量越高;横坐标为保留时间,是指物质从进样开始到通过色谱柱后达到最大浓度时所需要的时间,时间越长表示物质从毛细管柱分离出来的时间越久。
图1 室内培养(A)、田间种植(B)样品的GC-TOF/MS检测图
2.2 化合物鉴定结果
整理检测数据,根据离子峰匹配的命名条件,包括特征离子的相对分子质量、出峰时间、以及峰面积(即相对定量结果),共得到419个非靶标的代谢产物。将仪器检测所得峰的保留时间指数与Fiehn数据库数值比较,如果与数据库中的Fiehn RI(数据库中该物质的保留时间指数)差值在±5 000以内,则认为被测峰定性为此物质是有意义的,然后再与CAS、KEGG、PubChem数据库中的值比对,满足了差值在±5 000间条件之后,按照数据库中的匹配度从高到低排列,即可得到所要定性的目标代谢物。
根据以上筛选原则,共得到163个代谢产物,根据每种物质相对定量的结果,得到代谢产物相对含量的热图(图2),依据HMDB数据库(http://www.hmdb.ca/)将得到的代谢产物分为6个组,分别为:(1)糖、糖醇、糖酸;(2)有机酸及衍生物;(3)氨基酸、肽和类似物;(4)含氮化合物;(5)核苷、核苷酸和类似物;(6)其他化合物。从图2A可以看出,室内培养组样品的大部分糖、糖醇、糖酸的含量高于田间种植组,有机酸及衍生物组分也有类似的表现。图2B中,室内培养组与田间种植组相比,氨基酸含量有较大的差异,含氮化合物组中尿素和乙二胺差异较明显,核苷,核苷酸和类似物组中胸苷和胞苷一磷酸差异较明显,其他化合物组中含量差异也比较显著。
2.3 数据降维处理结果
数据降维处理采用主成分分析(PCA)、正交偏最小二乘法-判别分析(OPLS-DA)以及置换检验(Permutation test)方法进行。处理结果如图3所示。由图3A可以看出,左上角绿色方框代表的质控样本(Quality control)比较集中,表明仪器的稳定性较好,检测数据可靠,可进行后续试验。由图3B可以看出,室内培养与田间种植两组间PCA得分差异显著,在得分图上相距较远,且各组分的重复性较好,并处在95%置信区间以内。图3C是对模型进行OPLS-DA分析的结果,从图中可看出,在第一维预测主成分上,两组间代谢产物的得分相差较大,表明两个组分间的代谢产物存在较大的差异。
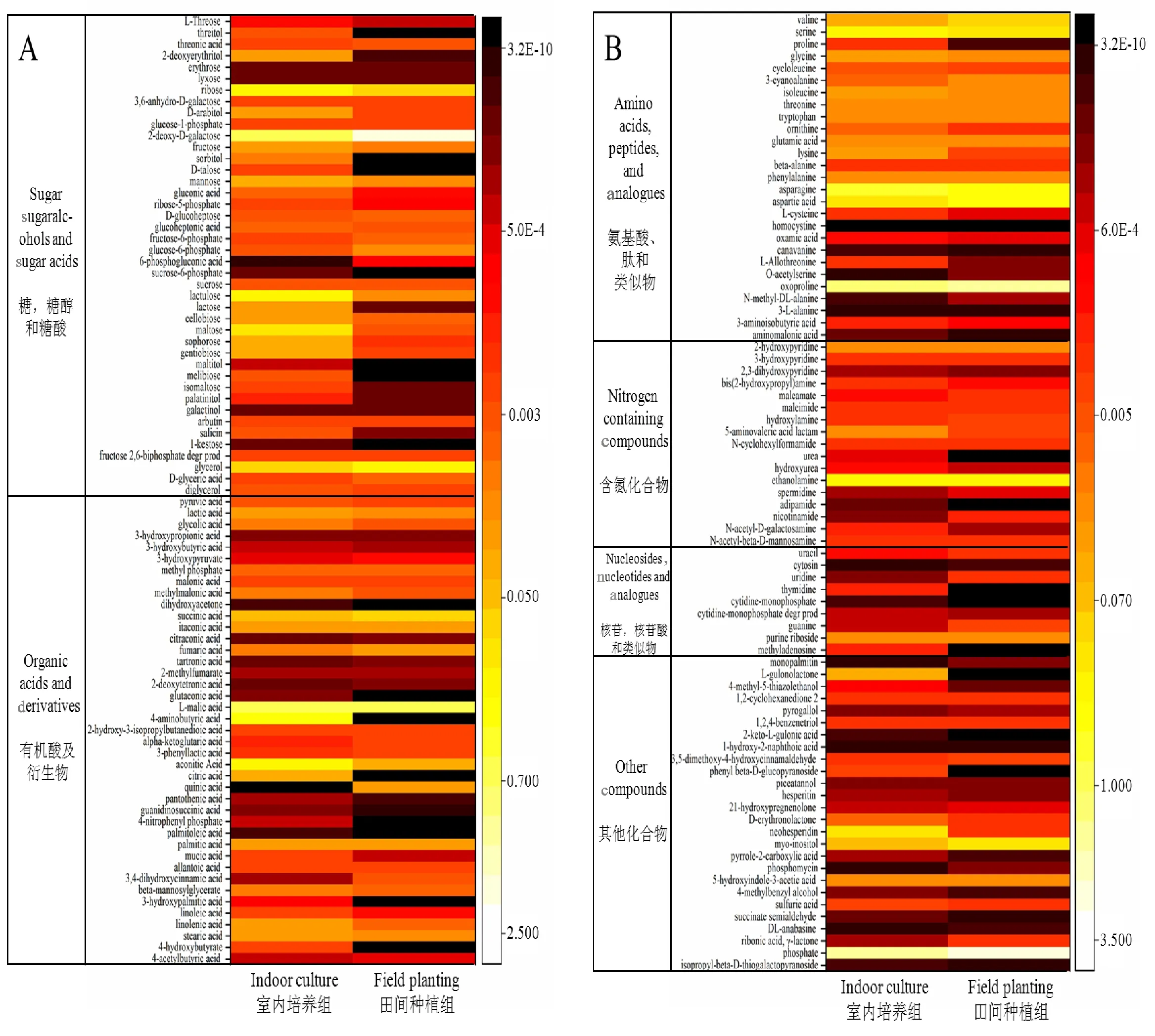
图2 163个代谢产物的热图
模型质量用7折交叉验证进行检验,得到模型的评价参数R2X、R2Y、Q2分别为0.425、1、0.949。其中,Q2接近1表明模型的可预测性较强。通过200次随机重复试验,得到了图3D所示的结果,左侧所有的点均低于最右侧两个相同颜色的原始点,同时,置换检验截距R2=0.951、Q2=-0.099 6可以很好体现模型的稳健性。因此,本试验建立的OPLS-DA模型可为后续的数据分析提供支持。
2.4 差异代谢物的筛选及通路富集分析
根据OPLS-DA分析过滤掉了不相关的正交信号,所以获得的差异性代谢物更加可靠。本试验采用 OPLS-DA 模型第一主成分的VIP(Variable importance in the projection)值(阈值>1),结合t检验(t-test)的P值(阈值<0.05),得到不同处理间差异较大的代谢产物54个(表1)。其中,糖代谢相关产物有20种,占差异物的37.0%,氨基酸代谢相关产物有8种,占差异物的14.8%。
将差异物对应的KEGG编号映射到KEGG网站中,可得到含有两个以上差异物的代谢通路图。采用此方法,共得到36幅代谢通路图。为得到具有更显著意义的代谢通路,利用通路富集分析得到了如图4所示的富集结果,从图4可以看出,变化较明显的是:精氨酸和脯氨酸代谢;甘氨酸、丝氨酸和苏氨酸代谢;丙氨酸、天冬氨酸和谷氨酸盐代谢;丙酮酸代谢;糖酵解和糖异生以及肌醇磷酸盐代谢。
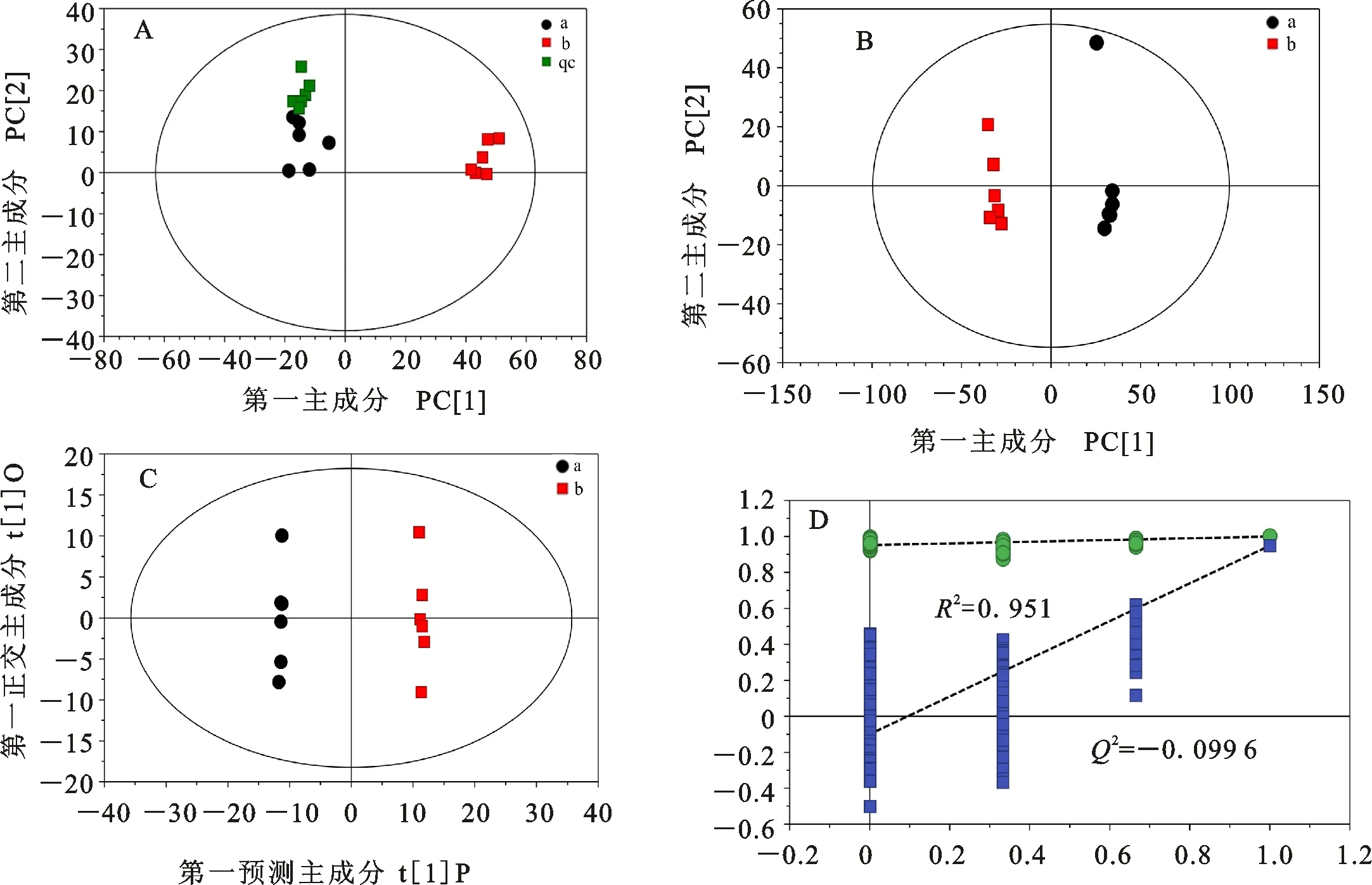
A:两种样本以及控制样本的主成分分析总得分图;B:两组样本比较的主成分分析得分图;C:两组样本比较的正交偏最小二乘法-判别分析得分图;D:两组样本比较建立的置换检验图;a:室内培养组;b:田间种植组;qc:质控样本。
A:PCA score plot of indoor culture,field planting and quality control; B:PCA score plot of indoor culture and field planting; C:OPLS-DA score plots of indoor culture and field planting; D:Permutation test result of OPLS-DA model established by the comparison between indoor culture and field planting; a:Indoor culture; b:Field planting; qc:Quality control.
图3 数据降维处理结果
Fig.3 The result of data reduction
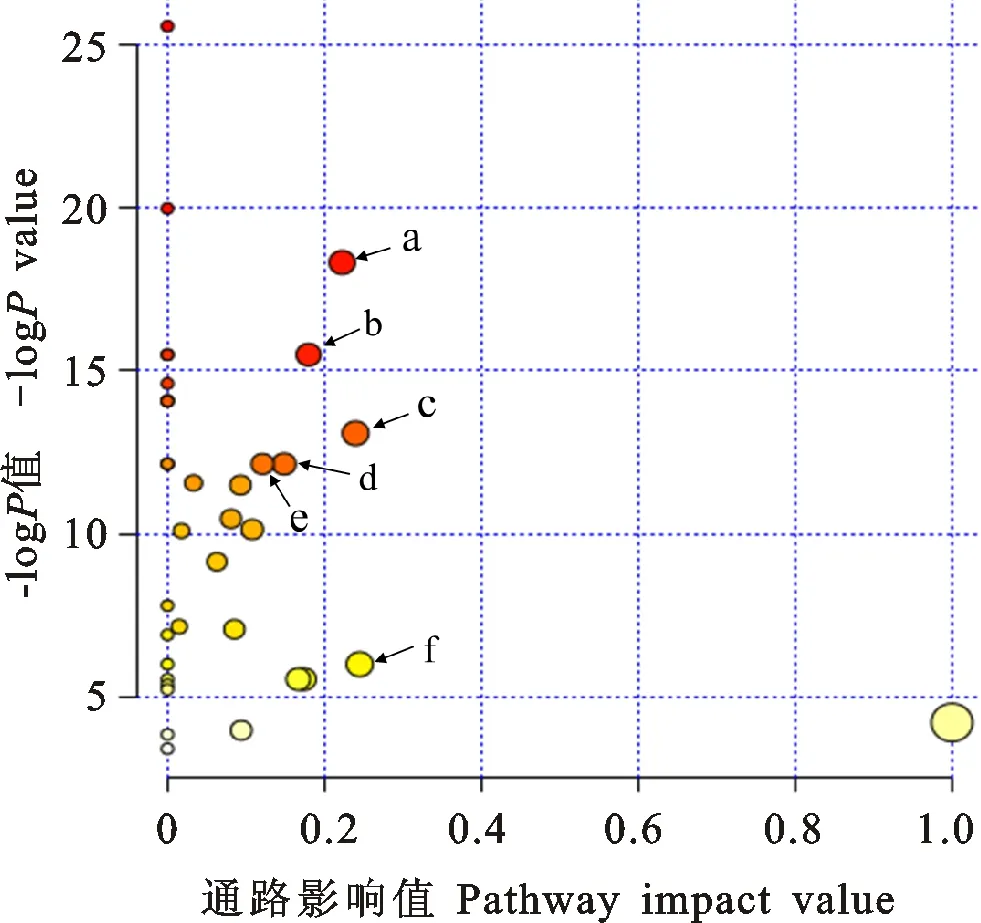
a:精氨酸和脯氨酸代谢;b:甘氨酸、丝氨酸和苏氨酸代谢;c:丙氨酸、天冬氨酸和谷氨酸盐代谢;d:丙酮酸代谢;e:糖酵解和糖异生;f:磷酸肌醇代谢。
a:Arginine and proline metabolism; b:Glycine,serine and threonine metabolism; c:Alanine,aspartate and glutamate metabolism; d:Pyruvate metabolism; e:Glycolysis and gluconeogenesis; f:Inositol phosphate metabolism.
图4 代谢物的通路富集分析
Fig.4 Metabolite pathway enrichment analysis
2.5 差异显著代谢物的通路分析
针对通路富集分析结果,以及代谢物相对含量的比较结果,得到了如图5所示的代谢流程图。左侧代谢流程图中黑色字体表示通路富集分析得到的变化量较大的代谢产物,灰色字体表示起承接作用的物质;右侧为室内培养组(A)与田间种植组(B)代谢物比值,红色表示室内培养组高于田间种植组,绿色表示相反的结果,紫色表示该物质只在室内培养组检测到。综合分析发现,与室内培养组相比,田间种植组中只有天冬氨酸、缬氨酸和肌醇含量高于室内培养组;而其他代谢产物的含量则明显低于室内培养组,其中,γ-氨基丁酸(GABA)、6-磷酸蔗糖和尿素,只在室内培养组中检测到,而在田间种植组中几乎未检出。
3 讨 论
本试验采用目前国内外比较先进的代谢组学研究方法,得到了强抗寒性品种东农冬麦1号的非靶标代谢产物400余个,得到变化较大的差异代谢产物54个,KEGG映射后得到36幅代谢通路图,通路富集分析得到6个差异明显的代谢通路。
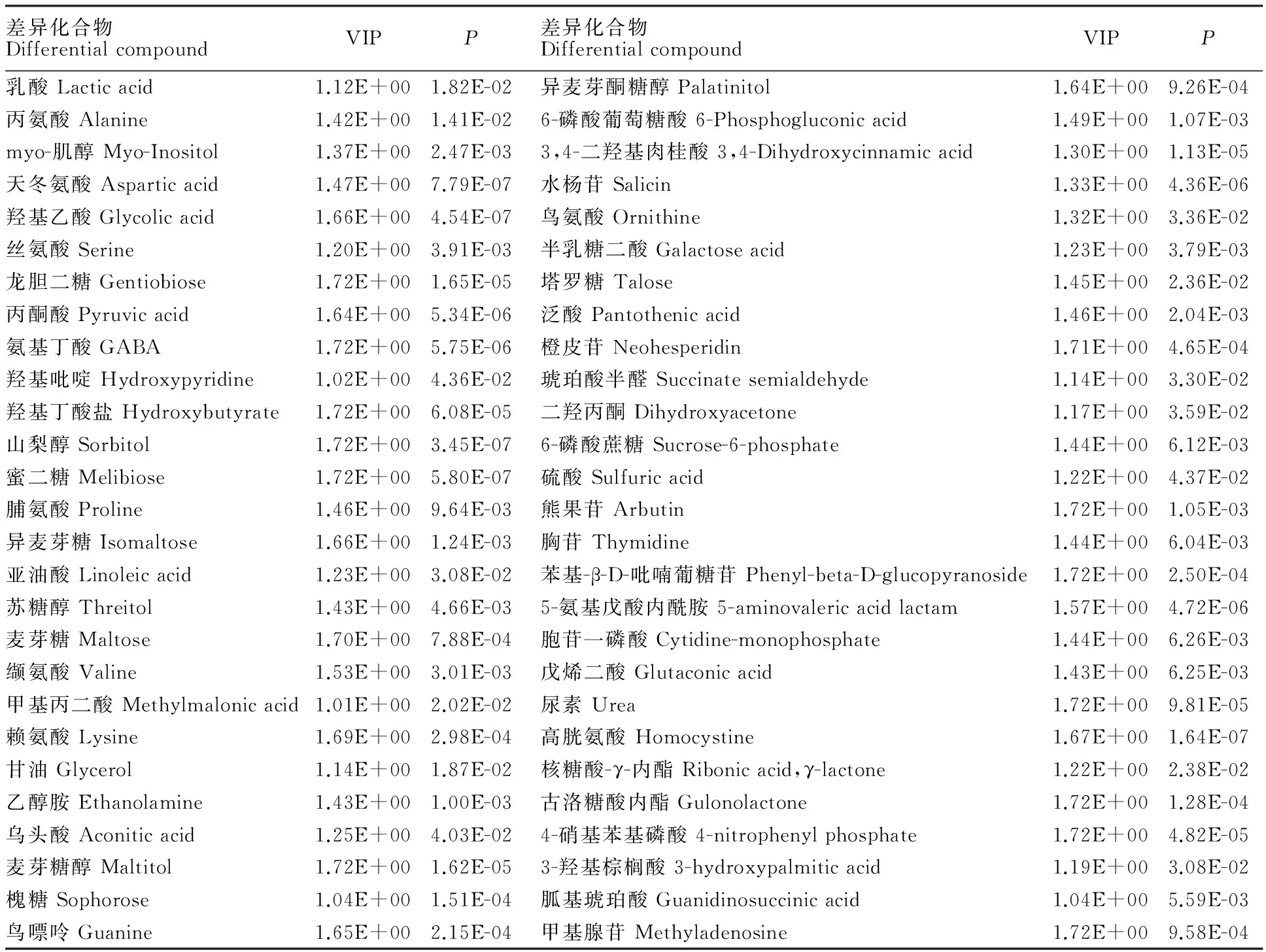
表1 差异代谢物的鉴定结果
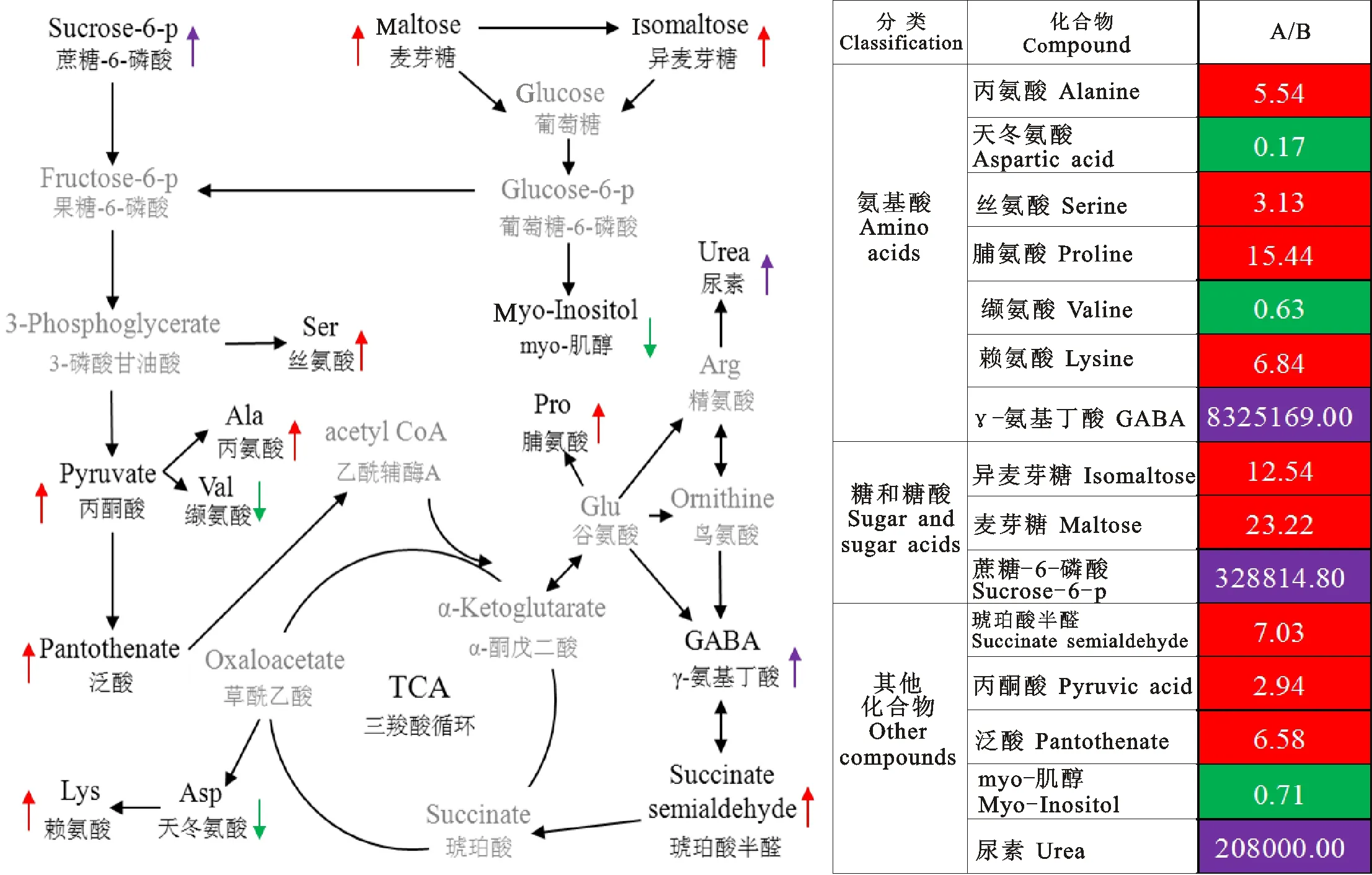
图5 差异代谢物的循环途径与变化倍数
大田植物的生长发育易受低温影响,有些物种处于低温逆境胁迫时,会通过改变蔗糖或由蔗糖衍生而来的寡糖的含量适应不利环境,可溶性糖是植物重要的渗透调节物质,蔗糖的积累可降低植物的冰点,增强细胞的保水力[10-12]。本试验中,仅在室内培养组中测得蔗糖-6-磷酸,这可能因为田间种植的冬小麦幼苗在感知外界温度降低后,将蔗糖-6-磷酸在蔗糖-6-磷酸水解酶的作用下转化为蔗糖,以提高小麦幼苗对于低温的适应。室内培养组的麦芽糖和异麦芽糖的含量高于田间种植组,这可能是低温促进了麦芽糖和异麦芽糖向葡萄糖的转化,磷酸化后的葡萄糖在低温下更加活跃,一方面转化为果糖-6-磷酸参与糖酵解反应;另一方面在肌醇-1-磷酸合成酶和碱性磷酸酶的作用下形成myo-肌醇[13-14],而肌醇是一种在植物体内无处不在的必需成分[15]。张 梦等[16]认为植物体内肌醇代谢过程为:肌醇单体被氧化成 D-葡萄糖醛酸,最终聚合为果胶和半纤维素。本试验结果显示,室内培养组的肌醇含量明显低于田间种植组,推测田间种植的冬小麦在平均最低温度为5 ℃时,已经准备开始启动抗寒相关的代谢,相对于室内培养组的小麦积累更多的肌醇作为信号转导因子,将感受到的低温在体内逐渐放大;同时积累大量的肌醇通过低温诱导后进入氧化途径,形成果胶和纤维素,增加细胞壁的机械强度和韧性,为即将到来的更低温度做准备。
氨基酸是生物功能大分子蛋白质的前体和植物体中重要的氮代谢物。在外界环境胁迫下,植物组织中的游离氨基酸能直接或间接的做出相应的改变,以适应环境[17]。在游离氨基酸中,受环境影响变化较明显的是脯氨酸(Pro)和γ-氨基丁酸(GABA)[18]。Ghoulam 等[19]研究认为,Pro是植物很好的渗透压调节剂,但Kishor等[20]研究认为, Pro 是一种无效的渗透压调节剂,实际上不同植物品种在遭受逆境时所表现的情况不尽相同。还有试验表明,Pro累积可以影响许多与能量相关的代谢途径和碳代谢,Pro合成提高了NADP+/NADPH的比值,该值的变化会影响到氧化磷酸戊糖途径(OPPP)碳的流动,从而提供了赤藓糖-4-磷酸,用于在胁迫条件下合成类苯丙醇或其他次级代谢物;而OPPP 的碳流量的变化可导致核苷酸的合成并促进细胞分裂[21]。高等植物中GABA代谢旁路在植物细胞响应逆境胁迫和增强植物抗逆适应性方面发挥着重要的作用[22]。GABA代谢旁路也被看作是最可能与胁迫抗性相关的代谢途径之一,植物在正常生长条件下其体内GABA含量通常较低,其内源水平一般维持在0.03~32.50 μmol·g-1FW 范围内,当植物受到逆境胁迫时,体内GABA会大量合成,其浓度能快速增加几倍甚至几十倍以上[23]。逆境(如盐碱、干旱、冷热胁迫以及机械损伤等)对谷氨酸脱羧酶(GAD)活性、谷氨酸脱羧酶基因的表达具有影响,可促进GABA的合成。Lancien等[24]研究发现,GABA、ABA 和乙烯等信号途径之间存在相互作用,推测盐胁迫时会诱导ABA增加,从而影响胞内Ca2+浓度变化来调控GAD的活性,进而诱导GABA的大量合成。对于逆境下GABA积累的另一种解释为与腐胺降解途径有关[25],Dittami 等[26]证实了褐藻长囊水云在盐胁迫下其体内 GABA 含量的增加主要是由胺降解途径形成的,说明GABA的积累与多胺氧化降解有关,在植物抗逆生理中发挥作用。但对于逆境下GABA积累的真正作用还不是很清楚,有试验表明植物在低氧胁迫时其体内会大量积累 GABA,同时丙氨酸(Ala)含量也显著提高,而研究发现拟南芥的GAD突变体 gad1和GABA转氨酶突变体 gaba-t1中,不仅GABA合成受到影响,Ala的合成也受到 gaba-t1抑制,说明GABA代谢旁路影响着低氧胁迫时Ala的代谢,也进一步说明植物在逆境条件下以 GABA为碳和氮的储存库[27]。在本研究中,室内培养组与田间种植组相比,其Pro含量增加了15.44倍,而GABA只在室内培养组中检测到。田间种植组Pro的含量相对较少,推测是因为5 ℃的环境温度是其生长过程中的正常温度,此时东农冬麦1号刚刚启动抗寒的响应,对于Pro的积累刚刚开始[8],并没有达到渗透胁迫以及作为信号转导的浓度;而室内培养组由于受到相对高温的影响,Pro的含量有所增高,从而引起OPPP的代谢循环加强,促进细胞分裂,使得室内培养冬小麦幼苗发生徒长。对于GABA只在室内培养组的出现,可能是室内温度相对较高,使GAD活性增强,从而引起GABA含量的突然增加。试验结果显示Ala含量也高于田间种植组5.54倍,印证了逆境下GABA作为碳和氮的存储库的结论;在GABA 转氨酶的作用下,GABA的含量增加促进了琥珀酸半醛的生成,本试验的结果显示琥珀酸半醛的含量相对于田间种植组高出7.03倍,在琥珀酸半醛脱氢酶的作用下,琥珀酸半醛可以生成琥珀酸,实现三羧酸反应的回补,从而促进三羧酸反应产生更多的中间产物,加速室内幼苗的生长。
依据代谢组学的分析,室内培养组出现徒长的原因,可能因为室内培养组的GABA、Urea、Pro以及其他游离氨基酸均处在一个含量较高的动态循环中,造成氮素的过多积累,从而导致室内培养组冬小麦幼苗徒长。
[1] 李春燕,李东升,宋森楠,等.小麦阶段性冻害的生理机制及预防途径研究进展[J].麦类作物学报,2010,30(6):1175.
LI C Y,LI D S,SONG S N,etal.Research progress on physiological-mechanisms and prevention approaches of cold injury in wheat [J].JournalofTriticeaeCrops,2010,30(11):1175.
[2] NICHOLSON J K,LINDON J C,HOLMES E.Metabonomics:Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J].Xenobiotica,1999,29(11):1181.
[3] 倪建伟,杨秀艳,张华新,等.代谢组学在植物逆境胁迫研究中的应用[J].世界林业研究,2014,27(5):12.
NI J W,YANG X Y,ZHANG H X,etal.Metabolomics and its application to plant press research [J].WorldForestryResearch,2014,27(5):12.
[4] GRIMPLET J,WHEATLEY M D,JOUIRA H B,etal.Proteomic and selected metabolite analysis of grape berry tissues under well-watered and water-deficit stress conditions [J].Proteomics,2009,9(9):2507.
[5] RIZHSKY L,LIANG H,SHUMAN J,etal.The response ofArabidopsisto a combination of drought and heat stress [J].PlantPhysiology,2004,134(4):1683.
[6] KEMPA S,KRASENSKY J,DALSANTO S,etal.A central role of abscisic acid in stress-regulated carbohydrate metabolism [J].PLosOne,2008,3(12):3914.
[7] SUNG J K,LEE S,LEE Y J,etal.Metabolomic profiling from leaves and roots of tomato(SolanumlycopersicumL.) plants grown under nitrogen,phosphorus or potassium-deficient condition [J].PlantScience,2015(241):62.
[8] 于 晶,张 林,崔 红,等.高寒地区冬小麦东农冬麦1号越冬前的生理生化特性[J].作物学报,2008,34(11):2019.
YU J,ZHANG L,CUI H,etal.Physiological and biochemical characteristics of Dongnongdongmai 1 before wintering in high-cold area [J].ActaAgronomicaSinica,2008,34(11):2019.
[9] KIND T,WOHLGEMUTH G,LEE D Y,etal.FiehnLib - mass spectral and retention index libraries for metabolomics based on quadrupole and time-of-flight gas chromatography/mass spectrometry [J].AnalyticalChemistry,2009,81(24):10040.
[10] BAGA M,CHODAPARAMBIL S V,LIMIN A E,etal.Identification of quantitative trait loci and associated candidate genes for low-temperature tolerance in cold-hardy winter wheat [J].Functional&IntegrativeGenomics,2007(7):53.
[11] 吴 冰,苍 晶,张 达,等.SA处理对低温胁迫下冬小麦(TriticumaestivumL.)蔗糖代谢的影响[J].植物生理学报,2015,51(4):537.
WU B,CANG J,ZHANG D,etal.Effects of SA treatment on winter wheat(TriticumaestivumL.) sucrose metabolism in low temperature [J].PlantPhysiologyJournal,2015,51(4):537.
[12] ONEILL S D.Osmotic adjustment and the development of freezing resistance inFragariavirginiana[J].PlantPhysiology,1983,72(4):938.
[13] KINDL H,HOFFMAN-OSTENHOF O.Sudies on the biosynthesis of cyclitols,II.Formation of meso-inositol from 14 C-1-glocose in sinapis alba and selective degradation of the resulting product [J].BiochemischeZeitschrift,1964,339(93):374.
[14] MAJUMDER A L,JOHNSON M D,HENRY S A.1L-myo-Inositol-1-phosphate synthase [J].BiochimicaetBiophysicaActa-biomembranes,1997,1348(1/2):245.
[15] LOEWUS F A,MURTHYP P N.Myo-inositol metabolism in plants [J].PlantScience,2000,150(1):1.
[16] 张 梦,谢益民,杨海涛,等.肌醇在植物体内的代谢概述-肌醇作为细胞壁木聚糖和果胶前驱物的代谢途径[J].林产化学与工业,2013,33(5):109.
ZHANG M,XIE Y M,YANG H T,etal.Myo-inositol metamolism as the precursor of xylan and pectin in plants [J].ChemistryandIndustryofForestProducts,2013,33(5):109.
[17] ASHRAF M,HARRIS P J C.Potential biochemical indicators of salinity tolerance in plants [J].PlantScience,2004,166(1):6.
[18] 徐 宇,肖化云,郑能建,等.植物组织中游离氨基酸在盐胁迫下响应的研究进展[J].环境科学与技术,2016,39(7):41.
XU Y,XIAO H Y,ZHENG N J,etal.Progress on responding of free amino acid in plants to salt stress [J].EnvironmentalScience&Technology,2016,39(7):40.
[19] GHOULAM C,FOURSY A,FARES K.Effects of salt stress on growth,inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars [J].EnvironmentalandExperimentalBotany,2002,47(1):39.
[20] KISHOR P K,SANGAM S,AMRUTHA R,etal.Regulation of proline biosynthesis,degradation,uptake and transport in higher plants:Its implications in plant growth and abiotic stress tolerance [J].CurrentScience,2005,88(3):424.
[21] 全先庆,张渝洁,单 雷,等.脯氨酸在植物生长和非生物胁迫耐受中的作用[J].生物技术通讯,2007,18(1):160.
QUAN X Q,ZHANG Y J,SHAN L,etal.The roles of proline in plant growth and the tolerance to abiotic stresses [J].LettersinBiotechnology,2007,18(1):160.
[22] AL-QURAAN N A,LOCY R D,SINGH N K.Implications of paraquat and hydrogen peroxide-induced oxidative stress treatments on the GABA shunt pathway inArabidopsisthalianacalmodulin mutants [J].PlantBiotechnoogylReports,2011,5(3):233.
[23] BOUCHE N,FAIT A,BOUCHEZ D,etal.Mitochondrial succinic-semialdehyde dehydrogenase of the γ-aminobutyrate shunt is required to restrict levels of reactive oxygen intermediates in plants [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2003,100(11):6848.
[24] LANCINE M,ROBERTS M R.Regulation ofArabidopsisthaliana14-3-3 gene expression by g-aminobutyric acid [J].PlantCellEnvironment,2006,29(7):1434.
[25] SU G X,YU B J,ZHANG W H,etal.Higher accumulation of g-aminobutyric acid induced by salt stress through stimulating the activity of diamine oxidases inGlycinemax(L.) Merr.roots [J].PlantPhysiologyandBiochemistry,2007,45(8):560.
[26] DITTAMI S M,GRAVOT A,RENAULT D,etal.Integrative analysis of metabolite and transcript abundance during the short-term response to saline and oxidative stress in the brown algaEctocarpussiliculosus[J].PlantCellEnvironment,2011,34(4):629.
[27] MIYASHITA Y,GOOD A G.Contribution of the GABA shunt tohypoxia-induced alanine accumulation in roots ofArabidopsisthaliana[J].PlantCellPhysiology,2008,49(1):92.
[28] 曹凤秋,刘国伟,王伟红,等.高等植物尿素代谢及转运的分子机理[J].植物学报,2009,44(3):274.
CAO F Q,LIU G W,WANG W H,etal.Molecular mechanisms of urea metabolism and transport in higher plants [J].ChineseBulletinofBotany,2009,44(3):274.
[29] TODD C D,TIPTON P A,BLEVINS D G,etal.Update on ureide degradation in legumes [J].JournalofExperimentalBotany,2006,57(1):10.
Metabolomic Profiling of Winter Wheat Dongnongdongmai 1 Grown at Different Temperatures
BAO Yuzhuo,YANG Ning,CANG Jing,FENG Mingfang,LÜ Yan,PENG Kankan,TIAN Yu,ZHANG Da,WANG Junhong,MENG Jing
(College of Life Science,Northeast Agricultural University,Harbin,Heilongjiang 150030,China)
To clarify the cold-resistant and cold hardening mechanism of Dongnongdongmai 1,the tillering nodes were collected from different temperature conditions for the study. The modern metabolomics research method(GC-TOF/MS) was employed to test the tillering nodes. Then the SIMCA software was used to analyze the data. The results showed that,54 metabolites which presented significant changes were detected. Significant changes of metabolic pathways were obtained through KEGG analysis,such as arginine and proline metabolism;glycine,serine and threonine metabolism;alanine,aspartate and glutamate metabolism;pyruvate metabolism;glycolysis or gluconeogenesis and inositol phosphate metabolism.As mentioned above,the γ-aminobutyric acid,sucrose-6-phosphate and urea were found to present the most significant changes in indoor culture group,which maintained the content of nitrogen at a high dynamic balance value. Therefore,these results could explain the phenomenon that the wheat at high temperature(room temperature) showed an excessive growth. In conclusion,the results of this study provided a new scientific research idea for further study of the physiological characteristics of winter wheat.
Dongnongdongmai 1; Field low temperature; Indoor recovery culture; Metabolomics analysis
时间:2017-05-12
2016-11-18
2016-12-06
国家自然科学基金项目(31471423,31601236);国家自然科学基金人才培养科研训练项目(J1210069);黑龙江省自然科学基金项目(C201418)
E-mail:baoyuzhuo1230@163.com
苍 晶(E-mail:cangjing2003@163.com)
S512.1;S311
A
1009-1041(2017)05-0647-09
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170512.2001.022.html
