大麦茎尖愈伤组织的诱导和植株高频再生
2017-06-22胡有良汪军成司二静任盼荣姚立蓉李葆春马小乐孟亚雄王化俊
胡有良,汪军成,司二静,任盼荣,姚立蓉,李葆春,马小乐,孟亚雄,王化俊
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室,甘肃兰州 730070;2.甘肃农业大学农学院,甘肃兰州 730070; 3.甘肃农业大学生命科学技术学院,甘肃兰州 730070)
大麦茎尖愈伤组织的诱导和植株高频再生
胡有良1,2,汪军成1,2,司二静1,2,任盼荣1,2,姚立蓉1,2,李葆春1,3,马小乐1,2,孟亚雄1,2,王化俊1,2
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃省干旱生境作物学重点实验室,甘肃兰州 730070;2.甘肃农业大学农学院,甘肃兰州 730070; 3.甘肃农业大学生命科学技术学院,甘肃兰州 730070)
为明确大麦茎尖高频再生培养体系的影响因素,以大麦品种甘啤3号、甘啤4号和甘啤6号为材料,研究颖壳去除方法、灭菌处理方式、无菌苗的苗龄、茎尖切段的大小和位置以及外源激素(2,4-D)浓度对大麦茎尖愈伤组织培养和植株高频再生的影响。结果表明,大麦种子颖壳去除的最佳方法是将种子浸泡在30%的硫酸中,并置于水平摇床30 ℃、180 r·min-1摇动1 h;同时发现参试品种中甘啤4号发芽率最高;75%的乙醇1.5 min + 2% 的NaClO 15 min的灭菌处理效果最好,其带菌率和发芽率与其他处理有显著差异,并且对种子伤害较小,幼苗整齐度较好,有利于无菌苗的培养;茎尖外植体愈伤组织的形成和植株再生频率与茎尖切段的位置和苗龄密切相关,3 d苗龄、茎尖基部2 mm处的切段效果最好;3 mg·L-12,4-D适宜愈伤组织的离体培养,在出愈率和植株再生率上差异显著,可以诱导出大量愈伤组织。
大麦;茎尖外植体;带菌率;出愈率;植株再生率
大麦(HordeumvulgareL.)是禾本科大麦属的一年生或越年生作物,用途比较广泛,可食用、饲用,也是制造啤酒的重要原料[1]。随着生物技术研究的进步,大麦组织培养技术日趋完善,为大麦转基因研究提供了可利用的受体材料。大麦不同部位的外植体材料已被尝试用于建立高效的再生体系,主要有花药[2]、幼穗[3]、幼叶[4]、幼胚[5-7]、成熟胚[8-9]、分生组织[10]、茎尖[11]、根尖[12]及叶基[13-15]等。在大麦体细胞培养中,成熟胚和幼胚是最常用的外植体。成熟胚具有无可比拟的优越性,但其诱导能力差,分化能力低下;而以幼胚及其胚性愈伤组织作为外植体转化分化周期较长,培养过程中容易造成体细胞无性系变异,而且分化及转化效率受基因型限制很大。因此寻找一种受基因型和季节限制小、快速、简单、高效的大麦再生体系对大麦组织培养以及大麦转基因研究具有重要意义。通过植物茎尖先诱导愈伤组织,再诱导再生植株已有许多报道,如小麦[16-17]、珍珠黍[18]、早熟禾[19]、大豆[20]、黑麦草[21]、水稻[22]等。茎尖外植体的来源广泛,不受季节、基因型限制,而且周期很短。Polumahanthi等[23]研究了高粱茎尖外植体的高效再生;陈 莉等[24]研究了玉米茎尖再生体系的建立。关于大麦茎尖离体培养已有报道,但目前尚缺乏针对大麦茎尖外植体高效再生的系统研究。
大麦种子被颖壳包裹且颖壳很难去除。在培养无菌苗时如果不去除颖壳,种子灭菌不彻底,接种时很容易污染。目前,试验中常采用人工去除大麦颖壳[25],但人工去壳速度较慢,胚破损多,不能满足大量试验的需求,且还有一定的污染,因此研究一种快速、大量且破损较小的去壳方法至关重要。
生长素(2,4-D)在禾本科植物中愈伤组织的诱导和继代培养中具有重要作用,在大麦愈伤组织培养中2,4-D更是一个关键因素。Bregitzer 等[26]报道,在大麦中绿色植株的再生和2,4-D的浓度成正相关。Sahrawat等[27]在大麦胚芽鞘再生体系中研究表明,在MSB体系中添加11.3 μmol·L-12,4-D能高频诱导出愈伤组织。Pasternak等[28]在大麦叶基高频再生中利用2 mg·L-1的2,4-D成功诱导出愈伤组织。但关于大麦茎尖愈伤组织诱导方面2,4-D的最适浓度尚未见研究报道。
本研究以大麦栽培品种甘啤3号、甘啤4号、甘啤6号种子为材料,探讨大麦种子颖壳去除的不同方法对幼苗的污染和对种子发芽情况的影响,并以筛选出的发芽率较好的种子(甘啤4号)为材料,研究不同灭菌方式、苗龄、茎尖外植体不同切段和部位以及外源激素(2,4-D)浓度对大麦茎尖愈伤组织诱导和植株再生的影响,旨在建立大麦茎尖高频再生体系,为大麦的遗传转化提供基础。
1 材料与方法
1.1 材 料
所用大麦品种为甘啤3号、甘啤4号、甘啤6号,均由麦类实验室(甘肃省干旱生境作物学重点实验室)提供。
1.2 培养基
茎尖愈伤组织诱导培养基:MS+琼脂(0.7%)+麦芽糖(3%)+2,4-D(3 mg·L-1)+水解酪蛋白(0.5 g·L-1)+脯氨酸(0.5 g·L-1)
愈伤组织继代培养基:MS+琼脂(0.7%)+麦芽糖(3%)+2,4-D(1.5 mg·L-1)+水解酪蛋白(0.5 g·L-1)+脯氨酸(0.5 g·L-1)+KT(0.2 mg·L-1)
愈伤组织分化培养基:MS+琼脂(0.4%)+麦芽糖(3%)+6-BA(0.5 mg·L-1)+KT(0.5 mg·L-1)
生根培养基:MS+琼脂(0.4%)+麦芽糖(3%)+NAA(0.5 mg·L-1)
以上培养基pH均调至5.8,121 ℃高压灭菌20 min。
1.3 种子去壳试验
选用当年收获的甘啤3号、甘啤4号、甘啤6号大麦成熟种子,挑选籽粒饱满、无发霉、颜色相近、大小一致的种子分别进行以下不同处理:A1(人工去壳)、A2(人工去壳后加入50 mL蒸馏水,在摇床中30 ℃、180 r·min-1下摇动1 h)、A3(加入30%的硫酸50 mL,在摇床中30 ℃、180 r·min-1下摇动1 h)、A4(种子未去壳)。每个处理60粒种子,3次重复。将各处理的种子分别装入灭菌过的培养瓶,用75%乙醇浸泡30 s,再用0.1%升汞按常规方法灭菌,接种于MS培养基[29],在25 ℃下培养 3 d 后,观察种子上面有无细菌、真菌等长出,若有则认为被污染,记录被污染种子数即为菌落数;同时观察种子发芽情况,记录发芽数。以灭菌种子的平均带菌率、发芽率分别表示灭菌和发芽效果。种子平均带菌率(%)=被污染种子数(菌落数)/每处理供试种子数×100;发芽率(%)=发芽种子数/每处理供试种子数×100;整齐度(%)=苗高大于或等于2 cm的幼苗数/每处理供试种子数×100。下同。
1.4 种子灭菌试验
供试大麦品种为1.3节中筛选出的发芽率较好的品种(甘啤4号)。挑选该大麦品种的种子2 160粒,通过30%的硫酸去壳后,用无菌蒸馏水冲洗5~7次,洗去多余的硫酸,再用75%酒精灭菌处理一定的时间,紧接着用相应灭菌剂处理15 min,灭菌后的种子接种于MS培养基,在25 ℃、光照时间16 h·d-1、3 000 lx光照下培养3 d,记录菌落数、发芽数以及苗高≥2 cm的幼苗数,以灭菌种子的平均带菌率和发芽率、整齐度分别表示灭菌和发芽效果。本试验为二因子试验,因子1为灭菌剂使用前先用 75%乙醇浸泡一定时间,处理时间设6个水平,依次为0、0.5、1、1.5、2、3 min(依次编号为C1、C2、C3、C4、C5、C6)。因子2为灭菌剂处理,即在75%乙醇浸泡一定时间后,再分别用三种灭菌剂进行灭菌,三种灭菌剂依次编号为B1(10%H2O2)、B2(2%有效氯的NaClO)、B3(1%升汞),灭菌剂处理时间均为15 min,总共18个处理组合(表1),每个组合3次重复,每重复40粒。
1.5 茎尖外植体准备
将已灭菌处理的甘啤4号种子接种于MS基本培养基,25 ℃下光照培养3 d后,选取健壮苗(苗的高度为2 cm左右)分别进行以下处理:(1)剥离胚芽鞘及2片左右的幼叶,切下包含茎尖分生组织和叶原基在内的长约2 mm的茎尖,命名为ST00;(2)自幼苗基部去掉种子和根,由基部向上依次切取长约2 mm左右的茎尖切段6段(编号依次为ST0、ST1、ST2、ST3、ST4、ST5),ST0切段包括胚芽鞘基部、第1、2真叶叶基和茎尖分生组织。共7个处理,每一处理设3个重复,每重复包括60个茎尖外植体。
1.6 茎尖外植体愈伤组织诱导、继代培养及植株再生
将以上切段置于诱导培养基, 25 ±1 ℃黑暗条件下培养。接种后随时观察愈伤组织生长状况,14 d后统计出愈率。接种7 d左右,初始愈伤组织形成,其结构松散、呈水渍状、且颜色发白。初始愈伤组织经过继代培养,便会形成具有再生能力的胚性愈伤组织。分别选取继代后不同切段产生的乳黄、颜色鲜亮、致密的愈伤组织,转移到分化培养基上于3 000 lx光照下培养,光照时间为16 h·d-1。分化培养后随时观察愈伤组织出现绿点的情况,每14 d进行继代,继代2次后将分化出的小苗转至生根培养基上生根培养,定期统计植株再生率。
1.7 不同苗龄茎尖的愈伤组织诱导及植株再生
将生长1~10 d的幼苗分别设6个苗龄梯度(1 d、2 d、3 d、5 d、8 d、10 d)并去掉种子和根,从每个材料的茎尖基部切取2 mm左右的切段,按苗龄梯度顺序接种于愈伤组织诱导培养基上,于25 ℃、黑暗培养2 d后,多数茎尖开始膨大,部分茎尖开始伸长,少数茎尖产生愈伤组织。培养7 d时剥去由叶原基发育的幼叶,剥离幼叶时要避免损伤叶原基附近的分生组织,将诱导出的小愈伤组织接种于愈伤组织继代培养基上进行增殖和继代培养,14 d后统计出愈情况。分别选取继代后不同苗龄茎尖基部切段产生的乳黄 、颜色鲜亮、致密的愈伤组织,转移到分化培养基上于3 000 lx光照下培养,光照时间为16 h·d-1。分化培养后随时观察愈伤组织出现绿点的状况,每14 d进行继代,继代2次后将分化出的小苗转至生根培养基上生根培养,定期统计植株再生率。
1.8 愈伤诱导培养基中2,4-D浓度的设置
接种甘啤4号茎尖外植体材料,在基础培养基(MS+0.7%琼脂+3%麦芽糖+0.5 g·L-1水解酪蛋白+0.5 g·L-1脯氨酸)中分别添加不同浓度的2,4-D(1、2、3、4、5、6、7 mg·L-1)诱导愈伤,观察愈伤组织的颜色、形态等,14 d后统计出愈率,待其产生乳黄、 致密的愈伤组织,转移到分化培养基上于3 000 lx光照下培养,光照时间为16 h·d-1,分化培养后随时观察愈伤组织出现绿点的状况,每14 d进行继代,继代2次后将分化出的小苗转至生根培养基上生根培养,定期统计植株再生率。每个2,4-D浓度设置3个重复。
1.9 植株生根培养和移栽
当幼苗长至2~3 cm时,转接至生根培养基上,光照培养。待苗长出部分健壮的根时,进行锻炼后移入土中。
1.10 数据统计及分析
出愈率(%)=(形成愈伤组织的茎尖数/总接种茎尖数)×100
植株再生率(%)=(分化出完整植株的愈伤数/总接种愈伤数)×100
用 Excel 2007 和 SPSS 19.0对数据进行统计、方差分析(LSD法)和作图。
2 结果与分析
2.1 大麦种子不同颖壳去除方式的效果
如图1所示,A3处理后再按1.3节中方法常规灭菌,种子的平均带菌率为0,与其他处理相比差异显著;不同品种中只有甘啤6号在A1、A2、A3处理间发芽率差异不显著;整齐度在不同处理间差异显著,但品种间差异均不显著。A4处理带菌率达到100%,发芽率也较低,为2.8%~8.9%,整齐度为1.1%~3.9%; A1处理带菌率为33%以上,发芽率较高,其中最高为甘啤4号,甘啤3号次之,甘啤6号最低。A2处理明显降低了污染,带菌率在3.3%~5.0%之间,发芽率较高,最高为甘啤4号,甘啤3号次之,甘啤6号最低。以上结果表明,A3处理极大地降低了污染,增强了种子的发芽率和长势,说明30%硫酸不仅能够有效去壳,还能打破种子的休眠,增加发芽率。种子颖壳去除后,发芽率和整齐度显著提高。
2.2 种子最佳灭菌组合
从表1可以看出,未经75%乙醇预浸泡而直接用三种灭菌剂处理,C1B2和C1B3灭菌效果显著高于C1B1。随着75%乙醇处理时间的延长,带菌率呈下降趋势,说明75%乙醇预处理能降低种子带菌率。75%乙醇处理1.5 min以上,再结合2%的有效氯NaClO 15 min或1%升汞15 min,灭菌效果最好,带菌率都为0。C6B1的灭菌效果与直接利用B1(C1B1)相比达极显著水平,带菌率下降80%。从发芽率可以看出,B3和B2的灭菌效果差异不显著,都显著高于B1。随着75%乙醇处理时间的延长,种子发芽率逐渐下降。C4结合B1或B2灭菌,对种子较安全,发芽率无显著差异;C5、C6结合B1或B2灭菌对种子伤害显著。整齐度的趋势和发芽率相似。结合种子带菌率、发芽率、整齐度三个方面来看,C4B2组合灭菌效果最好,不仅能有效降低种子带菌率,而且对种子伤害较小,整齐度较好,有助于无菌苗的培养。
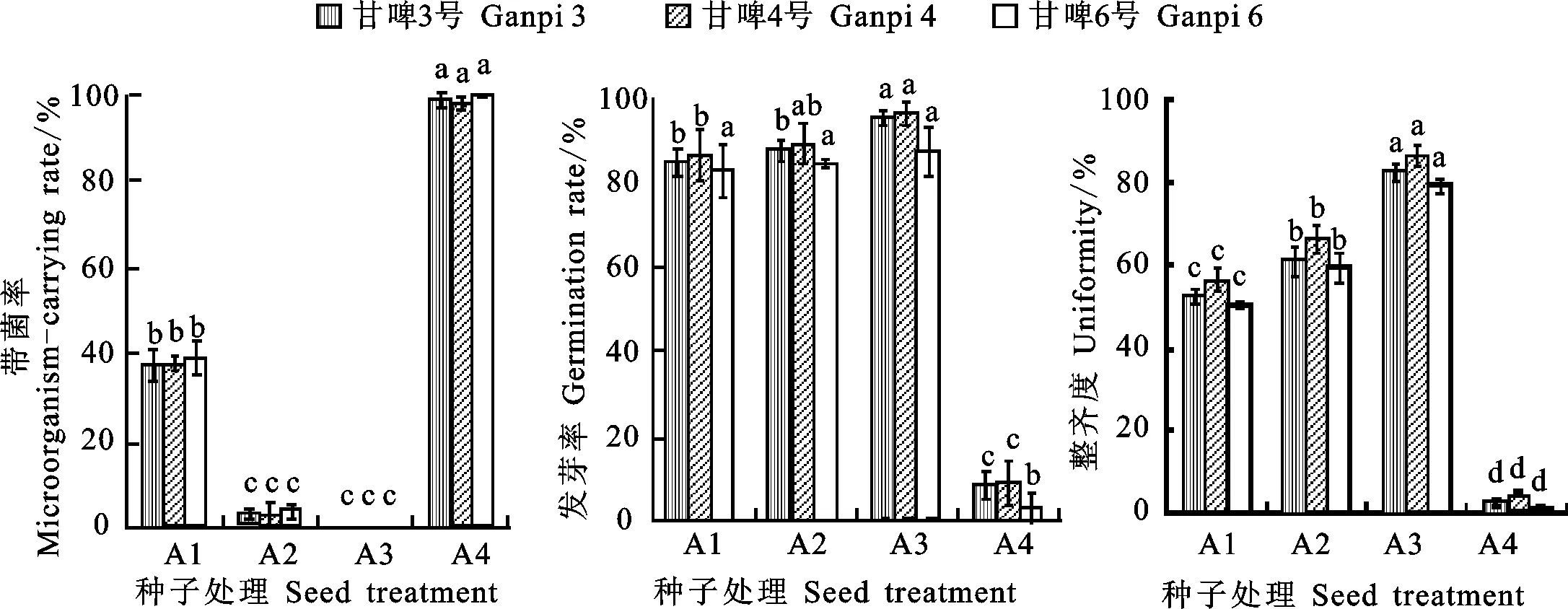
图柱上不同小写字母表示同一品种不同处理间差异在0.05水平上显著;A1:人工去壳;A2:人工去壳后加入50 mL蒸馏水,在摇床中30 ℃、180 r·min-1下摇动1 h;A3:加入50 mL 30%的硫酸,在摇床中30 ℃、180 r·min-1下摇动1 h;A4:种子未去壳。
Different small letters on the columns indicate significant difference among different treatments of the same cultivar at 0.05 level.A1:Artificial dehulling;A2:Artificial dehulling and soaking in 50 mL distilled water at 30 ℃ and 180 r·min-1for 1 h;A3:Soaking in 30% sulfuric acid at 30 ℃ and 180 r·min-1for 1 h;A4:No dehulling.
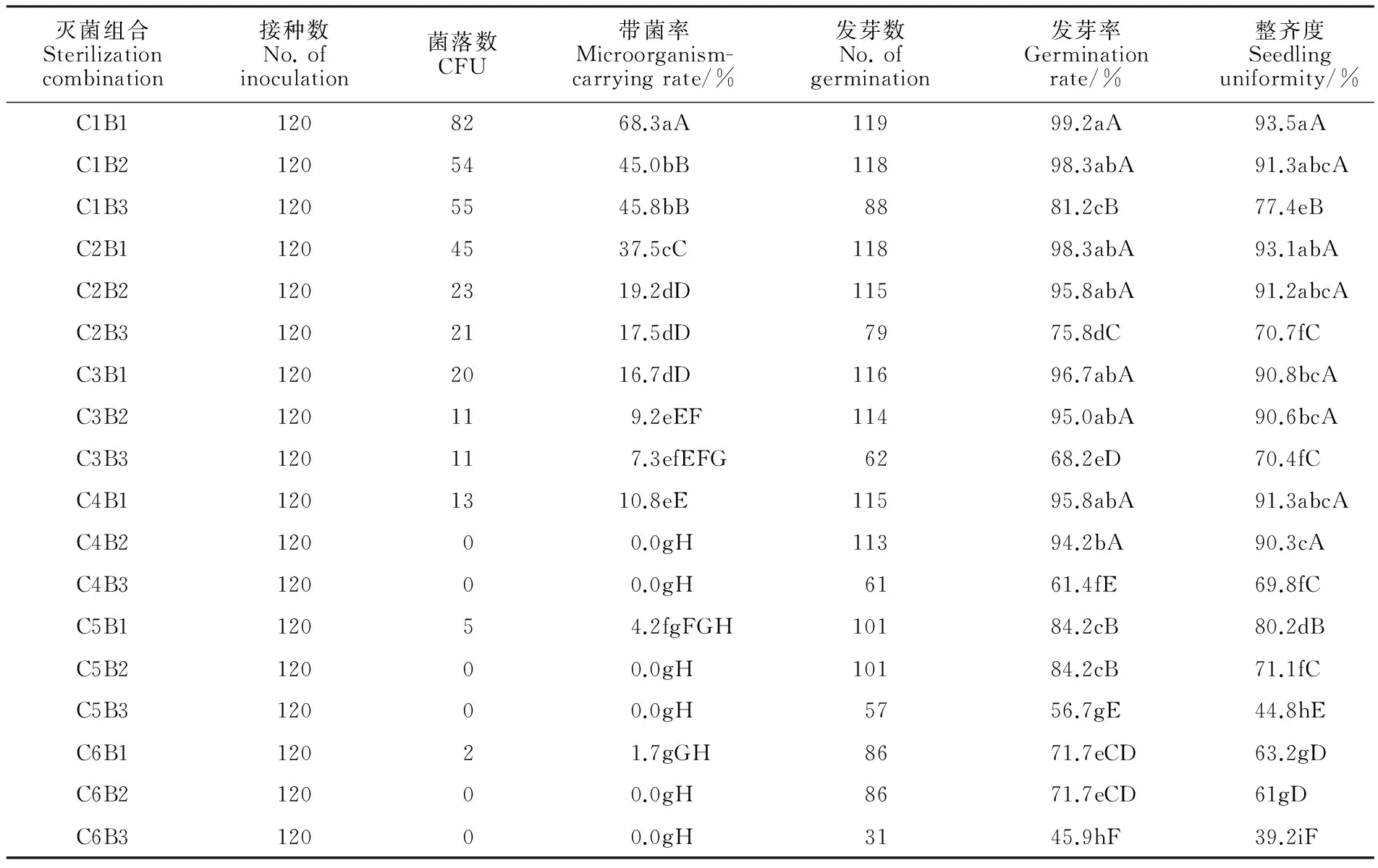
图1 不同处理方式对种子带菌率、发芽率和幼苗整齐度的影响
C1~C6:75%酒精处理0、0.5、1、1.5、2、3 min;B1~B3:10%H2O2、2%有效氯的NaClO、1%升汞处理15 min;同列数据后的不同小写和大写字母分别表示差异达 5%和 1%显著水平。
C1~C6:Soaking in 75% ethanol for 0,0.5,1,1.5,2,3 min;B1~B3:Sterilizing with 10% H2O2,sodium hypochlorite with 2% available chlorine and 1% mercuric chloride,respectively;Values within a column followed by different small and capital letters mean difference significant at the 0.05 and 0.01 levels,respectively.
2.3 茎尖外植体愈伤组织诱导的影响因素
2.3.1 苗龄对愈伤组织培养的影响
由图2可知,不同苗龄的茎尖外植体不仅形成愈伤组织的频率不同,而且愈伤组织的再生能力也有很大差异。出愈率随着苗龄的增加而先上升后下降,在苗龄为3 d时达到最高。愈伤组织的再生能力亦有相同表现。苗龄3 d的茎尖出愈率高达94.1%,明显高于苗龄1 d (20.4%)、2 d(72.2%)、5 d(77.8%)和10 d(20.4%)的。而对于植株再生率,3 d苗龄茎尖诱导的愈伤组织有大约31.1% 的再生率,明显高于其他苗龄的。来源于10 d苗龄的茎尖愈伤组织未见分化。因此,在大麦茎尖愈伤组织诱导和植株再生过程中选用3 d苗龄茎尖效果最好。
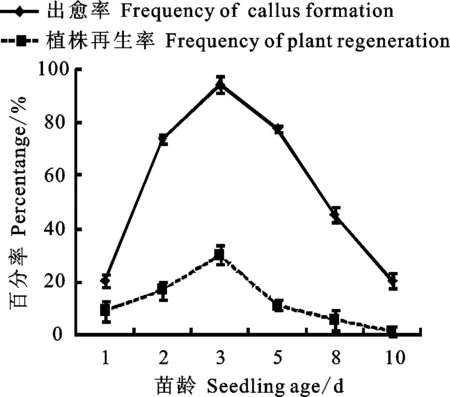
图2 苗龄对茎尖外植体出愈率和植株再生率的影响
2.3.2 不同茎尖外植体切段培养效果的比较
体外培养条件下,研究3 d苗龄的甘啤4号茎尖外植体切段(ST0~ST5),以及直接剥取的2 mm的茎尖外植体(ST00)产生愈伤组织和再生绿苗能力。培养7 d后,转移到新鲜的继代培养基中继续愈伤组织诱导,14 d后统计结果。结果表明,除了ST5切段,大多数茎尖切段都会高频产生愈伤组织,其中茎尖基部切段(ST0)和直接剥取的茎尖(ST00)更可能产生愈伤组织和再生植株,与其他切段相比都达到极显著水平。ST00与ST0的出愈率和植株再生率无显著差异,但茎尖的剥取操作较困难,不适用于大量试验。ST00和ST0在诱导培养基中培养14 d后,出愈率分别为93.9%、94.4%,植株再生率分别为31.1%、30.6%(图3)。尽管茎尖切段ST4产生了少量的愈伤组织,但已经失去了分化能力,不能形成再生植株。因此,ST0切段是最适合于愈伤组织的诱导的外植体材料。
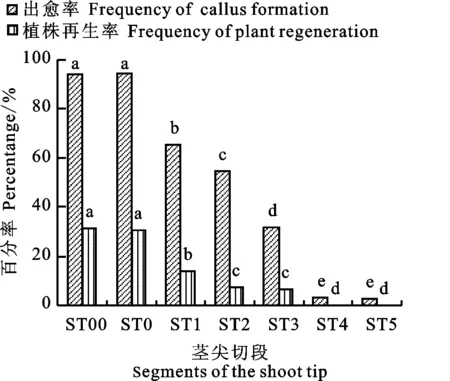
ST00表示剥离胚芽鞘及2片左右的幼叶,切下包含茎尖分生组织和叶原基在内的长约2 mm的茎尖; ST0、ST1、ST2、ST3、ST4、ST5分别表示自幼苗基部去掉种子及根并由基部向上依次切取2 mm左右的茎尖切段;图柱上不同小写字母表示不同处理间差异在0.05水平上显著。下同。
ST00:Stripping the coleoptile and two young leaves,cutting the 2 mm stem tip contained of stem tip meristem and leaf base; ST0,ST1,ST2,ST3,ST4,ST5:Removing the seeds and roots from the seedling base and cutting about 2 mm shoot tip segments from the base of the shoot tips successively;Different small letters on the columns indicate significant difference among different treatments at 0.05 level.The same below.
图3 甘啤4号不同茎尖外植体切段对愈伤组织诱导和植株再生的影响
Fig.3 Effect of shoot tip segments of Ganpi 4 on frequency of callus formation and plant regeneration
2.3.3 2,4-D浓度对茎尖外植体再生的影响
在MS基础培养基上设置7个2,4-D浓度梯度,统计甘啤4号大麦茎尖的出愈率和植株再生率,结果如图4所示。
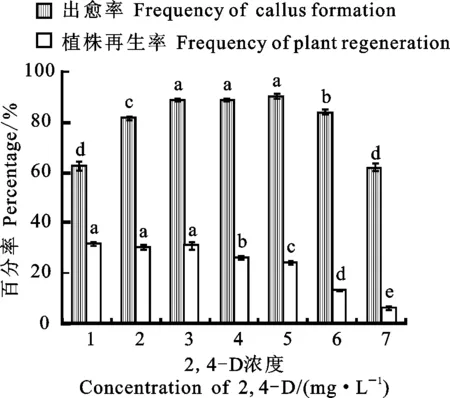
图4 不同2,4-D浓度对大麦茎尖外植体出愈率及再生率的影响
随着2,4-D浓度的升高,甘啤4号茎尖的出愈率先上升后下降,而植株再生率则逐渐下降。2,4-D浓度达到3 mg·L-1之后,出愈率升高缓慢,而植株再生率大幅度下降;3~5 mg·L-1浓度之间的出愈率无显著差异,但植株再生率差异显著;2,4-D浓度高于6 mg·L-1后出愈率和植株再生率显著下降;1~3 mg·L-12,4-D浓度之间的植株再生率差异不显著,但较≥4 mg·L-12,4-D的差异显著。2,4-D浓度为1 mg·L-1和7 mg·L-1时出愈率最低。说明2,4-D浓度过高会抑制大麦茎尖诱导愈伤组织且植株再生率较低,2,4-D浓度过低达不到茎尖愈伤组织诱导的要求。因此,3 mg·L-12,4-D是适宜愈伤组织离体培养的最佳条件。
3 讨 论
3.1 大麦种子无菌苗的培养
颖壳对大麦愈伤组织的培养和植株的高频再生影响较大。严华军等[30]在研究大麦成熟胚愈伤组织的高频诱导和植株再生时,利用50% H2SO4在25 ℃下处理3 h,振荡去壳。潘向群等[31]在大麦成熟胚愈伤组织培养前经过50% H2SO4在30 ℃水浴中处理2 h,振荡去壳。但他们并未说明H2SO4去壳的效果以及对种子发芽的影响。本研究发现,30% H2SO4去壳效果最好且对种胚伤害较小。Becher等[32]利用15%H2O2对种子进行种子灭菌。据报道,在常用的几种灭菌剂(次氯酸钙、次氯酸钠、过氧化氢、溴水、硝酸银、升汞、抗生素)中,升汞的灭菌效果最好[33]。然而本研究中发现,当75%乙醇处理1.5 min 以上,再结合2%有效氯的NaClO或1%升汞处理15 min,灭菌效果最好,带菌率都为0,但升汞毒性较大,伤害种子,影响种子发芽,因此适于大麦种子灭菌的组合为75%乙醇1.5 min+2%有效氯的NaClO 15 min。
3.2 大麦愈伤组织的培养
郝建国等[34]研究发现,苗龄3 d的小麦叶基愈伤组织诱导率为 72%,明显高于苗龄5 d(50%)和10 d(25.3%)的外植体;来自10 d苗龄的切段愈伤组织未见芽的分化,3 d苗龄的叶基切段愈伤组织有大约 20% 的芽分化率,明显高5 d苗龄的材料。这与本研究对1~10 d苗龄大麦茎尖再生的研究结果相似。因此,在大麦茎尖再生体系中,用3 d苗龄是茎尖外植体诱导具有再生能力的愈伤组织的最佳取材时期。在大多数的植物组织培养研究中,通常使用2,4-D诱导愈伤组织的产生,使用浓度为 10-5~10-7mol·L-1[35]。本试验结果表明,2,4-D对大麦茎尖愈伤组织的诱导影响很大,随着2,4-D浓度升高,出愈率明显提高,但2,4-D 浓度超过6 mg·L-1时,出愈率、植株再生率明显下降。愈伤组织变硬,容易褐化,这可能也是导致植株再生率低的原因,跟以往的研究结论相符[36],故3 mg·L-12,4-D是适宜大麦茎尖愈伤组织离体培养的条件。
[1] 卢良恕.中国大麦学[M].北京:中国农业出版社,1996,119-122.
LU L S.Chinese Barley Science [M].Beijing:China Agriculture Press,1996,119-122.
[2] ZIAUDDIN A,SIMION E,KASHA K J.Improved plant regeneration from shed microspore culture in barley(HordeumvulgareL.) cv.Igri [J].PlantCellReports,1990,9(2):69.
[3] SENER O,CAN E,ARSLAN M.Effects of genotype and picloram concentrations on callus induction and plant regeneration from immature inflorescence of spring barley cultivars (HordeumvulgareL.) [J].BiotechnologyandBiotechnologicalEquipment,2008,22(4):915.
[4] SIDOR L S,ORLOV P A.Regeneration potential of different wheat,rye and barley species in leaf explant culture [J].TsitologiiaIGenetika,2005,39(5):28.
[5] NORSTOG K.Induction of embryolike structures by kinetin in cultured barley embryos [J].DevelopmentalBiology,1970,23(4):665.
[6] BARTLETT J G,ALVES S C,SMEDLEY M,etal.High-throughputAgrobacterium-mediated barley transformation[J].PlantMethods,2008,4(1):1.
[7] HOLME I B,BRINCH-PEDERSEN H,LANGE M,etal.Transformation of different barley (HordeumvulgareL.) cultivars byAgrobacteriumtumefaciens infection ofinvitrocultured ovules [J].PlantCellReports,2008,27(12):1833.
[8] AKULA C,AKULA A,HENRY R.Improved regeneration efficiency from mature embryos of barley cultivars [J].BiologiaPlantarum,1999,42(4):505.
[9] DAHLEEN L S,BREGITZER P.An improved media system for high regeneration rates from barley immature embryo-derived callus cultures of commercial cultivars [J].CropScience,2002,42(3):934.
[10] SHARMA V K,HÖNSCH R,MENDEL R R,etal.A highly efficient plant regeneration system through multiple shoot differentiation from commercial cultivars of barley (HordeumvulgareL.) using meristematic shoot segments excised from ger minated mature embryos [J].PlantCellReports,2004,23(1-2):9.
[11] MAHESWARI M,LAKSHMI N J,YADAV S K,etal.Efficient plant regeneration from shoot apices of sorghum [J].BiologiaPlantarum,2006,50(50):741.
[12] RENGEL Z,JELASKA S.Somatic embryogenesis and plant regeneration from seedling tissues ofHordeumvulgareL. [J].JournalofPlantPhysiology,1986,124(5):385.
[13] LI H P,HUANG T,WANG C X,etal.An efficient regeneration system of barley cultivars from leaf base segments [J].BiologiaPlantarum,2009,53(4):733.
[14] HALILOGLU K.Efficient regeneration system from wheat leaf base segments [J].BiologiaPlantarum,2006,50(4):326.
[15] WANG C T,WEI Z M.Embryogenesis and regeneration of green plantlets from wheat (Triticumaestivum) leaf base [J].PlantCellTissue&OrganCulture,2004,77(1):149.
[16] GANESHAN S,CHODAPARAMBIL S V,BÖGA M,etal.Invitroregeneration of cereals based on multiple shoot induction from mature embryos in response to thidiazuron [J].PlantCellTissue&OrganCulture,2006,85(1):63.
[17] VIERTEL K,HESS D.Shoot tips of wheat as an alternative source for regenerable embryogenic callus cultures [J].PlantCell,TissueandOrganCulture,1996,44(3):183.
[18] DEVI P,ZHONG H,STICKLEN M B.Invitromorphogenesis of pearl millet [Pennisetumglaucum(L.) R.Br.]:efficient production of multiple shoots and inflorescences from shoot apices [J].PlantCellReports,2000,19(6):546.
[19] HU X R,YANG A F,ZHANG K W,etal.Optimization ofinvitromultiple shoot clump induction and plantlet regeneration ofKentuckybluegrass(Poa pratensis) [J].Plantcell,TissueandOrganCulture,2006,84(1):90.
[20] 李文霞,宁海龙,李文滨,等.6-BA对大豆子叶节再生的影响 [J].核农学报,2007,21(5):502.
LI W X,NING H L,LI W B,etal.The effect of 6-BA on the regeneration of soybean cotyledonary node [J].JournalofNuclearAgriculturalScience,2007,21(5):502.
[21] 姜素云,胡孝瑞,晁相蓉,等.黑麦草高效丛生芽的发生及离体开花的初步研究[J].草业学报,2005,14(6):100.
JIANG S Y,HU X R,YAO X R,etal.A preliminary study on the occurrence andinvitroflowering of highly efficient shoot of ryegrass [J].ActaPrataculturaeSinica,2005,14(6):100.
[22] DEY M,BAKSHI S,GALIBA G,etal.Development of a genotype independent and transformation amenable regeneration system from shoot apex in rice (Oryzasativaspp.indica) using TDZ [J].Biotechnology,2012,2(3):233.
[23] POLUMAHANTHI S,MANI N S,KUMAR P K R.Callus induction and multiple shoot regeneration of sorghum cultivars using shoot tip as an explants [J].InternationalJournalofAdvancedLifeSciences,2014,7(1):66.
[24] 陈 莉,窦秉德,罗玉明,等.玉米茎尖培养再生体系的建立[J].淮阴师范学院学报(自然科学版),2006,5(1):64.
CHEN L,DOU B D,LUO Y M,etal.Maize shoot tip establishment of regeneration system [J].JournalofHuaiyinTeachersCollege(NaturalScience),2006,5(1):64.
[25] 马玲珑,任盼荣,汪军成,等.啤酒大麦品种甘啤4号成熟胚再生体系的建立[J].分子植物育种,2015(3):663.
MA L L,REN P R,WANG J C,etal.Establishing regeneration system from mature embryos of beer barley variety Ganpi 4 [J].MolecularPlantBreeding,2015(3):663.
[26] BREGITZER P,CAMPBELL R D,WU Y.Plant regeneration from barley callus:Effects of 2,4-dichlorophenoxyacetic acid and phenylacetic acid [J].PlantCellTissue&OrganCulture,1995,43(3):229.
[27] SAHRAWAT A K,CHAND S.High frequency plant regeneration from coleoptile tissue of barley (HordeumvulgareL.) [J].PlantScience,2004,167(1):27.
[28] PASTERNAK T P,RUDAS V A,LÖRZ H,etal.Embryogenic callus formation and plant regeneration from leaf base segments of barley (HordeumvulgareL.) [J].JournalofPlantPhysiology,1999,155(3):371.
[29] MURASHIGE T,SKOOG F.A revised medium for rapid growth and bioassays with tobacco tissue cultures [J].PhysiologiaPlantarum,1962,15(3):473.
[30] 严华军,王君晖.大麦成熟胚胚性愈伤组织的高频诱导和植株再生[J].作物学报,1996,22(1):58.
YAN H J,WANG J H.Callus induction of high frequency and plant regeneration from mature embryos of barley [J].ActaAgronomicaSinica,1996,22(1):58.
[31] 潘向群,梁海曼.大麦成熟胚培养的培养基研究[J].作物学报,1991,17(4):267.
PAN X Q,LIANG H M.The study of cultural medium on barley mature embryo [J].ActaAgronomicaSinica,1991,17(4):267.
[32] BECHER T,HABERLAND G,KOOP H U.Callus formation and plant regeneration in standard and microexplants from seedlings of barley(HordeumvulgareL.) [J].PlantCellReports,1992,11(1):39.
[33] 熊 丽,吴丽芳.观赏花卉的组织培养与大规模生产[M].北京:化学工业出版社.2003:80.
XIONG L,WU L F.Tissue Culture of Ornamental Flowers and Large-Scale Production [M].Beijing:Chemical Industry Press,2003:80.
[34] 郝建国,贾敬芬.小麦叶基切段愈伤组织的诱导和植株再生 [J].西北大学学报,2003,33(4):489.
HAO J G,JIA J F.Callus induction and plantlets regeneration of wheat leaf segments [J].JournalofNorthwestUniversity,2003,33(4):489.
[35] HE H,PAN R,HE Y,etal.Factors affecting organogenesis ofCitrusmicrocarpaBunge [J].JournalofTropicalandSubtropicalBotany,1996,5(3):53.
[36] GAIRI A,RASHID A.TDZ-induced somatic embryogenesis in non-responsive caryopses of rice using a short treatment with 2,4-D [J].PlantCell,TissueandOrganCulture,2004,76(1):29.
Callus Induction and High Frequency Regeneration of Plant from Shoot Tip of Barley (HordeumvulgareL.)
HU Youliang1,2,WANG Juncheng1,2,SI Erjing1,2,REN Panrong1,2,YAO Lirong1,2,LI Baochun1,3,MA Xiaole1,2,MENG Yaxiong1,2,WANG Huajun1,2
(1.Gansu Key Laboratory of Crop Improvement & Germplasm Enhancement/Gansu Provincial Key Laboratory of Aridland Crop Science,Lanzhou,Gansu 730070,China; 2.College of Agronomy,Gansu Agricultural University,Lanzhou,Gansu 730070,China;3.College of Life Sciences and Technology,Gansu Agricultural University,Lanzhou,Gansu 730070,China)
High frequency regeneration system for tissue culture possesses high efficient and stable regeneration,and it is also the foundation of genetic transformation. Explant materials of different parts were tried to establish high frequency regeneration system in barley. In order to study the factors related to high frequency regeneration from shoot tip of barley,Ganpi 3,Ganpi 4 and Ganpi 6 were used to study the effects of the dehulling methods,sterilization ways,seedling age,shoot tip size and location,and the concentration of exogenous hormone (2,4-D) on the stem tip callus induction and the plant high frequency regeneration. The results showed that the optimal dehulling way is to use 30% sulfate and shake for an hour at 180 r·min-1and 30 ℃, and Ganpi 4 has the highest germination rate. The optimal method for surface sterilization was soaking in 75% ethanol for 1.5 min and then 2% sodium hypochlorite for 15 min,which is benefit for the aseptic seedling cultivation,with significant difference in microorganism-carrying and germination rate for seeds,less damage on seed and the good uniformity for seedlings. Callus formation of the shoot tip explants and plant regeneration frequency are closely related to shoot tip position and seedling age,and the optimal length of basal segments is 2 mm and the optimal seedling age is 3 d. The optimal concentration of 2,4-D for callus culture is 3 mg·L-1,which indicated the most significant difference in recovery and differentiation rates and could induce a large number of callus.
HordeumvulgareL.;Shoot tip explants;Microorganism-carrying;Frquency of callus formation;Frequency of plant regeneration
时间:2017-05-12
2016-10-25
2016-12-05
国家自然科学基金项目(31460347);盛彤笙创新基金项目(GSAU-STS-1513);甘肃省财政厅科研业务费项目(035-041047); 国家现代农业产业技术体系建设专项(CARS-05)
E-mail:hyliang008@163.com
王化俊(E-mail:whuajun@yahoo.com)
S512.3;S330
A
1009-1041(2017)05-0601-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170512.1955.010.html
