小鼠肝组织扫描电镜样本的制备及改良方法*
2017-06-21姚莹华陈育尧吕志平
姚莹华陈育尧吕志平
[文章编号] 1672-8270(2017)06-0165-03 [中图分类号] R-332 [文献标识码] A
小鼠肝组织扫描电镜样本的制备及改良方法*
姚莹华①陈育尧②吕志平②
目的:探讨优化小鼠肝组织扫描电镜样本的制备方法。方法:通过改良灌注固定的部位、优化灌注材料及步骤、采用经门静脉灌注固定和改变固定流程等制备小鼠肝脏扫描电镜样本,并对比改良制备方法与常规制备方法的组织细胞形态观察结果。结果:改良后的样本制备方法较好地保存了小鼠肝组织以及细胞的生活状态,可清晰观察肝脏组织及细胞的超微形态结构,获得了颇为理想的观察效果,且操作简便,成功率高,优于传统制备方法。结论:经门静脉灌注固定制备小鼠扫描电镜样本是比较优越的扫描电镜制样方法,具有一定应用价值。
肝组织;扫描电镜;样本制备;改良方法
电子显微镜术的应用使人们对肝脏的认识从组织学水平上升到细胞器水平,并进入分子生物学研究领域[1]。扫描电镜可清晰地观察物体表面的立体微细结构及其形态学变化,从三维水平研究肝脏的亚微结构,是现今一种较为常见和实用的形态学研究方法[2]。实验发现,肝脏细胞的超微结构只能在完整的肝组织或培养的细胞中使用电子显微镜进行观察,而理想的生物样品应如实反映其生理过程中的状态,在高真空和强电子束的轰击下保持稳定,且亚微结构清晰、无变形[3-4]。理想的生物样品与样品的制备技术密切相关,由于小鼠门静脉短且壁薄,其样品制备为一大技术难点。因此,本研究对小鼠肝组织扫描电子显微镜标本的制备方法进行改良。
1 材料与方法
1.1 实验动物
NIH小鼠,雄性,体重18~22 g,由南方医科大学动物实验中心提供。
1.2 仪器与试剂
(1)S-3000N型扫描电子显微镜(HITACHI,日本);HPC-2型CO2临界点干燥器(HITACHI,日本)。
(2)二甲胂酸钠购自Amresco公司;25%戊二醛(美国SIGMA公司);1%四氧化锇为进口分装(美国SIGMA公司);24 G一次性静脉留置针、一次性输液器、一次性输液瓶和T型连接管均由南方医科大学中西医结合医院提供。
1.3 缓冲液和固定液的配制
(1)0.1 mol/L的二甲胂酸钠缓冲液(pH值为7.4):二甲胂酸钠4.28 g,0.2 NHCl 2.7 ml加蒸馏水至200 ml。
(2)1.5%戊二醛固定液(pH值为7.4):0.2 mol/L的二甲胂酸钠缓冲液50 ml,25%戊二醛6 ml,加蒸馏水至100 ml。
1.4 肝脏灌注固定
将缓冲液和固定液分别装入输液瓶中,连接输液器和“T”形连接管,调节输液器使其中无气泡。①实验小鼠用10%水合氯醛腹腔注射麻醉,仰卧位固定,酒精棉球皮肤消毒,打开腹腔暴露门静脉及下腔静脉;②用弯型镊分离门静脉,取一定长度4#丝线从分离的门静脉下端穿过,打一个留有少许空隙的活结;③用清洁棉球压迫于胃食管静脉丛上端,使门静脉充盈,用24 G一次性静脉留置针从门静脉主干远端刺入,待针尾部有回血时迅速抽出针芯,用镊子拉紧预先打好的活结,再打一结将留置针与门静脉固定,使之不能退出,然后将针尾部与缓冲液输液器连接,打开调节阀,灌注缓冲液,调节灌流量至5~7 ml/ min;④迅速切断下腔静脉,使血液和缓冲液流出,并观察血液流出情况和肝脏变化;⑤当流出的血液逐渐由红转淡,肝脏发白时旋转“T”形管,使之对准固定液,开始灌注1.5%戊二醛,待肝脏变硬后,迅速切取肝组织,并置于冰上切块取材,放置于1.5%戊二醛固定液中,于4 ℃冰箱中保存备用[5]。
1.5 扫描电镜样本的处理
样品浸于戊二醛中固定3 h后,于4 ℃下用0.1 mol/L的二甲胂酸钠缓冲液(pH值为7.4)反复漂洗数次,并将组织置于缓冲液中过夜。第2 d除去缓冲液,加入1%的锇酸固定1 h,弃固定液,再用缓冲液反复漂洗5次,每次15 min。梯度乙醇脱水(50%、70%、90%、100%)3次,每次15 min,乙酸异戊酯置换2次,第1次5~10 min,第2次>30 min。将置换后的组织取出放于滤纸上,待部分液体吸收,剪取适当大小滤纸放于样品干燥笼内,并进行标记。组织放入标记后的样品干燥笼,封口后连笼移入CO2临界点干燥器样品杯内,将盖拧紧,以防漏气。样品干燥后取出,放于事先标记的样品袋中。光学显微镜下观察样本大体结构,镜下将大块组织分离成不同不规则断面的组织小块,选取需要观察的断面,用导电胶粘合于样本观察板上,真空喷镀金膜后置于扫描电子显微镜下观察。
1.6 扫描电镜样本的观察
使用低倍镜找到每个标本的汇管区,定位于汇管区周围,观察5个斜断面肝组织形态结构,调节观察倍数和焦距仔细观察所要观察的部位和细胞;然后在远离汇管区的部位找5个视野,观察5个斜断面。观察肝细胞、肝血窦、间质细胞以及肝内血管和毛细小胆管的形态结构[6]。
2 结果
通过经门静脉灌注固定方法制得的小鼠肝组织,扫描电镜样本表面结构保持完整,无污染,无挤压龟裂。在电镜下观察肝细胞、肝窦内皮细胞及其窗孔结构、其他间质细胞、少量淋巴细胞和毛细胆管。肝细胞围绕中央静脉呈放射状排列,肝细胞表面可见清晰的毛细小胆管结构,部分肝细胞在断裂过程中破裂,细胞器掉落。经改良后采用经门静脉灌注固定小鼠肝组织,可见清晰的肝血窦及肝窦内皮细胞窗孔,个别血细胞和炎性细胞附着肝窦腔。而未经改进的灌注方法,镜下肝细胞正常结构难以辨认(如图1所示)。
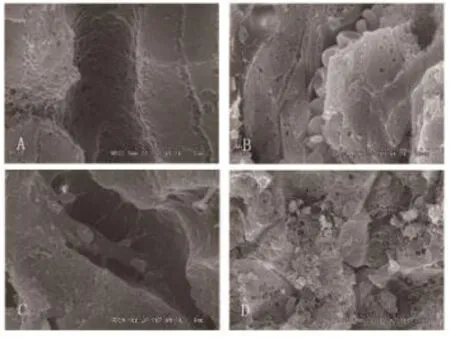
图1 小鼠肝组织扫描电镜样本(×8.0 K)
3 讨论
肝脏是全身代谢最为旺盛的器官,同时又是各种细胞器最有代表性的器官之一,机体各种疾病都会直接或者间接地影响肝细胞的亚微结构[7]。病理检查是反映肝脏病理学变化的最直接指标,由于肝脏容易取得生理状态下的样品,肝脏活检常成为临床诊断的直接证据。肝脏是体内重要的代谢和免疫器官,组织结构致密,离体后迅速自溶,固定不及时将难以保持生活状态下样品原貌,细胞内的微细变化即刻呈现电镜假象。扫描电镜要求观察样品结构完整且清洁无杂物,但由于肝脏血流及代谢物丰富,血细胞与组织液等易沉积于肝组织内表面,造成对电镜图像的错误理解[8]。灌注压升高,固定剂和缓冲液的渗透压不正确,固定不足,并且固定后脱水和干燥的速度都是可能产生干扰超微结构保存的人为因素[9-10]。因此,扫描电镜样本固定前应做好表面清洁,且从标本的取材到后续处理过程都应尽量做到符合活体状态下的生理条件,如缓冲液和固定液的离子浓度、pH值、渗透压及温度等[11]。
扫描电镜不同于透射电镜,组织块过小不易形成自然断裂层,从而影响观察效果。而固定液渗透力有限,较大的组织块所需渗透时间长,单纯浸泡于固定液中容易出现渗透不足导致组织细胞自溶,造成结构的损坏。采用门静脉灌注固定制备小鼠扫描电镜样本,通过血管灌注固定肝脏能够及时地保存肝组织和细胞正常存活状态,减少离体死亡后引起的自溶变化,为取材与修整争取了时间。此外,能清洁样品内表面的血细胞及组织液体,使镜下视野清晰,观察效果良好。一般多采用插入心脏的全身灌注法,操作较简单。但肝脏则应采用局部灌注法,经门静脉灌注能更快、更及时地固定正常存活状态下的肝组织,且固定均匀,速度快,灌注效果优于全身灌注。停止血液流动后应尽可能快地进行固定,以防止由于组织细胞自溶而发生的超微结构变化[12]。灌注时,由于灌注针头非常容易从门静脉管腔中滑脱,采用4#丝线将灌注针与门静脉固定,有效的提高了灌注的成功率。以往灌注多采用金属注射针头,但其表面光滑,丝线结扎易滑脱,且小鼠的门静脉管壁较薄,金属针头易造成管壁破损,导致灌注失败或灌注不全。因此,采用24 G静脉留置针,刺入门静脉针尾有回血后退出金属针芯,将留置针的套管和门静脉用丝线结扎固定。经反复验证,结扎稳固,不会轻易发生位移、脱落。此外,灌注时应注意下腔静脉流出液情况,随着流出血液颜色逐渐变淡,肝脏逐渐发白,表明灌注位置正确;若无液体流出或肝脏无明显变化,则可能是针头刺入过深,穿破门静脉,或刺入位置不正确,应及时停止灌注,重新调整针头位置,直至肝脏变化,但调整应尽量在短时间内完成,以免发生组织自溶。肝脏变硬后可停止,取材速度要快,修整后放入固定液中于冰箱内4 ℃保存。
灌注液的渗透压,pH值应与固定液一致,不同渗透压会导致组织细胞形态发生变化,最好用同种缓冲液配所需固定液。固定足够时间后用缓冲液清洗组织块,目的是除去固定液及组织表面的杂质,清洗不足则样品表面杂质较多,影响镜下观察,可清洗4~6次,每次30 min,或放置于冰箱内4 ℃保存12 h。换液过程中吸管应尽量不触碰组织,亦要避免样品长时间裸露在空气中发生改变。组织脱水采用“乙醇梯度脱水法”,其脱水力度较丙酮缓和,根据样品的大小而确定具体脱水时间,避免过度脱水造成组织收缩变化,每次15 min左右。干燥时采用“临界点干燥法”,可减少组织细胞表面的张力,使样品得到更好的保护。该制备方法较好的保存了肝组织以及细胞的生活状态,获得了颇为理想的观察效果,优于以往传统制备方法,具有一定的应用价值。
[1]杭振,蔡文琴.电子显微镜术在临床医学的应用[M].重庆:重庆出版社,1988:193.
[2]杨勇骥.实用生物医学电子显微镜技术[M].上海:第二军医大学出版社,2003.
[3]Cogger VC,O'Reilly JN,Warren A,et al.A standardized method for the analysis of liver sinusoidal endothelial cells and their fenestrations by scanning electron microscopy[J].J Vis Exp,2015,30(98):e52698.
[4]路菊,赵建华,郭乔楠,等.细胞与生物材料共培养的样品扫描电镜制备法[J].第三军医大学学报,2007,29(14):1446-1447.
[5]姚莹华.丹参多糖对急性肝损伤小鼠肝窦内皮细胞的影响及保护作用的研究[D].广州:南方医科大学,2010.
[6]陶忠芬,可金星,黄文琪,等.树突状细胞的培养与扫描电镜样品制备[C].贵阳:全国电子显微学会议论文集,2005.
[7]王宝恩,张定凤.现代肝脏病学[M]北京:科学出版社,2003.
[8]张景强,朴英杰,蔡福筹,等.生物电子显微技术[M].广州:中山大学出版社,1993:133.
[9]Fraser R,Bowler LM,Day WA,et al.High perfusion pressure damages the sieving ability of sinusoidal endothelium in rat livers[J].Br J Exp Pathol,1980,61(2):222-228.
[10]Wisse E.An electron microscopic study of the fenestrated endothelial lining of rat liver sinusoids[J].J Ultrastruct Res,1970,31(1):125-150.
[11]Wisse E,Braet F,Duimel H,et al.Fixation methods for electron microscopy of human and other liver[J].World J Gastroenterol,2010,16(23):2851-2866.
[12]Vreuls C,Wisse E,Duimel H,et al.Jet-fixation:a novel method to improve microscopy of human liver needle biopsies[J].Hepatology,2014,59(2):737-739.
Preparation of specimen about mouse liver tissue for scanning electron microscope and its improvement method/
YAO Ying-hua, CHEN Yu-yao, LV Zhi-ping//China Medical Equipment,2017,14(6):165-167.
Objective: To explore and optimize the preparation method of specimen about mouse liver tissue for scanning electron microscopy. Methods: The specimens of mouse liver using for scanning electron microscope were prepared through improving the fixed location of perfusion, optimizing material and procedure of perfusion, adopting fixation of perfusion via portal vein and changing the process of fixation and so on. And the results of morphological observation of histocyte were compared between the improved method and traditional method. Results: The improved preparation method could save the liver tissue and the living state of the cells in preferably situation. By using this method, the ultra-micro morphological structure of liver tissue and cell could be clearly observed and the ideal effect of observation could be achieved. Besides, its operation was simple and its success rate was high. Therefore, it was superior to traditional method. Conclusion: The preparation of specimen about the fixation of mouse liver tissue via perfusion of portal vein for scanning electron microscope is a superior method, which has certain applied value.
Liver tissue; Scanning electron microscopy; Specimen preparation; Improvement method
Shantou Hospital of TCM, Guangzhou University of Chinese Medicine, Shantou 515031, China.
10.3969/J.ISSN.1672-8270.2017.06.045
[文章编号] 1672-8270(2017)06-0165-03 [中图分类号] R-332 [文献标识码] A
姚莹华,女,(1984- ),博士研究生,主治医师。广州中医药大学附属汕头中医院科教科,从事消化系统疾病的中西医临床诊治。
2017-03-23
国家自然科学基金(30973699)“肝窦内皮细胞的调节机制与肝主疏泄的相关性研究”
①广州中医药大学附属汕头中医院科教科 广东 汕头 515031
②南方医科大学中医药学院 广东 广州 510515
