AGT在高血压合并心肌肥厚大鼠体内表达的研究
2017-06-21袁丽粉杜勤王玉强王
袁丽粉杜 勤王玉强王 健*
AGT在高血压合并心肌肥厚大鼠体内表达的研究
袁丽粉①杜 勤②王玉强②王 健①*
目的:探讨自发性高血压大鼠(SHR)心肌肥厚与血管紧张素原(AGT)的相关性。方法:选用20只18周龄的雄性SHR,为SHR组;选用20只同龄WKY雄性高血压模型对照大鼠,为WKY组,均饲以标准饲料。对两组大鼠分别于0周和12周时采用无创尾套法测量尾动脉收缩压(SBP)和心率,采用酶联免疫吸附测定(ELISA)法检测血清AGT、AngⅡ浓度,并于光镜、电镜下评估心肌组织超微结构病变。结果:经ELISA法血清检测,SHR组大鼠血清AGT、AngⅡ水平在0周和12周的时间点均显著高于WKY组大鼠,两组比较差异有统计学意义(tAGT=27.94、t=27.29,tAngII=16.20、t=31.33;P<0.05)。存在心肌病变的SHR组大鼠,12周时血清AGT、AngⅡ浓度水平明显高于0周时的浓度水平,2个时间点AGT、AngⅡ浓度水平比较,其差异有统计学意义(t=15.17,t=13.77;P<0.05),且随着心肌肥厚病变严重性的增加,血清AGT、AngⅡ浓度亦增加。结论:AGT与自发性高血压大鼠中心肌病变有一定的相关性,抑制AGT的表达很有可能会为高血压患者中心肌肥厚的防治提供一种新方法。
自发性高血压大鼠;高血压;心肌肥厚;血管紧张素原
高血压引起的心血管疾病是中老年患者重要的死亡原因之一。流行病学调查显示,在我国中老年患者中高血压的患病率约为25%,其中近半数高血压患者合并有心肌肥厚[1]。高血压是心肌肥厚发生发展的一个重要危险因素[2]。肾素-血管紧张素系统(reninangiotensin system,RAS)在高血压以及心肌肥厚的发生发展过程中起着重要的作用[3-4]。而血管紧张素原(angiotensinogen,AGT),作为RAS系统中的初始底物,直接控制着RAS系统活性的强弱[5]。为探索AGT在高血压合并心肌肥厚大鼠中的表达情况,进行自发性高血压大鼠心肌肥厚与AGT的相关性研究。
1 材料与方法
1.1 仪器与试剂
(1)Nikon生物光学显微镜(日本Nikon公司);CMl20透射电镜(荷兰飞利浦公司);Powerlab/8SP生理信号采集与处理系统(澳大利亚AD Instruments,Castle Hill,NSM,Australia);Chart多通道生理信号记录仪系统软件,全自动生化分析仪(美国DADE公司Dimension RXL)。
(2)5%戊巴比妥钠(中国医药集团上海化学试剂公司);大鼠AGT ELISA试剂盒(美国R&D公司);大鼠血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)ELISA试剂盒(美国R&D公司)。
1.2 实验动物
选用20只雄性自发性高血压大鼠(spontaneously hypertensive rats,SHR)为SHR组;选用20只Wistar京都大鼠(Wistar Kyoto rats,WKY)为WKY组,均为18周龄,大鼠体重均为395~450 g,购自上海斯莱克实验动物有限责任公司。40只大鼠均分笼饲养(每笼3只),自由饮用食物和水,12 h昼夜周期喂养。所有大鼠经标准饲料适应性喂养2周,分别于2周后的0周、12周时各组取10只处死。
1.3 血压测量
将清醒状态的大鼠置于PowerLab系统配备的大鼠固定器内,露出鼠尾,于40 ℃恒温水浸泡30 min,待鼠尾动脉充分扩张,将鼠尾套入套袖,待动物安静后充气,测量尾动脉收缩压和心率,重复3次,取平均值。每周测量1次。
1.4 测量全心重量与体重比值
测量全心重量与体重比值(heart weight/body weight,HW/BW)于实验结束时,称取大鼠体重,按0.4 ml/l00g的剂量腹腔注射戊巴比妥钠麻醉大鼠,迅速取出心脏,称取全心重量,求HW/BW值(即心肌肥厚指数)。
1.5 标本采集和处理
各组动物分别于喂养2周后的0周、12周时空腹股静脉采血,置于抗凝管中,摇匀,于3 000 r/min离心15 min,收集上层血清,通过酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测血清AGT、AngⅡ水平。
1.6 观察心肌组织超微结构
大鼠处死后无菌分离心肌,将经10%甲醛固定的心肌标本,常规脱水,石蜡包埋,间断均匀切片,切片厚度为5 μm,行苏木素-伊红(hematoxylineosin,HE)染色,切片做好后光镜下观察。取1 mm3心尖区心肌组织数粒于4 ℃、2%的戊二醛固定液中固定24 h,电镜下观察组织超微结构。
1.7 统计学方法
采用SPSS 19.0统计软件进行数据分析。数据以均值±标准差(x-±s)表示,呈正态分布,两组比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
两组大鼠在2周的适应性喂养期间均生长情况良好。两组大鼠至实验结束均无不良反应。
2.1 血压和心肌肥厚指数HW/BW值
(1)对两组大鼠于0周和12周时测量血压,SHR组大鼠血压值明显高于WKY组,其差异有统计学意义(t=31.99,t=35.01;P<0.05);SHR组大鼠12周时血压值明显高于0周,其差异有统计学意义(t=19.48,P<0.05),见表1。
表1 两组大鼠血压变化情况,mmHg)
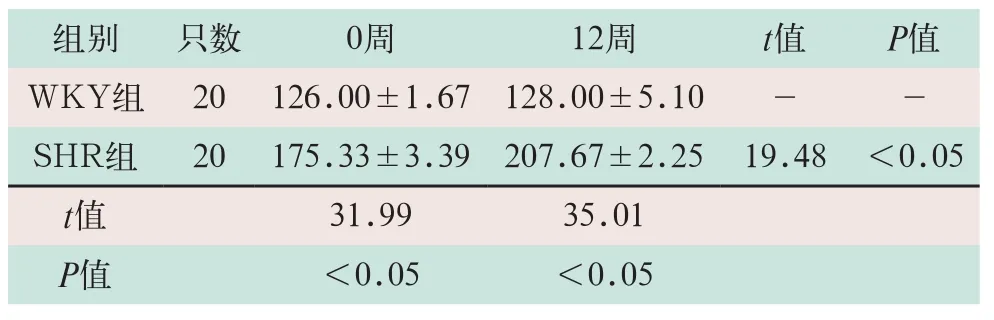
表1 两组大鼠血压变化情况,mmHg)
组别只数0周12周t值P值WKY组20126.00±1.67128.00±5.10--SHR组20175.33±3.39207.67±2.2519.48<0.05 t值31.9935.01 P值<0.05<0.05
(2)大鼠的心肌HW/BW值测量,SHR组大鼠与WKY组大鼠于0周时心肌重量分别为(3.16±0.11)mg/g和(2.53±0.06)mg/g;12周时分别为(3.96±0.13) mg/g和(2.55±0.03)mg/g,HW/BW值明显高于WKY组,两组比较其差异有统计学意义(t=12.25,t=26.15;P<0.05);而SHR组大鼠HW/BW值12周时明显高于0周时的HW/BW值,其差异有统计学意义(t=11.66,P<0.05),提示SHR组大鼠有明显的心肌肥厚现象,且随着周龄的增加,心肌肥厚加重。两组大鼠之间心率变化无差异。
2.2 血清AGT和AngⅡ水平
经ELISA法血清检测,SHR组大鼠血清AGT、AngⅡ水平在0周和12周的时间点均显著高于WKY组大鼠,两组比较差异有统计学意义(tAGT=27.94、t=27.29,tAngII=16.20、t=31.33;P<0.05)。SHR组大鼠12周时血清AGT、AngII水平较0周时显著升高,2个时间点比较差异有统计学意义(t=15.17,t=13.77;P<0.05),见表2。
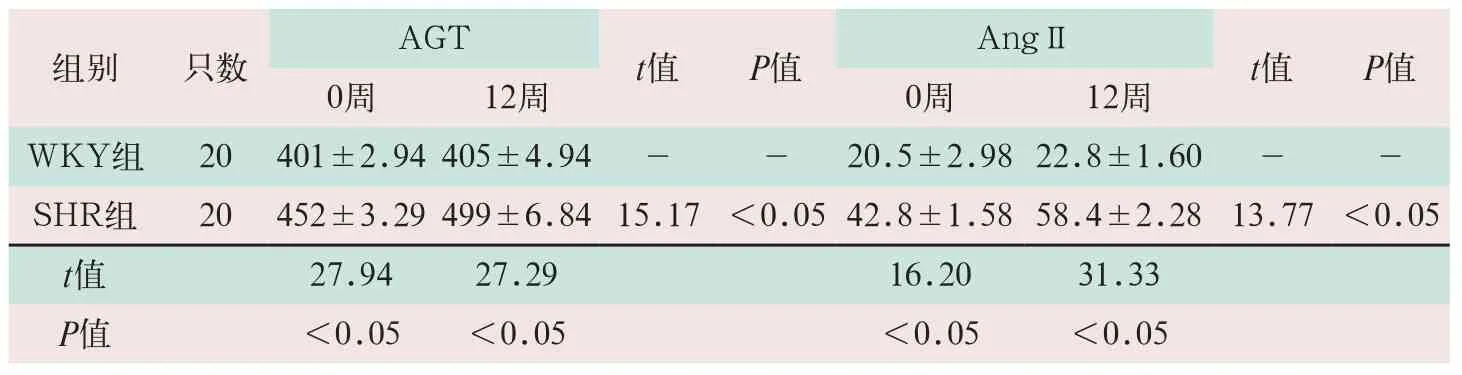
表2 两组大鼠不同时间点血清AGT和AngII水平变化(x-±s,pmol/L)
2.3 心肌组织超微结构改变
2.3.1 光镜结果
经HE染色光镜下显示,SHR组较WKY组心肌细胞明显肥大,肌纤维排列紊乱,部分有溶解。随着时间的变化,SHR组大鼠12周时心肌细胞肥大较0周时明显,且肌纤维排列越加紊乱,溶解较多。而WKY组大鼠,心肌组织结构从0周至12周未发生明显改变(如图1所示)。
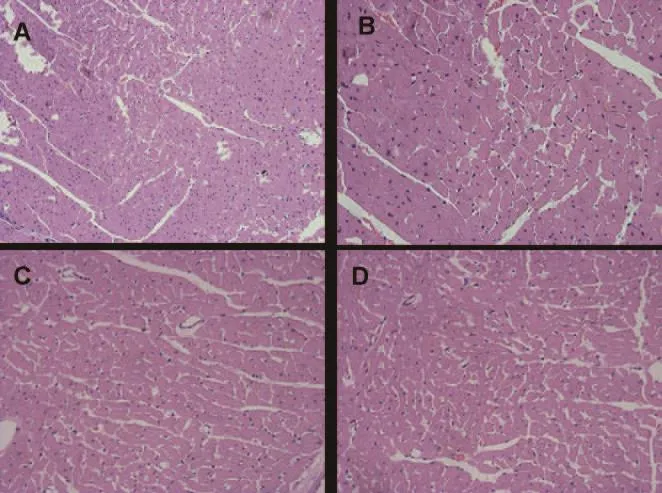
图1 两组大鼠各个时间点光镜心肌组织结构(HE染色,×200)
2.3.2 电镜结果
电镜下显示,WKY组大鼠心肌细胞核膜完整,横纹清楚,线粒体清晰,肌原纤维清晰,排列整齐,间质胶原纤维无增生。SHR组心肌细胞核膜不完整,线粒体肿胀堆积,内有空泡形成,内质网增生,肌原纤维模糊,排列紊乱,肌丝有部分消失,可见横纹不清,间质胶原纤维增生。随着时间的变化,SHR组大鼠心肌细胞核膜不完整越加明显,内质网大量增生,线粒体空泡形成明显,间质胶原纤维明显增生。而WKY组从0周到12周未见明显变化(如图2所示)。
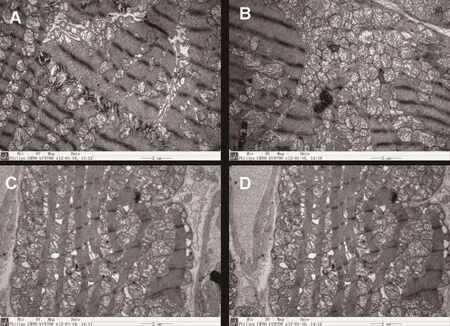
图2 两组大鼠各个时间点心肌组织电镜结果(×9700 )
3 讨论
高血压是多种心、脑血管疾病的重要病因和危险因素,影响重要脏器例如心脏的结构和功能,最终导致心肌肥厚、心力衰竭,近半数高血压患者伴有心肌肥厚[6]。高血压、心肌肥厚被称为人类健康的“无形杀手”,是全球范围内的重大公共卫生问题。随着人民生活水平的提高和人口老龄化的加速,高血压、心肌肥厚的发病率呈上升趋势。研究显示,高血压是促进心肌肥厚发生、发展的重要因子,而心肌肥厚又可引起继发性高血压[7]。二者之间互相影响,互相促进,形影不离。因此,如何预防高血压患者中心肌肥厚的发生已成为当今心血管病研究的重要课题。
SHR大鼠是一种高血压模型鼠,与人类原发性高血压的病态表现极为相似,平均寿命雄性为430 d,雌性为550 d,其高血压发病率极高,8~10周龄几乎全部动物血压都在150 mmHg以上,16~20周龄达最高峰180~210 mmHg,并且与人类高血压病的发病机制及所致病理生理学方面的变化十分相似,是进行人类原发性高血压病研究理想动物模型[8]。本实验选择18周龄的SHR,其结果显示,SHR组尾动脉压显著高于正常血压对照组,证实了模型的成功建立。
AGT作为RAS中的初始底物,直接控制着RAS活性的强弱,主要在肝脏合成,血浆中的AGT主要来源于肝脏[9]。此外,脂肪组织、大动脉、肾脏、肾上腺及脑等也合成AGT[10]。AGT作为血管紧张素前体,是肾素的唯一作用底物。在血循环中,AGT在肾脏球旁细胞分泌的肾素作用下水解生成无活性的十肽Ang I,后者在肺等器官内皮细胞血管紧张素转换酶(angiotensin converting enzymes,ACE)作用下,从AngIC端切除两个氨基酸生成有生物活性的八肽血管紧张素Ⅱ。AngⅡ是RAS的主要效应物质,作用于血管紧张素Ⅱ受体(angiotensin Ⅱ receptor type 1,AT1),使得小动脉平滑肌收缩,刺激肾上腺皮质球状带分泌醛固酮,通过交感神经末梢突触前膜的正反馈使去甲肾上素分泌增加。这些作用均可使血压升高,参与高血压发病并维持[11-13]。AGT是这一最强血管活性物质AngⅡ的唯一前体,外周血循环及局部组织中AGT微小浓度变化即可引起AngⅡ产生量的明显变化[14]。因此,血中AGT的浓度从根本上影响着AngⅡ的生成。本研究结果证实,SHR组大鼠AGT、AngⅡ浓度明显高于WKY组,而且随着时间的变化,SHR血AGT、AngⅡ浓度亦明显升高。
血压长期升高可逐渐加重左心室负荷,心室因代偿而逐渐肥厚、扩张和功能不全而形成的器质性心脏病[15]。高血压性心肌肥厚是最常见的病理改变,可见心肌细胞肥大,间质纤维化,同时出现一系列亚细胞形态和结构的改变,具体表现在肌膜的皱褶变多,细胞表面有许多指状突起,常呈现活跃的吞饮现象,线粒体增多肿胀,后期线粒体也可发生空泡样变性,肌浆网常有增生及扩张。在明显肥大和变性的心肌细胞中,肌原纤维可见某种程度的排列紊乱或出现异常分支,随着心肌细胞变性程度的增加,肌原纤维逐渐减少以至部分消失,在肌丝溶解部位可见增生的线粒体、肌浆网等。SHR在出生后10周龄左右开始出现左心室肥厚,随年龄增加而进行性加重。由于本研究SHR组采用的是20周龄的大鼠,因此电镜或光镜下均观察到了SHR组有很明显的心肌肥大,肌原纤维模糊,排列紊乱,肌丝有部分消失,可见横纹不清,线粒体肿胀堆积,内有空泡形成,内质网大量增生,间质胶原纤维增生,而且随着年龄的增加呈现进行性加重,而WKY组未见上述变化。本研究结果显示,随着时间的变化,SHR组血AGT、AngⅡ浓度明显升高,心肌肥厚程度亦明显加重,而WKY组血AGT、AngⅡ浓度未见明显变化,也未见明显心肌肥厚。
高血压性心肌肥厚是由于血压长期升高导致心脏后负荷过重所诱发的心脏损害,本研究结果间接证明通过抑制AGT的表达,可减少血清AngⅡ水平,进而降低血压,从而降低心脏后负荷,减轻甚至逆转心肌肥厚的发生发展,为临床对高血压患者心肌肥厚的发生提供一种新的防治策略。
[1]吴锡桂,武阳丰,周北凡,等.我国十组人群高血压发病率及其影响因素[J].中华医学杂志,1996,76(1):24-29.
[2]Ostroumova OD,Kochetkov AI.Effects of Amlodipine/Lisinopril Fixed-Dose Combination on Severity of Left Ventricular Hypertrophy and Parameters of Myocardial Stiffness in Patients With Hypertension[J].Kardiologiia,2016,56(11):27-37.
[3]Ferrario CM,Strawn WB.Role of the renninangiotensin-aldosterone system and proinflammatory mediators in cardiovascular disease[J]. Am J Cardiol,2006,98(1):121-128.
[4]Xu P,Wang Y,Sterner-Kock A,et al.Excessive hypertension and end-organ damage in a transgenic mouse line carrying the rat angiotensinogen gene[J].J Cardiovasc Pharmacol,2009,53(1):38-43.
[5]Lu H,Cassis LA,Kooi CW,et al.Structure and functions of angiotensinogen[J].Hypertens Res,2016,39(7):492-500.
[6]He J,Bian Y,Gao F,et al.RNA interference targeting the ACE gene reduced blood pressure and improved myocardial remodelling in SHRs[J].Clinical Science,2009,116:249-255.
[7]Nadruz W.Myocardial remodeling in hypertension[J].J Hum Hypertens,2015,29(1):1.
[8]方喜业.医学实验动物学[M].北京:人民卫生出版社,1995:121.
[9]Ortiz-Melo DI,Spurney RF.Special delivery:podocyte injury promotes renal angiotensin II generation from liver-derived angiotensinogen[J]. Kidney Int,2014,5(5):1009-1011.
[10]Kim S,Soltani-Bejnood M,Quignard-Boulange A,et al.The adipose renin-angiotensin system modulates systemic markers of insulin sensitivity and activates the intrarenal renin-angiotensin system[J].J Biomed Biotechnol,2006(5):1-6.
[11]Meng W,Zhao W,Zhao T,et al.Autocrine and paracrine function of Angiotensin 1-7 in tissue repair during hypertension[J].Am J Hypertens,2014,27(6):775-782.
[12]Wu J,You J,Wang S,et al.Insights into the activation and inhibition of angiotensin II type 1 receptor in the mechanically loaded heart[J]. Circ J,2014,78(6):1283-1289.
[13]Wang X,Ye Y,Gong H,et al.The effects of different angiotensin II type 1 receptor blockers on the regulation of the ACE-AngII-AT1 and ACE2-Ang(1-7)-Mas axes in pressure overload-induced cardiac remodeling in male mice[J].J Mol Cell Cardiol,2016,97:180-190.
[14]Huo ZJ,Li D,Guo J,et al.Effect of electroacupuncture stimulation on expression of angiote-nsinogen,angiotensin II type 1 receptor,endothelin-1,and endothelin a receptor mRNA in spontaneously hypertensive rat aorta[J].Chin J Integr Med,2016,22(10):778-782.
[15]Díez J.Arterial hypertension in patients with heart failure[J].Heart Fail Clin,2014,10(2):233-242.
The study of expression of AGT in hypertensive rats model combined with myocardial hypertrophy/
YUAN Li-fen, DU Qin, WANG Yu-qiang, et al//China Medical Equipment,2017, 14(6):161-164.
Objective: To discuss the correlation between myocardial hypertrophy and angiotensinogen (AGT) in spontaneously hypertensive rats (SHR). Methods: The 20 healthy 18-week-old male SHRs were divided in SHR group and 20 age-matched male Wistar Kyoto rats (WKYs) were divided in WKY group. Both of them were fed with standard diet. The systolic blood pressure (SBP) and heart rate were detected by using noninvasive tail-cuff method in the 0 week and 12th week, respectively. The serum AGT and serum Ang II were detected by ELISA. And the lesion of ultra structure about cardiac muscle tissue were evaluated under light microscope and electron microscope. Results: The results of ELISA indicated that the serum AGT and serum Ang II of SHR group were significantly higher than that of WKY group at 0 week and 12th week (tAGT=27.94, t=27.29, tAngII=16.20, t=31.33; P<0.05), respectively. The concentrations of serum AGT and serum AngII of rats with myocardial lesions of SHR group at 12th week were statistically significantly higher than that of SHR group at 0 week (t=15.17, t=13.77, P<0.05), respectively. And the concentrations of serum AGT and serum Ang II increased with the increase of the seriousness of myocardial lesions. Conclusion: There might be a certain correlation between AGT and myocardial hypertrophy in spontaneously hypertensive rats. To inhibit the expression of AGT might likely provide a new method for the prevention and cure of patients with hypertension combined with myocardial hypertrophy.
Spontaneously hypertensive rats; Hypertension; Myocardial hypertrophy; Angiotensinogen
Department of Respiratory Medicine, Shanghai Ninth People's Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China.
10.3969/J.ISSN.1672-8270.2017.06.044
1672-8270(2017)06-0161-04
R-332
A
袁丽粉,女,(1985- ),硕士,医师。上海交通大学医学院附属第九人民医院呼吸内科,研究方向:呼吸内科。
2017-01-20
①上海交通大学医学院附属第九人民医院呼吸内科 上海 200011
②上海交通大学医学院附属第九人民医院老年病科 上海 200011
*通讯作者:wangjian0628@163.com
