X射线及UVB对人表皮细胞细胞增殖及褪黑素受体表达的影响*
2017-06-21玲李至荟封江彬陆雪蔡恬静李爽赵骅田雪蕾刘青杰
高 玲李至荟封江彬陆 雪蔡恬静李 爽赵 骅田雪蕾刘青杰*
X射线及UVB对人表皮细胞细胞增殖及褪黑素受体表达的影响*
高 玲①李至荟②封江彬①陆 雪①蔡恬静①李 爽①赵 骅①田雪蕾①刘青杰①*
目的:研究X射线和紫外线B(UVB)对表皮细胞增殖的影响,以及对褪黑素受体(MTNR)蛋白表达的影响,为生活在高海拔地区可能受到较高电离和非电离辐射的公众辐射效应及其防护提供指导。方法:经照射剂量为0 Gy(对照组)、0.5 Gy、2 Gy和5 Gy(照射组)X射线以及0 mJ/cm2、20 mJ/cm2、50 mJ/cm2、100 mJ/cm2和200 mJ/cm2的UVB分别照射人表皮细胞Hacat和人黑色素瘤细胞A875,通过四甲基偶氮唑(MTT)和克隆形成率实验检测细胞增殖能力变化,采用蛋白质印迹法检测褪黑素受体MTNR-1B蛋白表达变化。结果:在照射剂量为0.5 Gy、2 Gy和5 Gy的X射线以及20 mJ/cm2和50 mJ/cm2UVB的照射下,可导致Hacat和A875细胞生长不同程度的降低。3种不同剂量X射线照射后Hacat细胞克隆形成率分别为对照组的71.2%、36.7%和16.3%,与对照组比较差异有统计学意义(F=249.96,P<0.05),A875细胞细胞克隆形成率分别为对照组的64.7%、49.5%和31.6%,与对照组比较差异有统计学意义(F=147.29,P<0.05);在照射剂量为20 mJ/cm2和50 mJ/cm2的UVB照射后Hacat细胞的克隆形成率分别为对照组的40.74%和12.96%,A875细胞的克隆形成率分别为对照组的16.33%和6.12%;50 mJ/cm、100 mJ/cm和200 mJ/cm2的UVB照射后A875细胞中MTNR1B表达随着剂量的增大而显著增加,而3种不同剂量X射线对MTNR1B表达在不同剂量之间无显著影响。结论:X射线和UVB照射后均可引起细胞增殖和存活能力的降低,UVB照射后引起的细胞增殖抑制可能与褪黑素受体表达变化相关。
X射线; 紫外线B(UVB); 细胞增殖; 褪黑素受体;蛋白印迹法
褪黑素(melatonin,MEL)是对光线和射线非常敏感的一类激素,通常过强的紫外线照射可导致褪黑素分泌的减少。MEL通过与褪黑素受体,即特异性膜受体或核受体结合而产生效应,具有延缓衰老、调节免疫、改善睡眠、抗击肿瘤以及引起DNA损伤等作用[1-3]。MEL在人体组织视交叉、嗅球、中脑、下丘脑、桥脑、延髓、海马和小脑等神经系统组织、视网膜、免疫系统、生殖系统以及内分泌系统等外周组织中均有分布。血清中褪黑素水平存在昼夜节律性变化,表现为夜间分泌到峰值而白天降至谷值。褪黑素受体属于G蛋白偶联受体超家族,有7个跨膜结构,不仅存在于神经系统,也广泛存在于免疫系统、生殖系统和内分泌系统等。且褪黑素受体也存在昼夜节律,节律也是自主的,受控于昼夜节律起步点而不受控于褪黑素的节律[4]。电离辐射及非电离辐射对褪黑素及其受体的影响尚不明确,因此本研究初步探索X射线和UVB对人表皮细胞细胞增殖及褪黑素受体表达的影响。
1 材料与方法
1.1 仪器与试剂
(1)Precise直线加速器(瑞典Elekta公司);SH4B-T紫外光疗仪(上海Sigma公司);
Thermo Labsystems MK3酶标仪(美国Thermo Fisher Scientific公司)。
(2)特级胎牛血清和DMEM培养基购自美国Gibco公司;四甲基偶氮唑(methyl thiazolyltetrazolium,MTT)试剂购自美国Sigma公司;D-Hank's缓冲液、甲醛溶液、姬姆萨染色液以及PBS缓冲液均为本实验室配制;蛋白提取试剂盒及蛋白浓度测定试剂盒购自美国Pierce公司;NC膜购自美国GE公司;MTNR1B抗体及β-肌动蛋白抗体购自美国Santa cruz公司;人表皮细胞Hacat、人黑色素瘤细胞A875购自北京协和医学院细胞库。
1.2 细胞培养与分组
细胞株采用含有10%灭活胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养液培养。实验分为照射组和对照组,照射组的X射线吸收剂量分别为0.5 Gy、2 Gy和5 Gy;UVB吸收剂量分别为20 mJ/ cm2、50 mJ/cm2、100 mJ/cm2和200 mJ/cm2;对照组X射线和UVB照射的吸收剂量均为0。
1.3 X射线与紫外线B照射
X射线照射使用Precise直线加速器产生的X射线单次照射细胞,源靶距为100 cm,能量为6 MV,照射组吸收剂量分别为0.5 Gy、2 Gy和5 Gy,采用电离室进行剂量校准;紫外线B(ultraviolet B,UVB)照射采用SH4B-T紫外光疗仪,UVB发射光波长为311~313 nm,照射距离约为40 cm。照射剂量采用本所辐射防护与建设项目评价室TN-2340紫外线强度计校准细胞,照射组吸收剂量分别为20 mJ/cm2、50 mJ/cm2、100 mJ/cm2和200 mJ/cm2。
1.4 MTT实验
细胞浓度调整为5×104/ml;取24孔培养板,各孔加0.2 ml培养液,设5个复孔,在37 ℃培养箱培养2%灭活胎牛血清;分别培养至1 d、2 d和3 d,在相应的孔里加入20 μl四甲基偶氮唑(methyl thiazolyl tetrazolium,MTT)比色试剂,继续在培养箱中培养4 h;在每孔中加入100 μl二甲基亚砜(dimethyl sulfoxide,DMSO),震荡混匀10 min后使用Thermo Labsystems MK3酶标仪检测波长492 nm处的吸光度(D492)值。
1.5 克隆形成率实验
常规消化指数生长期的细胞,用DMEM培养液悬成单细胞后置于10 ml离心管中,密封照射,各组细胞分别接种于5 ml预温37 ℃培养液的60 mm培养皿中,接种500个细胞。以十字方向轻轻晃动培养皿,使细胞分散均匀。将培养皿移入CO2培养箱,在37 ℃、CO2体积分数为5%和95%湿度环境下静止培养7 d后终止培养。用预温的D-Hank's洗涤2遍后,甲醇固定20 min,去甲醇,姬姆萨染色液染色15 min,冲洗晾干后解剖显微镜下计数克隆数,克隆形成率(colony forming efficiency,CFE)计算为公式1:

生存分数(survival fraction,SF)计算为公式2:

1.6 蛋白提取及Western blot
消化并收集细胞,按Pierce蛋白提取试剂盒说明书提取细胞总蛋白,Bradford法测定蛋白浓度,取50 μg上样,制备12%的聚丙烯酰胺凝胶垂直电泳,将蛋白转移至NC膜,分别用抗MTNR1B抗体(工作浓度1∶1000)及抗β-肌动蛋白多抗(工作浓度1∶500)检测MTNR1B及β-肌动蛋白的表达,一抗及二抗孵育后,采用增强化学发光(enhanced chemiluminescence,ECL)法显影。电泳条带经ImageJ软件处理计算积分光密度(integrated density),使用光密度总和÷面积计算积分光密度,目的条带与内参照条带的比值代表目的蛋白的表达水平。
1.7 统计学方法
应用SPSS 12.0统计软件进行数据处理,数据符合正态分布,两组比较采用独立样本,每个照射组均与对照组配对,照射组与对照组之间的比较采用单因素方差分析,以α=0.05为检验水准,以P<0.05为差异有统计学意义。
2 结果
2.1 不同剂量X射线照射对细胞增殖的影响
利用MTT和克隆形成率方法检测两组X射线对Hacat和A875细胞增殖的影响,MTT结果显示Hacat和A875细胞增殖如下。
(1)Hacat细胞照射后48 h,照射组吸收剂量0.5 Gy、2 Gy和5 Gy与对照组相比,细胞增殖能力均出现降低,两组比较差异有统计学意义(F=249.96,P<0.05);照射后72 h吸收剂量0.5 Gy和5 Gy与对照组相比,细胞增殖能力均出现统计学差异的降低;吸收剂量2 Gy与0.5 Gy相比,出现统计学差异的降低;吸收剂量5 Gy与2 Gy比较,出现统计学差异的降低(见表1)。
(2)A875细胞照射后24 h和48 h,吸收剂量0.5和5 Gy与对照组相比,细胞增殖能力出现显著降低,差异有统计学意义(F=174.29,P<0.05)。照射后72 h,吸收剂量0.5 Gy、2 Gy和5 Gy与对照组相比,细胞增殖能力均出现明显降低;吸收剂量2 Gy与0.5 Gy相比,出现明显降低;吸收剂量5 Gy与2 Gy比较,细胞增殖能力出现明显降低(见表2)。
(3)克隆形成率实验结果显示,X射线照射2种细胞后克隆形成率在吸收剂量0.5 Gy、2 Gy和5 Gy不同剂量间均出现统计学差异。Hacat细胞克隆形成率分别为对照组的71.2%、36.7%和16.3%,如图1所示。
A875细胞细胞克隆形成率分别为对照组的64.7%、49.5%和31.6%。如图2所示。
2.2 UVB照射对细胞增殖的影响
(1)经0、20 mJ/cm2和50 mJ/cm2UVB照射后,人表皮细胞Hacat、人黑色素瘤细胞A875的MTT吸光度数值均出显著降低(见表3、表4)[5]。
(2)细胞受到照射后,部分细胞尽管DNA发生损伤,却仍然可以进行1~2代细胞分裂,但最终丧失细胞的再分裂和增殖能力。为了更准确检测射线对细胞增殖能力的远后影响而进行克隆形成率实验。采用20 mJ/cm2和50 mJ/cm2的UVB照射后进行克隆形成率实验,Hacat、A875的克隆形成率和存活分数均显著降低。其中在50 mJ/cm2剂量时对UVB紫外线耐受性较强的Hacat细胞克隆形成率和存活分数分别为3.11%和12.96%,克隆形成率为对照组的12.96%;对UVB紫外线耐受性较弱的A875细胞克隆形成率和存活分数分别为0.67%和6.12%,克隆形成率为对照组的6.12%,见表5[5]。
表1 MTT检测两组X射线对Hacat 细胞生长的影响
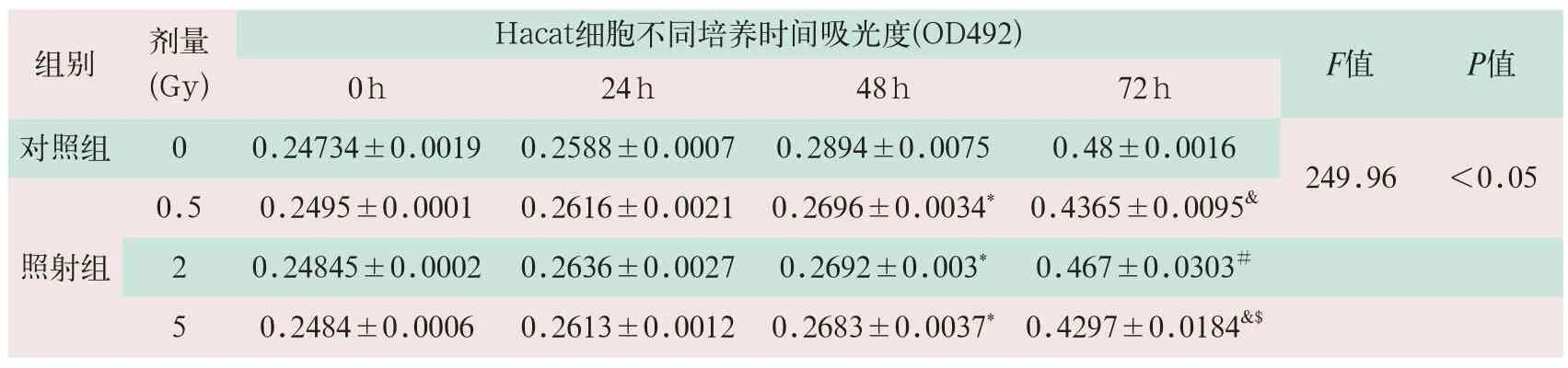
表1 MTT检测两组X射线对Hacat 细胞生长的影响
注:*表示48 h照射组与对照组细胞吸光值比较有统计学意义;&表示72 h照射组与对照组细胞吸光值比较有统计学意义;#表示72 h照射组与0.5 Gy组细胞吸光值比较有统计学意义;$表示72 h照射组与2 Gy组细胞吸光值比较有统计学意义。
组别剂量( G y ) F值P值0 h 2 4 h 4 8 h 7 2 h H a c a t细胞不同培养时间吸光度( O D 4 9 2 ) 0 . 5 0 . 2 4 9 5 ± 0 . 0 0 0 1 0 . 2 6 1 6 ± 0 . 0 0 2 1 0 . 2 6 9 6 ± 0 . 0 0 3 4*0 . 4 3 6 5 ± 0 . 0 0 9 5&2 0 . 2 4 8 4 5 ± 0 . 0 0 0 2 0 . 2 6 3 6 ± 0 . 0 0 2 7 0 . 2 6 9 2 ± 0 . 0 0 3*0 . 4 6 7 ± 0 . 0 3 0 3#5 0 . 2 4 8 4 ± 0 . 0 0 0 6 0 . 2 6 1 3 ± 0 . 0 0 1 2 0 . 2 6 8 3 ± 0 . 0 0 3 7*0 . 4 2 9 7 ± 0 . 0 1 8 4&$对照组 0 0 . 2 4 7 3 4 ± 0 . 0 0 1 9 0 . 2 5 8 8 ± 0 . 0 0 0 7 0 . 2 8 9 4 ± 0 . 0 0 7 5 0 . 4 8 ± 0 . 0 0 1 6 2 4 9 . 9 6<0 . 0 5照射组
表2 MTT检测两组X射线对A875细胞生长的影响
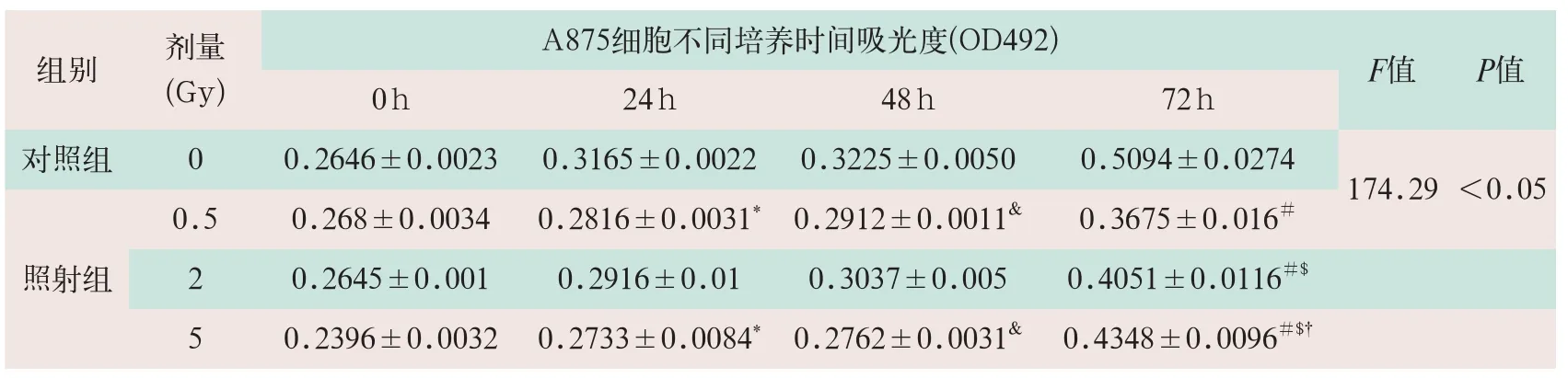
表2 MTT检测两组X射线对A875细胞生长的影响
注:*表示24 h照射组与对照组细胞吸光值比较有统计学意义;&表示48 h照射组与对照组细胞吸光值比较有统计学意义;#表示72 h照射组与对照组细胞吸光值比较有统计学意义;$表示72 h照射组与0.5 Gy组细胞吸光值比较有统计学意义;†表示72 h照射组与2 Gy组细胞吸光值比较有统计学意义。
组别剂量( G y ) F值P值0 h 2 4 h 4 8 h 7 2 h A 8 7 5细胞不同培养时间吸光度( O D 4 9 2 ) 0 . 5 0 . 2 6 8 ± 0 . 0 0 3 4 0 . 2 8 1 6 ± 0 . 0 0 3 1*0 . 2 9 1 2 ± 0 . 0 0 1 1&0 . 3 6 7 5 ± 0 . 0 1 6#2 0 . 2 6 4 5 ± 0 . 0 0 1 0 . 2 9 1 6 ± 0 . 0 1 0 . 3 0 3 7 ± 0 . 0 0 5 0 . 4 0 5 1 ± 0 . 0 1 1 6#$5 0 . 2 3 9 6 ± 0 . 0 0 3 2 0 . 2 7 3 3 ± 0 . 0 0 8 4*0 . 2 7 6 2 ± 0 . 0 0 3 1&0 . 4 3 4 8 ± 0 . 0 0 9 6#$†对照组 0 0 . 2 6 4 6 ± 0 . 0 0 2 3 0 . 3 1 6 5 ± 0 . 0 0 2 2 0 . 3 2 2 5 ± 0 . 0 0 5 0 0 . 5 0 9 4 ± 0 . 0 2 7 4 1 7 4 . 2 9<0 . 0 5照射组
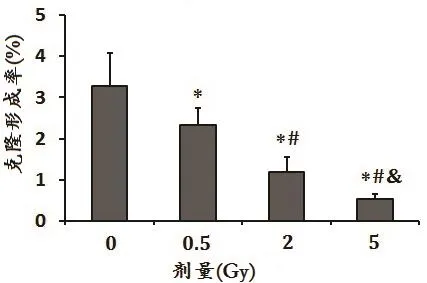
图1 克隆形成率检测不同剂量的X射线对Hacat细胞增殖的影响
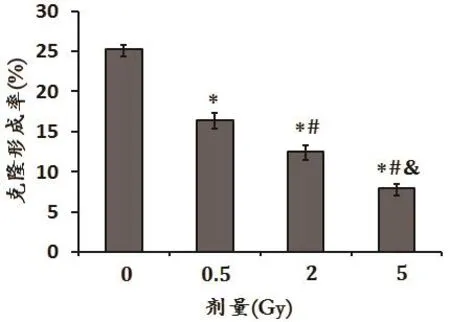
图2 克隆形成率检测不同剂量的X射线对A875细胞增殖的影响
2.3 X射线和UVB对褪黑素表达的影响
利用蛋白质印迹(western blot,WB)实验检测褪黑素受体MTNR-1B蛋白表达,结果显示,X射线对A875和Hacat细胞MTNR-1B表达无特别显著的影响;经50 mJ/cm2、100 mJ/cm2和200 mJ/cm2UVB照射后A875细胞中MTNR-1B表达随着剂量的增大而显著增加(如图3、图4所示)。X射线和UVB对MTNR-1B蛋白表达的影响积分光密度比值如图5所示。
表3 MTT检测两组UVB对Hacat细胞生长的影响
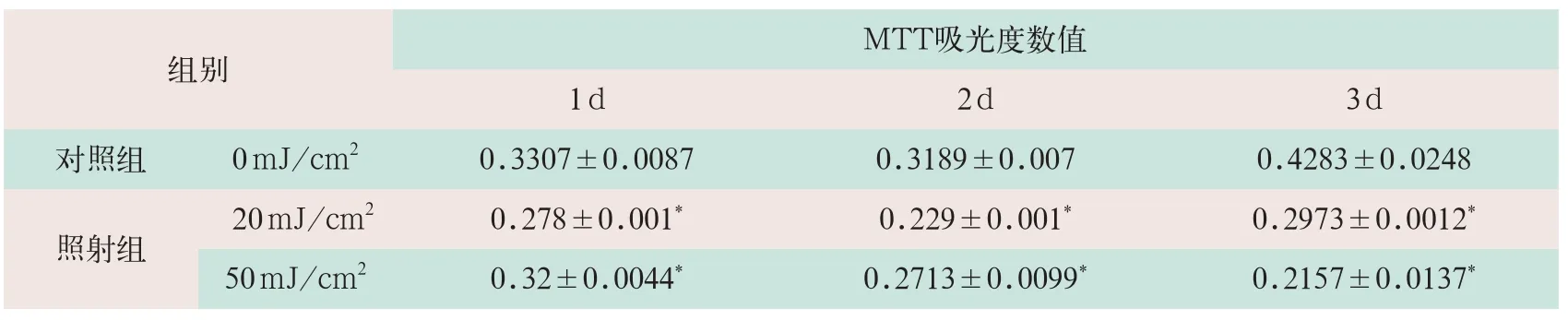
表3 MTT检测两组UVB对Hacat细胞生长的影响
注:表中*表示与对照组吸光值比较有统计学意义;表3引自参考文献[5]。
组别M T T吸光度数值1 d 2 d 3 d对照组0 m J / c m20 . 3 3 0 7 ± 0 . 0 0 8 7 0 . 3 1 8 9 ± 0 . 0 0 7 0 . 4 2 8 3 ± 0 . 0 2 4 8照射组 2 0 m J / c m20 . 2 7 8 ± 0 . 0 0 1*0 . 2 2 9 ± 0 . 0 0 1*0 . 2 9 7 3 ± 0 . 0 0 1 2*5 0 m J / c m20 . 3 2 ± 0 . 0 0 4 4*0 . 2 7 1 3 ± 0 . 0 0 9 9*0 . 2 1 5 7 ± 0 . 0 1 3 7*
表4 MTT检测两组UVB对A875细胞生长的影响
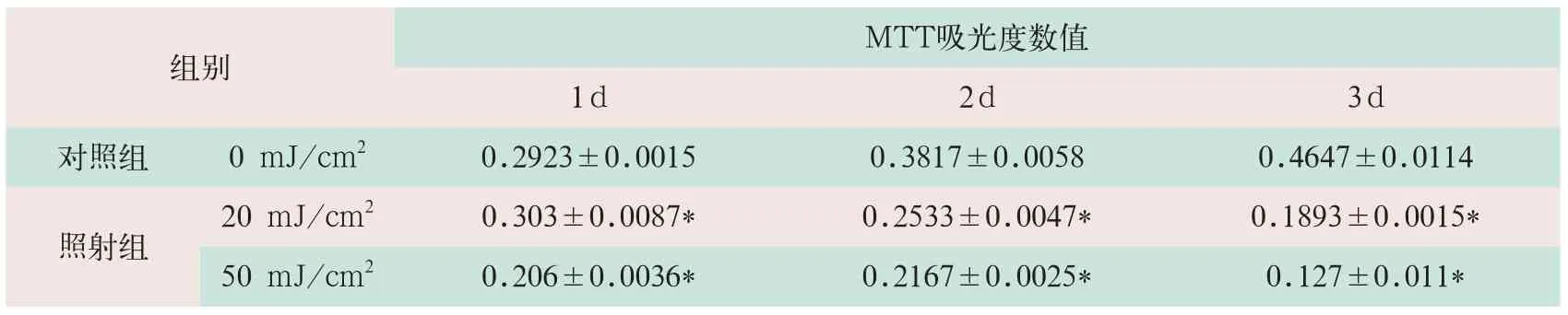
表4 MTT检测两组UVB对A875细胞生长的影响
注:表中*表示与对照组吸光值比较有统计学意义;表4引自参考文献[5]。
组别M T T吸光度数值1 d 2 d 3 d对照组0 m J / c m20 . 2 9 2 3 ± 0 . 0 0 1 5 0 . 3 8 1 7 ± 0 . 0 0 5 8 0 . 4 6 4 7 ± 0 . 0 1 1 4照射组2 0 m J / c m20 . 3 0 3 ± 0 . 0 0 8 7 * 0 . 2 5 3 3 ± 0 . 0 0 4 7 * 0 . 1 8 9 3 ± 0 . 0 0 1 5 * 5 0 m J / c m20 . 2 0 6 ± 0 . 0 0 3 6 * 0 . 2 1 6 7 ± 0 . 0 0 2 5 * 0 . 1 2 7 ± 0 . 0 1 1 *
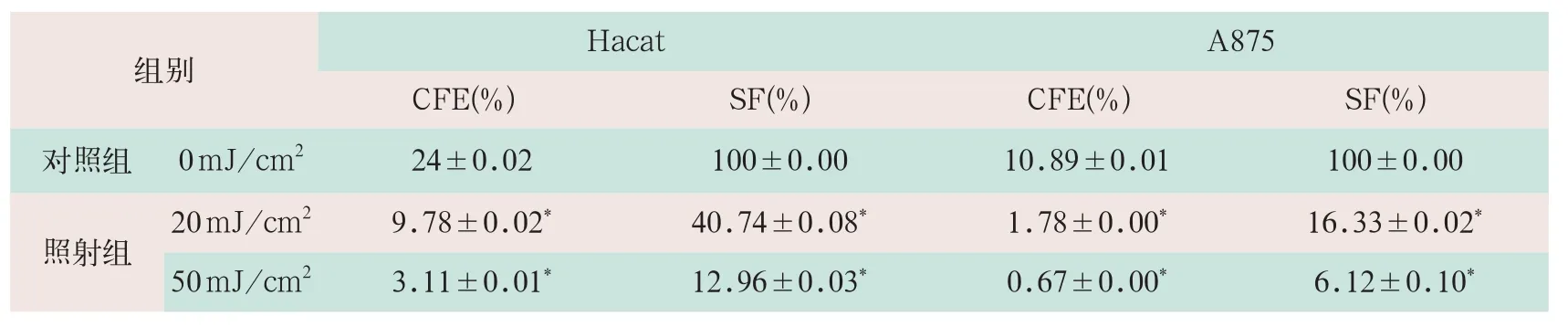
表5 克隆形成率检测UVB紫外线对Hacat、A875细胞增殖的影响(x-±s)
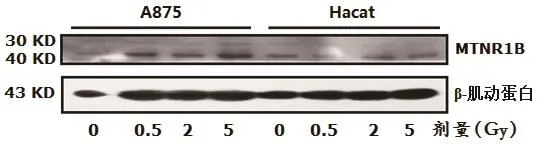
图3 不同剂量X射线对MTNR1B蛋白表达的影响
注:图中a和c使用A875细胞, b和d使用 Hacat细胞;其中a和b是X射线照射, c和d是UVB照射。
3 讨论
褪黑素与褪黑素受体(MTNR1A和MTNR1B)具有良好的亲和力,通过激活免疫活性细胞中的特异性受体,调节白细胞介素1α(interleukin-1α,IL-1α) IL-1α、IL-1β、IL-2、IL-6、TNF-α和IFN-γ等细胞因子的生成和释放,在多种疾病中发挥重要作用[6-9]。有研究表明,褪黑素可通过调节抗氧化物酶和自由基来发挥其辐射损伤防护的作用[10]。辐射对褪黑素受体表达的影响目前尚无定论。
研究表明,经50 mJ/cm2的UVB照射可引起表皮细胞Hacat增殖能力降低,发生凋亡和自噬[11-12]。克隆形成率实验结果与前期研究结果一致,均表明经20 mJ/cm2和50 mJ/cm2的UVB照射后,HaCaT和A875细胞克隆形成率和存活分数均显著降低。其中在50 mJ/cm2剂量时HaCaT细胞克隆形成率和存活分数分别为3.11%和12.96%;A875细胞克隆形成率和存活分数分别为0.67%和6.12%[5]。MTT和克隆形成率结果表明,经0.5 Gy、2 Gy和5 Gy的X射线和0 mJ/ cm2、20 mJ/cm2和50 mJ/cm2的UVB照射后可导致Hacat和A875细胞的增殖能力出现不同程度的降低。蛋白检测结果表明,经50 mJ/cm2、100 mJ/cm2和200 mJ/cm2的UVB照射后,A875细胞中MTNR-1B表达随着剂量的增大而显著增加。这些结果提示,X射线和UVB照射后均可引起细胞增殖能力的降低,UVB照射后引起的细胞增殖抑制可能与褪黑素受体表达变化相关。
[1]Fathollahi A,Daneshgari F,Hanna-Mitchell AT.Melatoninand Its Role in Lower Urinary Tract Function:An Article Review[J].Curr Urol,2015,8(3):113-118.
[2]Arushanian EB.Melatonin treatment of autoimmune and allergic pathology[J].Eksp Klin Farmakol,2015,78(8):29-34.
[3]Manchester LC,Coto-Montes A,Boga JA,et al. Melatonin:an ancient molecule that makes oxygen metabolically tolerable[J].J Pineal Res,2015,59(4):403-419.
[4]赵瑛.松果腺褪黑素受体研究现状及展望[J].第二军医大学学报,2001,22(11):1054-1057.
[5]高玲,李峰生,封江彬,等.不同种类细胞株对UVB紫外线的耐受性初探[J].癌变·畸变·突变,2014,26(5):357-360.
[6]Emet M,Ozcan H,Ozel L,et al.A Review of Melatonin,Its Receptors and Drugs[J].Eurasian J Med,2016,48(2):135-141.
[7]Cardinali DP,Vigo DE,Olivar N,et al.Melatonin Therapy in Patients with Alzheimer's Disease[J].Antioxidants(Basel),2014,3(2):245-277.
[8]Cardinali DP,Hardeland R.Inflammaging,Metabolic Syndrome and Melatonin:A Call for Treatment Studies[J].Neuroendocrinology,2017,104(4):382-397.
[9]Tarnowski M,Malinowski D,Safranow K,et al. MTNR1A and MTNR1B gene polymorphisms in women with gestational diabetes[J].Gynecol Endocrinol,2017,33(5):395-398.
[10]郭月凤,田宇,张慧芳.褪黑素抗辐射作用研究进展[J].辐射防护通讯,2013(6):23-26.
[11]An IS,An S,Choe TΒ,et al.Centella asiatica protects against UVB-induced Ha CaT keratinocyte damage through micro RNA expression changes[J].Int J Mol Med,2012,30(6):1349-1356.
[12]Vitale N,Kisslinger A,Paladino S,et al.Resveratrol couples apoptosis with autophagy in UVB-irradiated Ha CaT cells[J].PLoS One,2013,8(11):e80728.
Effects of X-ray and UVB for proliferation and the expression of melatonin receptor of human epidermal cells/
GAO Ling, LI Zhi-hui, FENG Jiang-bin, et al//China Medical Equipment,2017,14(6):156-160.
Objective: To explore the effects of X-rays and ultraviolet B (UVB) for the proliferation of human epidermal cells and the expression of melatonin receptor in human epidermal cells. This study can provide guidance about radiation effect and how to protect the public who may suffered higher ionization and non-ionizing radiation in high altitude region. Methods: Human epidermal cells (Hacat) and human melanoma cell lines A875 were irradiated with X-ray of different doses (0, 0.5, 2 and 5 Gy) and UVB of different doses (20, 50, 100 and 200 mJ/cm2), respectively. The change of cell proliferative capacity was detected by using methyl thiazolyl tetrazolium (MTT) and cloning efficiency experiment, and the change about expression of melatonin receptor (MTNR-1B) was detected by using western blot. Results: Cell proliferative capacity of Hacat and A875 were decreased in various degrees when they exposed in X-ray of different doses (0.5, 2 and 5 Gy) and ultraviolet B of different dose (20, 50 mJ/cm2). For Hacat cells, the cloning efficiencies of them in observation group after were irradiated by using X-ray of 3 kinds of doses were 71.2%, 36.7% and 16.3% of that in control group, and the differences between the two group were statistically significant (F=249.96, P<0.05), respectively. While for A875 cells, the cloning efficiencies of them in observation group were 64.7%, 49.5% and 31.6% of that in control group at the same 3 kinds of doses, and the differences between the two group also were statistically significant (F=147.29, P<0.05), respectively. On the other hand, after Hacat cells were radiated by using UVB of different doses (20 and 50 mJ/cm2), the cloning efficiencies of them in observation group were 40.74% and 12.96% of that in control group, respectively. And for A875 cell, they were 16.33% and 6.12% of that in control group at the same condition of dose, respectively. In addition, after Hacat cells were radiated by using UVB of 50 mJ/cm2, 100 mJ/cm2and 200 mJ/cm2, respectively, the results revealed that expression of MTNR1B was significantly increased with the enhancing of dose, while the X-ray of 3 kinds of doses were no significant effect for the expression of MTNR1B. Conclusion: Both of X-ray irradiation and UVB irradiation can cause the reductions of the capacities of proliferation and survival, and the inhibition of cell proliferation might be relative with the change of expression of melatonin receptor after UVB radiates cell.
X-ray; Ultraviolet-b(UVB); Cell proliferation; Melatonin receptor; Western blot
Key Laboratory of Radiological Protection and Nuclear Emergency, China CDC, National Institute for Radiological Protection, Chinese Center for Disease Control and Prevention, Beijing 100088, China.
10.3969/J.ISSN.1672-8270.2017.06.043
1672-8270(2017)06-0156-05
R-33
A
高玲,女,(1978- ),博士,副研究员,硕士生导师。中国疾病预防控制中心辐射防护与核应急中国疾病预防控制中心重点实验室,从事辐射损伤效应研究工作。
2017-04-25
国家自然科学基金面上项目(31570852)“STAT3调控caveolin-1介导的抗早衰在肿瘤辐射抗性中的作用及机制研究”;北京市自然科学基金面上项目(7162137)“UVB紫外线致黑素细胞早衰及对黑色素合成的调节机制研究”;中国疾病预防控制中心青年科研基金(2015A201)“利用负载lewis细胞的小鼠模型评价低剂量辐射对机体抗肿瘤免疫功能的影响”
①中国疾病预防控制中心辐射防护与核应急中国疾病预防控制中心重点实验室 北京 100088
②山西医科大学第二临床附属医院 山西 太原 030001
*通讯作者:qjliu@nirp.cn
