慢病毒携带shRNA对乳腺癌HPA基因表达的抑制作用*
2017-06-21陈国利郑志方张学军裴天禄张金光
陈国利郑志方张学军裴天禄张金光
[文章编号] 1672-8270(2017)06-0150-06 [中图分类号] R-332 [文献标识码] A
慢病毒携带shRNA对乳腺癌HPA基因表达的抑制作用*
陈国利①*郑志方②张学军①裴天禄③张金光④
目的:以乙酰肝素酶(HPA)基因为靶点,构建短发夹RNA(shRNA)慢病毒表达载体,研究慢病毒携带的shRNA对乳腺癌HPA基因表达的抑制作用。方法:以乳腺癌HPA基因为靶基因,根据RNA干扰(RNAi)序列设计原则,通过构建3对shRNA重组慢病毒的表达载体,转染乳腺癌MDA-MB-231细胞,在体外采用蛋白质印迹(Western blot)法检测HPA基因蛋白表达水平;在体内构建乳腺癌模型,通过免疫组化检测HPA基因蛋白的表达。结果:在体外实验中,HPA-shRNA-1组和HPA-shRNA-2组均有效抑制了人乳腺癌MDA-MB-231细胞HPA的表达。在体内实验中,HPA-shRNA-2组HPA基因蛋白的表达明显低于阴性对照组及空白对照组,HPA-shRNA-2组阳性率与空白对照组比较,差异有统计学意义(x2=12.504,P<0.05)。表明在体内实验中HPA-shRNA-2组可以下调HPA基因蛋白表达。结论:以HPA为靶点构建shRNA重组慢病毒载体,体内外实验均能下调乳腺癌HPA基因的表达,可为乳腺癌靶向治疗提供新的靶点。
乳腺癌;乙酰肝素酶;短发夹RNA;MDA-MB-231细胞;免疫组织化学;蛋白质印迹
乳腺癌是女性常见的恶性肿瘤,也是导致女性死亡主要肿瘤之一,且呈逐年上升趋势,严重威胁女性的身心健康,甚至生命安全。目前的研究认为,乳腺癌是全身性疾病,病因尚不清楚,可能与乳腺良性疾病、雌激素、孕激素、环境因素以及生活方式等有一定关系,乳腺癌目前的治疗方案与以往大不相同,目前以手术切除为主,配合放化疗和内分泌治疗以及生物治疗的个体化综合治疗。尽管乳腺癌患者5年生存率明显提高,但是乳腺癌的复发和转移仍然是导致患者死亡的主要原因,因此乳腺癌的复发转移是急需攻克的难题。乙酰肝素酶(heparanase,HPA)是目前发现的一种能裂解硫酸乙酰肝素蛋白聚糖的β-D糖苷内切酶,HPA通过降解细胞外基质和诱导血管生成促进乳腺癌的复发转移[1]。本研究以HPA基因为靶点构建HPA短发夹RNA(short hairpin RNA,shRNA)重组慢病毒表达载体,通过体内、体外实验研究靶向抑制乳腺癌HPA基因表达的可行性,为乳腺癌的基因治疗寻找新的靶点。
1 材料与方法
1.1 设备材料和试剂
(1)Thermo Forma培养箱(美国,Thermo Electron公司);Cytoprep-1离心机(长沙英泰仪器有限公司)。
(2)慢病毒包装293T细胞和人乳腺癌MDAMB-231细胞株均购自上海市中科院细胞库;L-15培养基和胰酶购自美国Gibco公司;胎牛血清购自杭州四季青公司;Mouse monoclonal to Heparanase 1抗体购自英国abcam公司;慢病毒系统由上海吉玛制药技术有限公司合成;健康BALB/C雌性裸鼠购自上海斯莱克实验动物有限责任公司。
(3)细胞可溶性蛋白制备试剂购自上海GenMed Scientifics公司;Trizol试剂盒购自美国Invitrogen公司;SYBR Premix Ex Taq荧光实时定量PCR试剂盒购自日本TaKaRa公司;
1.2 体外实验方法
(1)乳腺癌MDA-MB-231细胞培养。乳腺癌MDA-MB-231细胞株接种于含10%胎牛血清L-15培养基中,放置于37℃、5%CO2培养箱内培养。
(2)靶向HPA shRNA序列设计。以HPA为靶点,根据shRNA序列设计原则,设计出的shRNA序列见表1。
(3)HPA shRNA慢病毒表达载体的构建和重组慢病毒的包装。将合成寡核苷酸片段退火形成双链DNA,PCR扩增、回收、纯化。双链DNA经T4 DNAligase与线性化质粒连接,转化DH5α大肠杆菌,挑取重组阳性克隆进行测序鉴定。将293T细胞进行培养,当密度达到70%~90%开始转染,用HPARNA干扰(RNA interfering,RNAi)序列重组质粒和病毒包装3个质粒(pGag/Pol、pRev、pVSV-G),共转染细胞293T,72 h后收集上清液,离心(10000 r/ min,3 min),过滤浓缩获得慢病毒浓缩液,并测定慢病毒原液的滴度,分装后在-80 ℃保存。
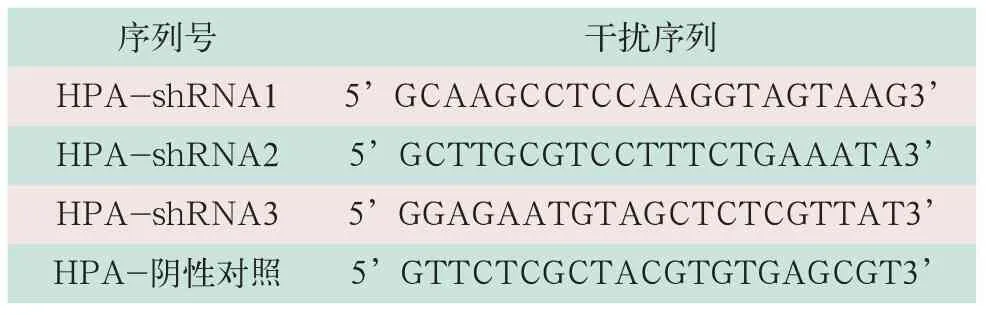
表1 HPA特异性干扰序列
(4)HPA shRNA重组慢病毒转染乳腺癌MDAMB-231细胞效果检测。实验中将细胞分为5组:①HPA-shRNA-1组;②HPA-shRNA-2组;③HPA-shRNA-3组;④HPA-阴性对照组;⑤空细胞组。其中,除空细胞组外的1~4组MDA-MB-231细胞分别感染HPA shRNA-1、HPA shRNA-2、HPA shRNA-3和HPA shRNA-阴性对照慢病毒,空细胞组未做任何处理。将感染后的细胞培养72 h后在荧光显微镜下观察转染效率。
(5)采用蛋白质印迹(western blot)法检测HPA的表达。转染72 h后去除各组细胞培养液,用PBS洗涤细胞,通过RIPA裂解液裂解细胞,提取细胞总蛋白,采用考马斯亮蓝法蛋白定量,10% SDSPAGE电泳分离后转移到PVDF膜,封闭转印膜2 h,然后加入稀释HPA单克隆抗体,于冰箱内4 ℃温育12 h,洗涤,加入稀释二抗,在室温温育2 h后显色,通过凝胶成像系统分析,采用3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参照。
1.3 体内实验方法
(1)动物分组。采用24只雌性裸鼠,体重17~19 g,鼠龄约5周,将裸鼠采用数表法随机分为HPA-shRNA-2组、阴性对照组和空白对照组3组,每组8只。
(2)构建乳腺癌模型。将培养好的乳腺癌MDAMB-231细胞配制成1×109细胞/ml单细胞悬液。碘伏消毒裸鼠右侧腋窝,取1×109细胞/ml单细胞悬液0.2 ml注射裸鼠右侧腋窝皮下,裸鼠右侧腋窝出现球形凸起;每日观察肿瘤的生长情况。
(3)HPA-shRNA重组慢病毒注射。将体外实验筛选出有效抑制乳腺癌MDA-MB-231细胞HPA表达的HPA-shRNA-2序列包装成重组慢病毒。待肿瘤生长至直径约1 cm,采用瘤体多点注射法,将携带HPA-shRNA-2、HPA-阴性对照重组慢病毒(滴度
为1×108
TU/ml)导入各组裸鼠肿瘤灶,隔日1次,共4次,每只裸鼠注射总量400 μl,观察裸鼠肿瘤的生长情况。
(4)获取肿瘤标本。重组慢病毒注射移植瘤1个月后,将HPA-shRNA-2组、阴性对照组、空白对照组裸鼠分别逐一编号。麻醉后用手术刀完整剥离出肿瘤组织。将每个肿瘤组织以10%甲醛固定后编号,采用石蜡包埋,做HE染色及免疫组织化学法检测。
(5)免疫组织化学法检测HPA蛋白的表达。24个肿瘤标本切片、脱蜡、酒精水化和磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗。然后切片放于枸橼酸钠缓冲溶液中,高温高压修复抗原,通过PBS冲洗。加3%的H2O2,10 min后用PBS冲洗。用2%的山羊血清封闭30 min,去掉多余液体。加入一抗兔抗鼠HPA抗体,于冰箱内4 ℃温育12 h,取出放置37 ℃、1 h后冲洗,加入山羊抗兔IgG抗体,放置37 ℃、30 min后冲洗。通过DAB显色剂显色,冲洗后苏木素复染,冲洗和脱水,透明干燥后封片。
(6)半定量评分法。镜下随机选取10个400倍视野,每个视野计数100个癌细胞。以癌细胞膜或细胞浆中出现黄褐色颗粒为阳性显色,阳性细胞数分级:阳性细胞数≤50%为0,50%<阳性细胞数<76%为1,阳性细胞数≥76%为2。染色强度分级:无着色0,浅黄褐色1,黄褐色2。染色强度与阳性细胞数评分相乘为该标本的阳性积分,阳性积分≥2为阳性表达标本。
1.4 统计学方法
应用SPSS 19.0统计软件对所得数据进行分析,对Western blot检测HPA蛋白的表达结果进行t检验方差分析;免疫组织化学法检测HPA基因蛋白的表达结果采用半定量评分法和卡方检验及Fisher确切概率法检测,以P<0.05为差异具有统计学意义。
2 结果
2.1 体外实验结果
(1)HPA shRNA慢病毒表达载体的构建和测序。构建的特异性靶向抑制人HPA基因的3个重组慢病毒表达载体HPA shRNA-1、HPA shRNA-2、HPA shRNA-3,经测序鉴定证实插入的碱基序列与设计的3个HPA shRNA序列完全一致,成功构建HPA shRNA重组慢病毒表达载体。
(2)乳腺癌MDA-MB-231细胞感染HPA shRNA重组慢病毒效果检测。用人乳腺癌MDA-MB-231细胞感染HPA shRNA重组慢病毒,将感染细胞培养72 h后检测可见大部分MDA-MB-231细胞表达荧光蛋白,证明转染效率较高(如图1所示)。
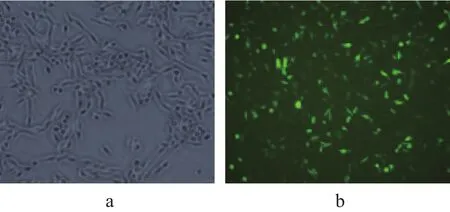
图1 感染72 h前后MDA-MB-231细胞(×200)
(3)Western blot检测HPA表达。重组慢病毒转染MDA-MB-231细胞,72 h后进行WB实验,检测HPA蛋白相对表达,结果5组分别为0.097±0.047、0.040±0.036、0.897±0.059、0.927±0.085和1.003±0.078。实验中HPA-shRNA-1组、HPA-shRNA-2组HPA蛋白的表达明显低于阴性对照组和空细胞组,表明HPA-shRNA-1、HPA-shRNA-2能够有效抑制HPA基因蛋白的表达。其结果如图2、图3所示。

图2 WB检测HPA蛋白表达电泳图
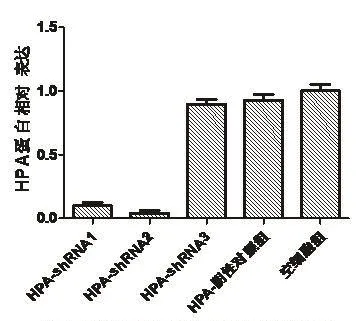
图3 WB检测HPA蛋白表达
2.2 体内实验结果
(1)HPA-shRNA重组慢病毒注射。肿瘤直径约1 cm,将重组慢病毒注射肿瘤灶。如图4、图5所示。
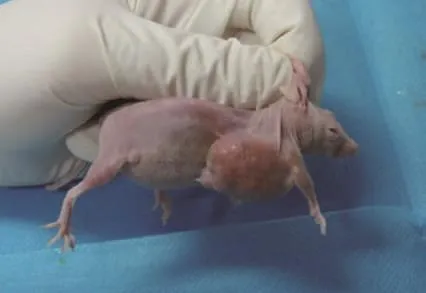
图4 注射前裸鼠乳腺癌模型
图5 裸鼠注射重组慢病毒
(2)获取肿瘤标本。重组慢病毒注射裸鼠移植瘤1个月后,手术完整取出肿瘤组织。如图6、图7所示。
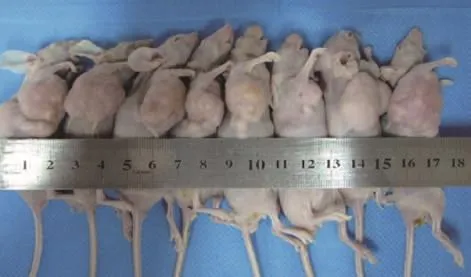
图6 术前裸鼠乳腺癌移植瘤
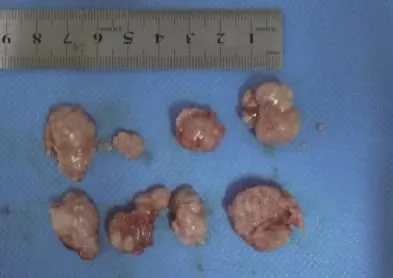
图7 术后裸鼠乳腺癌移植瘤
(3)免疫组织化学法检测HPA蛋白的表达。结果采用半定量评分法和卡方检验及Fisher确切概率法检测,采用半定量评分法所得数据,通过卡方检验及Fisher确切概率法检测,结果显示,空白对照组HPA蛋白表达和阴性对照组相比无差异;实验中HPA-shRNA-2组HPA蛋白表达明显低于空白对照组及阴性对照组,HPA-shRNA-2组阳性率与空白对照组比较,差异有统计学意义(x2=12.504,P<0.05)(见表2)。
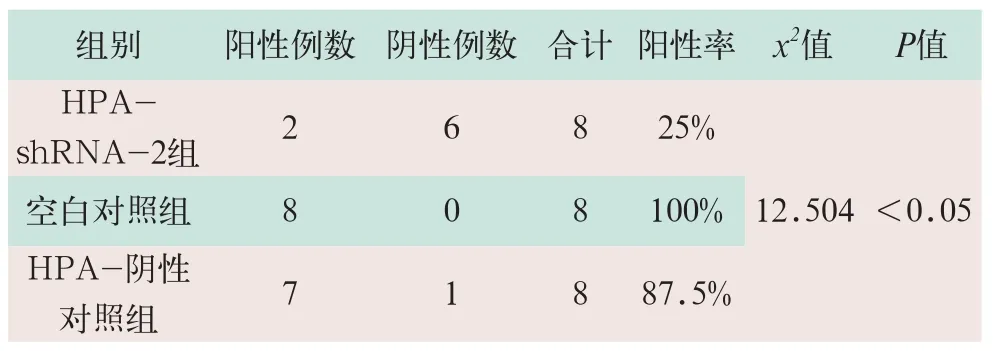
表2 体内实验乳腺癌HPA蛋白的表达
体内实验HPA-shRNA-2组有效抑制HPA基因蛋白表达如图8所示。
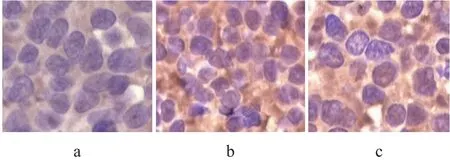
图8 HPA基因蛋白表达电镜图(×400)
3 讨论
近年来的研究表明,HPA基因在多种恶性肿瘤中高表达,如宫颈癌和子宫内膜癌及黑色素瘤等[2-4]。亦有研究表明,HPA基因在乳腺癌组织中高表达,而在癌旁正常组织呈低表达[5]。HPA作为葡萄糖醛酸酶,是唯一已知的哺乳动物糖类内切酶,能够降解细胞表面和细胞外基质的硫酸类肝素蛋白多糖促进肿瘤转移,并诱导肿瘤的血管生成和肿瘤周围的炎症反应,在大多数人类肿瘤中表达上调[6]。
肿瘤血管新生过程包括内皮细胞的迁移和增殖,是肿瘤增殖和迁移过程的重要组成部分,是多因子参与、多步骤的复杂过程,可作为判断恶性肿瘤转移的重要标志[7-8]。HPA是重要的细胞因子,促进肿瘤血管形成,其活性与肿瘤血管形成有关,参与血管内皮细胞迁移。硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycans,HSPG)是细胞膜和细胞外基质(extracellular matrixc,ECM)的主要成分,其结构中有硫酸乙酰肝素侧链,是生长因子和细胞因子的储存库[9]。肿瘤细胞能分泌HPA,HPA能降解HSPG的HS链,从而破坏细胞周围的阴离子和机械屏障,促进细胞因子,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)家族的蛋白水解作用[10]。VEGF是一种多功能细胞因子,在肿瘤血管形成过程中发挥重要作用,其能刺激静止的内皮细胞增殖和迁移,从而形成新的血管结构[11-12]。此外,VEGF还可以增强细胞外信号调节激酶的磷酸化作用,以提高内皮细胞的侵袭性和血管生成,HPA可以释放细胞膜和ECM中HS侧链储存的VEGF等细胞因子,其产生的HS片段可以促进细胞因子的活动,从而增加血管形成。HSPG与细胞增殖、分化和血管生成密切相关[13-15]。HS与促血管生成因子和抗血管生成因子相互作用,是重要的肿瘤血管形成调节器[16]。HPA裂解HS、基底膜并参与细胞外基质重构,从而促进肿瘤迁移和血管形成。HPA激活蛋白激酶B(protein kinase,PKB/Akt)信号通路,以促进内皮细胞迁移,激活Src(一种酪氨酸激酶)提高VEGF的表达水平,激活细胞外信号调节激酶(extracellular regulated kinases,ERK)以增加syndecan-1的脱落,脱落的syndecan-1反过来作用于肿瘤微环境,从而促进肿瘤生长、扩散和血管形成[17-20]。Syndecan由跨摸的HSPG组成,syndecan-1是其中一员[21]。VEGF与脱落的syndecan-1共同激活邻近内皮细胞的整合素和VEGF受体,从而促进肿瘤血管形成。由此可见,HPA与恶性肿瘤侵袭、转移以及肿瘤血管生成密切相关,成为研究阻止恶性肿瘤转移的新靶点。
细胞ERK调节肿瘤细胞增殖、耐药性和血管生成,ERK通路的超活化导致乳腺癌的发生和转移[22]。研究显示,ERK的磷酸化和HPA密切相关,而HPA和许多肿瘤的侵袭性相关,胰岛素受体广泛存在于HPA高表达或低表达的细胞中,与低表达的细胞相比,在HPA高表达的细胞中,胰岛素受体高度磷酸化。HPA在乳腺癌中高表达,并且高表达HPA的乳腺癌细胞胰岛素受体高度磷酸化,从而提高乳腺癌细胞的侵袭能力。HPA可以提高胰岛素受体底物(insulin receptor substrate,IRS)的表达水平,IRS调节蛋白连接乳腺癌中的胰岛素样生长因子1受体与下游信号通路,从而介导肿瘤细胞的增殖和转移,IRS在调节乳腺癌细胞中受体酪氨酸激酶活性的过程中发挥重要作用[23-24]。HPA激活Src(一种酪氨酸激酶)提高VEGF的表达水平,VEGF-A调控黏着斑激酶(focal adhesion kinase,FAK)或磷脂酰肌醇-3-羟激酶与蛋白激酶B(PI3K/Akt)信号通路,从而调节肿瘤细胞迁移和入侵[25]。FAK是一种胞质酪氨酸激酶,其位于整合素聚集的跨膜区域,调节多种细胞内信号转导通路,HPA增强信号级联作用,提高与侵袭性肿瘤恶化有关基因的转录水平[26-29]。
慢病毒载体是通过人类免疫缺陷病毒(human immunodeficiency virus,HIV-1)改造产生,传递遗传物质进入细胞,是目前基因转移的重要载体,其基因转染效率高,对分裂细胞和非分裂细胞都有感染能力,且具有安全、低毒和高稳定的特性[30-31]。RNAi技术是指在细胞内外源性或内源性双链RNA靶向诱导同源mRNA特异性降解,为转录后基因的沉默现象。RNAi可以参与固有免疫反应,从而使细胞免受病原体(如病毒和细菌)入侵,沉默同源目标靶基因的转录后表达[32]。RNAi通过不同的mRNA降解途径抑制目标基因的表达,RNAi主要通过三种方式进行基因调控:微小RNA、短发夹RNA和小干扰RNA[33]。本实验研究的RNA干扰方法是采用RNAi。慢病毒载体介导RNAi就是利用慢病毒载体的高效转染及整合特性与RNAi特异性沉默同源基因表达作用相结合。
本研究实验以乳腺癌HPA基因为靶基因,根据RNA干扰序列设计原则,构建3对HPA-shRNA重组慢病毒载体,在体外实验中,转染MDA-MB-231细胞,通过Western blot检测shRNA对HPA表达的抑制效果,表明实验HPA shRNA-1、HPA shRNA-2组均能够抑制HPA基因蛋白的表达。在体内实验中,实验HPA-shRNA-2组能够下调HPA基因蛋白的表达。本研究表明,以乙酰肝素酶为靶点构建的shRNA重组慢病毒表达载体,在体内外实验均能有效抑制乳腺癌HPA基因的表达,为乳腺癌的基因治疗提供新的靶点。
[1]Barash U,Cohen-Kapaln V,Dowek I,et al.Proteoglycans in health and disease:New concepts for heparanase function in tumor progression and metastasis[J].FEBS J,2010,277(19):3890-3903.
[2]Varchalama E,Rodolakis A,Strati A,et al.Quantitative analysis of heparanase gene expression in normal cervical,cervical intraepithelial neoplastic,and cervical carcinma tissues[J].Int J Gynecol Cancer,2009,19(9):1614-1619.
[3]Inamine M,Nagal Y,Hirakawa M,et al.Heparanase expression in endometrial cancer:analysis of immunohistochemistry[J].J Obstet Gynaecol,2008,28(6):634-637.
[4]Roy M,Marchetti D.Cell Surface Heparan Sulfate Released by Heparanase Promotes Melanoma Cell Migration and Angiogenesis[J].J Cell Biochem,2009,106(2):200-209.
[5]Theodoro TR,De Matos LL,Sant Anna AV,et al. Heparanase expression in circulating lymphocytes of breast cancer patients depends on the presence of the primary tumor and/or systemic metastasis[J].Neoplasia,2007,9(6):504-510.
[6]Purushothaman A,Babitz SK,Sanderson RD.Heparanase enhances the insulin receptor signaling pathway to activate extracellular signalregulated kinase in multiple myeloma[J].J Bilo Chem,2012,287(49):41288-41296.
[7]Park MS,Dong SM,Kim BR,et al.Thioridazine inhibits angiogenesis and tumor growth by targeting the VEGFR-2/PI3K/mTOR pathway in ovarian cancer xenografts[J].Oncotarget,2014,5(13):4929-4934.
[8]Chen Z,Xu S,Xu W,et al.Expression of cluster of differentiation 34 and vascular endothelial growth factor in breast cancer,and their prognostic significance[J].Oncol Lett, 2015,10(2):723-729.
[9]Lv B,Zhang B,Hu XY,et al.Heparanase regulates in vitro VEGF-C expression and its clinical significance to pancreatic ductal cell adenocarcinoma[J]. Oncol Lett,2016,11(2):1327-1334.
[10]Hammond E,Khurana A,Shridhr V,et al.The Role of Heparanase and Sulfatases in the Modification of Heparan Sulfate Proteoglycans within the Tumor Microenvironment and Opportunities for Novel Cancer Therapeutics[J].Front Oncol,2014,4:195-210.
[11]Benedetto MD,Toullec A,H Buteaulozano,et al. MDA-MB-231 breast cancer cells overexpressing single VEGF isoforms display distinct colonisation characteristics[J].Br J Cancer,2015,113(5):773-785.
[12]Liu L,Tong Q,Liu S,et al.ZEB1 Upregulates VEGF Expression and Stimulates Angiogenesis in Breast Cancer[J].PloS One,2016,11(2):e0148774.
[13]Zachary I.VEGF signalling:integration and multitasking in endothelial cell biology[J].Biochem Soc Trans,2003,31(6):1171-1177.
[14]Purushothaman A,Uyama T,Kobayashi F,et al. Heparanase-enhanced shedding of syndecan-1 by myeloma cells promotes endothlial invasion and angiogenesis[J].Blood,2010,115(12):2449-2457.
[15]Qiang B,Lim SY,Lekas M,et al.Perlecan heparan sulfate proteoglycan is a critical determinant of angiogenesis in response to mouse hind-limb ischemia[J].Can J Cardiol,2014,30(11):1444-1451. [16]van Wijk XM,van Kuppevelt TH.Heparan sulfate in angiogenesis:a target for therapy[J].Angiogene sis,2014,17(3):443-462.
[17]Gingisvelitski S,Zetser A,Flugelamn MY,et al. Heparanase induces endothelial cell migration via protein kinase B/Akt activation[J].J Biol Chem,2004,279(24):23536-23541.
[18]Zetser A,Bashenko Y,Edovitsky E,et al.Heparanase induces vascular endothelial growth factor expression:correlation with p38 phosphorylation levels and Src activation[J].Cancer Res,2006,66(3):1455-1463.
[19]Purushothaman A,Chen L,Yang Y,et al.Heparanase stimulation of protease expression implicates it as a master regulator of the aggressive tumor phenotype in myeloma[J].J Biol Chem,2008,283(47):32628-32636.
[20]Purushothaman A,Uyama T,Kobayashi F,et al. Heparanase-enhanced shedding of syndecan-1 by myeloma cells promotes endothelial invasion and angiogenesis[J].Blood,2010,115(12):2449-2457.
[21]Waisberg J,Theodoro TR,Matos LL,et al.Immunohistochemical expression of heparanase isoforms and syndecan-1 proteins in colorectal adenomas[J]. Eur J Histochem,2016,60(1):2590.
[22]Ho JY,Hsu RJ,Wu CH,et al.Reduced miR-550a-3p leads to breast cancer initiation,growth,and metastasis by increasing levels of ERK1 and 2[J]. Oncotarget,2016,7(33):53853-53868.
[23]Becker MA,Ibrahim YH,Oh AS,et al.Insulin Receptor Substrate Adaptor Proteins Mediate Prognostic Gene Expression Profiles in Breast Cancer[J].PLoS One,2016,11(3):e0150564.
[24]Shaw LM.The insulin receptor substrate(IRS) proteins:At the intersection of metabolism and cancer[J].Cell Cycle,2011,10(11):1750-1756.
[25]Choi SK,Kim HS,Jin T,et al.Overexpression of the miR-141/200c cluster promotes the migratory and invasive ability of triple-negative breast cancer cells through the activation of the FAK and PI3K/AKT signaling pathways by secreting VEGF-A[J]. BMC Cancer,2016,16(1):570-584.
[26]Gao SL,Wang SL,Liu HY,et al.miR-200a inhibits tumor proliferation by targeting AP-2γ in neuroblastoma cells[J].Asian Pac J Cancer Prev,2014,15(11):4671-4676.
[27]Zhao X,Guan JL.Focal adhesion kinase and its signaling pathways in cell migration and angiogenesis[J].Adv Drug Deliv Rev,2011,63(8):610-615.
[28]Ilan N,Elkin M,Vlodavsky I.Regulation,function and clinical significance of heparanase in cancer metastasis and angiogenesis[J].Int J Biochem Cell Biol,2006,38(12):2018-2039.
[29]Fuxl L,Ilan N,Sanderson ED,et al.Heparanase:busy at the cell surface[J].Trends Biochem Sci,2009,34(10):511-519.
[30]Masoud N,Karimi A,Allahbakhshian Farsani M.Production,purification and titration of a lentivirus-based vector for gene delivery purposes[J]. Cytotechnology,2014,66(6):1031-1038.
[31]Vannucci L,Lai M,Chiuppesi F,et al.Viral vectors:a look back and ahead on gene transfer technology[J].New Microbiol,2013,36(1):1-22.
[32]Ozcan G,Ozpolat B,Coleman RL,et al.Preclinical and clinical development of sh-RNA-based therapeutics[J].Adv Drug Deliv Rev,2015,87:108-119.
[33]Khatri N,Rathi M,Baradia D,et al.In vivo delivery aspects of miRNA,shRNA and shRNA[J]. Crit Rev Ther Drug Carrier Syst,2012,29(6):487-527.
Inhibitive effect of lentiviral vector carried shRNA for the expression level of HPA genes of breast cancer/
CHEN Guo-li, ZHENG Zhi-fang, ZHANG Xue-jun, et al//China Medical Equipment,2017,14(6):150-155.
Objective: To construct short hairpin RNA (shRNA) lentiviral expression vector by choosing HPA genes as the targeting point so as to investigate the inhibitive effect of lentiviral vector carryed shRNA for the expression level of heparanase (HPA) genes of breast cancer. Methods: The HPA genes were chosen as target gene, 3 pairs expression vectors of recombinant lentivirus carried shRNA were constructed according to the sequence designed principle of interfering RNA (RNAi) were transfected in MDA-MB-231 cell of breast cancer. Western Blot was used to detect the expression level of HPA gene in vitro, and the breast cancer model was constructed for vivo verification, and then the expression level of HPA gene was detected by using immunohistochemistry. Results: In vitro experiment, both of the HPA-shRNA-1 group and HPA-shRNA-2 group effectively inhibited the expression of HPA gene in MDA-MB-231 cells of breast cancer. In vivo experiment, the expression of HPA gene of HPA-shRNA-2 group was obviously lower than that of negative group and blank group. The difference of positive rate between HPA-shRNA-2 group and blank group was statistically significant (x2=12.504, P<0.05). And these results revealed that the expression of HPA gene in HPA-shRNA-2 group could be down-regulated in vivo experiment. Conclusion: The HPA is chosen as the targeting point to construct recombinant lentiviral vector carried shRNA, and the results of vitro and vivo experiment reveals that the expression of HPA gene can be down-regulated in the two groups. This result verifies that the new method can provide new targeting point for targeted therapy of breast cancer.
Breast cancer; HPA; shRNA; MDA-MB-231 cell; Immunohistochemistry; Western Blot
Department of The First Surgery, Affiliated Hospital of Chengde Medical University, Chengde 067000, China.
10.3969/J.ISSN.1672-8270.2017.06.042
[文章编号] 1672-8270(2017)06-0150-06 [中图分类号] R-332 [文献标识码] A
陈国利,男,(1980- ),硕士研究生,主治医师。承德医学院附属医院外一科,从事乳腺癌基础与临床研究。
2017-02-28
承德市科学技术研究与发展计划项目(20151029)“探讨以HPA为靶点治疗乳腺癌可行性”
①承德医学院附属医院外一科 河北 承德 067600
②承德医学院附属医院小儿内科 河北 承德 067000
③承德市平泉县医院药剂科 河北 平泉 067500
④承德市隆化县医院外二科 河北 隆化 068150
*通讯作者:chenguoli1015@126.com
