超声引导下射频消融与大功率微波消融治疗中晚期肝癌的疗效对比研究
2017-06-21杨李红云刘从明
李 杨李红云刘从明
超声引导下射频消融与大功率微波消融治疗中晚期肝癌的疗效对比研究
李 杨①*李红云①刘从明①
目的:比较超声引导下经皮射频消融(RFA)与大功率微波消融(MWA)在治疗中晚期原发性肝癌中的临床疗效。方法:选择符合入组标准的60例原发性肝癌确诊患者,采用数表法将其随机分为射频治疗组(RFA组)和微波治疗组(MWA组),每组30例。比较两组患者术后病灶完全缓解率、1年生存率、1年无进展生存率及术后不良反应、并发症情况。结果:RAF组和MWA组术后总完全缓解率分别为66.7%和76.7%,两组比较差异有统计学意义(x2=3.776,P<0.05);当病灶≥5 cm时RFA组和MWA组的完全缓解率分别为41.7%和63.6%,两组比较差异有统计学意义(x2=4.231,P<0.05);当病灶在3~5 cm时RFA组和MWA组完全缓解率分别为75.0%和81.2%,两组比较差异无统计学意义(x2=0.976,P>0.05)。RAF组术后并发症3例,MWA组术后并发症5例,两组比较差异有统计学意义(x2=3.373,P<0.05);两组术后均未出现与治疗相关的死亡病例。RAF组1年总生存率和无进展生存率分别为90.0%和53.3%,MWA组分别为86.7%和60.0%,两组比较差异无统计学意义(x2=0.877,P>0.05)。结论:对于较大病灶或多发病灶的中晚期原发性肝癌,大功率MWA治疗后的病灶完全缓解率优于RAF,但两者1年内总生存率和无进展生存率无明显差异,且大功率MWA组的术后不良反应发生率高于RAF组。
原发性肝癌;射频消融;微波消融;疗效;超声引导
原发性肝癌是位居我国第三位的常见恶性肿瘤,目前首选的治疗方案为手术切除,但因其恶性程度高,手术切除率低,确诊时80%肝癌患者已属于中晚期,只有20%的患者可获得手术机会[1-2]。因此,目前我国大部分肝癌患者以接受药物治疗、局部介入治疗及其他非手术治疗方式为主。近年来,以射频消融(radiofrequency ablation,RFA)和微波消融(microwave ablation,MWA)为代表的热消融技术迅速发展,因其疗效确切,安全性高,适用范围广,已成为中晚期肝癌局部治疗的主要治疗手段之一[3]。临床实践已经证明,RFA治疗小肝癌(<3 cm)可获得与手术切除相当的治疗效果,已用于肝癌的治疗[4]。MWA技术以其热效率高、热场分布均匀、升温稳定及疗效可靠等优势,已成为当前肝癌热消融治疗的另一重要手段[5-6]。本研究采用随机对照的研究方法,探讨超声引导下RFA和大功率MWA在较大中晚期肝癌治疗中的应用,比较两种治疗方法的临床疗效。
1 资料与方法
1.1 一般资料
选取2014年1月至2015年12月期间在凉山州第一人民医院接受治疗的60例原发性肝癌患者,采用数表法将其随机分为射频治疗组(RFA组)和微波治疗组(MWA组),每组30例。RFA组中男性25例,女性5例;年龄37~71岁,平均年龄(58±6)岁;共48枚病灶,其中3.0~5.0 cm为36个,≥5 cm为12个。MWA组中男性24例,女性6例;年龄40~75岁,平均年龄(61±8)岁;共43枚病灶,其中3.0~5.0 cm为32个,≥5 cm为11个。两组患者的一般资料及术前肝功能情况相比无差异,具有可比性。本研究符合医学伦理学标准,并通过医院伦理委员会批准,所有治疗均取得患者及家属的知情同意,并签署知情同意书。
1.2 纳入与排除标准
(1)纳入标准:①患者均符合2013年美国国立综合癌症网(national comprehensive cancer network,NCCN)肝癌临床实践指南的原发性肝癌诊断标准,并通过增强CT或MRI明确肿瘤数目、大小及位置和进行肝功能检查;②单病灶≥3 cm或多病灶;③无肝外转移、门静脉主干及左右分支主干癌栓;④肝功能分级(Child-Pugh)为A和B;⑤未接受过手术或介入治疗;⑥无其他严重疾病。
(2)排除标准:①合并严重的心脑血管疾病、甲状腺功能亢进症及糖尿病等;②合并其他恶性肿瘤;③腹部检查示大量积液者。
1.3 仪器设备
RF2000型射频治疗系统(美国Radiotheraprutic公司);Eco-100c型智能微波治疗仪(南京亿高微波系统工程有限公司);GE Vivid 7型彩色多普勒超声诊断仪(美国通用电气公司);GE HiSpeed型CT(美国通用电器公司)。
1.4 治疗方法
所有患者治疗前行血常规、肝肾功能、凝血功能以及AFP化验;两组患者无禁忌分别行1次RFA或大功率MWA(80~100 W)治疗,原则上一次治疗覆盖全部病灶,消融区超出瘤体0.5~1.0 cm。若患者首次消融治疗无法覆盖全部病灶,2周内再次对残余病灶施行同种方式补充治疗,治疗后给于保肝对症治疗,待4周后行增强CT评价治疗效果。
1.4.1 RFA治疗
RFA组采用RF2000型射频治疗系统,最大输出功率100 W。超声下明确穿刺位置及深度,根据肿瘤大小决定电极数目,合理布针,刺入肿瘤后逐步展开电极针进行消融,每点治疗12 min左右,对较大病灶进行分层多点叠合消融,消融范围大于病灶范围0.5 cm,手术期间进行心电、血压监护,密切观察患者生命体征变化。治疗结束时进行针道消融,防止术后针道出血或肿瘤种植。
1.4.2 MWA治疗
使用Eco-100c智能微波治疗仪,输出功率为10~100 W,微波频率为2450 MHz。经超声引导,选择最佳进针部位和途径后,将冷循环微波天线穿刺到肿瘤预定部位,根据肿瘤大小,选择80~100 W不同功率及作用时间(6 min左右)对肿瘤组织进行大功率微波消融。手术期间进行动态心电、血压监护,密切观察患者生命体征变化。辐射最远点应至肿瘤外周0.5 cm。
1.5 疗效指标及随访
(1)完全缓解率。①联合治疗后4周行增强CT扫描判断疗效,原病灶区域呈低密度且无增强定义为完全缓解率;②肝功能:热消融治疗前及治疗后24~72 h检查肝功能所有指标;③进展及生存情况。
(2)疗效判断。两组患者在消融治疗后24~48 h化验肝功能,并给予保肝治疗。术后4周复查增强CT,评价治疗效果:①病灶完全坏死表现为低密度无增强区域;②局部残留表现为病灶周围有局部增强;③对于有未完全灭活或残留的病灶给予补充治疗。随后每2~3个月复查增强CT,明确复发及转移情况。
(3)随访。随访患者1年内肿瘤进展情况和患者存活情况。在原消融灶或周边2 cm内重新出现新发病灶诊断为局部复发,发生在肝脏其他部位则定义为新发肿瘤,其他器官出现肿瘤定义为转移,记录其发生时间,无进展者随访时间至术后1年。
1.6 统计学方法
采用SPSS20.0计量软件对研究数据进行统计学处理,计量资料结果以均值±标准差(x-±s)表示,两组比较采用t检验,率的比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗效果比较
两组患者治疗后在肿瘤≥5 cm时RAF组完全缓解率为66.7%,MWA组完全缓解率为76.7%,MWA组完全缓解率较RAF组高,差异有统计学意义(x2=4.321,P<0.05),在肿瘤大小为3~5 cm时两组完全缓解率差异无统计学意义(x2=0.976,P>0.05),见表1。

表1 两组患者治疗后完全缓解率比较[枚(%)]
2.2 两组患者不良反应及并发症比较
两组患者在治疗后均有不同程度腹痛、恶心、呕吐及发热等不良反应,经对症支持治疗后均可好转。RFA组治疗后出现并发症3例,其中1例为术后肝脓肿,经穿刺引流、抗感染治疗后好转,1例为术后肝功能不全,腹腔积液,经保肝、补充白蛋白治疗后好转,1例胸腔积液。MWA组治疗后出现并发症5例,其中4例为术后肝功能不全,腹腔积液,经保肝、补充白蛋白治疗后好转,1例为肝包膜下血肿,经保守治疗后好转。MWA组不良反应及并发症明显高于RFA组,两组比较差异有统计学意义(x2=3.373,P<0.05),见表2。
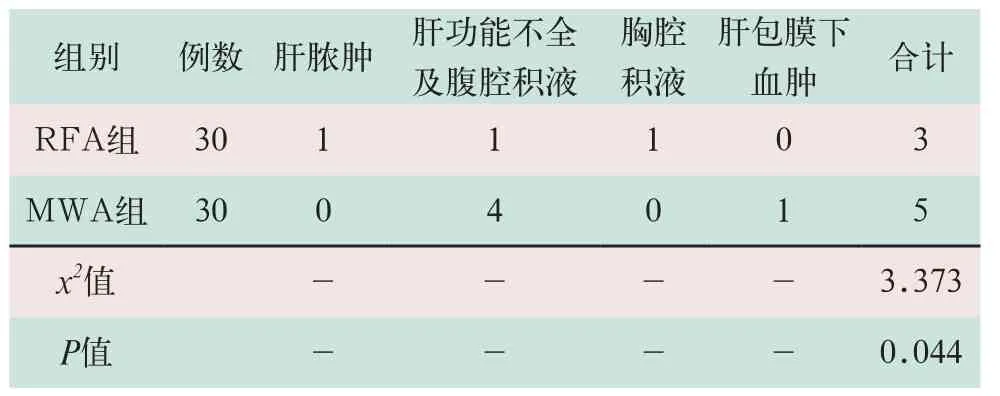
表2 两组患者治疗后并发症比较(例)
2.3 两组患者术后随访情况
对两组患者术后进行为期12个月的随访,随访期内RFA组死亡3人,1年总生存率为90%,其中无进展生存16人,无进展生存率为53.3%;MWA组死亡4人,1年总生存率为86.7%,其中无进展生存18人,无进展生存率为60.0%,两组比较差异无统计学意义(x2=0.877,P>0.05)。
3 讨论
我国多数原发性肝癌患者在确诊时已属中晚期,或因肝脏储备功能不足而无法获得手术治疗机会[7-9]。局部热消融治疗为这些患者开辟了新的治疗机会,已成为中晚期肝癌姑息治疗和联合治疗中的重要组成部分,能够起到灭活肿瘤、控制肿瘤生长及延长生存期的作用。热消融治疗肝癌的作用原理基于射频或微波的热效应及肝肿瘤组织对热量的敏感反应[10]。肿瘤是否灭活取决于局部治疗温度和持续时间,当温度达到50~55 ℃并持续4~6 min时,可使肿瘤组织发生凝固性坏死,60~100 ℃时则即刻凝固坏死,使一定范围内的病灶毁损,切断肿瘤血供并防止肿瘤转移[11]。在治疗后的一段时间内,由于肿瘤组织的内部微血管损伤、缺血再灌注损伤、细胞凋亡的诱导、Chuffer细胞活化、细胞因子表达改变和激发免疫反应等多种机制导致肿瘤组织的进一步坏死[12-14]。
RFA对于肿瘤直径<3 cm的小肝癌,疗效确切,已成为一线治疗方法,但对于较大肿瘤因受消融范围限制,及肿瘤内部血流可带走大部分热量,使局部温度无法达到要求,导致肿瘤残存[15]。在临床应用中可通过分层多点叠合消融的方式扩大消融范围,提高治疗效果。与RFA相比,MWA过程中不受组织电阻率和炭化的影响,因此具有更高的消融温度和更大的消融范围,被越来越多的应用于肝癌治疗[16-17]。现阶段,低功率(60 W左右)MWA治疗肝癌的文献报道较多,Bhardwaj等[18]报道,在小肝癌的治疗中与RFA具有相似的治疗效果,但对于体积较大的肝癌,为了增大消融范围,治疗中需增大功率及延长消融时间,会因电极杆温过高而灼伤皮肤,因而限制增大功率以获得更大消融范围的设想。随着硬质水冷微波的出现,降低了杆温而且还增大了消融体积,为大功率消融在较大肝癌中的应用提供了技术上的支持。张宁宁等[19]报道,MWA技术与RFA技术比较,其优势显著,对于>5 cm的较大肝癌,大功率MWA治疗的完全坏死率高于RFA治疗。但相关报道较少,其可行性、安全性及有效性还需进一步证实。
本研究使用超声引导热消融治疗,其优势为根据肿瘤的位置,患者可灵活摆放体位,可根据肿瘤的大小和形状调整电极位置进行适形治疗,当肿瘤较大时可行多位点消融治疗,且具有无放射性损伤,操作简单、安全性高等优点。本研究对比了RFA和大功率MWA两种消融技术治疗中晚期肝癌的近期临床疗效。RFA治疗组和MWA治疗组的总体完全坏死率分别为66.7%和76.7%,有明显统计学差异。当病灶为3~5 cm时,两组的完全坏死率分别为75.0%%和81.2%,两者无明显统计学差异;当病灶≥5 cm时,两组完全缓解率分别为41.7%和63.6%,两者有明显统计学差异。研究数据显示,MWA治疗后病灶的完全缓解率高于RFA,考虑与MWA消融范围大,且在治疗过程中不受组织电阻率和炭化的影响,治疗范围内均可达到有效的治疗温度,保证治疗其治疗效果。两组患者在治疗后均有不同程度腹痛、恶心、呕吐及发热等不良反应,经对症治疗后可好转,但MWA组术后并发症较RAF组增加,主要表现在术后肝功能不全,分析原因可能与MWA功率高、升温快,消融范围大,坏死组织较多,对治疗范围的控制也不及RFA有关。但上述不良反应、并发症仅表现在术后短期内,经保守治疗后均可好转[20]。从随访情况看,虽然WMA的局部治疗效果优于RAF,但两组1年总生存率接近,分别为90%和86.7%,1年无进展生存率两组分别为53.3%和60%,WMA组稍高于RFA组,但差异无明显统计学意义,考虑与本研究入组病例较少,随访时间较短有关,未显示出MWA治疗对长期生存的优势。
MWA技术较RFA技术在较大肝癌治疗中具有优势,尤其在肿瘤>5 cm时优势明显,但由于MWA会造成更大的肝损伤和较高的术后并发症发生率,术前应充分评估患者肝功能状态,并在治疗后给予充分保肝治疗。
[1]McWiuims JP,Yammoto S,Raman SS,et al. Percutaneous ablation of hepatocellular carcinoma:current status[J].J Vasc Interv Radiol,2010,2l(8 Suppl):S204-S213.
[2]Saraswat VA,Pandey G,Dhetty s.Treatment algorithms for managing hepatocellular carcinoma[J].J Clin Exp Hepatol,2014,4(suppl 3):S80-S89.
[3]Itoh S,Ikeda Y,Kawanaka H,et al.Efficacy of surgical microwave therapy in patients with unresectable hepatocellular carcinoma[J].Ann Surg Oncol,2011,18(13):3650-3656.
[4]Bruix J,Sherman M.AASLD Practice Guideline:Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020-1022.
[5]Dong B,Liang P,Yu X,et a1.Percutaneous sonographically guided microwave coagulation therapy for hepatocellular carcinoma:results in 234 patients[J].AJR Am J Roentgenol,2003,180(6):1547-1555.
[6]吕明德,徐辉雄,匡铭,等.改进微波消融技术治疗肝癌的研究[J].中国实用外科杂志,2004,24(11):678-680.
[7]万平,夏强,张建军,等.活体肝移植治疗原发性肝癌的中长期随访[J].实用器官移植电子杂志,2013,l(6):333-338.
[8]张庆,陈虹,田彦,等.进展期肝癌肝移植术后采用FOLF0x7方案辅助化疗的疗效观察[J].实用器官移植电子杂志,2013,1(2):75-81.
[9]沈中阳.客观认识肝移植适应证[J].中华危重病急救医学,201l,23(7):385.
[10]Yang WZ,Jiang N,Huang N,et al.Combined therapy with transcatheter arterial chemoembolization and percutaneous microwave coagulation for small hepatocellular carcinoma[J]. World J Gastroenterol,2009,15(6):748-752.
[11]古琼芳,周懂晶,李益红,等.超声引导下微波与射频消融治疗肝肿瘤的临床疗效比较[J].医学理论与实践,2010,23(6):683-684.
[12]Nikfarjam M,Malcontenti-Wilson C,Christophi C.Focal hyperthermia produces progressive tumor necrosis independent 0f the initial thermal effects[J].J Gastrointest Surg,2005,9(3):410-417.
[13]李书芹,杨志勇,季艳霞.等.微波消融治疗对晚期肝癌患者免疫功能的影响[J].肿瘤研究与临床,2008,20(6):411-413.
[14]Dang BW,Zhang J,Liang P,et al.Sequential pathological and immunologic analysis of percutaneous microwave coagulation therapy of hepatocellular carcinoma[J].Int J Hypertherm ia,2003,19(2):119-133.
[15]刘玉海.多层螺旋CT评估肝癌射频消融术后肿瘤灭活的临床价值[J].中国医学装备,2016,13(2):77-79,80.
[16]Li X,Zhang L,Fan W,et al.Comparison of microwave ablation and multipolar radiofrequency ablation,both using a pair of internally cooled interstitial applicators:Results in ex vivo porcine livers[J].Int J Hyperthermia,2011,27(3):240-248.
[17]Liang P,Wang Y,Yu XL,et al.Malignant liver tumors:treatment with percutaneous microwave ablation-complications among cohort of 1136 patients[J].Radiology,2009,251(3):933-940.
[18]Bhardwaj N,Strickland AD,Ahmad F,et al. Liver ablation techniques:a review[J].Surg Endosc,2010,24(2):254-265.
[19]张宁宁,程晓静,刘建勇,等.大功率微波与射频消融治疗较大肝癌的近期疗效研究[J].实用肿瘤杂志,2014,29(4):349-356.
[20]田利玲,黄涛,文达辉,等.超声造影在肝肿瘤定性及射频消融治疗效果中的评价[J].中国现代医生,2013,51(34):90-92.
Comparative study of radiofrequency ablation under ultrasound guidance and high power microwave ablation in the treatment of intermediated or advanced-staged liver cancer/
LI Yang, LI Hong-yun, LIU Cong-ming//China Medical Equipment,2017,14(6):74-77.
Objective: To compare the clinical efficacy of percutaneous radiofrequency ablation (RFA) under ultrasound guidance and high power microwave ablation (MWA) in the treatment of intermediated or advancedstaged primary liver cancer. Methods: 60 patients with primary liver cancer who were in accordance with the inclusion criteria were divided into radiofrequency ablation group (RFA group, 30 cases) and microwave ablation group (MWA group, 30 cases). A series indicators, such as postoperative complete remission rate of lesion, 1 year survival rate, 1 year progression-free survival rate, postoperative adverse reaction and postoperative complication, for these patients of two groups were compared and analyzed. Results: The total complete remission rate of the RAF group and the MWA group were 66.7% and 76.7%, respectively, and the difference between them was significant (x2=3.776, P<0.05). When the lesion was larger than 5 cm, the complete remission rate of RFA group and MWA group were 41.7% and 63.6%, respectively, and the difference between them was significant (x2=4.231, P<0.05). When the lesion was between in 3-5 cm, the complete remission rate of RFA group and MWA group were 75.0% and 81.2%, respectively, while the difference between them was no significant (x2=0.976, P>0.05). For postoperative complication, there were 3 cases in RAF group while there were 5 cases in MWA group, and the difference between them was significant (x2=3.373, P<0.05). There was no death case that was related with treatment in the two postoperative groups. The 1 year survival rate and 1 year progression-free survival rate of RAF group were 90.0% and 53.3%, respectively, and that of MWA group were 86.7% and 60.0%, and the difference between them was no significant (x2=0.877, P>0.05). Conclusion: For intermediated or advanced-staged primary liver cancer with the larger or multiple lesions, complete remission rate of high-power MWA group is better than that of RAF. But there was no significant difference for 1 year total survival rate and 1 year progression-free survival rate between the two groups, respectively. And the postoperative adverse reaction of high-power MWA group was higher than that of RAF group.
Primary liver cancer; Radiofrequency ablation; Microwave ablation; Curative effect; Ultrasound guidance
Department of Oncology, The First People's Hospital of Liangshan Yi Autonomous Prefecture, Liangshan 615000, China.
10.3969/J.ISSN.1672-8270.2017.06.021
1672-8270(2017)06-0074-04
R735.7
A
李杨,女,(1977- ),本科学历,主治医师。凉山州第一人民医院肿瘤科,从事肿瘤的诊治工作。
2017-02-11
①凉山州第一人民医院肿瘤科 四川 凉山 615000
*通讯作者:liyang197707@126.com
