经皮肺穿刺氩氦刀靶向治疗老年原发性肺部恶性肿瘤的临床观察
2017-06-21伏婷婷张宝和徐洪涛韩志海段蕴铀聂舟山王吉温居一
伏婷婷张宝和徐洪涛韩志海段蕴铀聂舟山王 吉温居一
[文章编号] 1672-8270(2017)06-0069-05 [中图分类号] R734.2 [文献标识码] A
经皮肺穿刺氩氦刀靶向治疗老年原发性肺部恶性肿瘤的临床观察
伏婷婷①张宝和①徐洪涛①韩志海②段蕴铀②聂舟山②王 吉①温居一③
目的:探讨经皮肺穿刺氩氦刀靶向治疗老年原发性肺部恶性肿瘤的临床疗效和安全性。方法:对227例70岁以上原发性肺部恶性肿瘤患者的230个病灶行经皮肺穿刺氩氦刀靶向冷冻消融治疗,术后即刻观察不同直径的肿瘤冰球覆盖情况,按实体瘤评价标准评价疗效,动态观察肺部肿瘤治疗前后的变化、并发症和生存率。结果:氩氦刀靶向治疗后肿瘤直径<4 cm的90个冰球覆盖率为(98.6±0.4)%,肿瘤直径>4 cm的140个冰球覆盖率为(90.3±5.4)%,两种不同直径的肿瘤冰球覆盖率比较,其差异有统计学意义(t=4.69,P<0.01)。术后1个月、3个月、6个月和12个月的有效缓解率(CP+PR)分别为56.4%、56.2%、55.4%和53.9%,组间比较差异均无统计学意义(x2=3.705,x2=3.500,x2=1.604,x2=0.935;P>0.05)。所有患者治疗过程安全,无死亡病例,术后发热81例(占35.7%),咯血31例(占13.7%),气胸18例(占7.9%),胸腔积液14例(占6.2%),冷休克1例,经对症处理恢复正常。随访6个月、1年、2年和3年,患者生存率分别为89%、68%、26%和12%, 中位生存时间14个月。结论:CT引导下经皮穿刺氩氦刀靶向治疗肺部肿瘤对老年患者是一种有效、安全的治疗方法。
氩氦刀; 冷冻消融; 老年;肺部肿瘤
肺癌是临床上常见的恶性肿瘤,多数患者确诊时已到中晚期,失去外科手术治疗的机会,尤其是老年肺癌患者,全身基础疾病较多,或存在其他症状不明显的潜在疾病,身体健康状况和营养状况导致患者无法耐受外科手术、放射治疗及化疗等,且患者或家庭对疾病的认识不足,担心外科手术、放化疗的风险而拒绝手术或放化疗治疗。随着冷冻技术的发展,冷冻微创手术已经逐渐应用于实体肿瘤的治疗。近年来,氩氦刀靶向治疗以其高精准度、创伤小、出血少、并发症少、操作安全和简单而在肺癌、肝癌、肾癌以及前列腺癌的治疗中广泛应用[1-5]。对于无法耐受或拒绝外科手术的患者,可选择氩氦刀冷冻微创治疗。为此,本研究对227例70岁以上的老年肺部原发恶性肿瘤患者,在CT引导下经皮肺穿刺行氩氦刀靶向治疗,探讨氩氦刀靶向治疗老年原发性肺部恶性肿瘤的临床疗效和安全性。
1 资料与方法
1.1 一般资料
回顾性分析2001年7月至2016年4月在海军总医院院呼吸内科住院的单纯接受CT引导下经皮穿刺氩氦刀靶向治疗的227例70岁以上原发性肺癌患者,其中男性162例,女性65例;年龄70~95岁,平均年龄(76.1±4.6)岁;腺癌150例,鳞癌70例,腺鳞癌4例,小细胞肺癌3例;Ⅰ~Ⅱ期20例,Ⅲ期139例(Ⅲa期40例,Ⅲb期99例),Ⅳ期68例。Ⅰ~Ⅲa期中12例拒绝外科开胸手术治疗,48例因心脏、肺功能差、或合并其他基础疾病无法耐受手术。中央型肺癌82例,周围型肺癌145例。单次冷冻治疗214例次,双次冷冻治疗12例次,3次以上冷冻1例次。瘤体直径<4 cm的患者共87例(90个肿瘤),其中直径0.8~2 cm的11例,直径2~4 cm的76例(79个肿瘤);瘤体直径>4 cm的患者共140例(140个肿瘤),其中直径4~6 cm的116例,直径6~8 cm的22例,直径8.7 cm的1例,直径11 cm的1例。所有患者均经病理确诊并签署知情同意书。
1.2 纳入与排除标准
(1)纳入标准:①年龄>70岁;②经病理证实为肺部恶性肿瘤者;③全身状况较差、不能耐受外科手术治疗或放化疗者;④有手术适应证,但拒绝外科手术治疗者;⑤外科手术无法切除的肿瘤;⑥拒绝放化疗者。
(2)排除标准:①肺功能差、最大通气量<39%,剧烈咳嗽,无法配合手术体位,有严重出血倾向;②肿瘤位置不易穿刺或穿刺冷冻过程极易损伤重要血管脏器者;③原发病灶显示不清,双肺弥漫性癌肿,胸膜广泛转移,有大量胸水。
1.3 仪器与材料
(1)采用CYROCARETM 24型氩氦刀设备的超导冷冻治疗系统(美国Endocare公司),配有4把直径为2 mm、3 mm、5 mm和8 mm规格的冷热绝缘超导刀,其内为中空。可输出高压常温氩气(冷媒)或高压常温氦气(热媒),高压常温氩气(冷媒)的温度可在十余秒内达到-100~-145 ℃,并恒定在-120~-150 ℃;刀尖的冷冻温度由温差电偶监测。Somatom螺旋CT机(德国Siemens公司)。M8002A型心电监护仪(荷兰Philips公司)。
(2)自制定位器,由一排间距为3 mm的等距铅丝制成。恒温毯,预防冷休克。
1.4 治疗方法
1.4.1 术前准备
所有患者入院后完善术前常规检查并包括肺功能检查及动脉血气分析,根据患者基础疾病监测血压、血糖、血氧或心电图等。无手术禁忌,于术前1 d嘱患者锻炼体位,保持手术体位30~60 min,并练习憋气至少15 s。术前2 d经过由医院呼吸内科、胸外科、放疗科、放射科和病理科主任组成的胸部肿瘤会诊中心进行会诊,明确氩氦刀靶向手术治疗对该患者的可行性。
1.4.2 治疗方案
术前1 d根据影像资料中肿瘤及周围组织结构的三维立体解剖关系,注意需避开支气管、重要血管,制订合理的氩氦刀手术方案,初步确定术中患者体位(根据进针点,采用平卧位、俯卧位或侧卧位)、氩氦刀型号及数量、进针角度、进针深度、针尖所在肿瘤的靶点位置和冷冻范围(冰球大小)。靶点选择在肿瘤的边缘处,对于较小的肿瘤可选择单刀冷冻方案,对于较大的肿瘤可选择以3 mm冷刀为主的多刀组合冷冻方案,肿瘤周围远离重要血管、支气管和脏器,使用5 mm冷刀冷冻效果更好。冰球的冷冻范围应超过肿瘤边缘1 cm。对于>6 cm的肿瘤,根据患者的基础疾病及术中耐受情况决定冰球大小,冰球若无法一次包裹肿瘤需待患者术后恢复再行二次或多次冷冻治疗。
1.4.3 手术方法
经皮穿刺定位点给予5%利多卡因10~30 ml局部浸润麻醉。对于氩氦刀进针困难的老年患者,可在穿刺点处切开皮肤0.3~0.5 cm。根据术前CT定位所测量的进针方向、角度和层面,将氩氦刀穿刺针迅速刺入肿瘤靶点,再行CT扫描观察针尖是否到达预定位置并做深度或角度的微调,较大瘤体可同时插入多个氩氦刀。当氩氦刀前端冷冻至-140 ℃,冰球温度至-40 ℃左右时,维持15 min后关闭氩气冷冻系统,开启氦气复温系统。复温至40 ℃,维持15 min,再重复冷冻第二个循环。再次行CT扫描,以确定冰球是否包绕整个肿瘤,并观察冰球边缘是否超出肿瘤边缘。当氦气复温至>0 ℃时,氩氦刀与冰球松动后即可拔出氩氦刀。局部压迫止血,加压包扎。术后行常规CT扫描,了解冷冻效果、冰球大小、覆盖病灶的百分比以及有无气胸、出血等并发症,如发现大量气胸,立即给于胸腔穿刺抽气。
1.4.4 术后处理
手术当日平卧6 h,持续低流量吸氧,心电监护监测生命体征,观察患者有无咯血、发热、胸痛、寒战及呼吸困难等表现,警惕气胸、冷休克的发生。对于肿瘤>6 cm的老年患者、术后剧烈咳嗽导致气胸的患者或术中已出现大量气胸的患者,术后常规入监护室观察1 d。常规使用抗生素、止血药物,剧烈咳嗽者给于镇咳治疗。
1.5 观察与评价指标
(1)近期疗效评价:术后即刻行CT扫描测量冰球覆盖率;术后1个月、3个月、6个月和1年复查,通过CT扫描测量肿瘤大小评价手术疗效。按照实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)分为完全缓解、部分缓解、稳定和进展,有效缓解率=(完全缓解+部分缓解)÷总例数。有条件者可于术后3个月至1年全身评估观察是否出现远处转移。
(2)远期疗效评价:采用生存率和中位生存时间,随访6个月、1年、2年和3年,患者死亡或失访为随访终点。
(3)观察术中与术后并发症:①术中并发症,患者肺压缩>30%,烦躁、呼吸困难,氧饱和度下降,心率>80次/min;②术后并发症,患者术后出现发热、咯血、气胸、胸腔积液及冷休克等。
1.6 统计学方法
采用SPSS20.0软件对所得数据进行统计分析,冰球覆盖率用均数±标准差(x-±s)表示,采用t检验,计数资料以率(%)表示,采用x2检验,以P<0.05为差异具有统计学意义。采用Kaplan-Meier法进行生存分析,计算中位生存时间,Log-Rank检验生存率差异。
2 结果
2.1 不同大小肿瘤冷冻冰球覆盖率及病灶变化情况
(1)肿瘤病灶<4 cm冰球覆盖肿瘤面积的覆盖率为(98.6±0.4)%,肿瘤直径>4 cm的冰球覆盖率为(90.3±5.4)%,两者比较差异有统计学意义(t=4.69,P<0.01),见表1。

表1 不同大小肿瘤冷冻冰球覆盖情况
(2)按照RECIST疗效评价标准,术后1个月、3个月、6个月和12个月行肺CT复查,有效缓解率分别为56.4%、56.2%、55.4%和53.9%,术后各时间段复查病灶变化情况比较,差异均无统计学意义(x2=3.705,x2=3.500,x2=1.604,x2=0.935;P>0.05),见表2。
2.2 术中并发症
术中拔针时出现气胸1例,肺压缩>30%,患者出现烦躁、呼吸困难,氧饱和度下降到68%,心率130次/min,立即给于胸腔穿刺抽气后,氧饱和度升至98%,心率80次/min。
2.3 术后并发症
(1)肿瘤小、冷冻范围小的患者无不良反应,平卧6 h后即下地活动、正常饮食。
(2)肿瘤直径>4 cm、冷冻范围大的患者氩氦刀治疗出现发热、咯血、气胸胸腔积液及冷休克等不良反应:①发热,术后81例患者在手术当日或次日出现体温波动在37℃~38.3 ℃,给予吲哚美辛栓纳肛,3~5 d后体温恢复正常;②咯血,术后痰中带血31例,其中26例患者术后第2 d出现痰中带少量血丝,2 d后消失,5例患者出现痰中带血块,给予止血治疗后1周消失;③气胸,术后出现气胸18例,其中13例术后有剧烈咳嗽的表现,2例术后当日出现气胸,16例术后第2 d出现气胸,15例肺压缩<20%,3例肺压缩>20%,1例给予胸腔穿刺抽气后好转,2例给予胸腔闭式引流后5 d拔管;④胸腔积液,术后有胸腔积液14例,其中13例患者少量胸腔积液,1例患者术后2 d出现中量的血性胸腔积液并感胸闷;⑤1例患者出现冷休克,于术后10 min感到发冷,出现寒战、四肢厥冷,血氧饱和度降至60%,血压68/30 mmHg,术中冰球覆盖面积达85%。治疗前症状与治疗后并发症比较差异有统计学意义(x2=17.485,P<0.05),见表3。
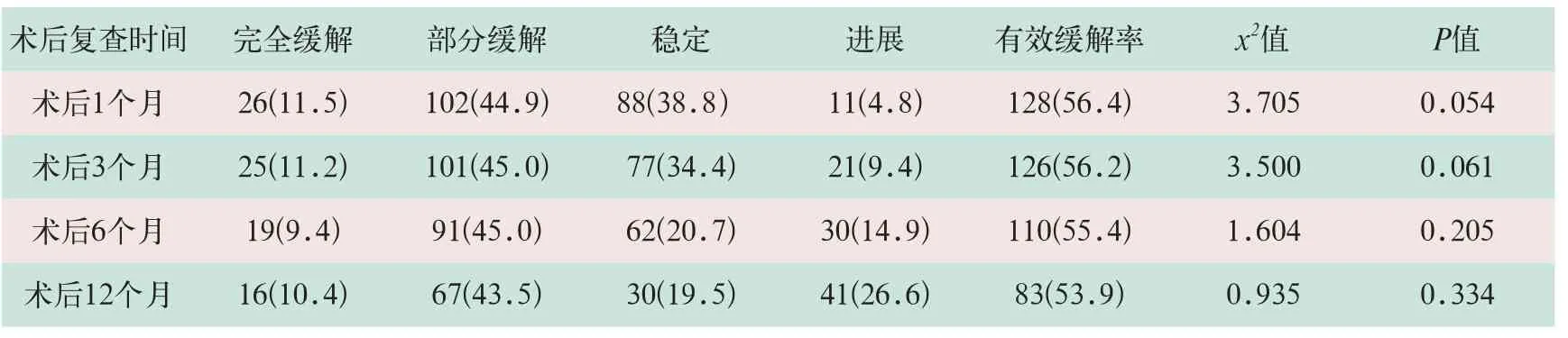
表2 氩氦刀靶向治疗术后复查病灶大小变化情况[例(%)]
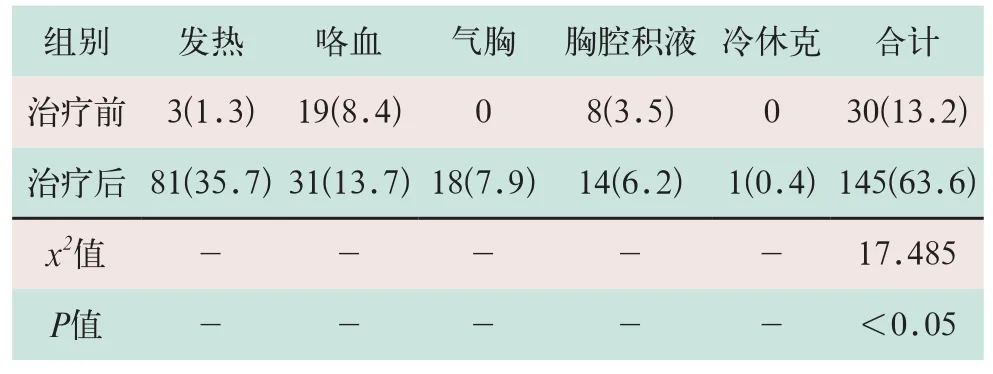
表3 227例患者氩氦刀治疗前症状与治疗后并发症对比[例(%)]
2.4 术后CT影像学评价
(1)术后即刻对227例患者行CT影像学评价,患者左肺腺癌氩氦刀治疗前后CT对比如图1所示。
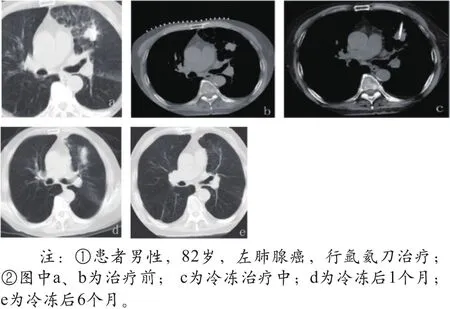
图1 左肺腺癌氩氦刀治疗前后CT对比图像
(2)患者右肺鳞癌,行氩氦刀治疗,治疗后1年肿瘤明显缩小,形成条索状瘢痕。治疗前后CT对比如图2所示。
2.5 术后随访
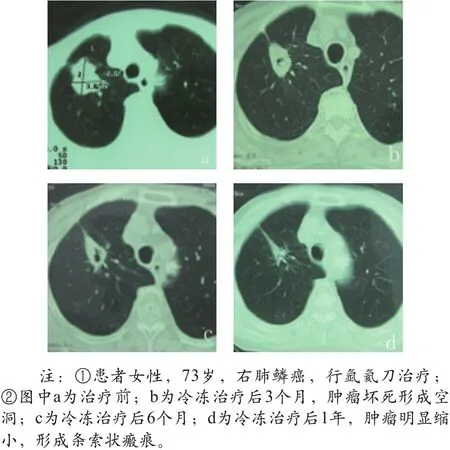
图2 右肺鳞癌氩氦刀治疗前后CT对比图像
患者氩氦刀冷冻治疗后随访6个月、1年、2年和3年,生存率分别为89%、68%、26%和12%,中位生存时间14个月。按肺癌TNM临床分期,随访6个月的生存率Ⅰ~Ⅱ期达100%,Ⅲ期90%,Ⅳ期83.8%。随访1年的生存率Ⅰ~Ⅱ期90%,Ⅲ期78%,Ⅳ期40%。随访2年的生存率Ⅰ~Ⅱ期85%,Ⅲ期25%,Ⅳ期12%。随访3年的生存率Ⅰ~Ⅱ期75%,Ⅲ期8%,Ⅳ期1.5%。
3 讨论
近年来,以肿瘤灭活、局部减轻肿瘤负荷的微创消融治疗得到广泛关注,并成为肿瘤治疗新的主导方向[6-7]。氩氦刀靶向冷冻技术具有多探头、高精准、急速冷冻及迅速复温的特点,是一种迅速减轻肿瘤负荷的微创手术系统,对小的肿瘤病灶可以达到完全灭活。在超低温治疗时通过对肿瘤靶区进行精准的监控,减少术中损伤肿瘤靶区周围正常组织的几率,是肺部肿瘤理想的消融方法,目前已广泛用于实体瘤的治疗[8]。
氩氦刀治疗肺部肿瘤的适应症为:①单发的或较为局限的多发的周围型肺癌、肿瘤直径尽量>1 cm;②全身状况较差、不能耐受外科手术,外科手术无法切除的肿瘤,放化疗以及手术后复发的肿瘤;③可配合放化疗,作为小细胞肺癌的减瘤负荷治疗;④原发病灶控制的局限性的转移性肺癌。
本研究中完成的老年原发性肺癌227例氩氦刀治疗中无1例死亡。对于术后发热、咯血为氩氦刀冷冻治疗后常见的伴随症状,给予退热、止血治疗后恢复正常。咯血原因可能与术中多次穿刺损伤肺组织有关,因此应提高穿刺的准确性。对于术后冷休克的患者立即给于保暖,同时静脉补液,给于肾上腺素、阿托品、多巴胺、西地兰和糖皮质激素等处理治疗后好转。术后出现冷休克的原因考虑神经源性,可能与肿瘤冷冻冰球较大,损伤周围神经节导致血管收缩舒张功能所致。故对于较大瘤体的患者进行冷冻治疗时需注意充分保暖,并尽量采取分次冷冻治疗。
术后定期复查肺CT观察肿瘤大小均有不同程度的减少,疗效确切。有学者研究得出氩氦刀的治疗效果优于单纯放化疗[9-10]。氩氦靶向冷冻治疗肺癌的疗效与肿瘤的大小和部位、临床分期、术中进针的角度深度和冰球冷冻范围等因素密切相关,并与术中老年患者的配合有关。氩氦刀冷冻靶向治疗对各型肺癌均有效,与病理组织类型无明显关系,周围型肺癌的显效率高于中央型肺癌,冰球覆盖超过肿瘤边缘1~1.5 cm,可完全摧毁肿瘤,对早期周围型的肺癌有望达到根治性的目的[9-11]。本研究观察12个月达到完全缓解的16位患者均为早期周围型肺癌,有7例为直径<2 cm的Ⅰ期患者,9例为直径<4 cm的Ⅱa期患者。邻近支气管、大血管及重要脏器的肿瘤,尤其是较大的肿瘤更易毗邻重要脏器,往往限制了进针的位置、冷冻时间和冰球的大小,导致冰冻不彻底而出现肿瘤进展。
CT引导下氩氦刀靶向冷冻治疗肺癌,创伤小、出血少、并发症少,操作安全简单,并可以重复治疗,也可与冷冻同时局部植入放射性粒子、化疗、放射治疗或外科手术相结合。患者只需局麻,手术创伤小,只在皮肤上留有进针的1~3 mm的冷冻创口,术后患者恢复快,尤其适用于不能手术切除或难于耐受手术或其他疗法治疗失败的患者[9]。氩氦刀冷冻靶向治疗是一种局部减轻肿瘤负荷的治疗手段,属于姑息性治疗,需配合其他治疗手段方能更有效地控制肿瘤发展,延长患者生存期[12-13]。
目前,氩氦刀靶向治疗已与新辅助化疗、放射治疗及分子靶向治疗等相结合。对于老年甚至是高龄的肺部原发性恶性肿瘤患者,其身体状况往往不允许外科开胸手术和正规疗程的放化疗治疗,老年患者的心理也更愿意选择接受对身体创伤小、治疗疗程短的治疗方法。因此,氩氦刀冷冻靶向治疗因其安全、有效、创伤小以及术后恢复快而成为老年肺癌患者治疗的理想选择。
[1]Wang SM,Zhang JR,Reng QP,et al.The treatment of unresectable irresectable live tumors by percutaneous targeted Ar-He cryoablation[J].Int J Mod Cancer Ther,2000,3(1):16-18.
[2]Sheen AJ,Poston GJ,Sherlock DJ.Cryotherapeutic ablation of liver tumors[J].Brit J Surg,2002,89(11):1396-1401.
[3]Bageacu S,Kaczmarek D,Lacroix M.Cryosurgery for resectable and unresectable and unresectable hepatic metastases from colorectal cancer[J].Eur J Surg Oncol,2007,33(5):590-596.
[4]Kerkar S,Carlin AM,Sohn RL,et al.Longterm follow up and prognostic factors for cryotherapy of malignant liver tumors[J]. Surgery,2004,136(4):770-779.
[5]Atwell TD,Farrell MA,Callstrom MR.Percutaneous cryoablation of 40 solid renal tumors with US guidance and CT monitoring:initial experience[J].Radiology,2007,243(1):276-283.
[6]Lang-Lazdunski L.Surgery for nonsmall cell lung cance[J].EurRespir Rev,2013,22(129):382-404.
[7]Petre EN,Solomon SB,Sofocleous CT.The role of percutaneous image-guided ablation for lung tumors[J].Radiol Med,2014,119(7):541-554.
[8]Zalcman G,Bergot E,Lechapt E.Update on nonsmall cell lung cancer[J].Eur Respir ReV,2010,19(117):173-185.
[9]冯华松,段蕴铀,聂舟山,等.氩氦靶向治疗肺部肿瘤725例的临床研究[J].中国肿瘤,2007,16(11):906-909.
[10]申文江.放射性粒子植入的现状与进展[J].中国微创外科杂志,2007,7(2):118-119.
[11]Yashiro H,Nakatsuka S,Inoue M,et al Factors affecting local progression after percutaneous cryoablation of lung tumors[J].J Vasc Interv Radiol,2013,24(6):813-821.
[12]Goto T,Izumi Y,Nakatsuka S,et al.Percutaneous cryoablation as a salvage therapy for local recurrence of lung cancer[J/OL].Ann Thorac Surg,2012(2014-08-10)[2017-02-17].http:// www.ncbi.nlm.nih.gov/pubmed/22579884.
[13]Maiwand MO,Asimakopoulos G.Cryosurgery for lung cancer:clinical results and technical aspects[J].Technol Cancer Res Treat,2004,3(2):143-150.
The clinical observation of the targeted Cryocare surgical system through percutaneous lung puncture for primary pulmonary malignant tumors in the elderly patient/
FU Tingting, ZHANG Bao-he, XU Hong-tao, et al//China Medical Equipment,2017,14(6):69-73.
Objective: To investigate the clinical efficacy and safety of targeted Cryocare surgical system through percutaneous lung puncture in the treatment of primary pulmonary malignant tumors for senile patients. Methods: The 230 lesions from 227 patients (over 70 years) with primary pulmonary malignant tumor were treated by using targeted Cryocare surgical system through percutaneous lung puncture. The coverage situations of tumor ice ball of different diameter were immediately observed, and the curative effects were evaluated as response evaluation criteria in solid tumors (RECIST). Besides, the change, complication and survival rate of pulmonary malignant tumor before and after treatment were dynamic observed. Results: After the targeted cryocare surgery, the coverage rate of 90 ice balls (diameter of tumor was less than 4 cm) was (98.6±0.4)%, and the tumor diameters of 140 ice balls were larger than 4cm and their coverage rate was (90.3±5.4)%. The difference of the coverage rate of tumor ice ball between two kind diameters was significant (t=4.69, P<0.01). The effective remission rates (CP+PR) post-surgery 1 month, 3 months, 6 months and 12 months were 56.4%, 56.2%, 55.4% and 53.9%, respectively, and there were no significant difference among these groups (x2=3.705, x2=3.500, x2=1.604, x2=0.935, P>0.05). The whole process of treatment was safety and there was no death cases, while 81 cases were fever post-operation (35.7%), 31 cases were hemoptysis post-operation (13.7%), 18 cases were pneumothorax post-operation (7.9%), 14 cases were pleural effusion postoperation (6.2%) and 1 cases was cold shock post-operation. And all of them recovered to normal situation after were treated as their relative symptom. Follow-up of post-operation 6 months, 1 years, 2 years and 3 years, the survival rates of patients were 89%, 68%, 26% and 12%, and the median survival time was 14 months. Conclusion: CT guided percutaneous targeted cryocare surgical system for pulmonary malignant tumors of the elderly patient is an effective and safe treatment method.
Cryocare surgical system; Cryoablation; Old age; Lung cancer
Department of Geriatrics, Navy General Hospital of People's Liberation Army, Beijing 100048, China.
10.3969/J.ISSN.1672-8270.2017.06.020
[文章编号] 1672-8270(2017)06-0069-05 [中图分类号] R734.2 [文献标识码] A
伏婷婷,女,(1980- ),本科学历,医师。海军总医院干部保健科,从事老年呼吸病诊治工作。
2017-03-02
①海军总医院干部保健科 北京 100048
②海军总医院呼吸内科 北京 100048
③海军总医院放射肿瘤科 北京 100048
