螺旋断层放射治疗系统根治性放射治疗29例寡转移非小细胞肺癌的临床效果研究
2017-06-21胡小龙李宏奇刘鹤飞徐向生吴伟章夏廷毅王颖杰
胡小龙李宏奇刘鹤飞徐向生吴伟章夏廷毅王颖杰*
螺旋断层放射治疗系统根治性放射治疗29例寡转移非小细胞肺癌的临床效果研究
胡小龙①李宏奇①刘鹤飞①徐向生①吴伟章①夏廷毅①王颖杰①*
目的:研究应用螺旋断层放射治疗系统(TOMO)根治性放射治疗寡转移非小细胞肺癌(NSCLC)患者原发灶及所有转移灶的疗效和不良反应。方法:回顾性分析29例初治转移灶≤5个的寡转移NSCLC患者,应用螺旋断层调强放射治疗系统对原发灶及所有转移灶行根治性放疗,平均和中位生物有效剂量(BED10)分别为95 Gy和94 Gy,中位化疗周期数4个。结果:中位随访时间30个月,近期疗效中病灶治疗总有效率为80%,1年、2年和3年的生存率分别为93%、69%和34%;中位生存时间为30个月,1年、2年和3年的无进展生存率分别为52%、17%和7%,中位无进展时间为12个月。多数患者仅出现1~2级不良反应,仅少数患者出现3级不良反应,未出现4级不良反应及治疗相关性死亡。结论:螺旋断层TOMO对寡转移NSCLC患者原发灶及所有转移灶均行根治性放疗,可以显著改善患者的总生存和无进展生存情况,治疗中的不良反应可耐受。
非小细胞肺癌;寡转移;根治性放射治疗;螺旋断层放射治疗系统
肺癌是我国发病率和病死率居第一位的恶性肿瘤,约50%的患者确诊时已经出现了远处转移,失去了行根治性手术的机会[1-2]。以铂类为基础的两药联合化疗被认为是Ⅳ期非小细胞肺癌(non-small cell lung cancer,NSCLC)的标准治疗方案,但生存期通常少于1年[3-4]。Hellman等[5]于1995年提出寡转移(Oligometastases)概念,即远处转移发生于1个或数量有限的器官,且转移具有靶器官特性。关于寡转移的定义尚无统一标准,但欧洲临床肿瘤学会及近期的研究将其定义为经全面影像诊断转移瘤数目<5个,无论转移部位及转移器官数[6-7]。寡转移是肿瘤生物侵袭性较温和的时期,介于局部原发灶与广泛转移的过渡阶段,具有潜在的治愈可能性。孤立有限的病灶及较小的肿瘤负荷为手术和根治性放射治疗创造了有利条件。有研究报道,在系统性全身治疗基础上对胸内原发灶及转移灶行根治性放射治疗可以明显提高寡转移患者的总生存率(overall survival rate,OSR)和无进展生存率(progression free survival rate,PFSR)[8]。但对寡转移患者原发灶及所有转移灶均行根治性放射治疗的报道较少见,本研究采用螺旋断层放射治疗系统(tomotherapy system,TOMO)对TOMO寡转移NSCLC患者原发灶及所有转移灶同时行根治性放射治疗,评价其疗效结果。
1 资料与方法
1.1 一般资料
回顾性分析2009年2月至2014年2月在空军总医院肿瘤放疗科治疗的314例Ⅳ期NSCLC患者病例资料,其中寡转移NSCLC患者29例,男性18例,女性11例;年龄≥65岁者13例,<65岁者16例;经病理学诊断腺癌22例,其中基因突变者5例,鳞癌6例;病理分型未明者NSCLC1例;吸烟者16例,未吸烟者13例;体力评分<2分23例,≥2分6例;单器官转移者22例,多器官转移者7例,中位化疗周期数4个,采用TOMO放射治疗技术对29例寡转移患者的原发灶及所有转移灶实施根治性放射治疗。29例患者初诊时均行PET-CT检查。
1.2 纳入与排除标准
(1)纳入标准:①病理证实的Ⅵ期NSCLC非小细胞肺癌;②转移瘤数目≤5个;③经过系统性全身治疗后,原发灶及转移灶均未进展且至少持续2周未出现任何新的转移病灶;④血常规、肝肾功能及肺功能基本正常;⑤签署放射治疗同意书、化疗同意书及靶向治疗同意书。
(2)排除标准:①合并其他恶性肿瘤;②对原发灶及转移灶已进行过放射治疗;③转移瘤边界模糊无法鉴别;④严重肝肾功能障碍,多器官功能衰竭。
1.3 仪器与药物
采用(Biograrph HR 16 PET/-CT(德国西门子公司);Hi-ART螺旋断层调强放射治疗系统TOMO(Hi-ART,美国);西门子1.5 T高场强磁共振(德国西门子公司)。顺铂(江苏豪森药业),紫杉醇(北京双鹭药业),培美曲塞(江苏豪森药业),吉非替尼(阿斯利康)。
1.4 治疗方法
1.4.1 全身治疗
(1)化疗,以铂类为基础的双药联合方案,其中铂类药物剂量为:顺铂80~100 mg/m2,平均分3 d静脉滴注,2~4 d;紫杉醇140~170 mg/m2,1 d静脉滴注;培美曲塞500 mg/m2,1 d静脉滴注;靶向药物吉非替尼250 mg,1 d/次。
(2)前期系统性全身治疗中采用化疗的患者,在化疗周期的疗程结束后开始行局部放射治疗;采用分子靶向药物治疗的患者,如未发现耐药,则始终服用靶向治疗药物。
值得指出的是,2018年在家电市场整体放缓的形势下,在大家电市场接近饱和的状态下,个护小家电的增长却逆袭而上,具有多样保健功能的小家电逐渐受到追求个性、对健康意识重视的现代人青睐,像吸尘器、扫地机器人、除螨仪等产品销售额增长迅猛,前三季度均保持40-50%的增长率。不过有关呼吸健康的空净行业2018年却交出令人失望的成绩单,不少大品牌开始收缩空净业务,截至11月,线上线下空净品牌数减少至532家,至少有35%的空净企业退出市场。
1.4.2 定位扫描
患者仰卧位,根据不同的治疗部位分别采用体部、头颈肩部热塑膜经行体位固定;平静呼吸下行CT定位扫描,层厚≤5 mm;扫描范围包括原发灶及所有转移灶。
1.4.3 靶区勾画
在CT图像上勾画大体靶体积(gross tumor volume,GTV),GTV外扩5 mm形成临床靶体积(clinical target volume,CTV),不超过解剖边界,如果外扩的CTV临近危及器官时可进行适度的修改。计划靶体积(planning target volume,PTV)由摆位误差、呼吸运动并及相邻病灶的剂量关系共同确定,由CTV外扩5~10 mm形成PTV。最后勾画出正常组织器官双肺、脑、脊髓、心脏、肝脏及食管等靶区。
1.4.4 剂量分割模式
TOMO:肺内及淋巴结引流区Dt60~80 Gy,10~20次;骨及肾上腺转移灶Dt60~70 Gy,10~20次;胸椎、腰椎转移灶Dt30~60 Gy,10~20次;脊髓转移灶Dt40 Gy,20次。脑转移灶Dt40~60 Gy,10~20次;1次/d,5次/周。
1.5 疗效评价
(2)近期疗效评价标准:①CR,影像学检查示所有靶病灶完全消失,维持≥4周;②PR,影像学检查示所有靶病灶直径总和减少30%以上,维持≥4周;③病灶进展(progressive disease,PD),影像学检查示所有靶病灶直径总和增加超过20%;④病灶稳定(stable disease,SD),影像学检查示基线病灶长径总和有缩小但未达PR或有增加但未达PD。
1.6 放射反应评价
(1)早期放射反应:从所有病灶开始行根治性放射治疗开始之日至放射治疗结束后6个月内出现的不良反应,采用放射治疗肿瘤协作组(radiation therapy oncology group,RTOG)对早期放射损伤进行评价。
(2)晚期放射反应:所有病灶接受根治性放射治疗结束3个月后出现的不良反应,采用欧洲癌症治疗研究组(European Organisation for Research and Treatment of Cancer Cancer,EORTC)对晚期反应放射损伤分级进行评价。
1.7 统计学方法
采用SPSS 22.0软件包对数据进行统计分析,采用均值±和标准差(x-±s)描述定量资料分布,采用频数和构成比描述分类资料分布情况;生存分析采用Kplan-Meier法。
2 结果
2.1 随访结果
所有随访信息均来自患者门诊复查信息及电话随访,随访时间自治疗结束后1个月开始计算,截止到2016年12月,中位随访时间30个月。
2.2 近期疗效
采用RECIST标准评价近期疗效,完全缓解7例(占24%),部分缓解15例(占52%),稳定5例(占17%),进展2例(占7%),治疗总有效率为76%。
2.3 远期疗效及生存情况
截至末次随访,1年、2年和3年的生存率分别为93%、69%和34%;中位生存时间为30个月,1年、2年和3年的无进展生存率分别为52%、17%和7%,中位无进展时间为12个月。29例患者中死亡18例(占62.06%),其中14例死于肿瘤进展致多器官功能衰竭,1例死于肺部严重感染,3例死因不明。
2.4 早期不良反应
对29例寡转移NSCLC患者均顺利完成根治性放射治疗,患者主要的不良反应分别为白细胞减少,但均为轻度,其中2例出现了3级白细胞减少,2例出现了3级恶心、呕吐,4例患者出现了1级放射性肺炎,未见4级不良反应。上述反应在给予对症治疗后均好转,未出现难以纠正的重度不良反应,见表1。
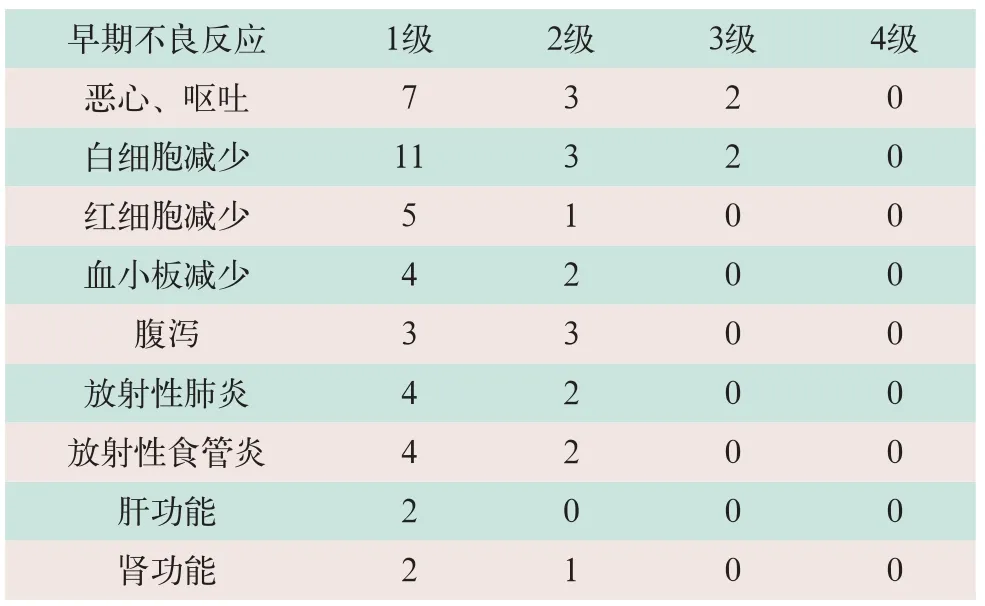
表1 行TOMO根治性放射治疗的29例寡转移NSCLC患者的早期不良反应(例)
2.5 晚期不良反应
对29例寡转移NSCLC患者行TOMO根治性放射治疗中,出现1级放射性纤维化的仅2例,且为轻度,肺功能轻微下降,其余患者放射治疗后肺功能均正常。具体不良反应见表2。

表2 行TOMO根治性放射治疗的29例寡转移NSCLC患者的晚期不良反应(例)
3 讨论
目前,表皮生长因子受体(epidermal growth factor receptor,RGFR)未突变或非敏感型突变的NSCLC患者仍以铂类为基础的双药联合方案化疗为主要治疗手段,其毒副作用较大,患者耐受性差,中位生存期仅为8~10个月,放射治疗通常作为有症状转移灶及经过全身综合治疗后残留病灶的一种姑息治疗手段[9-10]。出现肺外转移是影响NSCLC患者预后的重要因素,转移灶可造成局部疼痛、压迫症状及占位效应,增加肿瘤负荷,极大降低患者的生活质量。但寡转移NSCLC患者处于原发灶向全身广泛转移的中间过渡阶段,转移灶的数目及转移器官相对有限,且转移的器官具有特异性,此阶段患者肿瘤负荷较小,对综合治疗耐受性好,预后较好。肺癌患者一旦出现脑转移其预后极差,如不行局部治疗生存期极短,Flannery等[11]报道,对伴有孤立脑转移的NSCLC患者胸内病灶及脑孤立转移灶行根治性放射治疗或根治性手术其5年生存率约20%左右,表明伴有重要器官脑转移的患者经过有效的局部治疗,彻底性摧毁病灶可长期存活。Downey等[12]及Pfannschmidt等[13]研究报道,寡转移患者经过对胸内原发灶行根治性放射治疗其OS较全身广泛转移的患者明显延长。表明给予积极的局部治疗可明显的改善患者预后,延长患者生存时间。且有研究报道,寡转移患者对其胸内原发灶及转移灶给予根治性放射治疗其预后明显优于仅对转移灶行根治性放射治疗[6]。对胸内原发灶行根治性放射治疗是有利的预后因素[14]。以往放射治疗技术靶区适形性较差,剂量分布不均匀,不能很好的对周围正常组织器官保护。随着现代放射治疗技术的发展,图像引导调强放射治疗已经广泛运用到临床,使肺癌寡转移患者原发灶及少数孤立的转移灶同时接受根治性放射治疗成为可能。
螺旋断层TOMO是通过360°非共面旋转照射是目前放射治疗技术下,靶区剂量分布适形性最高的技术,能对靶区周围正常组织器官做最大程度的保护,可以对胸内原发灶和所有转移灶同时行根治性放射治疗。Hasselle等[15]报道,在系统性全身治疗基础上,对25例寡转移NSCLC患者原发灶及转移灶同时性根治性放射治疗,结果显示,中位OS为22.7个月,中位PFS为7.6个月。吕家华等[16]研究报道,66例寡转移NSCLC患者在全身化疗基础上同期对原发灶及转移灶行放射治疗,胸内病灶中位BED10为72 Gy,结果表明中位生存期为25个月。本研究中29例寡转移NSCLC患者在接受系统性的全身治疗后,对胸内原发灶及所有转移灶给予根治性放射治疗,平均和中位BED10分别为95 Gy和94 Gy,中位生存期为30个月。经过系统性的全身治疗,针对胸内原发病灶及所有转移灶行根治性的放射治疗,可以最大程度上降低肺癌寡转移患者的肿瘤负荷,降低重要器官转移灶的致死率,明显提高患者生存质量,延长生存时间。
本研究不良反应主要为骨髓抑制,这与多个病灶同时行照射有关,但大部分患者均为轻、中度,治疗过程中积极给予升血治疗后均好转,未出现治疗相关性死亡。其中2级放射性食管炎的发生率为6.9%,2级急性期放射性肺炎发生率为6.9%。既往有研究报道[17]在肺部病灶行TOMO治疗时,因V5值较高会增加放射性肺炎的发生率,但本研究中仅有2例出现2级急性期放射性肺炎,未见3级和4级急性期放射性肺炎,整体治疗过程顺利,治疗耐受性好。
本研究结果表明,寡转移NSCLC在系统性的全身化疗及靶向治疗基础上,对胸内原发灶及所有转移灶行根治性放射治疗,可以显著改善患者的总生存和无进展生存,提高患者生存质量,且不良反应可耐受,为寡转移NSCLC患者提供了一种新的治疗模式。
[1]Jemal A,Bray F,Center MM,et al.Global cancer tatistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Uoyang WW,Su SF,Ma Z,et al.Prognosis of non-small cell lung cancer patients with bone oligometastases treated concurrently with thoracic three-dimensional radiotherapy and chemotherapy[J].Radiat Oncol,2014,9(1):147.
[3]Ettinger DS,Akerley W,Bepler G,et al.Nonsmall cell lung cancer[J].J Natl Compr Canc Netw,2010,8(7):740-801.
[4]National Cancer Institute.Surveillance,Epidemiology and End Results program[OL].(2013-12-26)[2017-01-22].http://seer.cancer.gov/faststats/.Accessed November 26,2013.
[5]Hellman S,Weichselbaum RPR.Oligometastases[J]. J Clin Oncol,1995,13(1):8-10.
[6]D’Addario G,Fruh M,Reck M,et al.Metastatic non-small-cell lung cancer:ESMO Clinical clinical Practice practice Guidelines guidelines for diagnosis,treatment and followup[J].Ann Oncol,2014,21(Suppl 5):v116-v119.
[7]Salama JK,Chmura SJ,Mehta N,et al.An initial report of a radiation dose-escalation trial in patients with one to five sites of metastatic disease[J].Clin Cancer Res,2008,14(16):5255-5259.
[8]Parikh RB,Cronin AM,Kozono DE,et al. Definitive Primary primary Therapy therapy in Patients patients Presenting presenting With with Oligometastatic oligometastatic Nonnon-Small small Cell Lung Cancer[J].Int J Radiation Oncol Biol Phys,2014,89(4):880-887.
[9]Loriot Y,Sofia JC,Le Chevalier T.Expanding role of chemothrerapy in lung cancer[J].Am Oncol,2006,10(1):101-107.
[10]Sau S,Sau S,Dutta P,et al.A comparative study of different dose fractionations schedule of thoracic radiotherapy for pain palliation and health-related quality of life in metastatic NSCLC[J].Lung India,2014,31(4):348-353.
[11]Flannery TW,Suntharaligam M,Regine WF,et al. long-term surv Ⅳal in patients with synchronous,solitary brain metastasis from non-small-cell lung cancer treated with radiosurgery[J].Int J Radiat Oncol Biol Phys,2008,72(1):19-23.
[12]Downey RJ,Ng KK,Kris MG,et al.A phase II Ⅱtrial of chemotherapy and surgery for non-small cell lung cancer patients with a synchronous solitary metastasis[J].Lung Cancer 2002,38(2):193-197.
[13]Pfannschmidt J,Dienemann H.Surgical treatment of oligometastatic non-small cell lung cancer[J].Lung Cancer 2010,69(3):251-258.
[14]Ashworth A,Rodrigues G,Boldt G,et al.Is there an oligometastatic state in non-small cell cancer? A a systematic review of the literature[J].Lung Cancer,2013,82(2):197-203.
[15]Hasselle MD,Haraf DJ,Rusthoven KE,et al. Hypofractionated image-guided radition therapy for patients with limited volume metastatic non-small cell lung cancer[J].J Thorc Oncol,2012,7(2):376-381.
[16]吕家华,李涛.IV期寡转移NSCLC同期放化疗后巩固化疗前瞻性Ⅱ期临床研究[J].中华放射肿瘤学杂志,2015,24(6):611-614.
[17]Bral S,Duchateau M,Versmessen H,et al.Toxicity report of a phase 1/2 does-escalation study in patients with inoperable,locally advanced non-small cell lung cancer with helical tomotherapy and concurrent chemotherapy[J]. Cancer,2010,116(1):241-250.
Research on clinical effect of on the radical radiotherapy for 29 cases with non-small cell lung cancer of oligometastasis/
HU Xiao-long, LI Hong-qi, LIU He-fei, et al//China Medical Equipment,2017,14(6):65-68.
Objective: To research the curative effect and adverse reaction of using helical tomotherapy (TOMO) on the radical radiotherapy for primary lesion and all of metastases of patients with non-small cell lung cancer of oligometastasis. Methods: 29 patients with NSCLC of oligometastasis (the number of metastases≤5) in initial treatment were enrolled in this retrospective analysis. The primary lesion and all of metastases were taken radical radiotherapy by using TOMO system, and the average and median of biological effective dose (BED10) 95Gy and 94Gy, respectively, and the number of neutral position chemotherapy period was 4. Results: In 30 months of neutral position follow-up visit, the total effective rate of lesion treatment in short-term curative effect was 80%, and the survival rates after 1, 2 and 3 years, respectively, were 52%,17% and 7%. The median survival time was 30 months, the progression-free survivals were 52%, 17% and 7% after 1, 2 and 3 years, and the median progression-free time was 12 months. The adverse reactions of most patients were 1-2th degree, and only a few patients were 3th degree. And the 4th degree of adverse reaction or the death related with treatment hadn't were found. Conclusions: Based on systematic therapy for non-small cell lung cancer of oligometastasis, the radical radiotherapy of primary lesion and all metastases can obviously improve patients’ overall survival and progression-free survival, at the same time, its adverse reaction is durable during treatment.
Non-small cell lung cancer; Oligometastasis; Radical Radiotherapy; Tomotherapy (TOMO)
Department of Radiation Oncology, Air Force General Hospital of People's Liberation Army, Beijing 100142, China.
10.3969/J.ISSN.1672-8270.2017.06.019
1672-8270(2017)06-0065-04
R816.4
A
胡小龙,男,(1989- ),硕士研究生。空军总医院肿瘤放疗科,从事肿瘤放射治疗工作。
2017-03-29
①空军总医院肿瘤放疗科 北京 100142
*通讯作者:wangyj9999@163.com
