应用EP15-A2指南文件验证AU2700型全自动生化仪检测项目的精密度性能
2017-06-21赟欧渤苒洪海波张云霞
王 赟欧渤苒洪海波张云霞
应用EP15-A2指南文件验证AU2700型全自动生化仪检测项目的精密度性能
王 赟①欧渤苒①洪海波①张云霞①
目的:对生化检测系统的20项常规检测项目的精密度性能进行评价,以确定其是否满足临床需要。方法:应用美国临床和实验室标准化协会(CLSI)EP15-A2“精密度和真实度性能的用户验证指南”文件,选用2个不同批次、不同浓度水平的室内质控物,采用AU2700生化仪连续测定3~5 d,计算批内精密度(σ批内)和总的室内精密度(σ总),并与厂商声明的精密度进行比较,同时也分别与卫生与计划生育委员会临检中心室间质量评价标准(EQa)、WS/T403-2012:“临床生物化学检验常规项目分析质量指标”进行比较。结果:所检测的20个常规项目的σ批内和σ总100%小于厂商声明的精密度。同时,σ批内均<1/4的卫生与计划生育委员会临检中心室间质量评价标准,σ总均<1/3的卫生与计划生育委员会临检中心室间质量评价标准,也小于临床生物化学检验常规项目分析质量指标中规定的不精密度。结论:应用EP15-A2指南文件验证厂商声明的精密度性能操作简便,经济实用,适合临床实验室对精密度进行核实,所评价的检测系统的精密度性能既符合厂商声明的精密度,也符合国家相关规定要求,该生化检测系统精密度可以满足临床需要。
精密度;EP15-A2指南文件;生化检测系统;性能验证
精密度是指在规定条件下对同一或类似被测对象重复测量所得示值或测得值间的一致程度[1]。精密度性能是检测系统的基本分析性能之一,也是其他方法学评价的基础。ISO15189“医学实验室质量和能力认可准则”和“医疗机构临床实验室管理办法”均要求检测系统在用于常规工作前应对其分析性能进行验证确认或分析评价,以证实其能够满足预期用途。
美国临床和实验室标准化协会(CLSI)颁布了EP15-A2“精密度和真实度性能的用户验证指南”,为实验室较为简便地验证厂商做出的精密度提供了实用的方法[2]。本研究按照EP15-A2指南的方案,对“医学实验室质量和能力认可准则在临床化学检验领域的应用说明”(CNAS-CL38)中要求组合认可的20个常规生化项目采用AU2700型全自动生化仪进行精密度验证。
1 材料与方法
1.1 仪器与试剂
Beckman-Coulter AU2700型全自动生化仪(美国贝克曼);所有检测项目均采用Beckman-Coulter原装配套试剂(美国贝克曼);校准液(批号0116F)、日常质控物(批号 0029,0030)为Beckman-Coulter提供;采用与日常质控物不同批号的Beckman-Coulter质控物验证精密度(批号 0031,0032)。
1.2 精密度检测方法
根据厂商声明的批内精密度(σ批内)和总的室内精密度(σ总)比例关系分为以下两种情况。
(1)如果σ批内<2/3σ总:每日分析1个批次,2个浓度,每个浓度重复测定4次,连续5 d。总蛋白(TP)、总胆红素(Tbil)、碱性磷酸酶(ALP)、尿素(Urea)、尿酸(UA)、肌酐(Cr)、葡萄糖(Glu)、总胆固醇(TCHO)、天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK)、钙(Ca)、无机磷(P)以及谷氨酰转肽酶(GGT)采用该方式验证。
(2)如果σ批内>2/3σ总:每日分析1个批次,2个浓度,每个浓度重复测定3次,连续3 d。白蛋白(Alb)、丙氨酸氨基转移酶(ALT)、甘油三酯(TG)、钾(K)、钠(Na)、氯(Cl)以及乳酸脱氢酶(LDH)采用该方式验证。
每日应进行常规质量控制程序。如果某一批因为质量控制或操作困难而被拒绝,需在找到并纠正原因后重新进行一批实验。按照厂商说明书进行校准,如果厂商指出在其声明中的精密度数据是在多个校准周期下所产生,则在实验期间内应选择重新校准[3]。
1.3 统计学方法
按照EP15-A2文件进行试验数据的统计学处理,计算σ批内和σ总,并与厂商声明的精密度进行比较。如果厂商声明的精密度以变异系数(CV)表示,按公式1转换为分析物所有检测结果均值的标准差(公式1):

式中CV为厂商声明的CV值,x-为所有结果的均值。
如果估计的标准差小于厂商声明的标准差,则核实精密度与厂商声明的一致。
如果估计的标准差大于厂商声明的标准差,可进一步计算验证值并与之比较,其验证值为公式2:
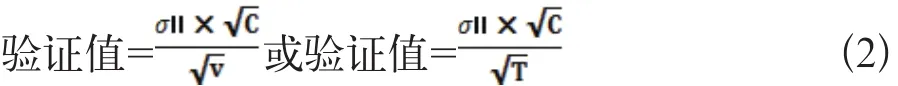
式中C为自由度为v(批内)或T(总)时百分位点(1-α/1)的x2分布值。
如果标准差小于验证值,厂商声明的精密度通过核实[3]。所有统计学处理在Excel上进行。
2 结果
2.1 σ批内结果
在40个测试结果中,有13个结果小于厂商声明的σ批内;有27个测试结果大于(或等于)厂商声明的σ批内,但经验证后均小于厂商声明的σ批内。
批内变异系数是实验中由批内标准差及均值计算得出,厂商声明的σ批内由其试剂说明书提供,1/4室间质量评价标准(EQa)是卫生与计划生育委员会临检中心EQa的1/4。CV/%是卫生与部发布的卫生行业标准WS/T 403-2012“临床生物化学检验常规项目分析质量指标”[4]中规定的不精密度,各项目的σ批内验证结果见表1和表2。
2.2 σ总结果
在40个测试结果中,有23个结果小于厂商声明的σ总;有17个测试结果大于(或等于)厂商声明的σ总,但经验证后均小于厂商声明的σ总。
批内变异系数是实验中由批内标准差及均值计算得出,厂商声明的σ批内由其试剂说明书提供,1/3EQa是卫生与计划生育委员会临检中心EQa的1/3。CV/%是国家卫生行业标准WS/T 403-2012“临床生物化学检验常规项目分析质量指标”[4]中规定的不精密度,各项目的总精密度验证结果见表3和表4。
3 讨论
ISO15189:2012对验证(verification)定义为:通过提供客观证据对规定要求已得到满足的认定,其中5.5.1.2检验程序验证,强调未经修改而使用的已确认的检验程序在常规使用前应经实验室的独立验证[6]。CNAS-CL38要求性能验证内容至少应包括正确度、精密度和可报告范围,所以在一个检测系统投入使用前应对其性能进行验证,而为了保证检验结果符合使用要求,在检测系统使用过程中也应对其性能进行验证[7]。

表1 中值质控物σ批内结果

表2 高值质控物σ批内结果

表3 中值质控物σ总结果
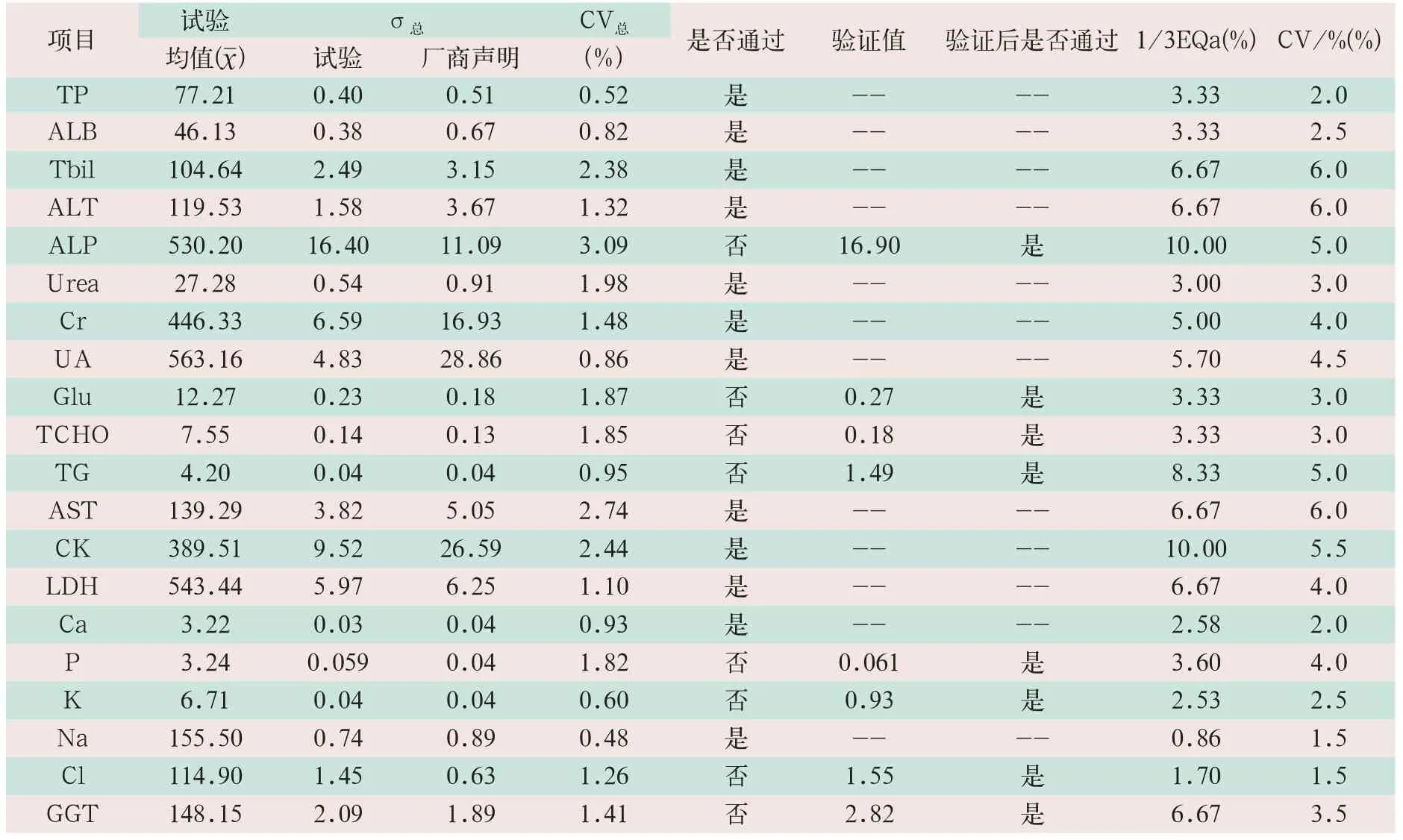
表4 高值质控物σ总结果
精密度可以反映分析过程中随机误差的大小,而CLSI EP文件是目前最为规范的检验方法或检测系统分析性能评价工具,涉及精密度的指南文件有EP5-A2、EP10-A2及EP15-A2。EP5-A2指南是最全面的系统方案,但其实验过程和统计过程较复杂,在许多情况下实用性不强,主要适用于新建立的检验方法或检测系统分析性能评价;EP10-A2指南仅用于初步研究;EP15-A2指南是针对临床实验室而设计,实验和统计过程均较简单,主要用于检验方法或检测系统的精密度性能,该指南简便实用,能在不同实验室应用,而且其提供的统计学结论也足够严密,但其应用范围有限,仅用于核实研究[8]。本研究实验所涉及的20个临床生化常规检测项目均使用配套的试剂盒及校准液,是已确认的检测系统,属于核实研究,可以使用EP15-A2指南验证其精密度是否符合厂商声明的精密度要求[9]。
通常厂商均会给出2种精密度的声明,即σ批内和σ总。因此EP15-A2指南主要通过实验得到估计的批内标准差(S批内)和总标准差(S总),并与厂商声明比较[3]。本研究实验室参照该方案对Beckman-Coulter AU2700型全自动生化分析仪检测20个常规生化项目的2种精密度进行了验证,这些常规生化项目是CNAS-CL38中要求组合认可的项目,是临床上使用广泛,方法成熟的项目。此外,在验证厂商的精密度性能时,应尽可能选择与厂商声明的精密度评价性能接近的样本。为此,本研究选择了2个浓度水平的质控物进行实验,研究中所有项目均可通过验证,表明以上项目在AU2700型全自动分析仪的检测系统中可以满足临床要求。
除了按照EP15-A2指南文件验证厂商提供的精密度外,本研究还使用国际上推荐的总不精密度来评价检测系统的误差。国际上为了更好地检出不稳定的误差,已明确提出检测系统的S批内应为美国的临床实验室室间质量评估允许误差的1/4,批间标准差应为允许误差的1/3(若允许误差以%表示,则批内变异系数CV小于允许误差的1/4,批间变异系数CV小于允许误差的1/3)。目前,国内大多采用卫生与计划生育委员会临检中心EQa作为总误差来评判一个系统的不精密度[10]。本研究中,所有项目的CV批内均<1/4EQa,而CV总均<1/3EQa,也能够表明检测系统的不精密度属可接受水平。而能达到此要求的检测系统,可认为其随机误差属于可接受的低水平。
2012年底原卫生部发布了卫生行业标准WS/T 403—2012“临床生物化学检验常规项目分析质量指标”,并于2013年8月1日起实施。该文件对总误差、不精密度和偏倚作出了具体规定,明确指出总误差、不精密度和偏倚主要用于室间质量评价、室内质量控制管理和正确度验证,3种方法可共同用于方法性能评价等[4-5]。这些指标的设定主要根据检验项目的个体内生物学变异和个体间生物学变异,同时考虑目前可实现的分析质量水平,在质量规范层次模型中属于第二层次[11]。而在本研究中,所有项目的CV批内和CV总均小于该质量指标规定的不精密度(CV/%),则进一步表明本实验室使用的AU2700生化分析仪检测系统检测常规项目的不精密度属可接受水平[12]。
[1]冯仁峰.再说说精密度[J].检验医学,2014,29(8):787-793.
[2]Anderson F,George H,Carey R.CLSI/NCCLS:EP15-A2.User verification of performance for precision and trueness approved guidelinesecond edition[S].CLSI,2005.
[3]杨有业,张秀明.临床检验方法学评价[M].北京:人民卫生出版社,2008:111-113.
[4]中华人民共和国卫生部.WS/T403-2012 临床生物化学检验常规项目分析质量指标[S].中华人民共和国卫生部,2012-12-25.
[5]王缚鲲,李玮,王宪灵,等.野战(应急)快速检验系统生化分析模块性能的综合评价[J].中国医学装备,2014,11(2):81-83.
[6]中国合格评定国家认可委员会.CNAS-CL02医学实验室质量和能力认可准则(ISO 15189:2012,IDT)[S].中国合格评定国家认可委员会,2013-11-22.
[7]中国合格评定国家认可委员会.CNAS-CL38医学实验室质量和能力认可准则在临床化学检验领域的应用说明[S].中国合格评定国家认可委员会,2015-11-11.
[8]沈荣春,杨春兰,崔明.不同精密度评价方法的比较及在临床血糖测定中的应用[J].检验医学与临床,2014,11(18):2497-2498.
[9]张艳果,唐爱国,李建忠.Beckman AU5800生化分析仪性能的评价[J].国际检验医学杂志,2013,34(24):3394-3395.
[10]康凤凤,王治国.ISO 15189:2012与临床检验定量检测方法确认和性能验证[J].临床检验杂志,2013,31(12):881-884.
[11]艾红梅.WS/T403-2012标准对临床生物化学常规项目检测质量控制的检验医学评估[J].蚌埠医学院学报,2014,39(5):653-654.
[12]艾红梅.两种质量规范在生物化学检验质量管理中的应用[J].国际检验医学杂志,2014,35(10):1329-1330.
Verification of the precision performance for AU2700 by the application of EP-15A2 file/
WANG Yun, OU Bo-ran, HONG Hai-bo, et al//China Medical Equipment,2017,14(6):21-25.
Objective: To evaluate the performance precisions of 20 routine test items
of biochemical analyzer system so as to confirm whether they can meet clinical demands.
Methods: 2 quality control materials ( different concentration, different lot) according to "verification guidance of precision and validity for user " of EP15-A2 were continuously detected 3-5d by using AU2700, and the within-run precision(σw) and total precision (σt)were calculated and compared with the declarations of manufacturers. At the same time, it also be compared with National Center for Clinical Laboratories's EQa standard and WS/T403-2012: Analytical quality specification for routine analytes in clinical biochemistry. Results: The within-run precisions and total precisions of the 20 routine items were less than that of the declaration of manufacturers. At the same time, all of the within-run precisions were less than 25% of EQa standard, and all of total precisions were less than one third of EQa standard. Besides, they also less than the relative standards of WS/T403-2012. Conclusion: It is easy and economic in practice that EP15-A2 is applied to verify the precisions of the declaration of manufacturer, and it suits to the verification for precision of clinical laboratory. As this method, the precision performance of the detection system not only accords with the precision of the declaration of manufacturers, but also accords with the national requirements. Finally, the precision of this biochemistry detection system can satisfy the clinical demands.
Precision; EP15-A2 guidance file; Biochemical analyzer; Performance verification
Center of Testing, Hematonosis Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Tianjin 300020,China.
10.3969/J.ISSN.1672-8270.2017.06.007
1672-8270(2017)06-0021-05
R197.39
A
王赟,女,(1975- ),本科学历,主管技师。中国医学科学院血液病医院检测中心,从事临床生化检验工作。
2017-03-07
①中国医学科学院血液病医院检测中心 天津 300020
