红曲强化对四川麸醋代谢组分的影响
2017-06-19邱雪黄钧张立强文平何培吴重德丁晓斐周荣清
邱雪,黄钧,张立强,文平,何培,吴重德,丁晓斐,周荣清,2,4*
1(四川大学 轻纺与食品学院,四川 成都,610065) 2(四川大学,皮革化学与工程教育部重点实验室,四川 成都,610065) 3(四川省阆州醋业有限公司,四川 阆中,637400) 4(国家固态酿造工程技术研究中心,四川 泸州,646000)
红曲强化对四川麸醋代谢组分的影响
邱雪1,黄钧1,张立强1,文平3,何培3,吴重德1,丁晓斐1,周荣清1,2,4*
1(四川大学 轻纺与食品学院,四川 成都,610065) 2(四川大学,皮革化学与工程教育部重点实验室,四川 成都,610065) 3(四川省阆州醋业有限公司,四川 阆中,637400) 4(国家固态酿造工程技术研究中心,四川 泸州,646000)
叙述了红曲强化对四川麸醋醋坯发酵过程的主要影响。结果表明,红曲强化提高了醋液酸度、总酯及非挥发酸的含量,柠檬酸、琥珀酸和乳酸显著提高,红色色值也增高;首次确定了四川麸醋同样具有清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl ,DPPH)自由基的能力;红曲强化对挥发性组分的贡献主要表现在醇类和酯类的含量与比例显著提高,而吡嗪类和酚类比例降低,苯乙醇和苯乙醛的香味贡献度增大,生醋的玫瑰香、花香及巧克力香突出。
四川麸醋;红曲;强化发酵;代谢组分;挥发性组分
食醋是广大消费者喜爱的调味品之一,具有多种保健功能[1-2]。生产工艺主要分为液态发酵和固态发酵。前者包括麦芽醋、葡萄酒醋和葡萄醋等的生产,是一种纯种多步发酵工艺,能保障过程参数的管理与控制,但产品风味单一。固态工艺是谷物食醋生产的主要工艺方式,因生产环境开放、原料不同、多种微生物参与及过程中群落规律性地交替变迁,致使生产工艺及产品特色迥异。
四川麸醋(保宁麸醋)是我国四大名醋之一,生料制曲,液化、糖化和发酵同时进行[3],其过程中总酸和有机酸含量逐渐增高,色泽加深,而在陈酿中这些组分都降低[4]。参与作用的主要是真菌和细菌,种类繁多,过程中交替变迁,但整体群落结构基本稳定[5]。筛选优良菌株及其应用是目前研究热点,如从醋坯中选育出产醇酯能力高的粟酒裂殖酵母(S.pombe)[6],产酮能力高的解淀粉芽孢杆菌(Bacillusamyloliquefaciens)[7],生淀粉降解能力高的犁头木霉CQB43[8]等。
本文报道了红曲共培强化四川麸醋对其代谢组分影响的研究,结果对认识功能菌株对代谢组分的影响及共培强化技术的应用具有借鉴和指导作用。
1 材料与方法
1.1 微生物与培养基
Monascuspurpureus(As3.972):本实验室保藏,购于中国普通微生物保藏管理中心;种子培养基:麦芽汁培养基。
1.2 材料
原材料:麸皮、次粉、糙米,购自本地农贸市场;醋曲、醋糟,四川阆州醋业有限公司提供。酿酒活性干酵母,安琪酵母股份有限公司;华丰根霉曲,上海科隆发酵制品有限公司。
1.3 主要试剂与仪器
试剂与药品:没食子酸:分析纯,成都市科龙化工试剂厂;辛酸甲酯(99%,内标);甲醇、草酸、柠檬酸、酒石酸、L-苹果酸、琥珀酸、乳酸、乙酸、L-焦谷氨酸:色谱纯,阿拉丁试剂有限公司;1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl, DPPH)、芦丁:标准品,阿拉丁试剂有限公司。
仪器:高效液相色谱,Agilent 1260 infinity (Agilent technologies, Palo Alto, CA),配备UV/Vis检测器和有机酸柱(6.5×300 mm Alltech OA-1000, GRACE, Columbia,美国);气-质联用仪,Trace GC Ultra DSQ II (Thermo,美国); 配备 HP-5MS毛细管色谱柱( 30.0 m × 320 μm ×0.25 μm,Agilent,美国)。
1.4 实验方法
红曲制作:参考文献[9]方法制作。
醋曲及醋坯制作:参考文献[10]所述的工艺流程操作与控制。醋坯的组成是:麸皮∶次粉∶淋后醋坯(湿重,水分58%~60%)∶醋曲∶水为1∶0.4∶2∶0.15∶0.9。酿酒活性干酵母0.14%及根霉曲0.14%,活化后,代替酒母加入醋坯中,然后分别加入曲坯质量的2%、3%和4%的红曲,混合均匀,装入陶缸内发酵,品温超过45 ℃时,翻醋坯降温。经30 d发酵后上层盖盐陈酿30 d。
1.5 分析检测方法
1.5.1 理化指标测定方法
总酸(以乙酸计):GB/T 5009.41—2003;氨基态氮:甲醛法GB/T5009.39—2003;非挥发酸(以乳酸计):GB/T18187—2000;总酯(以乙酸乙酯计):参考文献[11]所述方法。
1.5.2 有机酸测定
准确取10.00 mL醋液,移至25 mL容量瓶中,蒸馏水定容,离心分离(4 ℃,12 500 r/min,10 min),上清液经活化的Sep-PakC18固相萃取小柱过滤,滤清液再经0.22 μm微孔膜过滤后,注入高效液相色谱仪(high performance liquid chromatography, HPLC)检测各种有机酸的含量。操作条件:检测波长:210 nm;柱温:75 ℃;流动相:H2SO4(9 mmol/L);进样体积:10 μL;流速:0.6 mL/min。通过保留时间及峰面积确定检测的有机酸浓度。
1.5.3 挥发性组分的检测
[12]所述方法。操作过程简述如下:取0.5 mL样液置于20 mL顶空瓶中,加0.5 mL超纯水、5 μL辛酸甲酯混合均匀后,加入NaCl至饱和后,置于(60±0.5) ℃水浴中预平衡15 min后,插入固相微萃取针头萃取40 min,将其取出插入气相色谱-质谱联用仪(gas chromatography-mass spectrometry, GC-MS)进样口解吸3 min,进行GC-MS分析。
色谱及质谱的操作条件:色谱条件:进样口温度为250 ℃;不分流;初始温度40 ℃,保持5 min,以5 ℃/min升到220 ℃保持5 min;载气:高纯氦气(99.99%),流速为1 mL/min。质谱条件:连接口温度:250 ℃;电离方式:EI;电子能量:70 eV;离子源温度:200 ℃;扫描范围:40~500 amu。
定性:检出的质谱图,与NIST2005库比对鉴定,匹配度大于800(最大值为1 000)的结果才予以报道。
定量:样品中鉴定出的化合物以与辛酸甲酯质量浓度之比计算,挥发性组分的质量浓度为平均值±标准偏差(RSD)(n=3)。
1.5.4 总黄酮含量测定
参考文献[13]所述方法。步骤如下:准确吸取醋液1 mL, 定容至10 mL,混匀后取1 mL于10 mL容量瓶中,加入5 g/100 mL的NaNO2溶液0.5 mL混合均匀,放置6 min,然后加入10 g/100mL的Al(NO3)3溶液0.5 mL混合均匀,放置6 min,最后加入4 g/100 mL的NaOH溶液3 mL,以蒸馏水定容,静置15 min显色后,在波长510 nm处测定其吸光度。以同样条件芦丁浓度范围在0.0~4.8 μg/mL建立回归方程,确定测得所测ΔOD510的总黄酮的相对含量(以芦丁的相当量值表示)。
1.5.5 总多酚含量测定
参考文献[14]所述方法。步骤如下:取稀释10倍的醋液0.1 mL,转移至10 mL的容量瓶中,分别加入1.0 mL Folin-ciocalteu,3.0 mL Na2CO3溶液(0.7 mol/L),蒸馏水定容,混匀,室温显色反应2 h,在波长765 nm处测定吸光度。以同样条件没食子酸浓度范围为0~180 μg/mL建立回归方程,确定所测ΔOD765的总多酚的相对含量(以没食子酸的相当量表示)。
1.5.6 清除自由基能力的测定
参考文献[15]所述方法。步骤如下:准确称取59 mg DPPH,用乙醇溶解后定容至100 mL为储备液,使用时稀释10倍。取4 mL DPPH工作液(0.15 mmol/L)与2 mL稀释10倍的醋液混合均匀,暗反应30 min后,517 nm下测定吸光度OD1。以4 mL乙醇溶液代替工作液与2 mL稀释的醋液混合均匀及4 mL DPPH工作液与2 mL乙醇混合均匀,相同条件反应,分别测得的吸光度分别是OD2和OD0,根据公式(1)求得DPPH自由基清除率。
(1)
式中:OD1,4 mL DPPH工作液与2 mL稀释10倍的醋液在517 nm下的吸光度;OD2,4 mL乙醇溶液与2 mL稀释10倍的醋液在517 nm下的吸光度;OD0,4 mL DPPH工作液与2 mL乙醇溶液在517 nm下的吸光度。
1.5.7 色值测定
参考文献[16]所述方法。过程如下:醋液装入比色皿中,用x-rite 8200分光光度仪(爱色丽,美国)检测420 nm的吸收率及L*a*b*颜色空间(CIELAB)。
1.6 数据处理
使用X-caliber软件系统处理结果数据,各组分的相对含量。利用Origin Pro 8.5作图软件对单因素实验数据进行作图分析。利用 SPSS 17.0软件对数据进行显著性分析(P<0.05)
2 结果与分析
2.1 强化对生醋液的理化指标、有机酸及色值的影响
如表1所示,添加2%(H2)、3%(H3)和4%(H4)红曲,提高了醋液的酸度、总酯和非挥发酸。红曲参与酿造,强化了醋坯的酯化作用,所以其总酯分别提高了47.52%、38.46%和19.80%,同时乳酸是M.purpureus分泌的主要有机酸,其次是琥珀酸,因此非挥发酸分别增加了38.66%、18.49%和47.90%,而氨态氮的含量差异不显著。

表1 醋液理化指标
如表2所示,强化使有机酸含量显著增高,H4较对照样增高了1.28倍,而H2增加了88.96%,前者分别使柠檬酸、琥珀酸和乳酸增加了6.61倍、11.21倍、1.40倍,后者分别增加了2.29倍、5.17倍、0.99倍。酒石酸、L-焦谷氨酸、L-苹果酸和乙酸略有增高,前二者随红曲用量增大而增高。样品间有机酸的比例略有不同,乙酸和乳酸之和在H2和H3的比例分别是73.20%和78.34%,而H4中的则是66.27% ,低于对照的(70.40%)。强化改变了群落和代谢途径,影响了有机酸的含量与组分,这些参数可用于辨析工艺与产品特色[17]。

表2 醋液的有机酸含量 单位:μg/mL
在CIELAB颜色空间里,L*值表示亮度,其值从100(白色)过渡到0(黑色),a*和b*表示色度值,分别表示红绿轴上和蓝黄轴颜色的饱和度,即其中-a*为绿,+a*为红,其中-b*为蓝, +b*为黄。从表3和图1所示的结果表明,强化使醋液颜色加深,2%和4%用量的效果显著,因红曲产生大量红色素,提高了红色色值,但蓝黄饱和度差异不显著。
表3 醋液的色度值
Table 3 Color chromaticity in fresh vinegar
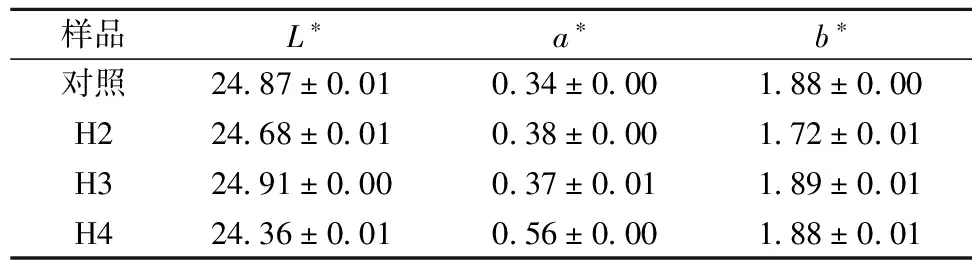
样品L∗a∗b∗对照2487±001034±000188±000H22468±001038±000172±001H32491±000037±001189±001H42436±001056±000188±001
2.2 对总黄酮、多酚及DPPH自由基清除能力的影响
多种中国食醋因含多酚类组分而具有抗氧化作用[18],同样的四川麸醋醋液中也检出了黄酮、多酚类组分,并证实具有清除DPPH自由基的能力,其含量低于文献报道数量。作为四川麸醋的主要原料之一麸皮,含有多酚,且含量与DPPH自由基清除率间呈线性关系[19]。除了原料的影响外,还与参与代谢的微生物菌群、工艺及煮醋过程所形成的类黑色素有关[20]。红曲用量几乎不影响其含量,且与DPPH自由基清除率间无相关性,但强化使黄酮类组分略有提高,红曲量在4%时,黄酮类含量显著提高,从而使其DPPH自由基清除率增幅较大。
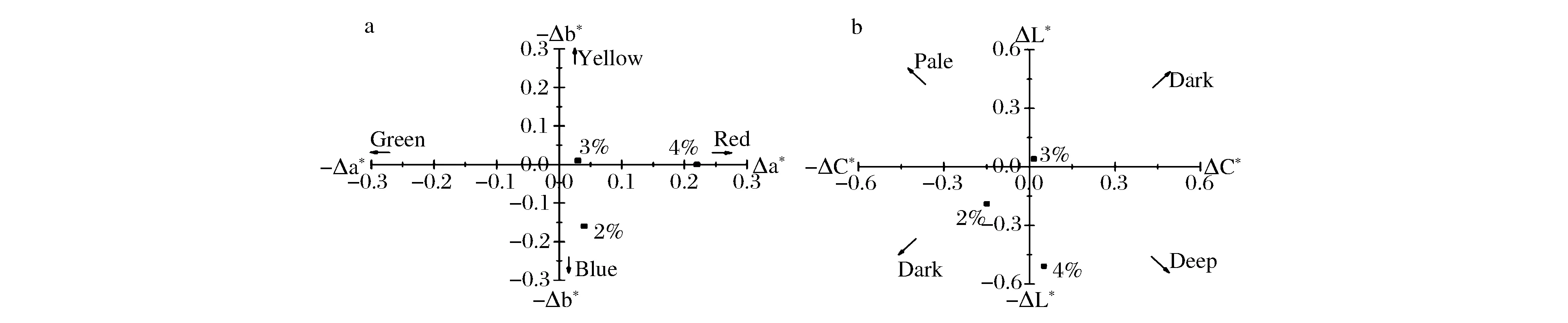
a-Δa*~Δb*散点;b-ΔC*~ΔL*散点图图1 醋液色度差异图Fig.1 Difference of color chromaticity in fresh vinegar
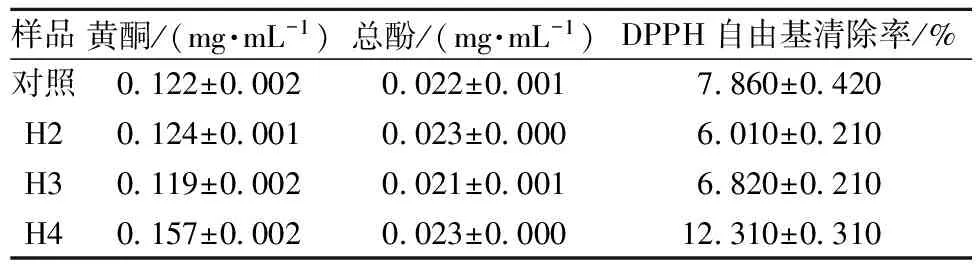
样品黄酮/(mg·mL-1)总酚/(mg·mL-1)DPPH自由基清除率/%对照0122±00020022±00017860±0420H20124±00010023±00006010±0210H30119±00020021±00016820±0210H40157±00020023±000012310±0310
2.3 醋液的挥发性组分分析
醋液中挥发性组分色谱图见图2。红曲强化改变了挥发性组分的总量、数量及比例,且因红曲用量不同而异,H4(18.44mg/L)增加、H2(16.83mg/L)略增,但H3(15.05mg/L)减少。对照样检出了56种组分,优势组分大小依次为酸类(40.21%)>吡嗪类(18.38%)>酮类(15.13%)>酚类(14.68%)。H2检出了60种组分,优势组分的大小顺序为酸类(35.50%)>醇类(16.44%)>吡嗪类(13.21%)>酮类(12.93%)。H3检出了55种组分,优势组分大小顺序为酸类(38.40%)>醇类(18.65%)>酮类(11.87%)>酚类(11.70%)。H4检出了59种组分,优势组分的大小顺序为酸类(33.32%)>醇类(31.14%)>酮类(12.05%)>酯类(9.19%)。如图3所示,强化使醇类、酯类比例与含量增高,醇类分别增高了2.25倍、2.30倍和5.75倍,酯类分别增高2.30倍、1.74倍及2.84倍了;酚类、酮类和吡嗪类降低,且后者与红曲用量成反比。

B-H2;C-H3;D-H4;E-对照图2 醋液中挥发性组分的色谱图Fig.2 Chromatograms of volatiles in fresh vinegar
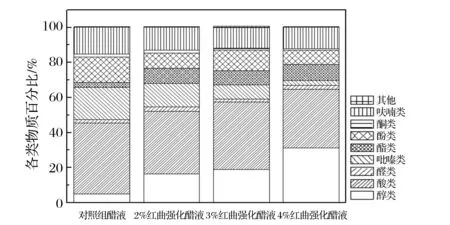
图3 各种样品中挥发性组分的比例Fig.3 Proportion of volatiles in fresh vinegar
仅在对照样中检出的有10种组分,分别是2,3-己二醇、2-糠醇、3-甲基-2-丁烯酸,3-癸烯酸、壬烯酸、苯丙醛、2,3-二甲基-5-乙基吡嗪、2,5-吡咯烷二酮、5-(1-苯乙基)-四氢呋喃-2-酮、1-异氰基-2-甲基苯。仅在所有强化醋液中检出的有9种组分,分别是苯甲醇,丙酸,壬酸、苯乙酸乙酯、丙酸-2-苯乙基酯、棕榈酸乙酯、3-呋喃甲醇、八氢-2,2-联呋喃、5-己基二氢-2(3H)-呋喃酮。而在强化醋液中仅H2和H3中新检出了2,3-丁二醇二乙酸酯、辛酸、甲基吡嗪、2,3-丁二醇二乙酸酯和3-乙基-4-羟基苯胺,仅在H3和H4中新检出是4-甲基戊酸、2,3-丁二醇、N-(2-甲基丙)-乙酰胺和1-异氰基-2-甲基苯。仅在H2、H3和对照样中检出的是辛酸和2,3-丁二醇二乙酸酯。仅在H2和对照样中检出的7-辛烯酸、香草醛、2,3-二甲基-5-(1-丙烯基)-吡嗪和2-乙酰基-3,4,6-三甲基吡嗪,而仅在H4和对照样中检出2-甲氧基-4-乙烯基苯酚和2-甲氧基-4-丙基苯酚。仅在H2中检出有5种组分,分别是5-甲基-2-(1-甲基乙基)环己醇、1-甲基-4-(1-甲基乙基)环己醇、2,3-双氢,1H-茚-4-联苯单甲醛、乙酸-5-甲基-2-(1-甲基乙基)环己醇酯、5-甲基-2(1-甲基乙基)环己酮,而仅在H4中检出的6种组分,分别是辛酸乙酯、2-羟基丙酸乙酯、甲酸己酯、草酸己基-2-苯乙基酯、5-庚基二氢-2(3H)-呋喃酮和1,2-环氧十一烷。苯乙酸乙酯、2-苯基乙酸乙酯、2-苯基丙酸乙酯和棕榈酸乙酯的含量随红曲用量增大而提高。
2.4 强化对风味影响的评估
基于挥发性组分的气味活度值(odor activity value,OAV,质量浓度与阈值的比值)确定强化对其风味轮廓特征的贡献度,结果如表5所示。
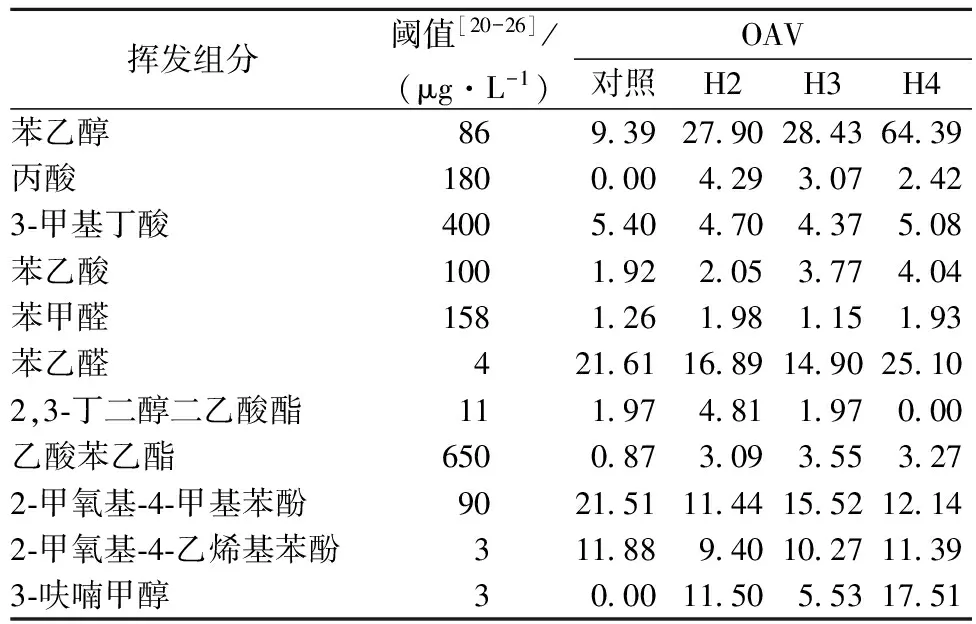
表5 生醋中主要贡献挥发组分的 OAV值
11个OAV>1的组分有显著的差异,贡献度大的有苯乙醇、苯乙醛、2-甲氧基-4-甲基苯酚、2-甲氧基-4-乙烯苯酚和3-呋喃甲醇。图4为醋液中11种特征风味化合物的OAV轮廓分析图,各物质对生醋风味的贡献度分为-0. 5~2. 0,其中大于0表示有贡献。对照样的主要香气成分为苯乙醛和2-甲氧基-4-甲基苯酚,呈现出蜜香、辛香、药香、木香及香荚兰香;强化醋液主要香气成分为苯乙醇和苯乙醛,呈现出玫瑰香、花香及巧克力香。
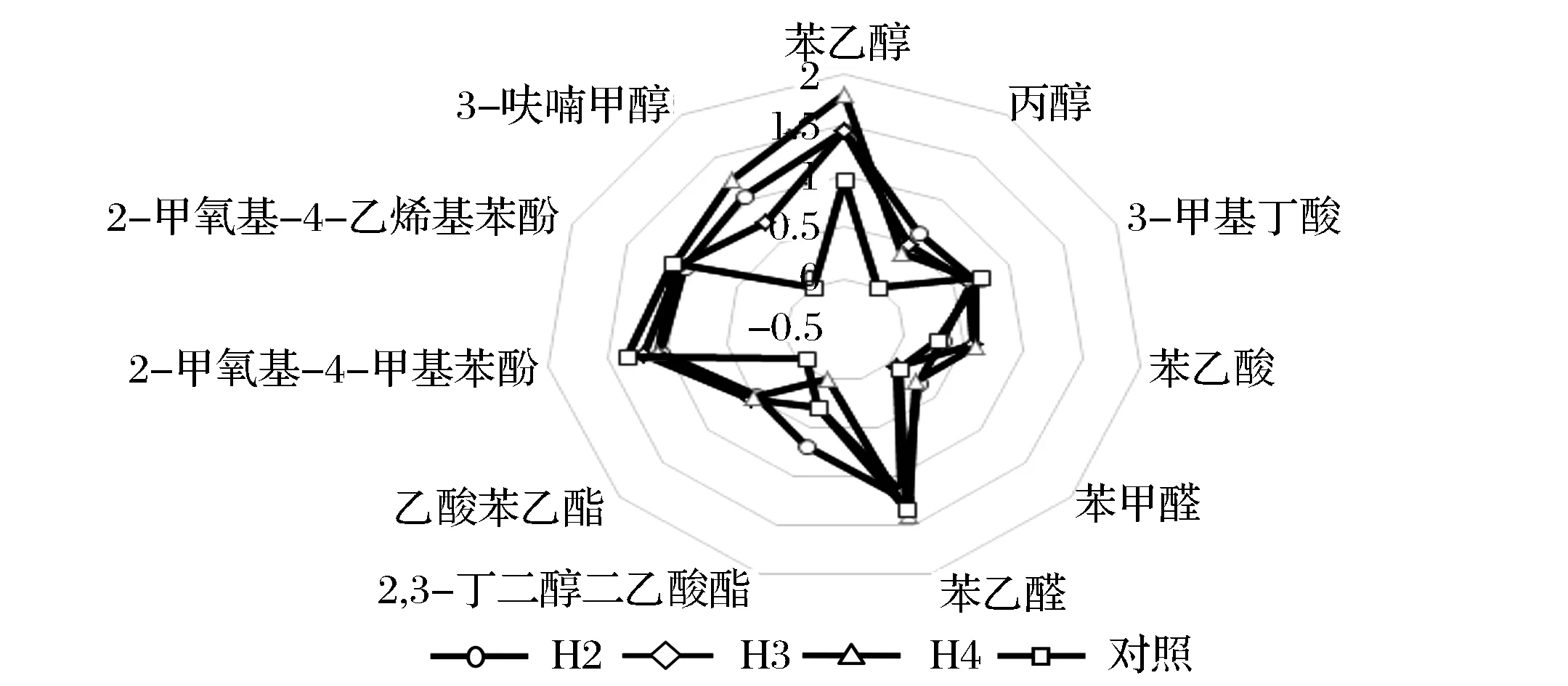
图4 特征风味组分的OAV轮廓分析图Fig.4 The OAVs profile of selected volatile compounds
3 结论
红曲强化显著地提高了醋液的酸度、总酯和非挥发酸;同时也使有机酸中的柠檬酸、琥珀酸和乳酸的含量显著提高,酒石酸、L-苹果酸、乙酸和L-焦谷氨酸略有增高;提高红曲用量有益于酒石酸和L-焦谷氨酸的增高,但使L-苹果酸和乙酸降低;红曲产生红色色素,因此强化提高了红色色值;首次确定了四川麸醋因含多酚、黄酮等组分,而具有DPPH自由基清除能力。
红曲强化同样导致其挥发性组分组成轮廓的改变,显著地提高了醇类和酯类组分的含量与比例,减少了吡嗪类和酚类等组分的含量与比例。对照样的酸类和吡嗪类为优势组分,其中苯乙醛和2-甲氧基-4-甲基苯酚有较大贡献,蜜香、辛香、药香、木香及香荚兰香突出。强化后醋液的苯乙醇和苯乙醛贡献度高,玫瑰香、花香及巧克力香突出。
参考文献
[1] ENTANI E,ASAI M,TSUJIHATA S,et al.Antibacterial action of vinegar against food-borne pathogenic bacteria includingEscherichiacoliO157:H7[J].Journal of Food Protection,1998,61(8):953-959.
[2] NA Li-xin,CHU Xia,JIANG Shuo,et al.Vinegar decreases blood pressure by down-regulating AT1R expression via the AMPK/PGC-1α/PPARγ pathway in spontaneously hypertensive rats[J].Eur J Nutr,2016,55:1 245-1 253.
[3] 刘军,朱文优,杨勇.保宁醋固态发酵理化指标的动态分析[J].中国酿造,2006,5(158):45-47.
[4] 张奶英,刘书亮,杨勇,等.四川麸醋发酵过程中理化指标与微生物菌相的动态分析[J].食品工业科技,2014(11):174-178.
[5] 彭杨,张奶英,何利,等.基于PCR-DGGE技术的四川麸醋固态发酵过程中微生物群落分析[J].现代食品科技,2016,8(32):优先出版.
[6] 韩志双,刘军,黄思敏,等.传统麸醋醋醅中一株产香酵母的筛选鉴定及生长特性研究[J].中国调味品,2013,10(380):41-45.
[7] 黄思敏,刘军,朱文优,等.传统麸醋醅中一株芽抱杆菌的筛选和鉴定[J].中国调味品,2013,38(5):18-22.
[8] 秦臻,蔡素梅,周荣清等.一株产生淀粉分解酶犁头霉的分离鉴定及其酶学性质的研究[J]. 微生物学报,2011,38(5):729-735.
[9] 彭熙敏,黄著,刘超兰,等.红曲霉培养条件对酯化力影响的研究[J].酿酒科技,2009(1):17-20.
[10] 赵德安.四川麸醋[J].中国酿造,1990(6):44-48.
[11] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007.
[12] CIRLINI M,CALIGIANI A,PALLA L,et al.HS-SPME/GC-MS and chemometrics for the classification of Balsamic Vinegars of Moderna of different maturation and ageing[J].Food Chemistry,2011,124:1 678-1 683.
[13] 李利华.鱼腥草中总黄酮的含量测定及抗氧化性的研究[J].西北药学杂志,2009,3(24):177-180.
[14] 田文礼,孙丽萍,董捷,等.Folin-Ciocaileu比色法测定蜂蜜花粉中总酚[J].食品科学,2007,28(2):258-260.
[15] SONG Y R,SHINN S,BAIK S H. Physicochemical properties, antioxidant activity and inhibition of α-glucosidase of a novel fermented pepper (CapsiccumannuumL.)leaves-based vinegar[J].International Journal of Food Science and Technology,2014,49:2 491-2 498.
[16] MIYAGI A,SUZUKI T,NATETANI H,et al.Color control of Japanese soy sauce (shoyu)using membrane technology[J].Food and Bioproducts Processing,2013,91:507-514.
[17] 余宁华,陆震明,许伟,等.基于主成分分析的中国发酵食醋有机酸含量的差异性分析[J].食品与发酵工业,2010,36(10):144-148.
[18] 徐清萍,陶文沂,敖宗华.26种市售食醋抗氧化性的比例[J].食品与发酵工业,2006,32(1):95-98.
[19] 张莉,李志西.小麦麸皮对不同原料食醋抗氧化性的影响[J].麦类作物学报,2009,29(5):915-918.
[20] XU Qing-ping,TAO Wen-yi,AO Zong-hua.Antioxidant activity of vinegar melanoidins[J]. Food Chemistry,2006,102:841-849.
[21] 张强,辛秀兰,陈亮.主成分分析法评价红树莓果醋的相对气味活度值[J].现代食品科技,2015,31(11):332-337.
[22] ZHU Hong,ZHU Jie,WANG Li-li,et al. Development of a SPME-GC-MS method for the determinationof volatile compounds in Shanxi aged vinegar and its analyticalcharacterization by aroma wheel[J].Food Sci Technol,2016,53(1):171-183.
[23] 熊越,贺稚非,李洪军,等.顶空固相微萃取-气质联用分析四川麸醋的香气成分[J].食品科学,2011,32(2):252-252.
[24] CALLEJON R M,MORALES M L,FERREIRA A C,et al.Defining the typical aroma of sherry vinegar: sensory and chemical approach[J].Agric Food Chem,2008,56(17):8 086-8 095.
[25] ACENA L,VERA L,GUASCH J,et al.Chemical Characterization of commercial sherry vinegar aroma by headspace solid-phase micro extraction and gas chromatography-olfactometry[J].Agric Food Chem,2011,56(17):8 086-8 095.
[26] 魏永义.镇江香醋香气检测及其香气指纹图谱的研究[D].镇江:江苏大学,2007.
Effect of strengthening Sichuan bran vinegar fermentation byMonascuskoji on the metabolites profiles
QIU Xue1, HUANG Jun1, ZHANG Li-qiang1, WEN Ping3, HE Pei3, WU Chong-de1, DING Xiao-fei1, ZHOU Rong-qing1,2,4*
1(Sichuan University, College of Light Industry, Textile & Food Engineering, Chengdu 610065,China) 2 (Sichuan University,National Engineering Laboratory for Clean Technology of Leather Manufacture, Chengdu 610065,China) 3 (Sichuan Langzhou Vinegar Co,Ltd, Langzhong 637400,China) 4(National Solid Fermentation Engineering Research Center,Luzhou 646000,China)
The effect of strengthening bran vinegar fermentation byMonascuskoji (Monascus purpureus:As3.972) on the metabolites was investigated in present article. Results showed that the titrable acidity and contents of esters and unvolatile acid were increased. The contents of citric acid, succinic acid and lactic acid among organic acid were also increased notably, and the red chromaticity in fresh vinegar was raised. Meanwhile, DPPH scavenging activity in Sichuan brane vinegar was firstly identified. The content of alcohols and esters and their proportion in the volatiles were enhanced significantly, while those of pyrazines and phenols decreased. The contents of phenethyl alcohols and phenylacetaldehyde increased with the strengthening ofMonascus, which contributed to the strong fragrance of rose, flowers and chocolate.
sichuan bran vinegar;Monascuskoji; strengthening fermentation; metabolites; volatiles
10.13995/j.cnki.11-1802/ts.201704008
硕士研究生(周荣清教授为通讯作者,E-mail:rqzhou@163.com)。
四川省科技支撑计划项目(2014SZ0129)
2016-10-11,改回日期:2016-12-14
