S100A8在非小细胞肺癌中的表达及其临床意义
2017-06-19吕彦天阮婷徐国鹏
吕彦天 阮婷 徐国鹏
S100A8在非小细胞肺癌中的表达及其临床意义
吕彦天 阮婷 徐国鹏
目的 探讨非小细胞肺癌(non-small cell lung cancer,NSCLC)中S100A8基因的表达以及其与NSCLC患者临床病理特点之间的关系。方法 以免疫组织化学方法检测96例NSCLC及35例癌旁肺组织中S100A8蛋白的表达,并分析其与临床病理特点之间的关系。 结果 免疫组化结果显示,S100A8在肿瘤组织中的水平显著高于癌旁组织(P<0.05)。在TNM分期较晚的患者中S100A8表达显著增高(P<0.05)。高分化NSCLC中S100A8表达水平显著低于中低分化NSCLC(P<0.05)。结论 S100A8蛋白表达在NSCLC组织中明显高于癌旁肺组织,随病理分期增高及肿瘤分化程度减低,S100A8蛋白表达阳性率增高,提示S100A8蛋白与NSCLC的关系密切相关。
非小细胞肺癌;S100A8;免疫组织化学
目前威胁人类的首要恶性肿瘤仍是肺癌,《CA Cancer J clin》在2015年2月4日发布了《2012年全球癌症统计报告》[1]。报告估算全球癌症新发例数约为1410万,其中气管和支气管和肺部肿瘤182.47万,每年癌症死亡例数为820万,其中呼吸道肿瘤158.99万,其发病率及死亡率居于癌症首位,并且无论是发展中国家还是发达国家,肺癌都是首要死亡原因。多数患者就诊时已处于中晚期,约4/5的患者失去了手术机会,5年生存率不到15%。因此,对肺癌的发病机制进行深入研究,找到新的治疗方法迫在眉睫。S100A8最初发现与许多炎症性疾病有关,近年来发现,其与肿瘤的关系密切,在多种肿瘤组织中其表达水平显著升高。目前关于S100A8在肺癌中的表达研究较少,其在组织内的分布及与临床病理特征的关系未被完全证实。本研究通过免疫组化方法检测S100A8在非小细胞肺癌中的表达并分析其与患者临床资料的相关性。
资料与方法
一、临床资料
选取苏州市立医院本部在2013年12月-2015年12月期间,手术切除及气管镜活检的非小细胞癌患者96例蜡块标本,以及术中收集切除的35例肺癌癌旁组织,经影像学和病理学确诊为肺癌。其中男50例,女46例;年龄36-78岁,中位年龄61岁。腺癌49例,鳞癌 38例,腺鳞癌9例。按分化程度:高分化癌41例,中分化癌30例,低分化癌25例。根据国际抗癌联盟2009年第7版的标准进行TNM分期。Ⅰ期18例,Ⅱ期 25例,Ⅲ期 32例,Ⅳ期21例,有淋巴结转移者67例,无淋巴结转移者29例。
二、 实验主要试剂
兔抗人S100A8单克隆抗体购自美Epitomics公司。羊抗兔二抗购自武汉博士德生物工程有限公司,HRP标记的山羊抗兔IgG及DAB 辣根过氧化物酶显色试剂盒(辣根过氧化物酶显色试剂盒)购自碧云天生物科技有限公司。
三、免疫组化
采用免疫组织化学SP法检测,染色步骤严格按试剂盒说明进行。S100A8抗体的稀释浓度为1:100。以肺癌组织作为阳性对照,以PBS液代替一抗作为阴性对照。
四、结果判读
阳性结果为在肿瘤细胞胞浆、胞核或包膜上出现浅黄色、黄褐色或棕黄色点片状特异性染色。染色强度分4个级别:0分为不着色,1分为轻度着色,2分为中度着色,3分为重度着色。每张切片随机选取5个高倍视野,每个高倍视野计数100个癌细胞,以阳性细胞百分比进行评分:<5%为0分;5%-25%为1分;25%-50%为2分;50%-75%为3分;>75%为4分。以染色阳性肿瘤细胞数目得分和着色强度得分的乘积为总分进行判断。0-1分为(-),2-4分为(+)5-8分为(),9-12为(),其中(-)和(+)为低表达组,()和()为高表达组。
五、统计学分析
采用SPSS19.0软件进行统计学分析,非小细胞肺癌及癌旁组织中S100A8蛋白表达比较以及S100A8在不同性别、年龄、分期、分化程度之间的表达差异比较均采用χ2检验。以P<0.05为差异具有统计学意义。
结 果
一、S100A8在NSCLC及其相应癌旁组织中的表达:S100A8定位于胞质和胞核,以细胞质表达为主,呈棕黄色或棕褐色。免疫组化结果显示:96例NSCLC中S100A8的阳性表达率为 78.1%(75/96),其中(+)占 15例,()占34例,()占26例,35例癌旁肺组织中S100A8的阳性表达率为8.5%(3/35)。 NSCLC中S100A8的表达显著高于癌旁组织(见图1),差异有统计学意义(P<0.05)。
二、S100A8阳性表达与NSCLC患者临床病理特征之间的关系:结果显示:S100A8的表达水平在不同性别、年龄、肿瘤大小、组织学类型、淋巴结转移的患者中表达无差异(P>0.05),而在低分化肺癌及较晚TNM分期的肺癌标本中显著表达,P<0.05,(表1)。
讨 论
S100A8为钙结合蛋白S100 蛋白家族成员之一,定位于人染色体lq21,该区易发生染色体的缺失、易位、重叠等改变,稳定性差,与肿瘤的发生、发展密切相关[2]。S100A8表达于骨髓来源的细胞中,包括软骨细胞、破骨细胞、肥大细胞、中性粒细胞以及一些处于早期分化阶段的骨髓细胞,但淋巴细胞中无表达[3-5]。S100A8初始发现与许多炎症性疾病有关,如炎症性肠病、囊性纤维化、类风湿关节炎、多发性硬化以及系统性红斑狼疮、血管炎、粥样硬化、糖尿病和其他炎症紊乱性疾病[6-8]。近年来在许多肿瘤组织如结肠癌、胰腺癌、膀胱癌、胃癌、甲状腺癌、乳腺癌、肺癌、卵巢癌和皮肤癌中, 肿瘤细胞及其周围浸润的间质免疫细胞上S100A8的表达明显上调[9]。但S100A8与肿瘤的关系目前仍较复杂,其在肿瘤组织中差异性表达,并且既有抗肿瘤作用,亦有促肿瘤作用,推测此双重作用与其局部浓度有关。在低浓度(<20 μg/mL)时,可促进肿瘤细胞增殖;而在较高浓度(20-250μg/mL)时可导致肿瘤细胞的凋亡[10-12]。
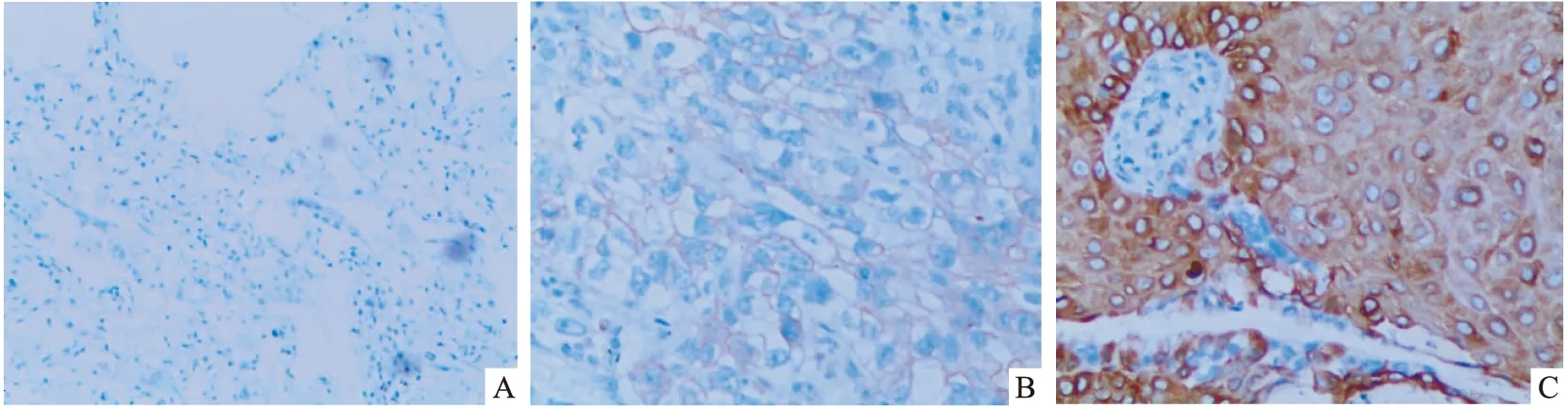
图1 S100A8在肺癌及癌旁组织中的表达 A:癌旁组织无表达(×200);B:肺癌组织中度表达(×400);C:肺癌组织高表达(×400)
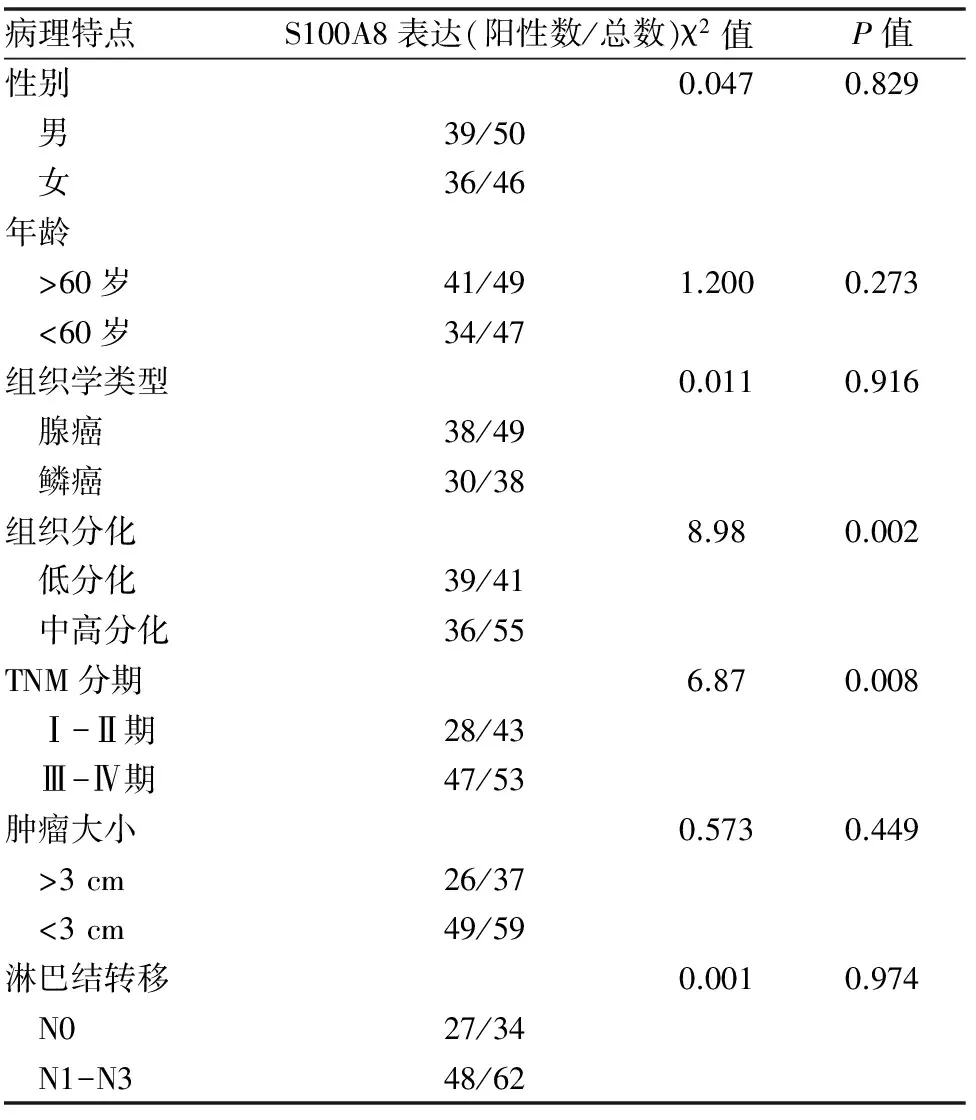
表1 S100A8蛋白阳性表达与NSCLC患者临床病理特征之间的关系
目前关于S100A8与肺癌的研究相对较少,Su等发现S100A8在肺癌组织中的表达明显高于正常肺组织及良性肿瘤,且在腺癌细胞和Ⅳ期肿瘤上更明显[13]。Xu等研究表明,鳞癌细胞上的S100A8的表达相对于腺癌、小细胞癌和大细胞癌更明显[14]。以上研究均从临床病理特点及预后分析研究S100A8与肺癌的关系,但在不同病理类型肿瘤表达S100A8的结论上不尽一致。本课题研究表明,S100A8蛋白表达在NSCLC组织中明显高于癌旁正常肺组织,随病理分期增高及肿瘤低分化,S100A8蛋白表达阳性率增高,而与年龄、性别、组织类型、肿瘤大小及淋巴结转移无明显相关,分析可能与所选病例数目及所采用试验方法不一有关。
肺癌的发生除了与肿瘤自身异常癌基因表达有关外,还与其周围微环境密切相关。肿瘤微环境包括肿瘤细胞及周边间质细胞,肿瘤微环境可诱导免疫抑制细胞的广泛聚集,免疫抑制细胞进一步合成大量的细胞因子释放入微环境中,促进微环境的形成,形成正反馈效应[3,15-16],免疫抑制细胞中以髓源性抑制细胞(MDSCs)具有重要作用。MDSCs是一群具有多向分化潜能及免疫抑制功能的缺乏淋巴系成熟标志的异质细胞,包括各种分化状态的未成熟粒细胞、巨噬细胞、骨髓祖细胞和树突状细胞等。研究表明,S100A8在MDSCs的产生和聚集过程中起到了重要的作用[17-18]。MDSCs不仅可以分泌S100A8,并且可以通过自分泌的方式促进MDSCs在肿瘤组织中的聚集。而肿瘤细胞高表达S100A8可以更易募集MDSCs在肿瘤微环境中聚集。有文献报道在小鼠肺癌肝转移模型中,MDSCs通过上调肿瘤细胞S100A8的表达促进侵袭和转移[19],抑制S100A8的表达小鼠的肝转移明显减少,这表明S100A8可作为肺癌治疗的潜在靶点。
总之,本课题研究表明,S100A8在肺癌中表达显著高于癌旁组织,且其与肿瘤低分化及转移有关,可作为肺癌治疗的潜在靶点。由于S100A8与肺癌的关系仍较复杂,且本研究仅是观察性研究,下一步拟通过肿瘤细胞行生物学功能实验进一步研究其与MDSCs和肺癌侵袭转移之间的作用。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Heizmann CW,Fritz G,Schafer BW.S100 proteins:structure,functions and pathology[J].Front Biosci,2002,7(5):1356-1368.
[3] Allavena P,Mantovani A.Immunology in the clinic review series; focus on cancer:tumour-associated macrophages: undisputed stars of the inflammatory tumour microenvironment[J].Clin Exp Immunol,2012,167(2):195-205.
[4] Trinchieri G.Cancer and inflammation: an old intuition with rapidly evolving new concepts[J].Annu Rev Immunol,2012,30(1):677-706.
[5] Cheng P,Corzo CA,Luetteke N,et al.Inhibition of dendritic cell differentiation and accumulation of myeloid-derived suppressor cells in cancer is regulated by S100A9 protein[J].J Exp Med,2008,205(10):2235-2249.
[6] Foell D,Wittkowski H,Vogl T,et al.S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules[J].J Leukoc Biol,2007,81(1):28-37.
[7] Goyette J,Geczy CL.Inflammation-associated S100 proteins: new mechanisms that regulate function[J].Amino Acids,2011,41(4):821-842.
[8] Van Lent PL,Grevers L,Blom AB,et al.Myeloid-related proteins S100A8/S100A9 regulate joint inflammation and cartilage destruction during antigen induced arthritis[J].Ann Rheum Dis,2008,67(12):1750-1758.
[9] Salama I,Malone PS,Mihaimeed F,et al.A review of the S100 proteins in cancer[J].Eur J Surg Oncol,2008, 34(4):357-364.
[10] Ghavami S,Chitayat S,Hashemi M,et al.S100A8/A9: a Janus-faced molecule in cancer therapy and tumorgenesis [J].Eur J Pharmacol,2009,625(1-3):73-83.
[11] Turovskaya O,Foell D,Sinha P,et al.RAGE,carboxylated glycans and S100A8/A9 play essential roles in colitis-associated carcinogenesis[J].Carcinogenesis,2008,29(10):2035-2043.
[12] Ghavami S,Kerkhoff C,Los M,et al.Mechanism of apoptosis induced by S100A8/A9 in colon cancer cell lines the role of ROS and theeffect of metal ions[J].J Leukoc Biol,2004,76(1):169-175.
[13] Su YJ,Xu F,Yu JP,et al.Up-regulation of the expression of S100A8 and S100A9 in lung adenocarcinoma and its correlation with inflammation and other clinical features[J].Chin Med J (Engl),2010,123(16):2215-2220.
[14] Xu Y,Cao LQ,Jin LY,et al.Quantitative Proteomic Study of Human Lung Squamous Carcinoma and Normal Bronchial Epithelial Acquired by Laser Capture Microdissection[J].J Biomed Biotechnol,2012,2012(1): 1-12.
[15] Gabrilovich DI,Ostrand-Rosenberg S,Bronte V.Coordinated regulation of myeloid cells by tumours[J].Nat Rev Immunol,2012,12(4):253-268.
[16] Fridlender ZG,Albelda SM.Tumor-associated neutrophils:friend or foe [J].Carcinogenesis,2012,33(5):949-955.
[17] Cheng P,Corzo CA,Luetteke N,et al.Inhibition of dendritic cell differentiation and accumulation of myeloid-derived suppressor cells in cancer is regulated by S100A9 protein[J].J Exp Med,2008,205(10):2235-2249.
[18] Wang L,Chang EW,Wong SC,et al.Increased myeloid-derived suppressor cells in gastric cancer correlate with cancer stage and plasma S100A8/A9 proinflammatory proteins[J].J Immunol,2013,190(2):794-804.
[19] Lim SY,Yuzhalin AE,Gordon-Weeks AN,et al.Tumor-infiltrating monocytes/macrophages promote tumor invasion and migration by upregulating S100A8 and S100A9 expression in cancer cells[J].Oncogene,2016,35(44):5735-5745.
Expression of S100A8 in non-small cell lung cancer and its clinical significance
LVYan-tian,RUANTing,XUGuo-peng
DepartmentofRespiratoryMedicine,theAffiliatedSuzhouHospitalofNanjingMedicalUniversity,Suzhou,Jiangsu215000,China
Objective To investigate the expression of S100A8 gene in non small cell lung cancer(NSCLC) and the relationship between the expression of S100A8 and clinicopathological features of patients with NSCLC. Methods The expression of S100A8 protein in 96 cases of NSCLC and 35 cases of corresponding para-carcinoma tissue were detected by immunohistochemistry, and the relationship between the expression of S100A8 protein and clinicopathological features was analyzed. Results The immunohistochemical results showed that the level of S100A8 in tumor tissues were significantly higher than that in para-carcinoma tissue (P<0.05). The expression of S100A8 was significantly higher in patients at late TNM stage (P<0.05). The expression level of S100A8 in the highly differentiated NSCLC was significantly lower than that in the low and middle differentiated NSCLC (P<0.05). Conclusion The expression of S100A8 protein in NSCLC tissues is significantly higher than that in para-carcinoma tissue. The positive rate of S100A8 protein expression increases with the late stage of pathology and poor tumor differentiation, which indicates that the S100A8 protein is closely related with NSCLC.
NSCLC; S100A8; immunohistochemistry
10.3969/j.issn.1009-6663.2017.07.011
南京医科大学科技发展基金面上项目(No 2014NJ MU105)
215002 江苏 苏州,南京医科大学附属苏州医院
徐国鹏,E-mail: xuguopeng2046@foxmail.com
2016-11-03]
