特雷唑来对结核分枝杆菌体外抑菌作用的初步研究
2017-06-19廖传玉李同心陈天刚罗明张汇征邓仁麑易学军周刚王静
廖传玉 李同心 陈天刚 罗明 张汇征 邓仁麑 易学军 周刚 王静
特雷唑来对结核分枝杆菌体外抑菌作用的初步研究
廖传玉 李同心 陈天刚 罗明 张汇征 邓仁麑 易学军 周刚 王静
目的 评价特雷唑来对不同耐药类型的结核分枝杆菌临床分离株的体外抑菌作用,为临床应用提供实验依据。方法 采用微孔板观察法,测定特雷唑来对标准株H37Rv及临床分离的敏感、单耐药、多耐药、耐多药以及广泛耐药各20株(共100株)的 MIC,再测定特雷唑来与7种常用抗结核药物联合使用时,对 H37Rv和 10株 MTB临床分离株(敏感、单耐药、多耐药、耐多药以及广泛耐药各2株)的 MIC,通过计算分级抑菌浓度指数(FICI),观察特雷唑来对结核分枝杆菌的体外抑菌作用以及与其他抗结核药物联合使用时是否有协同作用。结果 94.0% (94/100)的结核分枝杆菌临床分离株可被≤0.5mg/L的特雷唑来抑制生长,特雷唑来对敏感株、 MDR菌株(耐多药和广泛耐药)及非MDR耐药菌株(单耐药和多耐药)的MIC差异无统计学意义(χ2=0.578,P>0.05)。特雷唑来与7种抗结核药物在体外联合使用时对结核标准菌株H37Rv和临床分离株均未表现出相关性。 结论 特雷唑来对结核分枝杆菌,尤其是耐多药和广泛耐药菌株,均有很好的体外抑菌作用,且与细菌对其他抗结核药物是否耐药无关。
特雷唑来;结核分枝杆菌;体外抑菌作用
结核病是一种严重危害人民身体健康的慢性传染性疾病。世界卫生组织(WHO)新出版的《2015年全球结核病报告》[1]以及《全国第五次结核病流行病学抽样调查资料汇编》[2],均强调全球和我国新发肺结核患者以及新发耐多药结核病患者逐年增加。耐药结核病尤其耐多药(MDR-TB)和广泛耐药(XDR-TB)结核病已成为全球结核控制工作中的重点和难点。研究耐多药结核(MDR-TB)和广泛耐药结核(XDR-TB)耐药机制以寻找新的抗耐多药结核(MDR-TB)和广泛耐药结核(XDR-TB)药物变得刻不容缓。第一代噁唑烷酮类药物利奈唑胺在我国结核病临床治疗中刚刚起步[3],第二代噁唑烷酮类药物特雷唑来(torezolid)对临床所有的G+,某些G-菌及非典型衣原体显示出较好的抑菌作用[4]。本研究通过测定第二代噁唑烷酮类药物特雷唑来对临床分离的结核分枝杆菌的体外抑菌作用,探讨特雷唑来与其他抗结核药物联用时的体外相互作用,为临床合理使用特雷唑来提供实验室依据。
资料与方法
一、材料
1 菌株来源:结核分枝杆菌菌株:H37Rv标准株(ATCC27294)和100株临床分离株均为重庆市公共卫生医疗救治中心结核实验室(2015.01.01-2016.05.30)保留菌株。100株临床分离株已经结核菌药物敏感性试验(比例法)[5]确定的敏感、单耐药、多耐药、耐多药和广泛耐药的结核分枝杆菌菌株各20株。
2 主要药物和试剂:特雷唑来(美国MCE上海皓鸿药物研究有限公司原粉),异烟肼、利福平、链霉素、乙胺丁醇、卡那霉素、氧氟沙星、利福布汀均为美国Sigma公司产品。
二、方法
1 微孔板观察法检测MIC (mg/L):特雷唑来0.016-8,异烟肼0.0125-1.6,利福平0.0625-8,链霉素0.125-16,乙胺丁醇0.3125-40,卡那霉素0.3125-40,氧氟沙星0.125-16,利福布汀0.03125-4,药物浓度以二倍稀释方式由高至低递减[3]。将标准株H37Rv和100株临床分离菌株转种于改良罗氏培养基上,刮取培养2-3周的新鲜菌落,磨菌比浊制成1麦氏单位。再用液体培养基稀释100倍后,向无菌 96孔板各微孔加入 200 μL菌液[6]。各菌株均设2个不含抗菌药物对照孔,2个含10%及1%菌液浓度的生长对照孔和2个仅含有液体培养基的空白对照孔。将96孔板于37 ℃孵育,7 d后每日观察结果,孔底出现肉眼可见的白色菌体沉淀为生长阳性,无肉眼可见的菌体沉淀为生长阴性。本研究中MIC定义为孔底可见白色菌体沉淀<10%对照孔的最低药物浓度。空白对照孔出现白色沉淀时,提示检测板有污染,需重新进行检测[7]。
2 观察特雷唑来与其他抗结核药物联用的体外相互作用:从上述菌株中选取 H37Rv和10株临床分离株,其中包括敏感株、单耐药菌株、多耐药菌株、耐多药菌株、广泛耐药菌株各2株,进行药物相互作用实验。菌株对上述 7种药物单独应用的MIC检测及其与特雷唑来联合应用的 MIC检测方法同上。联合用药中每种抗结核药的浓度范围以二倍递增的方式,选取 1/32-8倍 MIC的 9个浓度[8]。计算分级抑菌浓度指数 (fractional inhibitory concentration index,FICI):FICI=甲药联用 MIC/甲药单用 MIC+乙药联用 MIC/乙药单用 MIC,FICI≤0.5为协同作用,0.5
三、统计学处理
采用 SPSS16.0统计软件进行统计学分析,3组间 MIC比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
一、特雷唑来对体外不同耐药类型结核分枝杆菌临床分离株的抑菌作用
100株 MTB临床分离株94株(94.0%)可被≤0.5mg/L特雷唑来抑制生长,其余 6株(敏感菌株1株、非MDR耐药菌株2株和 MDR耐药菌株3株)的 MIC>0.5mg/L。特雷唑来对敏感菌株、非MDR耐药菌株和 MDR 耐药菌株的 MIC 主要集中于 0.125 mg/L,在 3组中的比例分别为 65.00%(13/20)、60.00%(24/40)和 55.00% (22/40)。3组的特雷唑来MIC 比较,差异无统计学意义 (χ2=0.578,P>0.05)。(见表1)。
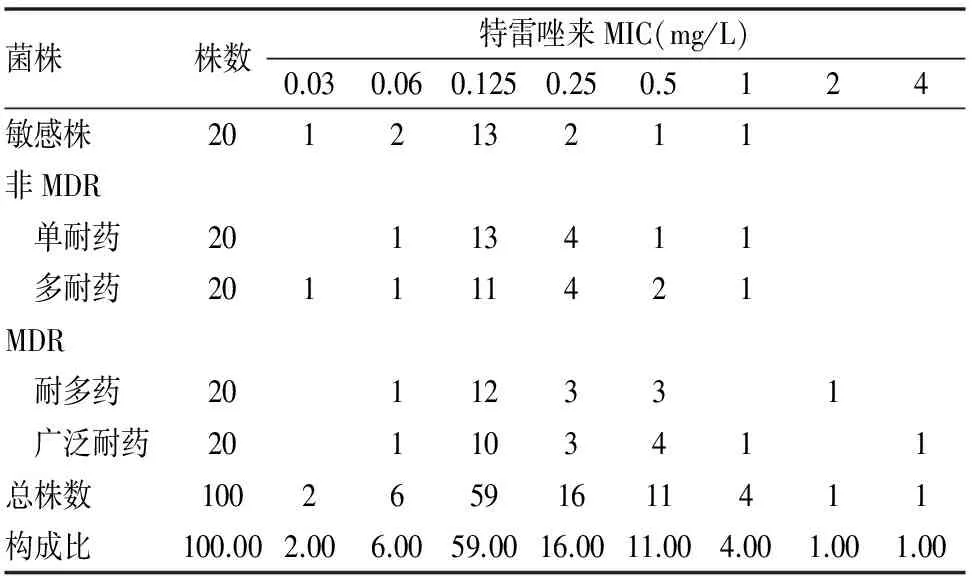
表1 不同耐药类型菌株对特雷唑来的最低抑菌浓度分布(株)
χ2=0.578,P>0.05
二、特雷唑来与其他抗结核药物联用的体外抑菌作用
特雷唑来与其他抗结核药物联用对 H37Rv和10株MTB临床分离株的体外抑制作用(见表2、3)。对于H37Rv,特雷唑来与其他抗结核药物联用后,均表现为无关。特雷唑来与异烟肼、利福平、链霉素、乙胺丁醇、卡那霉素和氧氟沙星联合用药,对10株临床株均表现为无关;特雷唑来与利福布汀联合用药时,其中1株为协同(FICI=0.5),另1株为拮抗(FICI=4.5),其余8株FICI均未表现出相关性。

表2 特雷唑来与其他抗结核药物联用对H37Rv标准株的作用(mg/L)

表3 特雷唑来与其他抗结核药物联用对10株结核分枝杆菌临床分离株的作用
讨 论
利奈唑胺作为第一代噁唑烷酮类药物,已显示出对结核病有良好的治疗效果[3]。噁唑烷酮类药物,可抑制蛋白质合成的起始阶段[9],与其他抗菌药具有不同的作用机制[10],不会与其他抗菌药发生交叉和耐药现象。黄海荣的研究表明,利奈唑胺有很好的抗MTB活性,且与常用抗结核药物在作用机制上完全没有交叉[3]。微孔板观察法检测药物对细菌的 MIC值,已广泛用于抗结核药物的高通量筛选。我们采用微孔板观察法测定第二代噁唑烷酮类药物特雷唑来对 100株 MTB的 MIC值,结果显示,94.0% (94/100)的MTB菌株可被≤0.5mg/L特雷唑来抑制。抗MTB菌活性略优于黄海荣[3]报道利奈唑胺MIC≤1.0 mg/L(94.2%)。与对MRSA和MSSA的MIC均为0.5 μg/mL一致[9]。所以,本研究结果提示,特雷唑来对 MTB敏感株和耐药株均有良好的抑菌作用,且敏感株,MDR菌株,及其他非MDR耐药菌株 MIC 之间的差异无统计学意义。
结核病的化疗原则是联合用药,其目的是利用多种抗结核药物的交叉杀菌作用,提高其杀菌和抑菌能力,以保证疗效和防止耐药性的产生[11]。研究中对结核分枝杆菌进行双向梯度的 MIC测定,根据 2种单药 MIC 设定 9个浓度采用棋盘微量稀释法[12],通过计算 FICI的方法,准确评价特雷唑来与其他抗结核药物联用的体外相互作用。结果表明特雷唑来与7种常用抗结核药物联用时,对 H37Rv标准株均表现出无相关性。特雷唑来与 7种常用抗结核药物联用时,对 10株结核分枝杆菌临床分离株的联合作用,其中1株与利福布汀联用时为协同( FICI=0.5),另1株为拮抗(FICI=4.5),但由于两株FICI处于临界值,提示拮抗和协同作用较轻微,其余8株均表现为无关。另外,其中相同的2种药物对不同菌株联合用药时效果不一致,可能与其浓度相关[3]。研究结果显示,特雷唑来与抗结核药物的联用对MTB临床分离株和标准株H37Rv均表现出不相关。
王吕鸣[13]报道,噁唑烷酮类抗菌药中最有发展前景的是torezolid磷酸盐,Torezolid作为磷酸脂型前药,大大提高了单胺氧化酶抑制剂的抑制作用,这是较于利奈唑胺的优点,该药在PH>5的水溶液中的溶解度为130mg·mL-1,口服生物利用度达到了91.7%。因torezolid解决了水溶性问题,使其可以口服或静脉注射,又因其极大改善了生物利用度,所以torezolid磷酸盐在临床有很好的前景。
本研究存在以下不足:① 微孔板观察法测定特雷唑来对分枝杆菌 MIC 的可靠性尚无定论,测定异烟肼和利福平的 MIC较为可靠,但测定乙胺丁醇和链霉素的重复性较差[14-15];② 本次研究是特雷唑来对MTB的体外抑菌作用的初步研究,没有进行临床用药观察,至于特雷唑来的抗结核作用,在今后的工作中,我们尚需多中心的深入研究以进一步证实。
[1] World Health Organization.Global tuberculosis report 2015[R].Geneva:World Health Organization,2015:1-30.
[2] 王宇.全国第五次结核病流行病学抽样调查资料汇编[M].北京:军事医学科学出版社,2011.
[3] 黄海荣,于霞,姜广路,等.利奈唑胺对分枝杆菌体外抑菌作用的初步研究[J].中华结核和呼吸杂志,2011,34(8):575-578.
[4] Livermore DM,Mushtaq S,Warner M,et al.Activity of oxazolidinone TR-700 against linezolid-susceptible and-resistant staphylococci and enterococci[J]. J Antimicrob Chemother,2009,63(4):713-715.
[5] 赵雁林,刘志敏.结核病实验室标准化操作与网络建设[M].北京:人民卫生出版社,2013:280-282.
[6] 中国疾病预防控制中心.结核分枝杆菌液体药敏实验标准化操作[S].北京:2016.
[7] 桂徐蔚,肖和平,胡忠义,等.氯法齐明对不同耐药类型结核分枝杆菌的体外抑菌活性研究[J].中华结核和呼吸杂志,2011,34 (8):579-581.
[8] Lewis RE,Diekema DJ,Messer SA,et al.Comparison of Etest,chequerboard dilution and time-kill studies for the detection of synergy or antagonism between antifungal agents tested against Candida species[J]. J Antimicrob Chemother,2002,49(2):345-351.
[9] 杨娜,尤启冬.噁唑烷酮类抗菌药的研究进展[J].药学与临床研究,2011,19(4):332-336.
[10] 吴晓光,陆宇,刘荣梅.结核病化学治疗的细菌学基础[J].中国临床医生,2009,27(7):9-10.
[11] 马玙,朱莉贞,潘毓萱.结核病[M].北京:人民卫生出版社,2006:507-531.
[12] Meletiadis J,Pournaras S,Roilides E,et al.Defining fractional inhibitory concentration index cutoffs for additive interactions based on self-drug additive combinations, Monte Carlo simulation analysis, and in vitro-in vivo correlation data for antifungal drug combinations against Aspergillus fumigatus [J].Antimicrob Agents Chemother,2010,54(2):602-609.
[13] 王吕鸣,刘敏,沈思思,等.噁唑烷酮类抗菌药物的研究进展[J].中国药物化学杂志,2013,23(3):218-225.
[14] Leonard B,Coronel J,Siedner M,et al.Inter- and intra-assay reproducibility of microplate Alamar blue assay results for isoniazid, rifampicin, ethambutol, streptomycin, ciprofloxacin, and capreomycin drug susceptibility testing of Mycobacterium tuberculosis[J].J Clin Microbiol,2008,46(10):3526-3529.
[15] 孙庆,赵丽丽,陈燕,等.三种方法进行结核分枝杆菌-乙胺丁醇药物敏感性试验的比较[J].中国防痨杂志,2015,37(4):366-370.
Preliminary study of torezolid on in vitro bacteriostasis of Mycobacterium tuberculosis
LIAOChuan-yu,LITong-xin,CHENTian-gang,LUOMing,ZHANGHui-zheng,DENRen-ni,YIXue-jun,ZHOUGang,WANGJing
DepartmentofClinicalLaboratory,ChongqingInfectiousDiseaseMedicalCenter,Chongqing400036,China
Objective To study torezolid on in vitro bacteriostasis of different types of Mycobacterium tuberculosis. Methods The minimal inhibitory concentrations (MICs) of torezolid against sensitive, single-drug resistant (SDR), poly-drug resistant (PDR), multi-drug resistant (MDR), and extensive-drug resistant (XDR) Mycobacterium tuberculosis strains isolated clinically were determined by microplate assay. The interactions between torezolid and isoniazid, rifampicin, streptomycin, ethambutol, kanamycin, ofloxacin and rifabutin were also tested in vitro by fractional inhibitory concentration index (FICI) method. Results 94.0% (94/100) of the Mycobacterium tuberculosis isolates were inhibited by torezolid at concentration ≤0.5 mg/L. There was no statistical difference in the MIC value of sensitive strains, MDR strains and non-MDR strains (χ2=0.578,P>0.05). There was no significant correlation between clinically standard isolates H37Rv and other clinical isolates treated with torezolid and 7 other anti-TB drugs. Conclusion Torezolid shows good in vitro activity against Mycobacterium tuberculosis clinical isolates, especially for MDR and XDR strains, regardless of the drug resistant parameters.
torezolid; Mycobacterium tuberculosis; in vitro antibacterial activities
10.3969/j.issn.1009-6663.2017.07.002
重庆市卫生局医学科研计划项目(No 2013-2-141)
400036 重庆,重庆市公共卫生医疗救治中心检验科
王静,E-mail:403413860@qq.com
2016-11-23]
