LMTK3对人肺癌A549细胞生物学功能的影响*
2017-06-19朱文王传翠张雨晴蒋敬庭王智刚
朱文,王传翠,张雨晴,蒋敬庭,王智刚
(苏州大学附属第三医院a.呼吸内科,b.肿瘤生物诊疗中心,江苏省肿瘤免疫治疗工程技术研究中心,苏州大学细胞治疗研究室,江苏常州 213003)
·研究生园地·
LMTK3对人肺癌A549细胞生物学功能的影响*
朱文a,王传翠a,张雨晴a,蒋敬庭b,王智刚a
(苏州大学附属第三医院a.呼吸内科,b.肿瘤生物诊疗中心,江苏省肿瘤免疫治疗工程技术研究中心,苏州大学细胞治疗研究室,江苏常州 213003)
目的 探讨Lemur酪氨酸激酶3(LMTK3)在人肺腺癌细胞系A549中表达下调后对细胞生物学功能的影响。方法 采用shRNA(small hairpin RNA)技术干扰A549细胞中LMTK3的表达并用RT-PCR对其进行鉴定,采用细胞增殖实验、划痕实验、Transwell实验及流式细胞术检测LMTK3对肺癌细胞增殖、迁移、细胞周期及凋亡等生物学行为的影响。结果 通过shRNA技术成功构建LMTK3表达下调的肺癌细胞系shLMTK3及对照组Scramble。细胞增殖实验结果显示,在培养24、48、72 h后,shLMTK3组细胞的增殖水平(0.305±0.018,0.461±0.044,0.74±0.029)明显低于Scramble组(0.354±0.011,0.551±0.027,0.881±0.028),差异均有统计学意义(t分别为5.24,3.91,7.70,P均<0.01);划痕试验结果表明,划痕24 h后的shLMTK3组细胞相对倍数(0.51±0.096)明显低于Scramble组(1.00±0.029),差异有统计学意义(t=4.81,P<0.01);Transwell迁移实验结果表明,shLMTK3组迁移到膜下的细胞数[(161±9.29)个]明显低于Scramble组[(308.66±17.60)个],差异有统计学意义(t=7.42,P<0.01);细胞周期检测结果显示,抑制LMTK3的表达可将细胞阻滞于G1期(t=4.35,P<0.05);细胞凋亡试验显示,抑制LMTK3的表达对A549细胞的凋亡率无影响。结论 下调A549细胞中LMTK3的表达可明显抑制细胞的增殖及迁移能力,提示肺癌细胞异常表达LMTK3参与调节其肿瘤生物学行为。
Lemur酪氨酸激酶3;A549;增殖;迁移;周期
Lemur酪氨酸激酶3(lemur tyrosine kinase 3,LMTK3)属于丝-苏-酪氨酸激酶家族,为酪氨酸激酶的一个亚型,是一种乳腺癌内分泌治疗的耐药蛋白[1]。研究发现,LMTK3可以促进乳腺癌的侵袭和转移,与乳腺癌的不良预后相关[2]。另有研究表明,LMTK3在胃癌、肠癌、肺癌等多种肿瘤患者的血清和组织中高表达,且可以作为非小细胞肺癌不良预后的独立危险因素[3-6]。本实验旨在构建针对人
LMTK3 mRNA的短发卡RNA(shRNA)表达载体,与慢病毒包装辅助质粒共转染人胚293T细胞后,收集上清,感染人肺癌细胞系A549并筛选出稳定转染的细胞,观察其对肺癌细胞增殖、迁移能力的影响,以期进一步阐明LMTK3在肺癌发生、发展中的作用。
1 材料与方法
1.1 细胞系、试剂及仪器 人胚肾细胞系293T、人肺腺癌细胞A549购自美国典型微生物菌种保藏中心(ATCC),均由本实验室保存,大肠埃希菌感受态细胞DH5α、DMEM培养基、胎牛血清、胰蛋白酶购自美国Invitrogen公司,慢病毒表达载体pSPAX2、pMD2G、pLVX-shRNA1、Plvx-LMTK3-shRNA均由Clontech公司构建。青霉素、链霉素、CCK8(美国Sigma公司);Trizol试剂(美国Invitrogen公司);PrimeScriptRTreagent Kit、SYBR Premix Ex Taq(大连TaKaRa公司);Transwell小室(美国Corning公司);碘化丙啶(PI)染料(美国Sigma公司),Annexin V-FITC(美国BD公司); NanoDrop超微量分光光度计(美国Thermo Thermo公司)。
1.2 LMTK3-shRNA慢病毒载体的构建 293T细胞接种于6孔细胞培养板中,于37 ℃、5% CO2培养箱培养,待细胞融合度达80%~90%时,用于转染实验。包装前1 h更换为新鲜且无双抗的DMEM高糖培养基。将LMTK3 shRNA的慢病毒表达载体pLVX-shRNA1(10 μg)与辅助质粒psPAX2(10 μg)、pMD2G(10 μg)加入200 μL无血清且无双抗的新鲜DMEM中涡旋振荡混匀,随后加入56 μL Fugene转染试剂,立即涡旋振荡混匀10 s,室温静置15 min,将混合物共转染至293T细胞中,转染24~48 h后,收集病毒上清,以0.45 μm滤器过滤,于40 mL超速离心管中,4 ℃、72 000 r/min离心120 min,500 μL PBS重悬病毒沉淀,置于4 ℃保存。
1.3 细胞培养和细胞转染 取生长状态良好的人肺腺癌细胞A549用含10%胎牛血清的DMEM培养基于5% CO2、37 ℃、饱和湿度条件下培养。实验分为shLMTK3组(转染LMTK3干扰慢病毒载体的A549细胞)和Scramble组(感染空载体的A549细胞)。将A549细胞接种于6孔细胞培养板,每孔接种5×105个细胞,在shLMTK3组和scramble组分别加入相应的病毒上清(MOI=10),于37 ℃、5% CO2培养箱中继续培养24 h后换液,48 h后加入2 μg/mL嘌呤霉素筛选稳定干扰LMTK3表达的靶细胞,72 h后部分细胞开始死亡,每d 换液1次,持续至细胞融合度达70%时,用2.5 g/L胰蛋白酶消化并传代,传代后持续加2 μg/mL嘌呤毒素维持1周时间。
1.4 RNA提取及逆转录 分别收集shLMTK3组、Scramble组细胞约5×105个,加入1 mL Trizol试剂提取总RNA,并用NanoDrop超微量分光光度计测定RNA浓度和纯度,取吸光度(A260/280 nm)为1.8~2.0的样本,按照逆转录试剂盒说明书操作将RNA逆转录为cDNA,样本置-20 ℃保存。
1.5 实时荧光定量PCR 用Primer Premier 5.0软件设计引物,并送上海生工公司合成,各引物序列见表1。qRT-PCR反应体系:5 μL SYBR Green PCR Master Mix,10 μmol/L上、下游引物各0.2 μL,cDNA 4 μL,无菌ddH2O补足至10 μL。循环参数:95 ℃预变性5 min; 95 ℃ 10 s,60 ℃ 20 s,72 ℃ 20 s,共50个循环。使用StepOneTM软件在72 ℃时采集荧光信号,并进行熔解曲线分析,以GAPDH为内参照,用2-ΔΔCt法计算LMTK3 mRNA的相对表达水平,公式:ΔCt=Ct目的基因-CtGAPDH;ΔΔCt =ΔCt待测组-ΔCt对照组。实验重复3次。
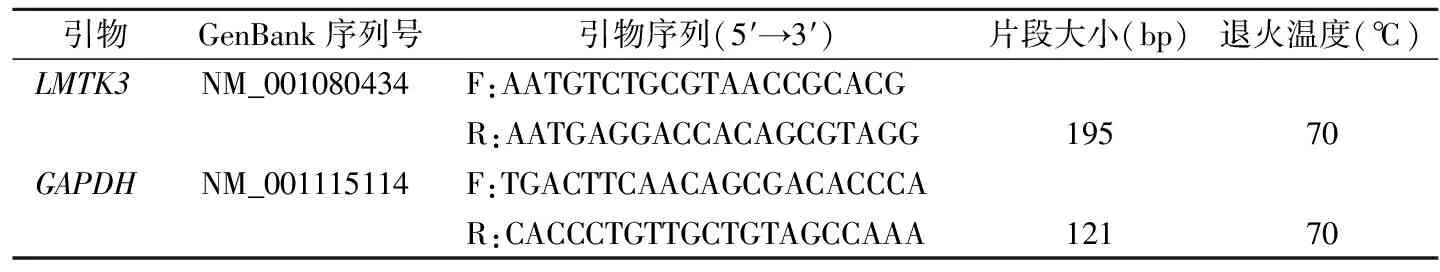
表1 RT-PCR引物序列及产物片段大小
1.6 CCK8细胞增殖实验 取对数生长期的shLMTK3组和Scramble组稳定的细胞系,用2.5 g/L胰蛋白酶消化后,高糖DMEM培养基稀释成2×104/mL,在96孔细胞培养板中每孔加入100 μL,实验设3个复孔,每组接种4块96孔细胞培养板。于培养24、48、72 h后每孔加入10 μL CCK8溶液,继续培养3 h后用酶联仪测定在450 nm处的吸光度(A450 nm)值,以时间为横坐标,A450 nm值为纵坐标绘制细胞生长曲线。
1.7 划痕实验 取shLMTK3组和Scramble组细胞(1×105个),2.5 g/L胰蛋白酶消化后接种于6孔细胞培养板,37 ℃、5% CO2过夜培养,形成均匀的单细胞层。使用无菌200 μL枪尖于单细胞层上垂直、均匀快速的划过培养皿底部,保持划痕宽度一致。PBS洗涤3次,洗去划痕产生的细胞碎片,加入无血清培养基,置于37 ℃、5% CO2条件下常规培养。于0、24 h时观察、拍照并测量划痕宽度。
1.8 Transwell实验 用无血清培养基将对数生长期shLMTK3组和Scramble组的细胞配制成单细胞悬液,按每孔5×105/mL的细胞密度接种100 μL于24孔细胞培养板中的Transwell小室的上室。下层小室内加入600 μL含20%胎牛血清的DMEM,并确保无气泡。于37 ℃、5% CO2的培养箱中培养48 h,取出Transwell小室,弃去孔中培养液, PBS洗涤2次,甲醛固定30 min,将小室风干。0.1%结晶紫染色20 min,用湿润的棉签轻轻擦掉上层未迁移细胞,PBS洗涤3次。倒置显微镜观察,每组随机选取3个视野,计数穿过膜的细胞数,计算平均值。
1.9 PI单染法测定细胞周期 细胞转染24 h后,2.5 g/L胰蛋白酶消化并收集shLMTK3组和Scramble组细胞,用预冷的PBS洗涤2次,重悬于预冷的70%乙醇(1×106/mL),4 ℃固定过夜。取100 μL细胞悬液(1×105个细胞)与500 μL PI染液充分混匀,4 ℃避光温育30 min,上流式细胞仪测定细胞周期。实验重复3次。
1.10 FITC双染法测定细胞凋亡 细胞转染24 h后,用不含EDTA的2.5 g/L胰蛋白酶消化并收集shLMTK3组和Scramble组细胞,用预冷的PBS洗涤2次,重悬于1×binding buffer(1×106/mL)。取100 μL细胞悬液(1×105个细胞)与5 μL Annexin V-FITC和3 μL PI充分混匀,室温避光温育15 min。再加入400 μL 1×binding buffer,上流式细胞仪测定凋亡细胞百分比。实验重复3次。
2 结果
2.1 实时荧光定量RT-PCR检测LMTK3 mRNA表达水平 结果显示,shLMTK3组LMTK3 mRNA的表达水平(1.00±0.078)低于Scramble组(0.18±0.023),差异有统计学意义(t=10.05,P<0.01)。表明慢病毒转染A549细胞后可抑制LMTK3 mRNA
的表达。
2.2 LMTK3对A549细胞增殖能力的影响 结果显示,在转染24、48和72 h后shLMTK3组细胞的平均吸光度值分别低于Scramble组,差异有统计学意义(t分别为5.24,3.91,7.70,P均<0.01)。表明下调A549细胞系中LMTK3的表达能够明显抑制细胞的增殖能力。见图1。
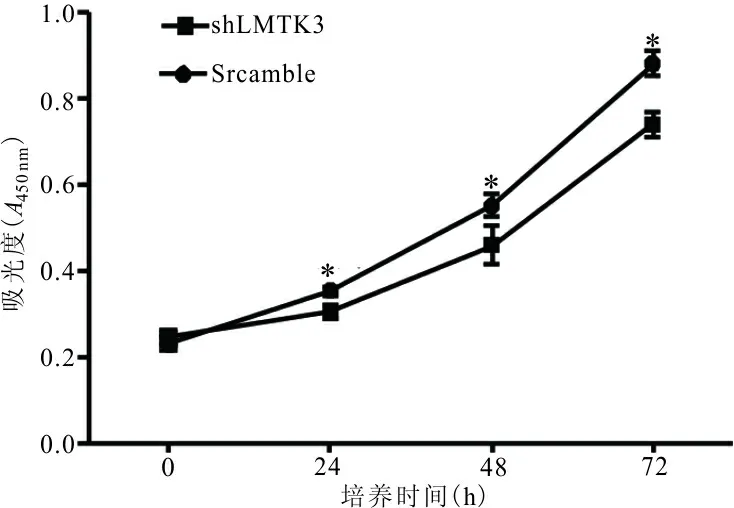
注:两组间比较,*,P<0.01。
图1 各组稳定转染细胞系的细胞增殖能力比较
2.3 LMTK3对A549细胞迁移能力的影响
2.3.1 划痕实验结果 shLMTK3组细胞在划痕24 h后的细胞迁移倍数(0.51±0.096)明显低于scramble组(1.00±0.029),差异有统计学意义(t=4.81,P<0.01)。提示LMTK3的表达下调后A549细胞的迁移能力下降。见图2。

注:A, Scramble组划痕0 h;B, Scramble组划痕24 h;C, shLMTK3组划痕0 h;D,shLMTK3组划痕24 h;黑线示细胞相对迁移距离,比例尺=100 μm。
图2 细胞划痕实验结果(×100)
2.3.2 Transwell实验结果 shLMTK3组细胞在培
养24 h迁移到膜下的细胞数[(161±9.29)个]明显低于scramble组[(308.66±17.60)个],差异有统计学意义(t=7.42,P<0.01)。表明下调LMTK3的表达后对肺癌细胞体外迁移能力具有抑制作用。见图3。
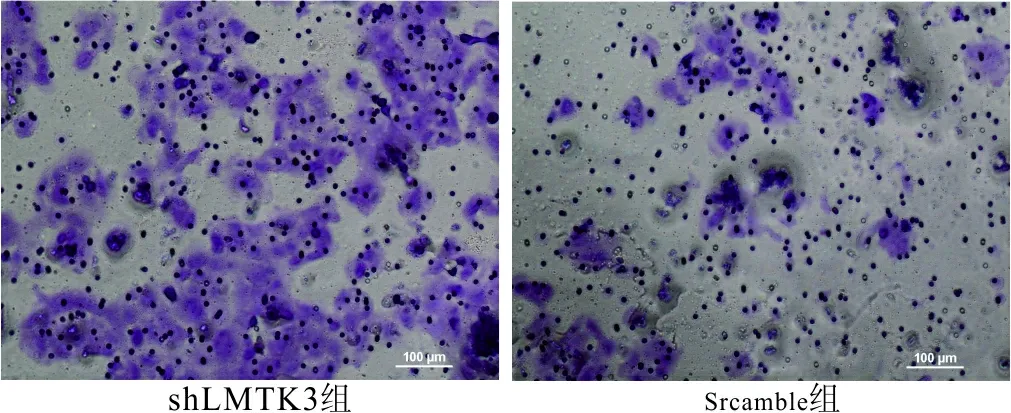
图3 细胞迁移能力Transwell实验结果(×100)
2.4 LMTK3对细胞周期与凋亡的影响
2.4.1 细胞周期结果 shLMTK3组细胞G1期所占百分比(65.33±1.05)%高于scramble组(56.64±1.70)%,两组差异有统计学意义(t=4.35,P<0.05),表明下调LMTK3的表达可将A549细胞阻滞于G1期。见图4。
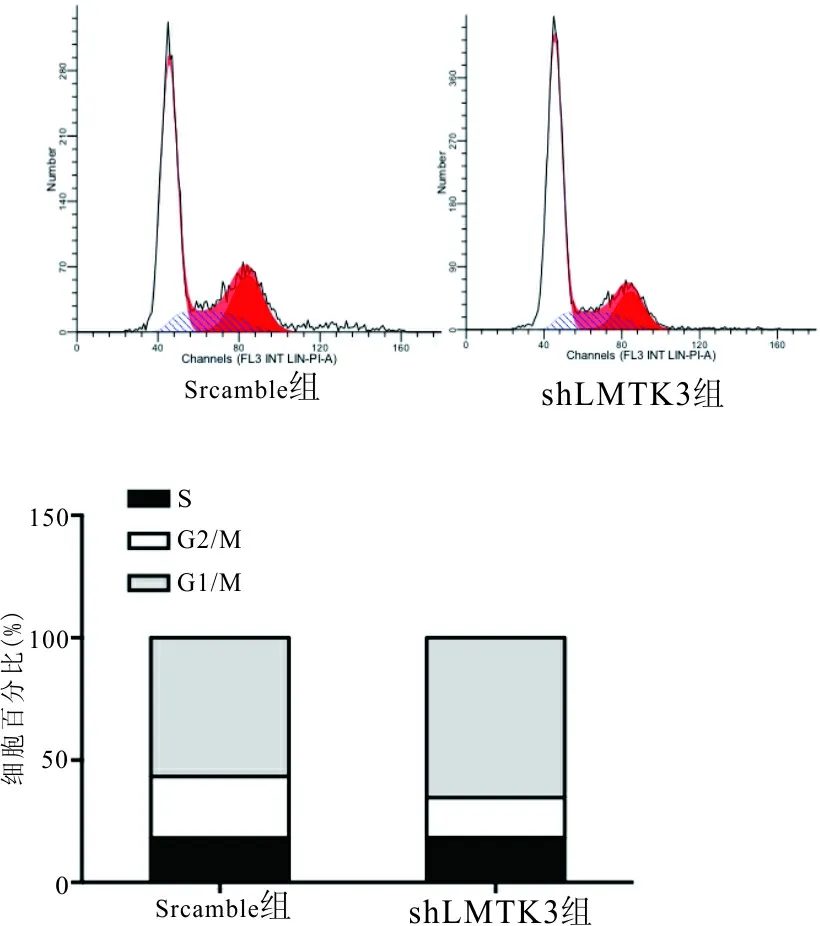
图4 各组稳定转染细胞系的周期分布
2.4.2 细胞凋亡检测结果 shLMTK3组和scramble组的凋亡率分别为(5.05±0.09)%、(5.31%±0.05)%,两组差异无统计学意义(t=2.61,P>0.05)。表明下调LMTK3的表达后,对A549细胞的凋亡没有明显地影响。
3 讨论
通过siRNA筛选,Giamas等[1]发现LMTK3能够调节ERα的稳定性和活性,LMTK3蛋白的高表达与更具有侵袭性乳腺癌的表型以及内分泌治疗的耐药性显著相关[7]。Stebbing等[8]发现在小鼠他莫西芬耐药的乳腺癌模型中抑制LMTK3的表达可以使肿瘤体积缩小,从而使小鼠耐药模型重新获得对他莫西芬的敏感性。另有研究发现,LMTK3高表达且ERα阳性的乳腺癌患者无病生存期及总生存期相较于LMTK3低表达的患者更短,LMTK3可作为接受内分泌治疗的ERα阳性乳腺癌患者不良预后的独立的预测因子[2]。另外, Shi等[5]发现肠癌患者血清sLMTK3含量高于健康人对照组,且与肠癌组织学类型、肿瘤侵润深度和TNM分期相关。其还发现LMTK3在肺癌患者血清中呈高表达,且与患者年龄、TNM分期、淋巴结转移以及低生存率明显相关。其进一步研究发现肺癌组织及癌旁组织胞核和胞浆中均有LMTK3蛋白的表达,但LMTK3蛋白在癌组织中表达的阳性率、表达强度明显高于癌旁组织。肺癌组织中LMTK3蛋白高表达患者血清中sLMTK3表达水平同样升高。LMTK3可能成为肺癌诊断新的标志物及肺癌独立预后指标[3-6]。然而,目前尚未见LMTK3在肺癌作用机制中的研究,本研究拟在细胞水平研究抑制LMTK3的表达对于肺癌细胞系A549增殖、迁移、周期和凋亡的影响。
本研究通过shRNA技术下调肺癌细胞系A549细胞中LMTK3的表达,并通过功能实验发现,LMTK3的表达下调后可明显抑制细胞增殖、迁移能力。细胞增殖实验显示在培养24、48、72 h时shLMTK3组细胞的相对增殖速率明显低于转染对照组;划痕实验结果显示划痕24 h后,shLMTK3组细胞的相对迁移距离明显小于转染对照组;Transwell迁移实验结果显示shLMTK3组迁移细胞数量相对于转染对照组明显减少;细胞周期实验结果显示,shLMTK3组G1期细胞增多,细胞停滞在G1期,表明LMTK3具有促进G1/S周期进展和细胞增殖的作用。此外,下调LMTK3的表达后对 A549细胞的凋亡率无明显影响,表明LMTK3可能对A549细胞的存活无影响。综合以上结果,我们认为LMTK3参与调控肿瘤细胞A549的增殖和迁移。虽然本研究在细胞学水平验证了LMTK3的异常表达可以促进肺癌细胞增殖和迁移,在肺癌中具有恶性生物学特性,但其作用机制目前仍不明确,我们将进一步阐明其分子作用机制,为肺癌的诊断及靶向治疗提供新的手段。
[1]Giamas G, Filipovic A, Jacob J,etal. Kinome screening for regulators of the estrogen receptor identifies LMTK3 as a new therapeutic target in breast cancer[J]. Nat Med, 2011, 17(6):715-719.
[2]Asano T, Sato S, Yoshimoto N,etal. High expression of LMTK3 is an independent factor indicating a poor prognosis in estrogen receptor alpha-positive breast cancer patients[J]. Jpn J Clin Oncol, 2014, 44(10):889-897.
[3]Xu Z, Qi X, Zhang X,etal. Preoperative serum LMTK3 as a novel biomarker in non-small cell lung cancer[J]. Tumour Biol, 2014, 35(5):5007-5011.
[4]Li Z, Wu J, Ji M,etal. Prognostic role of lemur tyrosine kinase 3 in postoperative gastric cancer[J]. Mol Clin Oncol, 2014, 2(5):756-760.
[5]Shi H, Wu J, Ji M,etal. Serum lemur tyrosine kinase 3 expression in colorectal cancer patients predicts cancer progression and prognosis[J]. Med Oncol, 2013, 30(4):754.
[6]Zhang K, Chen L, Deng H,etal. Serum lemur tyrosine kinase-3:a novel biomarker for screening primary non-small cell lung cancer and predicting cancer progression[J]. Int J Clin Exp Pathol, 2015, 8(1):629-635.
[7]Stebbing J, Filipovic A, Ellis IO,etal. LMTK3 expression in breast cancer:association with tumor phenotype and clinical outcome[J]. Breast Cancer Res Treat, 2012, 132(2):537-544.
[8]Stebbing J, Filipovic A, Lit LC,etal. LMTK3 is implicated in endocrine resistance via multiple signaling pathways[J]. Oncogene, 2013, 32(28):3371-3380.
(本文编辑:许晓蒙)
Effects of lemur tyrosine kinase 3 on the cytobiological function of human lung cancer A549 cells
ZHUWena,WANGChuan-cuia,ZHANGYu-qinga,JIANGJing-tingb,WANGZhi-ganga
(a.DepartmentofRespiratory,b.DepartmentofTumorBiologicalTreatmentCenter,JiangsuEngineeringResearchCenterforTumorImmunotherapy,InstituteofCellTherapy,theThirdAffiliatedHospitalofSoochowUniversity,Changzhou213003,Jiangsu,China)
Objective To investigate the effects of down-regulation of lemur tyrosine kinase 3 (LMTK3) on the cytobiological behaviors of human lung cancer A549 cells. Methods The expression of LMTK3 in A549 cells was interfered with small hair RNA (shRNA), and the expression level of LMTK3 was determined by RT-PCR. The effects of LMTK3 on the proliferation, migration, cell cycle and apoptosis of A549 cells were determined by the CCK-8 assay, scratch assay, Transwell assay and flow cytometry, respectively. Results The shLMTK3 cells with stably low expression of LMTK3 and control cells (Scramble) with normal expression of LMTK3 were successfully obtained. The relative proliferation rates of shLMTK3 cells cultured for 24, 48 and 72 hours were significantly lower than those in the control cells (0.305±0.018 vs 0.354±0.011,t=5.24,P<0.01; 0.461±0.044 vs 0.551±0.027,t=3.91,P<0.01; 0.74±0.029 vs 0.881±0.028,t=7.70,P<0.01). The relative migration rate of shLMTK3 cells 24 hours after scratching was significantly lower than that of control cells (0.51±0.096 vs 1.00±0.029,t=4.81,P<0.01). Transwell assay showed that the number of migration cells in shLMTK3 group was significantly less than that in Scramble group (161±9.29 vs 308.66±17.60,t=7.42,P<0.05). The results of flow cytometry showed that shLMTK3 cells were blocked at G1phase (t=4.35,P<0.05), and that the inhibition of LMTK3 had no influence on the apoptosis of A549 cells. Conclusion Down-regulation of LMTK3 expression in human lung cancer A549 cells may inhibit the proliferation and migration of A549 cells significantly, indicating that the abnormal expression of LMTK3 in lung carcinoma cells may regulate the biological behaviors and progression of tumors.
lemur tyrosine kinase 3; A549 cell; proliferation; migration; cell cycle
10.13602/j.cnki.jcls.2017.05.15
国家自然科学基金(31570877);常州市卫生局重大招标科技项目(ZD201402)。
朱文,1992年生,女,硕士研究生,研究方向:肺部肿瘤的基础与临床研究。
王智刚,教授,硕士研究生导师,E-mail:1410456717@qq.com。
R735.2
A
2017-03-02)
