全反式维甲酸对人肺癌细胞系A549细胞增殖及APLNR基因表达的影响*
2017-06-19陈淑敏刘怡李淑娜何姝仪许予馨张文玲
陈淑敏,刘怡,李淑娜,何姝仪,许予馨,张文玲
(1.中南大学湘雅医学院医学检验系,长沙410013;2.珠海市妇幼保健院检验科,广东珠海 519000)
·研究生园地·
全反式维甲酸对人肺癌细胞系A549细胞增殖及APLNR基因表达的影响*
陈淑敏1,刘怡1,李淑娜2,何姝仪1,许予馨1,张文玲1
(1.中南大学湘雅医学院医学检验系,长沙410013;2.珠海市妇幼保健院检验科,广东珠海 519000)
目的 探讨全反式维甲酸(ATRA)对人肺腺癌细胞系A549细胞增殖及APLNR(apelin receptor)基因表达的影响。方法 采用四甲基偶氮唑蓝 (methyl thiazolyl tetrazolium,MTT) 比色法检测ATRA对体外培养的A549细胞增殖的抑制情况,光学显微镜下观察细胞形态改变,流式细胞术检测细胞周期及凋亡,western blot检测APLNR蛋白、cyclin D1及p16蛋白的表达情况。结果 经ATRA作用后,A549 细胞增殖受到明显抑制且抑制程度呈剂量及时间依赖性(P均<0.01);其细胞形态发生明显变化,细胞周期被阻滞于G0/G1期且细胞凋亡率明显升高(P<0.01);western blot结果显示,随着ATRA浓度的升高,APLNR蛋白及cyclin D1蛋白的表达水平降低,而p16蛋白的表达水平升高(P均<0.01)。 结论 ATRA可抑制A549细胞增殖并促进其凋亡,且能下调APLNR基因的表达。
全反式维甲酸;肺癌A549细胞;增殖;凋亡;APLNR
自维甲酸衍生物全反式维甲酸(All-trans-retinoic acid,ATRA) 首次被用于急性早幼粒细胞白血病的临床治疗,为ATRA治疗恶性肿瘤提供了成功的范例后,关于 ATRA与肿瘤细胞间的研究逐年增多[1]。研究显示,ATRA对肝癌细胞[2]、肺癌细胞[3]、乳腺癌细胞[4]、胶质干细胞[5]等实体肿瘤细胞也具有增殖抑制作用。APLNR(apelin receptor)基因又称APJ基因或AGTRL1基因,在促进细胞增殖和新生血管形成的过程中发挥着重要的作用,研究发现,其过表达与某些肿瘤的发生密切相关[6]。有关ATRA对体外培养的肺癌细胞增殖的作用及与APLNR表达的关系在国内尚未见报道。本研究以人肺癌细胞系A549为研究对象,用ATRA进行处理,观察A549细胞增殖、凋亡及APLNR蛋白表达的变化,以期为临床合理实施化学治疗提供新的依据。
1 材料和方法
1.1 材料 A549细胞系来源于中南大学湘雅医学院医学检验系实验中心;RPMI-1640 培养基、胎牛血清(美国Gibco公司);ATRA、MTT(美国Sigma公司);全蛋白质提取试剂盒、BCA蛋白质提取试剂盒(南京凯基公司);兔单克隆抗体GAPDH、cyclinD1、p16(英国Abcam公司);兔抗人APLNR多克隆抗体(美国Proteintech公司);辣根过氧化物酶标记山羊抗兔 IgG (北京中杉金桥公司);ECL化学发光液(美国Advansta WesternBright公司);CKX41型倒置显微镜(日本Olympus公司);流式细胞仪(美国Coulter公司);化学发光凝胶成像分析仪(美国Bio-Rad公司)
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清(FBS)的 RPMI-1640培养液,在37 ℃、5% CO2、饱和湿度的条件下进行细胞培养。细胞融合度达80%~90%时传代,实验用细胞均处于对数生长期。
1.2.2 MTT法检测细胞存活率 将处于对数生长期且生长状态良好的A549细胞用2.5 g/L胰蛋白酶室温消化1~2 min。用完全培养基(RPMI-1640+10% FBS)调节细胞悬液浓度。以 5×103/孔接种于96孔细胞培养板中,分别设置对照组(仅含细胞、培养基以及无水乙醇)、空白组(只加入培养基)及实验组(浓度分别为3、9、27、81、243 μmol/L ATRA), 每组各设6个复孔。在37 ℃、5% CO2、饱和湿度的条件下培养18 h,更换为完全培养基或含ATRA的完全培养基继续培养 1、2、3、4、5、6 d,每d各取1块96孔细胞培养板,在同一时间内加入 MTT (5 g/L ) 20 μL,在5% CO2培养箱中继续培养4 h,吸弃孔内培养上清液,加入150 μL DMSO,恒温低速振摇20 min,于酶联仪490 nm处检测A490 nm值。根据公式:细胞存活率(%)=(实验组A490 nm值-空白组A490 nm值)/ (对照组A490 nm值-空白组A490 nm值)×100%计算,并绘制生长曲线,利用药物浓度及细胞抑制率(细胞抑制率=1-细胞存活率)计算出半抑制浓度 (IC50)值。实验重复3次。
1.2.3 光学显微镜观察ATRA对细胞形态的影响 用无水乙醇配制10-2mol/L ATRA贮存液,置-20 ℃避光保存,使用前用培养液配制成所需浓度。取上述A549细胞,调整细胞浓度,接种至6孔细胞培养板,每孔接种2 mL(即5×104/孔),设置实验组和对照组,其中实验组以30 μmol/L ATRA(10-2mol/L ATRA贮存液溶于完全培养基)处理,对照组不加药物(与实验组相同体积的无水乙醇溶于完全培养基)处理,于37 ℃、5% CO2、饱和湿度的条件下培养4 d, 倒置相差显微镜下观察细胞形态并拍照。
1.2.4 流式细胞术检测细胞周期及凋亡率 以5×104/孔的细胞密度接种对数生长期的A549细胞于6孔细胞培养板中,设置实验组(分别用30、50 μmol/L ATRA处理)与对照组(不加ATRA)。于37 ℃、5% CO2培养箱培养 4 d,后收集实验组和对照组细胞于离心管中, 1 000 r/min离心5 min,弃上清, PBS重悬细胞,1 000 r/min离心 5 min,重复2次,75%冰乙醇重悬细胞,4 ℃固定过夜。将固定完成的细胞悬液1 000 r/min离心5 min, 弃上清,PBS重悬细胞,1 000 r/min离心5 min,弃上清以除去固定液。向细胞中加入100 μL RNA酶,37 ℃水浴30 min以完全除去RNA酶,加入溴化丙锭(PI)染色液混匀,37 ℃避光30 min,轻弹离心管,使用流式细胞仪及Cell Quest软件对待检细胞进行细胞周期检测,每次分析1×106个细胞。实验重复3 次。
1.2.5 western blot检测细胞周期蛋白及APLNR蛋白表达情况 取上述A549细胞(5×104/孔)接种于6孔细胞培养板中,于37 ℃、5% CO2培养箱培养 4 d后收集。设置实验组(采用10、30、50 μmol/L ATRA处理)与对照组(不加ATRA)。根据全蛋白质提取试剂盒和BCA蛋白质提取试剂盒说明书操作提取上述A549 细胞的总蛋白质并进行定量。按照40 μg总蛋白质上样,经12% SDS-聚丙烯酰胺凝胶电泳(浓缩胶80 V/30 min、分离胶120 V/90 min),冰水浴中100 V、60 min 条件下电转移至PVDF膜上。37 ℃、50 g/L脱脂牛奶 (TBST配制)封闭2 h,分别加入兔单克隆抗体cyclinD1(1∶10 000稀释)、兔单克隆抗体p16 (1∶2 000稀释)、兔抗人多克隆抗体APLNR (1∶800稀释) 、兔单克隆抗体GAPDH(1∶10 000稀释)4 ℃过夜。TBST洗涤3次,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000稀释) 37 ℃温育1 h,TBST洗涤3次,经化学发光法(ECL)显色,于化学发光凝胶成像分析仪上成像,Image J图像处理软件对条带灰度值进行分析。公式:目的蛋白灰度值/GAPDH灰度值。实验重复3次。
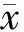
2 结果
2.1 MTT法检测ATRA对肺癌细胞增殖的影响 经ATRA处理后,A549细胞增殖受到明显抑制, 与对照组相比,差异具有统计学意义(F=413.36,P<0.01),且抑制程度呈时间和浓度依赖性(图1),其半抑制浓度(IC50)为31.47 μmol/L。
注:*,不同浓度ATRA处理组与对照组比较,P<0.01。
图1 A549细胞经不同浓度ATRA处理后的细胞生长曲线
2.2 ATRA对A549细胞形态的影响 光学显微镜下观察可见A549细胞呈长梭形,细胞生长密集,而经ATRA处理后的细胞变得细长,两端形成长尖状突起,且细胞密度相对对照组明显减少。见图2。

注:A,A549对照组;B,30 μmol/L ATRA处理组。
图2 ATRA对A549细胞形态学的影响(×400)
2.3 ATRA对A549细胞周期的影响 对A549细胞进行不同浓度的ATRA诱导处理后,其细胞周期明显受到阻滞,G1期比例明显升高,S、G2期比例下降(表1),且药物浓度在接近 IC50值(30 μmol/L)的作用最为明显。
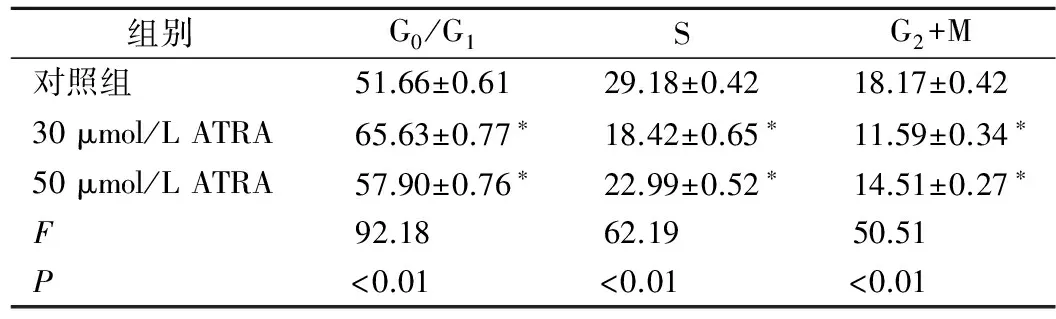
表1 不同浓度ATRA诱导A549 细胞后对细胞周期的影响
注:*,与对照组相比,P<0.01。
2.4 流式细胞术检测ATRA对 A549细胞凋亡的影响 对A549细胞进行不同浓度的ATRA诱导处理后,其细胞凋亡率均有不同程度的升高,且药物浓度在接近IC50值(30 μmol/L)的作用最为明显。30、50 μmol/L诱导组在ATRA 诱导第4天时的细胞凋亡率分别为6.09%和3.21%,30 μmol/L诱导组与对照组(1.84%)相比,差异有统计学意义(χ2=12.23,P<0.05),但50 μmol/L诱导组与对照组相比,差异无统计学意义(χ2=2.01,P=0.1)。
2.5 western blot检测ATRA对细胞周期蛋白及APLNR蛋白表达的影响 结果表明,随着 ARTA浓度的升高,p16蛋白质的表达水平逐渐升高,差异有统计学意义(P<0.05)。APLNR蛋白和cyclin D1蛋白的表达逐渐降低,差异具有统计学意义(P<0.01)。见图3、表2。
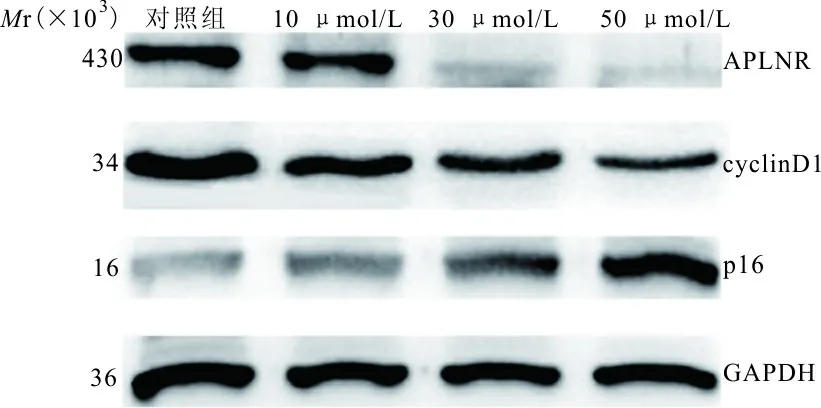
图3 western blot检测不同浓度ATRA诱导A549细胞周期蛋白及APLNR蛋白的表达
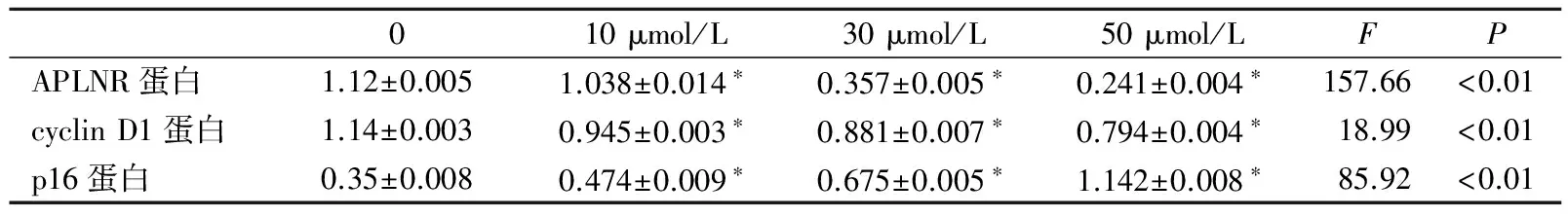
表2 不同浓度ATRA诱导A549 细胞周期蛋白及APLNR蛋白的表达水平
注:*,与对照组相比,P<0.01。
3 讨论
APLNR基因编码的APLNR蛋白于1993年被发现,其多数情况下被称为APJ受体。研究发现,以Apelin为配体,APJ为受体的Apelin-APJ系统在细胞增殖以及新生血管形成的过程中具有促进作用[7]。Apelin-APJ 系统与肺癌的发生及预后具有密切的相关性。Yang等[8]针对 APJ 受体进行人免疫组织化学分析发现,肺腺癌组织中的APJ表达量明显高于临近支气管粘膜下组织中的表达量。进一步分析后发现,Apelin-13可通过促进细胞外调解蛋白激酶的磷酸化促使细胞周期蛋白 cyclinD1表达量增加,推动细胞周期从G0/G1期向S期发展,从而促进肺癌 A549细胞增殖。此外,Lv等[9]通过对A549细胞进行损伤修复实验和干扰实验发现,Apelin-APJ系统可诱导肺癌A549细胞发生侵袭转移。以上研究提示,Apelin-APJ系统参与了肺癌的发展、侵袭转移等过程。
近年来,ATRA 抑制各类实体肿瘤增殖、诱导其分化的报道层出不穷。本研究以MTT法检测ATRA对肺癌细胞增殖的影响,发现ATRA可抑制细胞增殖、诱导细胞分化,且对肺癌细胞增殖的抑制程度是呈时间和剂量依赖的。
抑制细胞增殖主要是通过细胞周期阻滞来完成。细胞周期蛋白是一类呈细胞周期特异性或时相性表达、积累与分解的蛋白质,它与周期素依赖性激酶共同影响细胞周期的运行[10]。cyclin D1蛋白由CCND1基因编码而成,其是G1期细胞进入S期,从而顺利进行细胞增殖的关键蛋白。p16蛋白由p16基因编码而成,只存在于细胞核内。Martin等[11]研究证实,p16蛋白主要作用于细胞分裂周期的关键酶CDK4,从而抑制细胞增殖。而p16可与cyclin D1竞争性地与CDK4结合,阻止细胞由G1期进入S期,对细胞的增殖与分裂起到了负向调控的作用[12]。本研究结果表明,经不同浓度ATRA处理A549细胞后,其细胞形态发生变化,细胞周期被阻滞于G0/G1期。western blot检测结果显示,随着ATRA浓度的升高,cyclin D1和APLNR蛋白的表达量逐渐减少,但p16蛋白的表达量逐渐升高。表明ATRA可通过下调APLNR蛋白的表达抑制细胞周期蛋白cyclinD1的表达,阻滞细胞周期从G0/G1期向S期发展,抑制A549细胞增殖,促使与cyclin D1竞争的p16蛋白表达水平升高。
综上所述,本研究结果表明,ATRA可通过下调APLNR的表达,将A549细胞周期阻滞于 G0/G1期从而抑制细胞增殖、诱导细胞分化、促进细胞凋亡。提示ATRA可作为增强肺癌化疗效果的有效辅助药物。然而,关于ATRA下调肺癌细胞APLNR表达的机制和作用位点,依细胞类型不同而情况各异。此外,有关ATRA在肺癌组织中的药理学研究报道亦少见,真正合理地将 ATRA应用于肺癌的综合治疗还需进一步的深入研究。
[1]Akita T, Horiguchi M, Ozawa C,etal. The effect of a retinoic acid derivative on cell-growth inhibition in a pulmonary carcinoma cell line[J]. Biol Pharm Bull, 2016, 39(3):308-312.
[2]Rajasekaran D, Srivastava J, Ebeid K,etal. Combination of nanoparticle-delivered siRNA for astrocyte elevated gene-1 (AEG-1) and all-trans retinoic acid (ATRA):an effective therapeutic strategy for hepatocellular carcinoma (HCC)[J].Bioconjug Chem, 2015, 26(8):1651-1661.
[3]Cheng J, Qi J, Li XT,etal.ATRA and Genistein synergistically inhibit the metastatic potential of human lung adenocarcinoma cells[J].Int J Clin Exp Med, 2015, 8(3):4220-4227.
[4]Yan Y, Li Z, Xu X,etal. All-trans retinoic acids induce differentiation and sensitize a radioresistant breast cancer cells to chemotherapy[J]. BMC Complement Altern Med, 2016, 16(1): 113.
[5]Yin XP, Zhou J, Wu D,etal. Effects of thatATRAinhibits Nrf2-ARE pathway on glial cells activation after intracerebral hemorrhage [J]. Int J Clin Exp Pathol, 2015, 8(9):10436-10443.
[6]Berta J, Hoda MA, Laszlo V,etal. Apelin promotes lymphangiogenesis and lymph node metastasis[J]. Oncotarget, 2014, 5(12):4426-4437.
[7]Berta J, Hoda MA, Laszlo V,etal. Apelin promotes lymphangiogenesis and lymph node metastasis[J]. Oncotarget,2014,5(12): 4426-4437.
[8]Yang L, Su T, Lv D,etal. ERK1/2 mediates lung adenocarcinoma cell proliferation and autophagy induced by apelin-13[J].Acta Biochim Biophys Sin (Shanghai),2014,46(2): 100-111.
[9]Lv D,Li L,Lu Q,etal.PAK1-cofilin phosphorylation mediates human lung adenocarcinoma cells migration induced by apelin-13[J].Clin Exp Pharmacol Physiol,2016,43(5): 569-579.
[10]Park SJ, Yang SW, Kim BC. Transforming growth factor-beta1 induces cell cycle arrest by activating atypical cyclin-dependent kinase 5 through up-regulation of Smad3-dependent p35 expression in human MCF10A mammary epithelial cells[J]. Biochem Biophys Res Commun,2016, 472(3): 502-507.
[11]Martin N, Beach D, Gil J. Ageing as developmental decay: insights from p16(INK4a. )[J]. Trends Mol Med, 2014, 20(12): 667-674.
[12]Dey B, Raphael V, Khonglah Y,etal. Expression of Cyclin D1 andp16 in esophageal squamous cell carcinoma[J]. Middle East J Dig Dis, 2015, 7(4): 220-225.
(本文编辑:许晓蒙)
Effect of all-trans-retinoic acid on proliferation of human lung adenocarcinoma cell line A549 and expression ofAPLNRgene
CHENShu-min1,LIUYi1,LIShu-na2,HEShu-yi1,XUYu-xin1,ZHANGWen-ling1
(1.DepartmentofLaboratoryMedicine,XiangyaSchoolofMedicine,CentralSouthUniversity,Changsha410013,Hunan; 2.DepartmentofLaboratoryMedicine,ZhuhaiMaternalandChildHealthCareHospital,Zhuhai519000,Guangdong,China)
Objective To explore the effects of all-trans-retinoic acid (ATRA) on the proliferation of human lung adenocarcinoma cell line A549 and the expression ofAPLNR(apelin receptor) gene. Methods The inhibition of proliferation of human lung adenocarcinoma cell lines A549 cultured in vitro with or without ATRA was measured by MTT (methyl thiazolyl tetrazolium, MTT) method. The morphological changes in the cells were observed by light microscopy. The cell cycle and apoptosis were analyzed by flow cytometry. The levels of APLNR, cyclin D1 and p16 proteins were detected by western blot. Results After treatment of ATRA, the proliferation of A549 cells was obviously inhibited in dose-and time-independent manner (P<0.01). The cell morphology was significantly changed. The cycle of A549 cells was blocked at G0/G1phase and the apoptosis rate was increased. With the increasing concentration of ATRA, the expressions of cyclin D1 and APLNR were down-regulated but the expression of p16 was up-regulated (P<0.01). Conclusion ATRA could inhibit the proliferation of A549 cells by retardant cell cycle of A549 cells at G0/G1phase and inducing the apoptosis, and down-regulate the expression ofAPLNRgene.
all-trans-retinoic acid;lung adenocarcinoma cell lineA549;proliferation;apoptosis;APLNR
10.13602/j.cnki.jcls.2017.05.16
国家自然科学基金面上项目(81672688);研究生自主探索创新项目(2017zzts845)。
陈淑敏,1991年生,女,硕士研究生;主要从事肿瘤相关研究。
张文玲,教授,E-mail: zhangwenling73@126.com。
R730.43
A
2017-02-04)
