瞬时感受电位香草酸亚家族蛋白1受体在慢性偏头痛大鼠模型中的作用研究
2017-06-19宋晓文陈金波吴欣彤徐文香鲁文先董晓梦苏毅鹏
宋晓文, 陈金波, 吴欣彤, 李 斌, 徐文香, 鲁文先, 董晓梦, 苏毅鹏
瞬时感受电位香草酸亚家族蛋白1受体在慢性偏头痛大鼠模型中的作用研究
宋晓文1, 陈金波1, 吴欣彤1, 李 斌1, 徐文香2, 鲁文先1, 董晓梦1, 苏毅鹏1
目的 本研究通过炎性汤(IS)反复刺激SD大鼠上矢状窦区硬脑膜建立慢性偏头痛(CM)大鼠模型,探讨瞬时感受电位香草酸亚家族蛋白1(TRPV1)受体在CM发病过程中的作用,为研究CM发病机制和治疗药物提供理论依据。方法 72只SD大鼠随机数字表法分为空白对照组(A组)、假手术组(B组)、CM模型组(C组)及TRPV1受体拮抗剂Capsazepine组(D组),采用免疫组织化学染色、Western-Blot、Real-time PCR技术检测大鼠硬脑膜、三叉神经节(TG)、三叉神经脊束尾侧核(TNC)中的TRPV1受体、降钙素基因相关肽(CGRP)表达量变化。结果 TRPV1受体和CGRP在CM大鼠硬脑膜、TG及TNC上的表达量均增加(P<0.05),通过侧脑室注射Capsazepine药物后明显缓解大鼠疼痛,且TRPV1受体、CGRP表达量均明显下降(P<0.05)。结论 TRPV1受体通过影响CGRP释放参与CM神经源性炎症反应及痛觉传导,提示TRPV1可能通过TRPV1-CGRP信号通路参与CM病理生理过程。
慢性偏头痛; 瞬时感受电位香草酸亚家族蛋白1受体; 降钙素基因相关肽; 三叉神经血管系统; 机械刺激缩足反应阈值; 拮抗剂
偏头痛是临床常见的原发性头痛,以搏动样疼痛、活动时加重及反复发作为主要临床表现,可导致失能,严重影响患者的生活和工作,全球发病率为12%[1],是一个重大的全球公共卫生问题。偏头痛患者中每年约有2.5%~3%表现为“慢性化”趋势,CM患者约占偏头痛总数的8%,其人群患病率为1%~3%[2,3]。慢性偏头痛(chronic migraine,CM)的病理生理机制尚不明确,目前发现中枢敏化、神经源性炎症反应、疼痛调控异常及皮质兴奋性增高可能参与慢性偏头痛的发病过程,目前多数观点认为神经源性炎症引起的“中枢致敏”与CM发病密切相关,但其细胞和分子机制仍不清楚[1,4]。最近研究提示神经源性炎症可引起瞬时感受电位香草酸亚家族蛋白1(Transient Receptor Potential Vanilloid subfamily member 1,TRPV1)的异常激活,对疼痛的维持起着重要作用。TRPV1属于瞬时感觉电位(Transient Receptor Potential,TRP)阳离子通道超家族Ⅴ亚家族成员,是位于细胞膜及细胞器膜上的一种非选择性阳离子通道蛋白,作为伤害性刺激分子整合器参与疼痛的产生及痛觉敏感的病理过程,但参与CM发病机制尚不清晰[5,6]。降钙素基因相关肽(Calcition gene-related peptide,CGRP)是一种神经肽类物质,具有调节头部血管舒张的功能,被称为三叉神经血管激活的标志物质[7]。大量研究证明,在CM患者的血液、脑脊液中CGRP含量明显升高,发作间期CGRP血清浓度增高可作为CM的生物标记物[8]。注射外源性CGRP能诱发患者出现偏头痛样发作,使用CGRP受体拮抗剂能有效缓解偏头痛临床症状[9,10]。本实验研究采用炎性汤(Inflammatory soup,IS)刺激大鼠硬脑膜建立CM模型大鼠模拟CM患者,通过免疫组织化学染色、Western-Blot、Real-time PCR技术检测硬脑膜、三叉神经节(TG)、三叉神经脊柱核尾侧核(TNC)中的TRPV1受体表达量变化。通过侧脑室注射TRPV1受体拮抗剂Capsazepine,观察其镇痛效果及对硬脑膜、TG和TNC组织上CGRP表达影响,初步探讨TRPV1受体在CM发生中的可能作用,为探索CM发病机制及新的药物治疗靶点提供理论依据。
1 材料和方法
1.1 实验动物及分组 72只SPF级雄性SD大鼠(250~300 g),购于济南朋悦实验动物繁育有限公司,在滨州医学院SPF级动物饲养中心饲养,给予紫外线消毒后的标准颗粒和高压蒸汽灭菌水喂养,温度在18~25 ℃。大鼠按随机数字法分为空白对照组(A组,n=18)、假手术组(B组,n=18,PE-10管滴注NS 20 μl)、慢性偏头痛模型组[C组,n=18,PE-10管滴注IS 20 μl,皮下注射硝酸甘油(GTN)10 mg/kg建立CM大鼠模型]、Capsazepine组(D组,n=18,CM模型大鼠侧脑室注射10 μl TRPV1受体拮抗剂Capsazepine)。
1.2 主要试剂和仪器
1.2.1 主要试剂 复方致炎剂(Inflammatory soup,IS),TRPV1抗体、CGRP抗体、Capsazepine(美国ABcam公司),DAB染色液及苏木素染色液(福州迈新生物技术有限公司),RPIA、DPCPX、二甲基亚砜(美国sigma公司),TRPV1、CGRP、β-actin引物(上海生工公司),REAL-TIME PCR试剂盒(RNAIiso Plus、PrimeScriptTM RT reagent Kit、SYBR⑧Premix Ex TaqTM II)(大连宝生物技术公司)。
1.2.2 主要仪器 ZHRXZ 柔性颅骨钻及ZH蓝星脑立体定位仪(安徽正华生物仪器设备有限公司),OLYMPUS BX51 显微镜 + DP72 显微照相、单管微量给药系统(深圳瑞沃德生命科技有限公司),微量注射器20μl(上海高鸽工贸有限公司),低温高速离心机(德国Eppendorf公司)、酶标仪(美国Bio-rad公司)、实时荧光定量PCR仪(罗氏公司)。
1.3 方 法
1.3.1 建立慢性偏头痛大鼠模型 参照Oshinsky法[11],采用大鼠上矢状窦区硬脑膜炎性汤(IS)反复刺激,皮下注射硝酸甘油(GTN)建立慢性偏头痛(CM)模型。将大鼠用10%水合氯醛腹腔注射麻醉后固定在立体定位仪上,头部正中去毛,皮肤消毒,逐层切开皮肤、肌肉,钝性分离,H2O2清洗,暴露颅骨,脑立体定位仪定位前囟后1 mm、中线右1.5 mm处钻孔,暴露上矢状窦区(superior sagittal sinus,SSS)硬脑膜,颅骨下深1 mm置入PE-10软管至SSS,牙托水泥封闭软管周围,逐层缝合软组织、肌肉及皮肤,青霉素预防感染。术后大鼠单笼饲养于无菌环境中,正常饮食,C、D组术后1 w后开始经PE-10软管脑膜给药IS,20 μl,每周3次,共9次,GTN 10 mg/kg皮下注射,每周1次,共3次;A组不做任何处理,正常饮食;B组大鼠以0.01 mol/L 灭菌生理盐水代替IS及GTN作为对照。D组CM造模建立1 d 后使用微量进样器缓慢向侧脑室注射TRPV1受体拮抗剂Capsazepine 10 μl。以上所有操作均在无菌条件下进行,操作过程保持动作轻柔、环境安静,避免强光,室温保持25 ℃左右。
1.3.2 行为学观察及疼痛阈值测定 行为学观察:注射IS或者灭菌生理盐水后将大鼠置于安静环境,1 h后观察并记录大鼠挠头、打转、舔毛及爬笼次数。行为学评分标准为:搔头(10次记1分,每增加1次加记0.1分);打转(2次记1分,每增加1次加记1分):爬笼(3次记1分,每增加1次加记1分)。注:1 h内评分≥6为成功模型。
疼痛阈值测定:参照Oshinsky法[11]测定大鼠机械刺激缩足反应阈值(Paw withdrawal mechanical threshold,PWMT)。各组大鼠给予IS后1 d测定PWMT,在安静环境下,使用电子Von Frey测痛仪刺激大鼠足底皮肤,记录引出大鼠缩足反应的刺激强度,重复测量3次,每次间隔15 s,取平均值作为PWMT(注:以埋管前一天PWMT作为基础值)。
1.3.3 免疫组织化学染色 各组大鼠PE-10软管最后一次给药测定痛阈3 d后,10%水合氯醛腹腔注射麻醉大鼠,开胸经左心室插管至升主动脉快速注射37 ℃生理盐水至右心耳流出液变清、肝脏表白,预冷4 ℃ 4%多聚甲醛磷酸缓冲液先快速后慢速灌注至大鼠肝脏変韧,四肢抽搐且僵硬后取出硬脑膜、TG和TNC对应的低位脑干组织,分别置入4%多聚甲醛磷酸缓冲液中固定12-24后,常规脱色、包埋、切片(厚度3um),取切片烤片后二甲苯脱蜡至水,0.01 mol/L PBS洗5 min×3次流水冲洗,柠檬酸盐缓冲液微波炉热组织抗原修复,0.01 mol/L PBS洗5 min×3次,3% H2O2孵育 20 min(室温)去除内源性过氧化物酶,PBS洗5 min×3次,滴加1% BSA 封闭 30 min(21 ℃恒温),加一抗(TRPV1抗体稀释倍数1/2000,CGRP抗体1/400)4 ℃ 湿盒过夜(0.01 mol/L PBS代替一抗作阴性对照,余步骤相同),0.01 mol/L PBS洗5 min×3次,滴加二抗,37 ℃孵育30 min后流水冲洗3 min,0.01 mol/L PBS洗3 min×3次,DAB 显色、苏木素复染、盐酸酒精分化、常规梯度酒精脱水透明及中性树胶封片后显微镜下观察。光镜40×(硬脑膜切片100×)下观察拍摄,每只大鼠取5张切片,每张切片随机取6个视野,应用Image Pro Plus6.0图像分析系统测定阳性细胞的光密度值(optical density,OD),每组至少测定3次取均值(mean optical density,MOD),所得数据以 表示,采用GraphPad Prism5.0软件进行统计分析,以P<0.05作为判断差异显著性的标准。
1.3.4 Real-time PCR 各组大鼠麻醉后冰上快速断头取脑,将硬脑膜、TG及TNC分离干净后置入离心管中,液氮冷冻后置于-80 ℃保存。按照试剂盒操作指南提取总RNA,采用260 nm紫外线吸收法进行RNA定量后进行反转录合成cDNA,在20 μl反应体系:4 μl×PrimeScript Buffer,1 μl PrimeScript RT Enzyme Mix 1,1 μl Oligo dT Primer(50 μM),1 μl Random 6 mers(100 μM),每个反应体系用RNase Free dH2O补足至20 μl,反转录设置反转录条件(37 ℃,15 min;85 ℃,5 s),反转录完成后-20 ℃保存。参考大鼠TRPV1、CGRP受体cDNA序列进行特异性引物设计,选用β-actin作为内参对照,TRPV1上游引物序列为:5’-GTG CCG GTT TAT GTT CGT CT-3’,下游引物序列:5’-GCA CTT GTG TGG CGT GGA CT-3’;CGRP的上游引物序列:5’-TCC TGG TTG TCA GCA TCT TG-3’,下游引物序列:5’-CTC AGC CTC CTG TTC CTC CT-3’;β-actin上游引物序列:5’-TGG TG TAT GGG TCA GAA GAA CT-3’,下游引物序列:5’-CAT GGC TGG GGT GTT GAA GGT CTC A-3’。所有引物均有上海生工生物技术有限公司合成及纯化。在25 μl的反应体系中加入SYBR?Premix Ex Taq Ⅱ(2×),PCR Forward Primer(10 μM),PCR Reverse Primer(10 μM),DNA模板(<100 ng),dH2O。每个基因做三个复孔,放入设置好扩增程序的扩增仪中进行扩增,以β-actin作为内参照,采用2-ΔΔCT法进行相对定量分析。
1.3.5 Western Blot测定蛋白浓度 各组大鼠测定痛阈后冰上断头处死,取硬脑膜、TG及TNC组织后分别置于玻璃匀浆器中,加入裂解液和蛋白酶抑制剂研磨均匀,12000 rpm 4 ℃离心15 min,取上清,BCA法测蛋白浓度,100 ℃变性5 min,放入-20 ℃保存;配置SDS-PAGE分离胶,在每个上样孔中加入40 μg蛋白样品进行电泳,转到PVDF膜,5%脱脂奶粉封闭2 h,加一抗稀释液(TRPV1 1/2000,CGRP 1/500),β-actin(1/3000)作为内参对照,4 ℃孵育过夜,TBST洗膜后滴加HRP标记的山羊抗兔IgG二抗(1/5000),37℃孵育2 h,TBST洗膜,显影、定影、曝光,Image J软件分析可视带的吸光度值(A值),结果以目的蛋白A值与内参蛋白A值得比值表示。
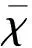
2 结 果
2.1 行为学观察 行为学观察结果显示,A组及B组大鼠挠头、打转、舔毛及爬笼次数和行为学评分(评分<6分)前后无明显差异(P>0.05)。C组CM模型建立大鼠行为学评分均>6分,造模成功,与A、B组相比,CM模型建立大鼠挠头、打转、舔毛及爬笼次数明显增多,行为学评分显著增高(P<0.05)。D组与C组相比挠头、爬笼、打转及舔毛次数明显减少,差异具有统计学意义(P<0.05)。各组行为学评分变化(见图1)。
2.2 疼痛阈值测定 机械刺激缩足反应阈值(Paw Withdrawal Mechanical Threshold,PWMT)测定结果与行为学观察结果一致。各组PWMT基础值无显著差异(P>0.05)。A、B组大鼠PWMT阈值无明显差异(P>0.05)。与A、B组相比,C组大鼠PWMT阈值明显降低(P<0.05)。D组大鼠与C组相比PWMT阈值显著增高,差异具有统计学意义(P<0.05)。各组大鼠PWMT测定结果(见图2)。
2.3 CM模型大鼠硬脑膜、TG及TNC组织上TRPV1受体表达情况
2.3.1 免疫组织化学染色检测慢性偏头痛模型大鼠硬脑膜、TG和TNC组织上TRPV1受体表达 A组与B组TRPV1受体在硬脑膜、TG及脑干TNC未见或仅可见少量表达,两组间比较差异无统计学意义(P>0.05);与A组和B组相比,C组大鼠的TRPV1受体在硬脑膜、TG及脑干TNC组织均呈强阳性表达(P<0.05),D组与模型组相比,表达量明显减少,但高于A组和B组,差异具有统计学意义(P<0.05)。(见图3)
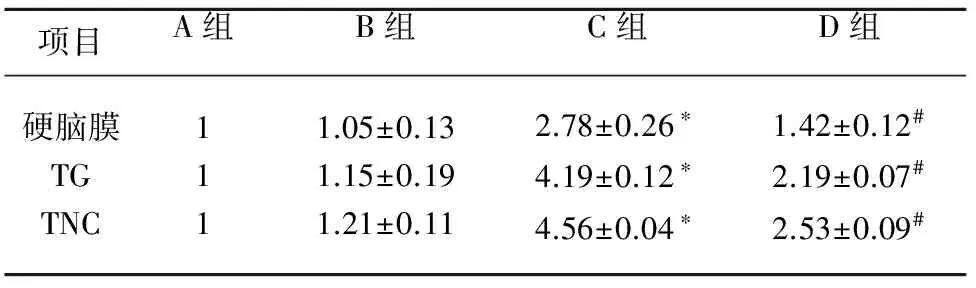
2.3.2 Western Blot检测慢性偏头痛模型大鼠硬脑膜、TG和TNC组织TRPV1表达 Western Blot结果显示,与A组和B组相比,C组大鼠硬脑膜、TG和TNC组织上TRPV1表达增加,差异具有统计学意义(P<0.05),D组与C组相比表达量均显著降低,且高于A组和B组,差异具有统计学意义(P<0.05)。各组组内均无统计学差异(P>0.05)(见图4)。
2.3.3 Real-time PCR检测慢性偏头痛模型大鼠硬脑膜、TG及TNC组织TRPV1 mRNA的表达 Real-time PCR分析显示,A组与B组mRNA表达量无统计学差异(P>0.05),C组与A和B组比较,TRPV1 mRNA表达显著上调,差异具有统计学意义(P<0.05),D组与C组相比,TRPV1的mRNA表达量下调,且高于A组和B组,差异具有统计学意义(P<0.05)。(见表1和图5)
2.4 TRPV1受体激活对CM大鼠硬脑膜、TG及TNC组织CGRP的影响 免疫组织化学染色结果显示,与A组、B组相比,C组CM大鼠硬脑膜、TG及TNC组织上CGRP阳性染色细胞明显增多,差异具有统计学意义(P<0.05)。与C组相比,D组侧脑室注射Capsazepine大鼠硬脑膜、TG及TNC组织上CGRP阳性染色细胞明显减少差异具有统计学意义(P<0.05),且多于A组和B组(见图6);Western Blot结果与免疫组织化学染色一致(见图7);Real-time PCR分析显示,A组与B组mRNA表达量无统计学差异(P>0.05),C组与A和B组比较,TRPV1 mRNA表达显著上调,差异具有统计学意义(P<0.05),D组与C组相比,TRPV1的mRNA表达量下调,且高于A组和B组,差异具有统计学意义(P<0.05)(见表2和图8)。

项目A组B组C组D组硬脑膜TGTNC1111.05±0.131.15±0.191.21±0.112.78±0.26∗4.19±0.12∗4.56±0.04∗1.42±0.12#2.19±0.07#2.53±0.09#
与A组相比,B组、C组和D组大鼠硬脑膜、TG、TNC部位TPRPV1基因的相对表达量。与A组和B组相比较*P<0.05;与C组相比较#P<0.05

与A组或B组相比较*P<0.05;与C组相比较#P<0.05
图1 大鼠行为学评分(n=18)

与A组或B组相比较*P<0.05;与C组相比较#P<0.05
图2 大鼠机械刺激缩足反应阈值(n=18)

图3 免疫组织化学染色检测慢性偏头痛模型大鼠硬脑膜、TG和TNC组织上TRPV1受体表达[硬脑膜免疫组化×100(a~d),TG和TNC免疫组化×40(e~l)]
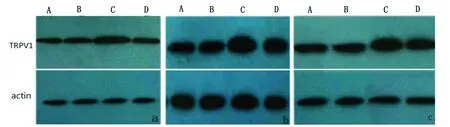
图4 Western Blot检测慢性偏头痛模型大鼠硬脑膜、TG和TNC组织TRPV1表达(a:硬脑膜;b:TG;c:TNC)
与A组或B组相比较*P<0.05;与C组相比较#P<0.05
图5 各组大鼠硬脑膜、TG、TNC部位TPRPV1基因的相对表达量(n=10)


项目A组B组C组D组硬脑膜TGTNC1111.16±0.121.26±0.241.07±0.156.06±0.42∗6.3±0.13∗6.25±0.05∗2.04±0.16#3.12±0.14#3.76±0.27#
与A组相比,B组、C组和D组大鼠硬脑膜、TG、TNC部位CGRP基因的相对表达量。与A组和B组相比较*P<0.05;与C组相比较#P<0.05

图6 免疫组织化学染色检测慢性偏头痛模型大鼠硬脑膜、TG和TNC组织上CGRP受体表达[硬脑膜免疫组化×100(a~d),TG和TNC免疫组化×40(e~l)]

图7 Western Blot检测慢性偏头痛模型大鼠硬脑膜、TG和TNC组织CGRP表达(a:硬脑膜;b:TG;c:TNC)

与A组和B组相比较*P<0.05;与C组相比较#P<0.05
图8 与A组相比,B组、C组和D组大鼠硬脑膜、TG、TNC部位CGRP基因的相对表达量(n=10)
3 讨 论
CM的发病机制尚不明确,目前研究发现可能与疼痛调控异常、中枢敏化、皮质兴奋性及神经源性炎症反应有关[12]。反复偏头痛发作导致三叉神经血管系统(trigenmi-novascular system,TVS)激活,可产生神经源性炎症反应产生神经肽类物质,如组胺、5-羟色胺(serotonin,5-HT)、缓激肽、前列腺素E2(prostaglandin E2,PGE2)等,进一步促使脑干下行疼痛调控系统功能减弱及皮质兴奋性增高和痛阈值降低,其中TVS激活导致痛觉中枢敏化是核心过程[13~15]。TVS包括三级神经元:一级神经元是接受源自硬脑膜血管传入冲动的TG,它将冲动传至二级神经元-TNC及C1、C2节段的脊髓后角表浅层,两者共同构成(trigerminocervical complex,TCC),再将冲动传导至丘脑的三级神经元[14,16]。基于以上作用机制学说,Oshinsky等[17]利用IS,反复刺激大鼠硬脑膜建立CM大鼠模型,这种敏化状态维持高达3 w时间,然后用硝酸甘油(GTN)诱导偏头痛发作进行模拟CM发作。实验通过观察大鼠行为学及PWMT测定评估造模是否成功,行为学评分大于6分及PWMT测定降低可判定造模成功。根据三叉神经血管理论学说[17],TVS介导的疼痛中枢敏化和神经源性炎症反应在CM发病机制中的核心地位,以及在偏头痛的痛觉产生和维持中的关键角色,硬脑膜、TG、TNC是TVS的重要组成部分,故在此三个部位组织探讨CM的发病过程中活性物质的表达水平可能性更大,结果也更具说服力。
TRPV1属于TRP家族,是一种非选择性阳离子通道,为颅内主要的痛觉敏感受器之一,主要表达在中、小直径伤害性感觉神经元及其无髓C纤维和有髓A 纤维上[18]。研究显示TRPV1主要表达于背根神经节(dorsal root ganglion,DRG)、三叉神经节、脊髓背角及脊髓三叉复合体尾核,其中大部分表达TRPV1的神经元与神经生长因子(nerve growth factor,NGF)受体、P物质或CGRP等一些伤害性感受传递的神经肽之间存在“递质共存”现象,因此,IS激活支配脑膜的痛觉纤维传递痛觉信号,也可产生神经肽类释放导致脑膜神经源性炎症形成反复激活的正反馈连锁反应,通过信号系统的逐级放大效应,促使疼痛阈值降低,TVS产生高反应性刺激,进而参与偏头痛痛觉敏感化分子机制形成[19,20]。作为与痛觉传递有着紧密关联的膜相关一类离子通道型受体,激活后引起膜外Ca2+内流,可伴有少量Mg2+、Na+、K+等流入,也可介导增强了突触传递效能和突触可塑性改变,参与疼痛等生理病理发生过程[18]。TRPV1最初是在疼痛领域受到关注的,由于其极高的临床和科研价值而被广泛深入研究,目前,TRPV1在炎性痛、内脏痛、癌性疼痛及痛觉敏化等起到重要作用[21]。有研究在体外培养的敲除TRPV1基因的初感觉神经细胞对外界各种刺激反应都减弱,提示其在疼痛的发生形成过程中发挥重要作用[22]。炎症介质可提高TRPV1膜蛋白表达和通过蛋白激酶途径激活磷酸化等途径敏化TRPV1通道[19,23]。Szabo等研究大鼠慢性关节炎模型后,TRPV1缺失的大鼠对机械性刺激产生痛觉敏感性显著低于野生型,推测出其对维持、增强痛觉敏感性起到重要作用,同时,该研究表明TRPV1也参与了模型大鼠关节炎慢性缓解节期缓解肽、PGE2和脂肪氧化酶产物激活TRPV1通道后产生对机械刺激高度敏感化的病理过程[23,24]。已有研究证实[18,23,25,26],磷酸化的ERK(the phosphorylation of extracellular signal-regulated kinase,p-ERK)可通过第二信使途径敏化TRPV1通道传递伤害性信息至外周神经末梢和脑干TNC,产生外周和中枢敏化介导痛觉信号传导,TRPV1拮抗剂通过直接阻断受体活性减轻辣椒素引起的疼痛超敏反应,提示TRPV1受体在CM发病机制中发挥重要作用。
CGRP是由颅内血管周围感觉神经末梢产生的一种具有强力舒张血管的神经肽类物质,广泛表达于TVS[7,8]。CGRP可通过扩张脑血管和硬脑膜血管参与硬脑膜无菌性神经源性炎症反应,敏化初级感觉神经纤维,也可与肥大细胞释放炎症因子和伤害性信号传递有关[7,27]。研究证实[9,10,28],CGRP受体拮抗剂CGRP8-37可减弱辣椒素诱导的TVS痛觉过敏反应,TVS激活与CM密切相关,当TVS受到刺激后促使CGRP的释放,促使头部血管扩张、炎症反应及神经元激活一系列感觉神经传导,信号传到丘脑及大脑皮质产生搏动样疼痛。大量研究显示[8~10],在CM患者的血液、脑脊液中的CGRP含量明显升高。CGRP是引起神经源性炎症反应的重要血管活性物质,CM发作期间CGRP血清浓度增高可作为CM的生物标志物重要的生物标记因子,其表达量增高可作为TVS激活的标志。静脉注射外源性CGRP可以诱发偏头痛发作,且CGRP受体拮抗剂Olcegepant能显著缓解偏头痛症状及其伴随症状[28~30]。
本实验研究参照Oshinsky造模方法通过IS反复刺激清醒大鼠硬脑膜促使大鼠产生稳定持久的敏化状态,利用GTN诱导偏头痛发作进行模拟CM发作,模拟CM发作的临床特点。反复炎性刺激通过周围硬脑膜初级疼痛感觉纤维传入,激活TG和TNC神经元并使其产生敏化状态,经丘脑、蓝斑及中央导水管周围灰质等传递到皮质产生临床症状。本实验反复间断刺激大鼠硬脑膜持续16 d,与国际头痛协会发布的国际头痛分类和诊断标准Ⅱ(ICHD-Ⅱ)定义的无先兆性偏头痛发作≥15 d/m和排除药物滥用等标准相符合。本实验通过观察评估大鼠行为学(如挠头、打转、爬笼等表现,行为学评分>6分)及PWMT测定判断造模成功。行为学观察和PWMT测定结果显示,与正常空白组及假手术组相比,慢性偏头痛大鼠挠头、打转、爬笼次数明显增多(P<0.05),PWMT明显下降(P<0.05);侧脑室注射TRPV1受体拮抗剂Capsazepine后能显著减少大鼠挠头、打转、爬笼等行为学次数,降低大鼠行为学评分,PWMT增高(P<0.05),提示TRPV1受体在CM模型大鼠偏头痛疼痛信号传导起到重要作用。本实验研究显示,与正常空白组和假手术组相比,慢性偏头痛模型大鼠硬脑膜、TG和TNC组织上TRPV1受体阳性细胞明显增多(P<0.05),此三个部位上TRPV1受体mRNA表达量与蛋白表达水平趋势一致,即慢性偏头痛大鼠TVS第一、二级神经元上TRPV1活性物质高表达,进一步提示TRPV1受体参与CM的发病机制形成,伤害性感觉刺激可由初级感觉纤维传递向二级感觉中枢,即TNC。
本实验研究显示,与正常组和假手术组相比,CM模型大鼠硬脑膜、TG及TNC组织上CGRP表达量明显增高(P<0.05),提示TRPV1受体与CGRP之间存在密切联系,且在CM发生中二者表达上调存在正相关关系,提示分布在TVS组织上TRPV1受体表达上调激活后促使CGRP释放;侧脑室注射Capsazepine能明显抑制CM大鼠硬脑膜、TG及TNC组织上CGRP表达水平(P<0.05)明显下降,TRPV1与CGRP表达量均下调,二者在TVS组织上表达下调量呈正相关,提示TRPV1拮抗剂可明显抑制TVS激活及偏头痛的发生程度。我们推测,可能通过TRPV1-CGRP信号通路参与CM痛觉信号传导及疼痛敏化的产生。
[1]黄立伟,雷革胜. 慢性偏头痛的概念和进展[J]. 中国神经免疫学和神经病学杂志,2016,23(6):447-450.
[2]May A,Schulte LH. Chronic migraine:risk factors,mechanisms and treatment[J]. Nat Rev Neurol,2016,12(8):455-464.
[3]Manack AN,Buse DC,Lipton RB. Chronic migraine:epidemiology and disease burden[J]. Curr Pain Headache Rep,2011,15(1):70-78.
[4]Schwedt TJ,Larson-Prior L,Coalson RS,et al. Allodynia and descending pain modulation in migraine:a resting state functional connectivity analysis[J]. Pain Med,2014,15(1):154-165.
[5]Meents JE,Hoffmann J,Chaplan SR,et al. Two TRPV1 receptor antagonists are effective in two different experimental models of migraine[J]. J Headache Pain,2015,16:57.
[6]Del Fiacco M,Quartu M,Boi M,et al. TRPV1,CGRP and SP in scalp arteries of patients suffering from chronic migraine[J]. J Neurol Neurosurg Psychiat,2015,86(4):393-397.
[7]Schwedt TJ. Chronic migraine[J]. BMJ,2014,348:1416.
[8]Cernuda-Moroll6n E,Larrosa D,Ramon C,et al. Interictal increase ofCGRP levels in peripheral blood as a biomarker for chronic migraine[J]. Neurology,2013,81(14):1191-1196.
[9]Ramón C,Cernuda-Morollón E,Pascual J. Calcitonin gene-related peptide in peripheral blood as a biomarker for migraine[J]. Curr Opin Neurol,2017,30:1-6.
[10]Guo S. The role of genetics on migraine induction triggered by CGRP and PACAP38[J]. Dan Med J,2017,64(3):1-11.
[11]Oshinsky ML,Gomonchareonsiri S. Episodic dural stimulation in awake rats:a model for recurrent headache[J]. Headache,2007,47(7):1 026-1036.
[12]D’Andrea G. Pathogenesis of chronic migraine:the role of neuromodulators[J]. J Headache Pain,2015,16(Suppl 1):38.
[13]Capuano A,Greco MC,Navarra P,et al. Correlation between algogenic effects of calcitonin-gene-related peptide(CGRP)and activation of trigeminal vascular system,in an in vivo experimental model of nitroglycerin-induced sensitization[J]. Eur J Pharmacol,2014,740:97-102.
[14]Burstein B,Noseda R,Borsook D. Migraine:multiple processes,complex pathophysiology[J]. J Neurosci,2015,35:6619-6629.
[15]徐 武,史兆春,韦俊超,等. 偏头痛大鼠硬脑膜肥大细胞脱颗粒与神经源性炎症相关因子的变化[J]. 中华神经科杂志,2011,44:563-567.
[16]Louter MA,Bosker EJ,Willerbrordus PJ,et al. Cutaneous allodynia as a predictor of migraine chronification[J]. Brain,2013,1:1-8.
[17]Archbold JK,Flanagan JU,Watkins HA,et al. Structural insights into RAMP modification of secretin family G protein-coupled receptors:implications for drug development[J]. Trends Pharmacol Sci,2011,32:591-600.
[18]Stemkowski P,García-Caballero A,De Maria Gadotti V,et al. TRPV1 Nociceptor Activity Initiates USP5/T-type Channel-Mediated Plasticity[J]. Cell Rep,2017,18(9):2289-2290.
[19]Shepherd A,Tiwari A,Loo L,et al. NGF and CNP induce mechanical hypersensitivity and hyperalgesic priming through distinct signaling mechanisms converging on TRPV1 and TRPA1 channels[J]. J Pain,2016,17(4):S50.
[20]Silberstein SD. TRPV1,CGRP and SP in scalp arteries of patients suffering from chronic migraine. Some like it hot! Chronic migraine increases TRPV1 receptors in the scalp[J]. J Neurol Neurosurg Psychiat,2015,86(4):361.
[21]Takayama Y,Furue H,Tominaga M. 4-isopropylcyclohexanol has potential analgesic effects through the inhibition of anoctamin 1,TRPV1 and TRPA1 channel activities[J]. Sci Rep,2017,7:43132.
[22]Benemei S,De Cesaris F,Fusi C,et al. TRPA1 and other TRP channels in migraine[J]. J Headache Pain,2013,14:71.
[23]Meents JE,Neeb L,Reuter U. TRPV1 in migraine pathophysiology[J]. Trends Mol Med,2010,16:153-159.
[24]Szabo A,Helyes Z,Sandor K,et al. Role of transient receptor potential vanilloid 1 receptors in adjuvant-induced chronic arthritis:in vivo study using gene-deficient mice[J]. J Pharmacol Exp Ther,2005,314(1):111-119.
[25]Isashita T,Shimizu T,Shibata M,et al. Activation of extracellular signal-reulated kinase in the trigeminal ganglion following both treatment of the dura mater with capsaicin and cortical spreading depression[J]. Neurosci Res,2013,77(1/2):110-119.
[26]Lee MG,Macglashan DW Jr,Undem BJ. Role of chloride channels in bradykinin-induced guinea pig airway vagal C-fibre activation[J]. J Physiol,2005,566:205-212.
[27]Cernuda-Morollón E,Larrosa D,Ramón C,et al. Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine[J]. Neurology,2013,81:1191-1196.
[28]Sixt ML,Messlinger K,Fischer MJ. Calcitonin gene-related peptide receptor antagonist olcegepant acts in the spinal trigeminal nucleus[J]. Brain,2009,132(11):3134-3141.
[29]Ho TW,Edvinsson L,Goadsby PJ. CGRP and its receptors provide new insights into migraine pathophysiology[J]. Nat Rev Neurol,2010,6(10):573-582.
[30]Riesco N,Cernuda-Morollo’n E,Martinez-Camblor P,et al. Relationship between serum levels of VIP,but not of CGRP,and cranial parasympathetic symptoms:a study in chronic migraine patients[J]. Cephalalgia,2016,PMID:27250233.
The role of Transient Receptor Potential Vanilloid subfamily member-1 in chronic migraine rat model.
SONGXiaowen,CHENJinbo,WUXintong,etal.
(DepartmentofNeurology,TheAffiliatedHospitalofBinzhouMedicalUniversity,Binzhou256600,China)
Objective In this study,the model rats with chronic inflammation(chronic migraine,CM)was established by repeated stimulation of the superior sagittal sinus of SD rats with inflammatory soup(IS). In order to study the pathogenesis of chronic migraine(CM)and provide theoretical basis for the treatment of drugs,to explore the role of Transient Receptor Potential Vanilloid subfamily member-1(TRPV1)receptor in the pathogenesis of CM. Methods Seventy-two Rats were randomly divided into four groups:blank control group(A group),sham operation group(B group),CM group(C group),Capsazepine group(D group). The dura mater,trigeminal ganglion(TG)and spinal trigeminal nucleus caudalis(TNC)were dissected to detect the expression of TRPV1 receptor and Calcition Gene-related Peptide(CGRP)by immunohistochemistry,Western blot and real-time PCR. Results The expression levels of TRPV1 receptor and CGRP in dura mater,TG and TNC were increased in CM rats(P<0.05),and the behavioral of rats was significantly reduced in rats after intracerebroventricular injection of Capsazepine,and the expression of TRPV1 receptor and CGRP were decreased(P<0.05). Conclusion TRPV1 receptor is involved in CM neurogenic inflammatory response and pain transmission by affecting CGRP release,and the results suggest that TRPV1 maybe involved in the pathophysiology of CM via TRPV1-CGRP signaling pathway.
Chronic migraine; Transient Receptor Potential Vanilloid subfamily member-1; Calcition gene-related peptide; Trigenmi-novascular system; Paw withdrawal mechanical threshold; Antagonist
2017-03-25;
2017-04-29
山东省高等学校科技计划项目(No. J12LL63) 作者单位:(1.滨州医学院附属医院神经内科,山东 滨州 256600;2.滨州医学院附属医院神经内科一病区护理部,山东 滨州 256600)
陈金波,E-mail:chenjinbo6720@126.com
1003-2754(2017)05-0398-08
R747.2
A
