羟基红花黄色素A对脑组织蛋白质羰基化影响的体外研究
2017-06-19赵瑞杰刘雅林杨银锋李喜朋
赵瑞杰, 王 坤, 刘雅林, 杨银锋, 李喜朋, 孙 莉, 程 焱
羟基红花黄色素A对脑组织蛋白质羰基化影响的体外研究
赵瑞杰1, 王 坤2, 刘雅林1, 杨银锋1, 李喜朋1, 孙 莉3, 程 焱3
目的 研究羟基红花黄色素A(HSYA)对体外ONOO-途径和亚铁血红素/亚硝酸钠/过氧化氢(heme/NaNO2/H2O2)途径引起脑组织蛋白质羰基化的影响。方法 分别模拟体内ONOO-、heme/NaNO2/H2O2羰基化途径,以脑组织蛋白为羰基化底物,分为空白对照组、对照组及低、高浓度组(以HSYA 0.1 mmol/L、1 mmol/L干预)。以2、4-二硝基苯肼(2、4-dinitrophenylhydrazine,DNPH)法检测蛋白质羰基化水平。结果 ONOO-途径和heme/NaNO2/H2O2途径均可以增加脑组织匀浆中羰基蛋白的含量。HSYA预处理可浓度依赖性地降低ONOO-途径诱导的蛋白质羰基化水平,低、高浓度组羰基蛋白含量分别降低了26.13%、46.23%,差异有统计学意义(F= 14.265,P<0.05)。HSYA预处理对体外heme/NaNO2/H2O2途径诱导的蛋白质羰基化没有明显抑制作用,差异无统计学意义(P>0.05)。结论 HSYA可剂量依赖性地抑制ONOO-途径在体外对脑组织蛋白的羰基化修饰;提示HSYA抑制蛋白质羰基化反应可能是其对抗脑血管疾病与神经系统变性疾病的分子机制之一。
羟基红花黄色素A; 过氧亚硝基离子; 亚铁血红素; 蛋白质羰基化
氧化应激状态下,机体内氧化系统与抗氧化防御系统的平衡遭到破坏,体内生成过多的高活性分子如活性氧自由基(reactire oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)超过了细胞内抗氧化剂的代偿能力,从而引起蛋白质氧化和组织损伤[1]。蛋白质氧化损伤伴随着蛋白质羰基的形成,而蛋白质羰基化已被广泛认为是蛋白质氧化的生物学标志[2]。研究表明,过氧亚硝基离子(peroxynitrite,ONOO-)依赖途径和亚铁血红素/亚硝酸钠/过氧化氢(heme/NaNO2/H2O2)途径是体内蛋白质羰基化的两条通路[3]。目前,对ONOO-依赖途径研究较多,而对heme/NaNO2/H2O2途径关注较少。红花为菊科植物红花(Carthamus tinctorius L,)的干燥花,是传统的活血化瘀类中药。研究表明,红花活血化瘀的主要成分集中在水溶性的黄色素部分,红花黄色素中含量最高且具有活性的成分为羟基红花黄色素A(Hydroxysafflower yellow A,HSYA)[4]。研究表明,HSYA具有神经保护作用,其机制与抑制血小板聚集、抗氧化应激等作用有关[5~7]。本研究通过体外构建ONOO-途径以及heme/NaNO2/H2O2途径诱导的脑组织蛋白质氧化模型,观察这两种途径能否产生脑组织蛋白质氧化修饰以及HSYA对其是否具有抑制作用,为HSYA在预防和治疗脑血管疾病和神经系统变性疾病等领域提供分子机制方面的实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性Sprague-Dawley(SD)大鼠20只,体重(340±10)g,由中国人民解放军军事医学科学院实验动物中心提供。分笼喂养,于室温、自然光环境下给予充足的食物和水,自然昼夜循环。所有动物均于实验室饲养1 w后进入实验。
1.1.2 主要试剂和药品 (1)过氧亚硝酸盐(Peroxynitrite)购自美国Millipore公司。(2)氯化高铁血红素(ferriprotoporphyrin IX,Hemin)为美国Sigma公司产品,Hemin溶于二甲亚砜(DMSO,美国Sigma公司)溶液中,储存液浓度为10 mmol/L,使用时以浓度为0.1 mmol/L的氢氧化钠稀释至所需工作浓度,避免反复冻融。(3)其他试剂和药品:2,4-二硝基苯肼(DNPH)为上海申翔化学试剂有限公司产品;PBS磷酸盐缓冲液为北京中衫金桥生物技术有限公司 产品;苯甲基磺酰氟(PMSF)为北京索莱宝科技有限公司产品;盐酸胍为美国Amresco 公司产品;羟基红花黄色素A(Hydroxysafflor yellow A,HSYA)冻干粉由山西华辉凯德制药有限公司惠赠;无水乙醇、三氯乙酸、盐酸、乙酸乙酯、过氧化氢(H2O2)、亚硝酸钠(NaNO2)等均为国产优级纯或国产分析纯试剂。
1.1.3 主要仪器 恒温水浴箱购自德国Julabo公司;低温超速离心机为德国Heraeus公司产品;UV-240紫外可见分光光度仪为日本岛津公司产品。
1.2 方法
1.2.1 实验分组 (1)空白对照组;在50 mmol/L PBS溶液中仅加入正常大鼠皮质脑组织匀浆;(2)对照组;反应底物为正常大鼠皮质脑组织匀浆,反应体系为ONOO-或heme/NaNO2/H2O2反应体系;(3)低、高药物浓度干预组:在对照组的基础上分别加入终浓度为0.1 mmol/L、1 mmol/L的 HSYA。
1.2.2 组织蛋白提取 SD大鼠处置前12 h禁食,自由饮水。10%水合氯醛麻醉后断头处死,冰盒内快速分离大脑,用4 ℃生理盐水漂洗组织,并仔细去除蛛网膜,用滤纸吸干组织表面的液体。组织称重后,切碎置于4℃磷酸盐缓冲液(50 mmol/L,pH 7.4)中,并加入PMSF(终浓度为0.2 mmol/L),于冰上研钵充分研磨,静置30 min,4 ℃ 13000 r/min离心15 min,取上清备用。Lowry法进行蛋白浓度测定。
1.2.3 体外蛋白质羰基化模型的建立 ONOO-反应体系:ONOO-5 mmol/L;heme/NaNO2/H2O2反应体系:hemin 100 μmol/L、NaNO210 mmol/L、H2O21 mmol/L。不同浓度的HSYA(终浓度分别为0 mmol/L、0 mmol/L、0.1 mmol/L、1 mmol/L)与脑组织(终浓度为4 mg/ml)37 ℃水浴预孵育5 min,之后加入ONOO-或heme/NaNO2/H2O2反应体系,继续37 ℃水浴孵育30 min,取出冰上终止反应。
1.2.4 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)法检测蛋白质羰基化水平 将脑组织匀浆上清液转移至干净离心管中,室温静置15 min;滴加质量体积分数为10%的硫酸链霉素,快速搅拌(使其终浓度为1%以沉淀DNA),剧烈震荡,充分混匀,室温间断震荡30 min;室温下高速离心机离心11000 r/min 15 min,以分离沉淀;取上清液,均分放入5个离心管中,3个离心管中加入等体积10 mmol/L DNPH,2个离心管中加入等体积2 mol/L的HCI。混合均匀后避光反应2 h以上,每10 min充分震荡混匀1次;反应完毕后,加入等体积20%的三氯乙酸溶液,静置15 min;11000 r/min离心3 min,弃上清(小心倾倒),留沉淀物;相同条件下,沉淀物用1 ml等体积混合的无水乙醇和乙酸乙酯洗涤3次,除去未反应的DNPH,每次室温静置10 min,11000 r/min离心3 min,小心弃上清,留沉淀物;沉淀物中加入1 ml 6 mol/L的盐酸胍溶液,37 ℃水浴30 min,使沉淀充分溶解后,11000 r/min离心5 min,沉淀未溶物;用盐酸胍溶液调零,取上清液于分光光度计370 nm处测定蛋白腙衍生物的吸光值,280 nm处测蛋白浓度;计算羰基蛋白的含量,计算公式为:,其中,C = 浓度(mol/L);A = 吸光度值(A370DNPH-A370HCL);b=吸光杯的内径或光程厚度(cm),ε =摩尔吸光系数[22000/(M·cm)]。最后根据蛋白总量[A280×1.8(mg/ml)]算出每单位蛋白中羰基蛋白的含量(nmol/mgprot)。
2 结 果
2.1 HSYA 对ONOO-途径诱导脑组织蛋白质羰基化的影响 蛋白质羰基化检测显示:与空白对照组相比,ONOO-途径使脑组织匀浆中羰基蛋白的含量增加了95.10%,提示该途径可诱导蛋白质羰基化;与对照组相比,HSYA预处理可浓度依赖性地降低蛋白质羰基化水平,低、高浓度组羰基蛋白含量分别降低了26.13%、46.23%,差异有统计学意义(F= 14.265,P<0.05)(见表1、图1)。
2.2 HSYA对heme/NaNO2/H2O2途径诱导蛋白质羰基化的影响 蛋白质羰基化检测显示:与空白对照组相比,heme/NaNO2/H2O2途径使脑组织匀浆中羰基蛋白含量增加了62.98%,差异有统计学意义(F= 8.784,P<0.05;见表2、图2),提示该途径可诱导蛋白质羰基化。HSYA预处理对体外蛋白质羰基化没有明显抑制作用,反而表现出轻微促氧化作用,差异无统计学意义(P>0.05;见表2、图2)。

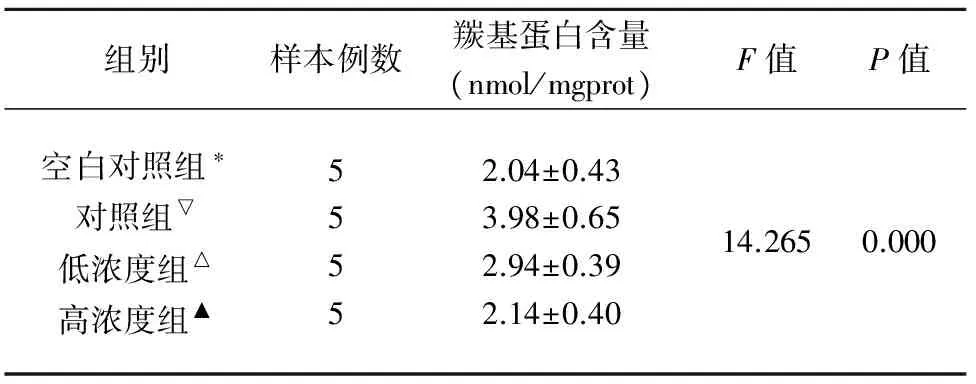
组别样本例数羰基蛋白含量(nmol/mgprot)F值P值空白对照组∗对照组▽低浓度组△高浓度组▲55552.04±0.433.98±0.652.94±0.392.14±0.4014.2650.000
注:组间两两比较行LSD-t检验:*▽P=0.000;*△P=0.020;*▲P=0.778;▽△P=0.010;▽▲P=0.000;△▲P=0.034;
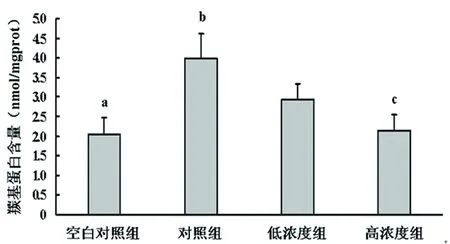
图1 HSYA 对ONOO-途径诱导脑组织蛋白质羰基化的影响;对照组与空白对照组相比aP<0.05;各HSYA干预组与对照组比较bP<0.05;与低浓度组比较cP<0.05

图2 HSYA对heme/NaNO2/H2O2途径诱导蛋白质羰基化的影响;对照组、低浓度组、高浓度组与空白对照组相比aP<0.05


组别样本例数羰基蛋白含量(nmol/mgprot)F值P值空白对照组∗对照组▽低浓度组△高浓度组▲55551.81±0.312.95±0.603.26±0.623.66±0.558.7840.002
注:组间两两比较行LSD-t检验:*▽P=0.011;*△P=0.002;*▲P=0.000;▽△P=0.429;▽▲P=0.087;△▲P=0.315
3 讨 论
蛋白质羰基化是一个比较复杂的过程,羰基的生成是由ROS攻击氨基酸分子中的自由氨基或亚氨基,经一系列反应最终生成NH3和相应的羰基衍生物(如醛基)。蛋白质羰基在体内的形成主要是通过金属离子催化氧化系统完成的,其中Fe2+和Cu2+起了重要作用。蛋白质氧化损伤伴随着蛋白质羰基的形成,而蛋白质羰基化已被广泛认为是蛋白质氧化的生物学标志[2]。研究表明,ONOO-依赖途径和heme/NaNO2/H2O2途径是体内蛋白质羰基化的两条通路[3]。其实质是基于自由基的化学反应。目前对ONOO-依赖途径研究较多,而对heme/NaNO2/H2O2途径关注较少。Heme/NaNO2/H2O2途径是蛋白质羰基化途径之一,在该途径中H2O2与NaNO2是使氧化发生的必需物质[8];heme的主要成分是原卟啉IX和铁,而铁是其发挥催化作用的关键物质[8,9],在体内主要存在于血红蛋白、肌红蛋白、细胞色素类物质、过氧化物酶等含铁卟啉的蛋白质中。Hemin为heme的氧化形式,具有同样的催化蛋白质氧化的作用[8]。ONOO-既是一种强氧化剂又是一种强硝化剂,性质很活泼。在氧化应激状态下,体内产生过量的超氧阴离子O2•-,同时诱导型一氧化氮合酶的表达也会增高,过量产生的NO与O2•-快速结合产生ONOO-[10]。因此,我们在体外构建蛋白质羰基化模型,研究HSYA对体外ONOO-途径和heme/NaNO2/H2O2途径引起脑组织蛋白质羰基化的影响。
本研究结果显示,脑组织蛋白在ONOO-和heme/NaNO2/H2O2体系中均可被羰基化修饰,该结果提示,ONOO-和heme/NaNO2/H2O2途径可能参与了病理情况下脑组织蛋白质的羰基化修饰。大量研究表明,脑缺血时ONOO-生成增多,蛋白质氧化参与脑缺血再灌注损伤的发病过程,而降低ONOO-水平对脑缺血再灌注损伤具有神经保护作用[11]。另外,相关研究表明,在脑出血、出血性脑梗死、神经系统变性疾病(如帕金森病、阿尔茨海默病、亨廷顿病、肌萎缩侧索硬化等)的发病机制中存在蛋白质氧化损伤,与局部过量蓄积的heme的神经毒性有关[12~14]。蛋白质羰基化修饰改变了蛋白质的结构,而结构的变化会影响一些生物学上的重要功能,如改变酶的催化活性、诱导免疫应答等,从而导致疾病的发生。
本研究结果显示,HSYA对两种体外蛋白质羰基化模型的影响是不同的。HSYA可剂量依赖性地抑制ONOO-诱导的蛋白质羰基化的生成,这与其可以很好地清除ONOO-衍生的自由基(如•OH、•NO2)有关。对于heme/NaNO2/H2O2途径诱导的氧化损伤,HSYA并未显示出抑制作用,反而在一定程度上表现出轻微促氧化作用。多酚类物质在某些情况下也可以表现出促氧化效应[3,15]。通常情况下,这些促氧化效应涉及多酚类物质与过渡金属离子(如铁离子、铜离子)的相互作用,多酚类物质的氧化反应产生O2•-、H2O2以及醌和半醌的混合物,而这些氧化产物具有潜在的细胞毒性[3]。因此,这可能解释我们观察到的HSYA对heme/NaNO2/H2O2途径诱导的蛋白质羰基化的轻度促氧化作用。在本研究中,HSYA对ONOO-途径诱导的蛋白质羰基化修饰具有抑制作用,且该作用呈剂量依赖性,提示HSYA对ONOO-途径诱导的蛋白质羰基化反应具有抑制作用。因此应用抗氧化剂通常是抑制自由基和铁介导的蛋白质羰基化的策略。HSYA属于黄酮类物质中的查尔酮类,其分子中含多个酚羟基,而后者已被表明具有抑制脂质过氧化、清除羟自由基等抗氧化功能[16]。因此我们推测,HSYA抑制ONOO-途径诱导的蛋白质羰基化可能为其酚羟基的作用。与本研究结果相一致,黄酮类中的其他物质(如山奈素、芹黄素、柚皮素、黄芩素、槲皮素等)也被证明可剂量依赖性地抑制ONOO-诱导的蛋白质羰基化的生成。同时,在某种程度上,表现出轻微促氧化作用[3]。据此,我们推测HSYA对蛋白质羰基化修饰的抑制作用与其抗氧化作用密不可分,这可能与其本身分子结构和自由基清除能力有关。
综上所述,HSYA可剂量依赖性地抑制ONOO-途径在体外对脑组织蛋白的羰基化修饰;提示HSYA抑制蛋白质羰基化反应可能是其治疗脑血管疾病与神经系统变性疾病的分子机制之一。
[1]赵瑞杰,孙 莉,刘星苗,等. 羟基红花黄色素A抑制脑组织蛋白质硝基化的体外研究[J]. 中风与神经疾病杂志,2013,30(3):204-207.
[2]Hauck AK,Bernlohr DA. Oxidative stress and lipotoxicity[J]. J Lipid Res,2016,57(11):1976-1986.
[3]Wang N,Li D,Lu NH,et al. Peroxynitrite and hemoglobin-mediated nitrative/oxidative modification of human plasma protein:effects of some flavonoids[J]. J Asian Nat Prod Res,2010,12(4):257-264.
[4]祝 明,郭增喜. 红花药材中红花黄色素含量的测定[J]. 中药材,2000,23(8):458-459.
[5]Wei X,Liu H,Sun X,et al. Hydroxysafflor yellow A protects rat brains against ischemia-reperfusion injury by antioxidant action[J]. Neurosci Lett,2005,386(1):58-62.
[6]Sun L,Yang L,Xu YW,et al. Neuroprotection of hydroxysaf?or yellow A in the transient focal ischemia:Inhibition of protein oxidation/nitration,12/15-lipoxygenase and blood-brain barrier disruption[J]. Brain Res,2012,1473:227-235.
[7]Wang T,Duan SJ,Wang SY,et al. Coadministration of hydroxysafflor yellow A with levodopa attenuates the dyskinesia[J]. Physiol Behav,2015,147:193-197.
[8]Bian K,Gao Z,Weisbrodt N,et al. The nature of heme/iron-induced protein tyrosine nitration[J]. Proc Natl Acad Sci USA,2003,100(10):5712-5717.
[9]Lu N,Zhou G,Pei D,et al. Peroxynitrite and heme protein-mediated nitrative/oxidative modification of human plasma protein:the role of free radical scavenging vs. complex forming[J]. Toxicol In Vitro,2009,23(7):1227-1233.
[10]Habib S,Ali A. Biochemistry of nitric oxide[J]. Indian J Clin Biochem,2011,26(1):3-17.
[11]Khan M,Dhammu TS,Matsuda F,et al. Blocking a vicious cycle nNOS/peroxynitrite/AMPK by S-nitrosoglutathione:implication for stroke therapy[J]. BMC Neuroscience,2015,16:42.
[12]Dang TN,Robinson SR,Dringen R,et al. Uptake,metabolism and toxicity of hemin in cultured neurons[J]. Neurochem Int,2011,58(7):804-811.
[13]Robinson SR,Dang TN,Dringen R,et al. Hemin toxicity:a preventable source of brain damage following hemorrhagic stroke[J]. Redox Rep,2009,14(6):228-235.
[14]Lee DW,Andersen JK,Kaur D. Iron dysregulation and neurodegeneration:the molecular connection[J]. Mol Interv,2006,6(2):89-97.
[15]Halliwell B. Are polyphenols antioxidants or pro-oxidants? What do we learn from cell culture and in vivo studies[J]? Arch Biochem Biophys,2008,476(2):107-112.
[16]Ramagiri S,Taliyan R. Neuroprotective effect of hydroxy safflor yellow A against cerebral ischemia-reperfusion injury in rats:putative role of mPTP[J]. J Basic Clin Physiol Pharmacol,2016,27(1):1-8.
Study on the effects of Hydroxysafflor yellow A to brain protein carbonylation in vitro
ZHAORuijie,WANGKun,LIUYalin,etal.
(DepartmentofNeurology,People’sHospitalofXingtai,Xingtai054000,China)
Objective To study the effects of Hydroxysafflor yellow A(HSYA)on brain protein carbonylation induced by peroxynitrite(ONOO-)and heme/NaNO2/H2O2 system in vitro. Methods To simulate in vivo peroxynitrite(ONOO-)and heme/NaNO2/H2O2system-induced carbonylative pathway,with brain protein for nitrification substrates,divided into blank group,control group and HSYA intervention groups(doses of 0.1 and 1 mM,respectively). 2,4-dinitrophenylhydrazine(DNPH)was used for the quantification of protein carbonylation. Results The treatment of brain tissue with ONOO-or heme/NaNO2/H2O2resulted in the significant formation of carbonyl groups. HSYA,at doses of 0.1 and 1 mM,dose-dependently decreased ONOO-induced protein carbonylation by 26.13% and 46.23% respectively,the difference was statistically significant(F=14.625,P<0.05). However,HSYA was relatively ineffective in protecting brain tissue from heme/NaNO2/H2O2-induced oxidative damage,the difference was not statistically significant(P>0.05). Conclusion HSYA could dose-dependently inhibit brain protein carbonylative modification induced by ONOO-system in vitro,which may be one of the molecular mechanisms to against cerebrovascular and neurodegenerative diseases.
Hydroxysafflor yellow A; Peroxynitrite; Heme; Protein carbonylation
2017-01-20;
2017-03-15 作者单位:(1.河北省邢台市人民医院神经内二科,河北 邢台 054000;2.河北省邢台市第三医院神经内一科,河北 邢台 054000;3.天津医科大学总医院天津市神经病学研究所,天津 300052)
赵瑞杰,E_mail:zrjaty@163.com
1003-2754(2017)05-0419-04
Q51
A
