Aβ310多价腺病毒疫苗鼻粘膜免疫阿尔茨海默病转基因鼠的炎症反应研究
2017-06-19宋贵军林璐璐辛世萌曹云鹏
李 昱, 宋贵军, 林璐璐, 辛世萌, 曹云鹏
Aβ310多价腺病毒疫苗鼻粘膜免疫阿尔茨海默病转基因鼠的炎症反应研究
李 昱1, 宋贵军1, 林璐璐1, 辛世萌1, 曹云鹏2
目的 探讨基因重组腺病毒疫苗Ad-Aβ(3-10)10-CpG鼻粘膜免疫APPswe/PSEN1dE9双转基因鼠诱导的炎症反应。方法 18只雄性10月龄APPswe/PSEN1dE9鼠,随机分为3组,分别以Aβ3-10多价腺病毒疫苗Ad-Aβ(3-10)10-CpG、空腺病毒载体鼻粘膜免疫及Aβ1-42肽肌内注射免疫,用MTT法检测脾细胞增殖反应、ELISA法检测脾细胞培养上清和脑组织匀浆中IL-4和INF-γ水平,免疫组化法检测脑内星形胶质细胞及淋巴细胞浸润。结果 Ad-Aβ(3-10)10-CpG组和Aβ1-42组,在相对应的免疫原刺激孔产生较高水平的增殖率,高于非相应免疫原刺激孔(P<0.05),但低于ConA刺激孔(P<0.05)。皮质和海马区GFAP阳性细胞所占面积百分比为:空腺病毒载体组>Aβ1-42组>Ad-Aβ(3-10)10-CpG组。各组小鼠脑组织在血管内和脑实质偶尔发现个别CD3、CD5阳性细胞,3组没有显著差异。Ad-Aβ(3-10)10-CpG组和Aβ1-42组中在其相对应的免疫原刺激时检测到较高水平的IL-4、IFN-γ。Aβ1-42组在Aβ1-42肽刺激孔的IFN-γ水平显著高于Ad-Aβ(3-10)10-CpG组在Aβ3-10肽刺激孔的IFN-γ水平(P<0.05)。Ad-Aβ(3-10)10-CpG组脑组织匀浆IL-4水平大于Aβ1-42组,但没有显著性差异(P>0.05),Ad-Aβ(3-10)10-CpG组脑组织匀浆中IFN-γ水平显著小于Aβ1-42组(P<0.05)。结论 腺病毒疫苗Ad-Aβ(3-10)10-CpG鼻粘膜免疫APPswe/ PSEN1dE9双转基因鼠主要产生Th2型免疫应答,可以减少脑内星形胶质细胞活化,未引起脑内炎症反应,即避免了Aβ1-42全肽段所引起的炎症反应。
阿尔茨海默病; 淀粉样蛋白; 炎症反应; 星形胶质细胞
阿尔茨海默病(Alzheimer’s disease,AD)是痴呆最常见的类型,但发病机制不明确,尚无有效的防治方法,是全世界急需解决的健康问题。早期研究发现,用Aβ1-42肽免疫PDAPP鼠可以减少脑内淀粉样沉积,使转基因鼠学习和记忆能力提高。但后期Aβ疫苗(AN1792)临床试验由于Ⅱa期临床试验6%的患者出现了中枢神经系统炎症而被迫停止。这种副作用确切原因不清楚,推测与Aβ的T细胞抗原决定簇特异性的细胞免疫应答引起的炎症反应有关[1]。后续免疫治疗研究集中在改变免疫原和免疫方式来克服不恰当的T细胞应答引起的中枢神经系统炎症。炎症反应不但是AD的主要发病机制之一[2],而且与免疫治疗的效果及疫苗的安全性密切相关。免疫治疗后进一步激活胶质细胞吞噬,参与Aβ斑的清除,但激活的胶质细胞可释放神经毒性细胞因子进而损害脑组织[3]。一种理想的疫苗,不但要有良好的治疗效果,而且不能激活体内过度的炎症反应,引起中枢神经系统炎症。
本研究前期工作已成功构建编码10次重复N末端片段Aβ3-10和CpG序列的新型腺病毒疫苗Ad-Aβ(3-10)10-CpG,并发现鼻粘膜免疫AD转基因鼠可以减少脑内Aβ沉积并改善转基因鼠的学习和记忆功能[4,5]。本研究进一步通过脾细胞增殖反应、细胞因子测定、脑内星形胶质细胞及淋巴细胞浸润检测来探讨腺病毒疫苗Ad-Aβ(3-10)10-CpG鼻粘膜免疫APPswe/ PSEN1dE9鼠诱导的炎症反应。进一步评估腺病毒疫苗Ad-Aβ(3-10)10-CpG的安全性。
1 材料与方法
1.1 材料 18只10月龄APPswe/PSEN1dE9鼠,雄性,每只鼠出生后均完成鼠尾DNA鉴定,购自中国医科大学动物部。APPswe/PSEN1dE9鼠表达鼠/人嵌合的淀粉样蛋白前体(Mo/HuAPP695swe)和突变的人早老素1(PS1-dE9),这两种突变与早发性AD相关。随机分为3组:Ad-Aβ(3-10)10-CpG 组、空腺病毒载体组、Aβ1-42组,每组6只。Aβ1-42多肽(AnaSpect),完全弗氏佐剂(Sigma,USA),不完全弗氏佐剂(Sigma,USA),羊抗小鼠IgG-HRP(R&D),小鼠IL-4 ELISA 试剂盒(Bender Med Systems@ BMS613),小鼠 IFN-γ ELISA试剂盒(Bender Med Systems@ BMS006),抗GFAP(武汉博士德),兔抗小鼠CD3(Sigma,USA),兔抗小鼠CD5(Sigma,USA),兔抗小鼠CD45(Sigma,USA)。
1.2 实验动物及免疫方法 Ad-Aβ(3-10)10-CpG组:Ad-Aβ(3-10)10-CpG 10 μl(1×108PFU)鼻腔免疫;空载体组:空载体10 μl(1×108PFU)鼻腔免疫;Aβ1-42组:第1次免疫用Aβ1-42肽50 μl(100 μg)+完全性弗氏佐剂(Sigma,USA)50 μl,股四头肌肌内注射,第2次及以后免疫用Aβ1-42肽50 μl(100 μg)+不完全性弗氏佐剂(Sigma,USA)50 μl,股四头肌肌内注射,每2 w免疫1次,共免疫7次。
1.3 MTT法检测脾T淋巴细胞增殖反应 新鲜脾脏置于罩在装有1640培养基的培养皿上的尼龙网(200 μm)上研磨,将细胞及培养基移至15 ml离心管,离心1000 r/min,4 ℃,10 min。弃上清,加入红细胞裂解液3 ml,混匀,室温静置5 min。加入7 ml 1640培养基,混匀,离心1000 r/min,4 ℃,10 min,重复上述过程1次。弃上清,加入含10%胎牛血清的1640培养基重悬细胞。取少量细胞液稀释50倍,用细胞计数板计数细胞,根据计数结果,将细胞液稀释至5×106/ml。将细胞液接种至96孔细胞培养板,每孔加入细胞悬液100 μl。分别设置对照孔(只加细胞液)、ConA孔(含ConA终浓度2 μg/ml的细胞液)、Aβ3-10孔(含Aβ3-10终浓度20 μg/ml的细胞液)、Aβ1-42孔(含Aβ1-42终浓度20 μg/ml的细胞液),每种刺激因素设6个复孔,每个96孔板设6个调零孔(加入100 μl含10%胎牛血清的1640培养基,不含脾细胞及刺激蛋白)。置于37 ℃含5% CO2的培养箱中培养72 h,每孔加入20 μl MTT(5 mg/ml),放入37 ℃含5%CO2培养箱中培养4 h。取出,用孔板离心机离心2000 r/min,4 ℃,10 min,收取上清-70 ℃保存。每孔加入150 μl DMSO,手摇孔板,待结晶全部溶解,用酶标仪在492 nm处测定各孔的吸光度(OD)值。各刺激抗原脾细胞增殖率=(各刺激抗原OD平均值-调零孔OD平均值)/(对照孔OD平均值-调零孔OD平均值)。
1.4 ELISA法检测细胞培养上清及脑组织匀浆中的IL-4和IFN-γ水平 取小鼠左侧半球脑组织,按湿重1:10加入0.2 M PBS,用超声波细胞粉碎机(Xinyi-ILD)匀浆,离心 10000 r/min,5 min,4 ℃,取上清分装-20 ℃保存。取脑组织匀浆及脾细胞培养上清,按照IL-4(Bender Med Systems@ BMS613)、IFN-γ(Bender Med Systems@ BMS006)试剂盒说明书操作。采用酶标仪(Elx800,BIOTEK)于450 nm处测定吸光度值(OD),根据标准曲线计算出各样本IL-4、IFN-γ的浓度。
1.5 免疫组化法检测脑内星形胶质细胞及淋巴细胞浸润 石蜡包埋的大脑右侧半球,按冠状位切片,厚约4 μm,常规二甲苯脱蜡,梯度酒精脱水;3%双氧水37 ℃孵育10 min以阻断灭活内源性过氧化物酶,PBS冲洗3次,每次5 min;置0.01 mol/L枸橼酸缓冲液(pH 6.0)中煮沸5 min以抗原修复,冷却至室温,PBS冲洗3次,每次5 min;正常羊血清工作液封闭,37 ℃,10 min,倾去勿洗;检测星形胶质细胞滴加兔抗小鼠GFAP 抗体(1∶200),检测淋巴细胞浸润滴加兔抗小鼠CD3,CD5,CD45(1∶200),4 ℃冰箱孵育过夜,PBS冲洗3次,每次5 min;滴加生物素标记相应的二抗,37 ℃孵育30 min,PBS冲洗3次,每次5 min;滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育30 min,PBS冲洗3次,每次5 min;DAB显色,自来水充分冲洗;苏木素复染5 min,常规脱水,透明,干燥,中性树胶封片。应用Polymer双染检测试剂盒(Zhongshan Golden bridge Biotechnology,China)对小鼠脑内星形胶质细胞与Aβ沉积进行双重标记。一抗为小鼠抗Aβ抗体(1∶200)和抗GFAP(1∶200)混合物,二抗为生物素标记的二抗混合物。图像分析应用MetaMorph显微图像分析系统,计算GFAP阳性细胞所占面积百分比。
2 结 果
2.1 脾淋巴细胞增殖反应 各组小鼠的脾细胞分别用Aβ3-10肽,Aβ1-42肽及ConA刺激,用MTT法检测体外脾细胞增殖率。加入刺激物培养72 h后,ConA在各组中都产生最高水平的增殖率,组间没有显著差异(P>0.05);Ad-Aβ(3-10)10-CpG组和Aβ1-42组在Aβ3-10肽及Aβ1-42肽刺激孔产生较高水平的增殖率,高于非相应免疫原刺激孔(P<0.05),但低于ConA刺激孔产生的增殖率(P<0.05);Ad-Aβ(3-10)10-CpG组在Aβ3-10肽刺激孔产生的增殖率和Aβ1-42组Aβ1-42肽刺激孔的增值率无显著差异(P>0.05)(见图1)。
2.2 脾细胞培养上清及脑组织匀浆中IL-4、IFN-γ水平检测 ConA刺激孔在各组中可检测到非常高水平的IL-4、IFN-γ,对于IL-4各组间比较无差异(P>0.05)。Ad-Aβ(3-10)10-CpG组和Aβ1-42组当分别给予其相对应抗原刺激时检测到较高水平的IL-4、IFN-γ,但都明显低于ConA刺激产生IL-4、IFN-γ水平(P<0.01)。Ad-Aβ(3-10)10-CpG组和Aβ1-42组分别在Aβ3-10肽和Aβ1-42肽刺激孔的IL-4水平无显著差异(P>0.05)。Aβ1-42组在Aβ1-42肽刺激孔的IFN-γ水平显著高于Ad-Aβ(3-10)10-CpG组在Aβ3-10肽刺激孔的IFN-γ水平(P<0.05)。空腺病毒载体组在Aβ3-10肽和Aβ1-42肽刺激孔都产生较低水平的IL-4、IFN-γ。Ad-Aβ(3-10)10-CpG组脑组织匀浆IL-4水平大于Aβ1-42组,但没有显著性差异(P>0.05),Ad-Aβ(3-10)10-CpG组和Aβ1-42组脑组织匀浆IL-4水平大于空腺病毒载体组(P<0.05),Ad-Aβ(3-10)10-CpG组脑组织匀浆IFN-γ水平大于空腺病毒载体组(P<0.05)小于Aβ1-42组(P<0.05)(见图2)。
2.3 免疫治疗后APPswe/PSEN1dE9鼠脑内星形胶质细胞 在每张抗GFAP单染片子的皮质及海马区各采集4张400倍图像,采用MetaMorph显微图像分析系统,计算GFAP阳性细胞所占面积百分比,Ad-Aβ(3-10)10-CpG组和空腺病毒载体组相比皮质和海马区GFAP阳性细胞所占面积百分比为分别减少28.5%和24.1%(P<0.05)。Aβ1-42组和空腺病毒载体组相比皮质和海马区GFAP阳性细胞所占面积百分比为分别减少17.5%和19.3%(P<0.05)(见图3)。双染显示GFAP阳性细胞呈深蓝色、Aβ沉积呈深棕色,GFAP阳性细胞数量及被激活的形态随着Aβ沉积数量改变而改变,GFAP阳性细胞分布于Aβ沉积的周围及内部,对Aβ沉积呈现明显的趋向聚集现象。空腺病毒载体组:皮质及海马区GFAP阳性细胞密集分布,呈深棕褐色,胞浆明显增大,突触增多,皮质区多于海马区,GFAP阳性细胞密集分布于老年斑周围及内部;Aβ1-42组:GFAP阳性细胞形态上与空腺病毒载体组相比较,胞浆变小,突触变少,稀疏分布于老年斑周围及内部;Ad-Aβ(3-10)10-CpG组:GFAP阳性细胞,形态上胞浆更小,突触更少,零星分布于淡红色颗粒状老年斑周围及内部(见图4)。
2.4 脑组织内淋巴细胞浸润检测 免疫后各组小鼠脑组织用免疫组化法检测CD3,CD5和CD45阳性淋巴细胞。三组小鼠血管内和脑实质可以偶尔发现少量CD3,CD5阳性细胞,三组小鼠均未观察到CD45阳性细胞。三组小鼠免疫组化结果未见明显差异(见图5)。
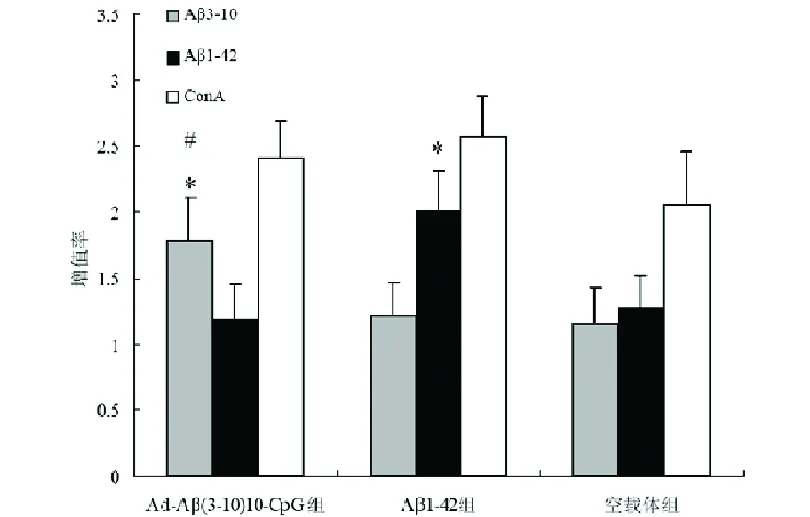
图1 体外脾T淋巴细胞增殖率。Ad-Aβ(3-10)10-CpG组和Aβ1-42组在相对应抗原刺激时产生较高水平的增殖率,*与空腺病毒载体组比较P<0.05,#与Aβ1-42组比较P>0.05
3 讨 论
研究表明小鼠和人的Aβ分子的B细胞抗原决定簇定位在Aβ1-15,T细胞抗原决定簇定位在Aβ的中间区域和C末端[6]。本研究用编码10次重复N末端片段Aβ3-10和CpG序列的新型腺病毒疫苗Ad-Aβ(3-10)10-CpG鼻粘膜免疫AD转基因鼠,通过MTT法检测体外脾T淋巴细胞增殖反应来观察Ad-Aβ(3-10)10-CpG引起的免疫反应只针对Aβ的B细胞抗原决定簇还是Aβ全肽段。脾T淋巴细胞增殖反应结果显示:只有当Ad-Aβ(3-10)10-CpG组给予Aβ3-10刺激时能产生较高的增殖率,提示Ad-Aβ(3-10)10-CpG引起了针对Aβ的B细胞抗原决定簇(Aβ3-10),而不是Aβ全肽段的免疫应答。这样可以避免T细胞抗原决定簇特异性的细胞免疫应答引起的炎症反应。近期研究也发现编码Aβ3-10的质粒疫苗也能引起针对Aβ的B细胞抗原决定簇的免疫应答[7],同时减少脑内炎症反应。
CD4+T辅助细胞可以分为五种功能性亚群,分别为Th1,Th2,Th3,Th7和调节性T细胞(Tregs)[8],其中Th1和Th2是两个重要的功能性亚群。Th1细胞主要分泌IL-2、IFN-γ等因子,Th1介导细胞免疫、细胞毒性T细胞和巨噬细胞活化;Th2细胞主要分泌IL-4、IL-5、IL-6、IL-8等因子,Th2介导体液免疫、B细胞和嗜酸性粒细胞活化。其中IL-4、IFN-γ是判断Th细胞类型的主要细胞因子[9],因此通过检测细胞因子,可以判断免疫所刺激的Th细胞类型。在脾细胞培养上清中,Ad-Aβ(3-10)10-CpG组和Aβ1-42组在相应抗原刺激时分泌较多的IL-4、IFN-γ,Ad-Aβ(3-10)10-CpG组和Aβ1-42组IL-4水平差别不明显,说明两组诱导的Th2反应相当,但Aβ1-42组IFN-γ水平明显高于Ad-Aβ(3-10)10-CpG组,说明Aβ1-42诱导了明显的Th1反应。Aβ1-42组脑组织匀浆中IFN-γ水平明显高于Ad-Aβ(3-10)10-CpG组,说明Aβ1-42上调了与炎症反应有关的IFN-γ释放。细胞因子检测结果提示:Ad-Aβ(3-10)10-CpG比Aβ1-42多肽疫苗减少了诱导与神经系统炎症有关的Th1免疫应答的趋势。
免疫后三组小鼠血管内和脑实质可以偶尔发现少量CD3,CD5阳性细胞,三组小鼠均未观察到CD45阳性细胞。这与AD患者接受Aβ1-42疫苗后发生脑膜脑炎的病理改变不同[1]。这与以往的研究结果相似[7,10]。说明Ad-Aβ(3-10)10-CpG鼻粘膜免疫没有引起脑膜脑炎的潜在危险。
在AD患者脑组织中,Aβ斑块周围有明显的星形胶质细胞活化,APPswe/PSEN1dE9双转基因鼠脑内星形胶质细胞聚集与Aβ沉积明显相关。星形胶质细胞可以产生炎性因子,促进Aβ聚集和纤维化转化[11]。研究表明,星形胶质细胞可以内化和降解Aβ,超微结构观察发现星形胶质细胞通过延长突起将神经元和纤维化Aβ分离,将Aβ内吞至内体/溶酶体[12]。进一步研究发现,Aβ聚集和被星形胶质细胞内吞通过改变神经元的代谢严重影响其活性[13]。在本研究中,GFAP阳性细胞所占面积百分比在Aβ1-42组及Ad-Aβ(3-10)10-CpG组明显减少,说明随着Aβ斑块的清除对胶质细胞的激活减少,Ad-Aβ(3-10)10-CpG可以下调对星形胶质细胞的激活,减少了胶质细胞活化对神经元的损害。
综上所述,腺病毒疫苗Ad-Aβ(3-10)10-CpG鼻粘膜免疫APPswe/ PSEN1dE9转基因鼠主要产生Th2型免疫应答,可以减少脑内星形胶质细胞活化,没有引起脑内炎症反应,避免了Aβ1-42全肽段所引起的炎症反应。基因重组腺病毒疫苗Ad-Aβ(3-10)10-CpG具有良好的安全性。
[1]Nicoll JA,Wilkinson D,Holmes C,et al. Neuropathology of human Alzheimer disease after immunization with amyloid-beta peptide:a case report[J]. Nat Med,2003,9(4):448-452.
[2]Heppner FL,Ransohoff RM,Becher B. Immune attack:the role of inflammation in Alzheimer disease[J]. Nat Rev Neurosci,2015,16(6):358-372.
[3]Boche D,Denham N,Holmes C,et al. Neuropathology after active Ab42 immunotherapy:implications for Alzheimer’s disease pathogenesis[J]. Acta Neuropathol,2010,120(3):369-384.
[4]Li Y,Ma Y,Zong LX,et al. Intranasal inoculation with an adenovirus vaccine encoding ten repeats of Aβ3-10reduces AD-like pathology and cognitive impairment in Tg-APPswe/PSEN1dE9 mice[J]. J Neuroimmunol,2012,249(1/2):16-26.
[5]李 昱,张 慧,林璐璐,等. Aβ3-10多价腺病毒疫苗鼻粘膜免疫AD转基因鼠的治疗效果研究[J]. 中风与神经疾病杂志,2017,34(1):4-8.
[6]Cribbs DH,Ghochikyan A,Vasilevko V,et al. Adjuvant-dependent modulation of Th1 and Th2 responses to immunization with beta-amyloid[J]. Int Immunol,2003,15(4):505-514.
[7]Xing XN,Sha S,Chen XH,et al. Active Immunization with DNA Vaccine Reduced Cerebral Inflammation and Improved Cognitive Ability in APP/PS1 Transgenic Mice by In Vivo Electroporation[J]. Neurochem Res,2015,40(5):1032-1041.
[8]Halonen M,Lohman IC,Stern DA,et al. Th1/Th2 patterns and balance in cytokine production in the parents and infants of a large birth cohort[J]. J Immunol,2009,182(5):3285-3293.
[9]Torres KC,Dutra WO,Gollob KJ,et al. Endogenous IL-4 and IFN-gamma are essential for expression of Th2,but not Th1 cytokine message during the early differentiation of human CD4+T helper cells[J]. Hum Immunol,2004,65(11):1328-1335.
[10]Mouri A,Noda Y,Hara H,et al. Oral vaccination with a viral vector containing Abeta cDNA attenuates age related Abeta accumulation and memory deficits without causing inflammation in a mouse Alzheimer model[J]. FASEB J,2007,21(9):2135-2148.
[11]Ruan L,Kang Z,Pei G,et al. Amyloid deposition and inflammation in APPswe/PS1dE9 mouse model of Alzheimer’s disease[J]. Curr Alzheimer Res,2009,6(6):531-540.
[12]Wegiel J,Wang KC,Imaki H,et al. The role of microglial cells and astrocytes in fibrillar plaque evolution in transgenic APP(SW)mice[J]. Neurobiol Aging,2001,22(1):49-61.
[13]Allaman I,Gavillet M,Bélanger M,et al. Amyloid-beta aggregates cause alterations of astrocytic metabolic phenotype:impact on neuronal viability[J]. J Neurosci,2010,30(9):3326-3338.
Inflammatory response after intranasal inoculation with an adenovirus vaccine encoding multivalent Aβ3-10in Alzheimer’s disease transgenic mice
LIYu,SONGGuijun,LINLulu,etal.
(DepartmentofNeurology,TheSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian116027,China)
Objective To study the inflammatory response after intranasal inoculation with a recombinant adenovirus vaccine Ad-Aβ(3-10)10-CpG in APPswe/PSEN1dE9 transgenic mice. Methods Eighteen ten-month old male APPswe/PSEN1dE9 mice were divided into three groups and immunized with recombinant adenovirus vaccine Ad-Aβ(3-10)10-CpG,empty adenoviral vector and Aβ1-42peptide,representatively. SpleenT-cell proliferation response was determined with MTT assay. Levels of IL-4 and INF-γ in spleen cell culture supernatant and brain homogenate were determined with ELISA. Astrocytes and CD3,CD5 and CD45 positive cells in the brain were detected with immunohistochemistry. Results Ad-Aβ(3-10)10-CpG group and Aβ1-42peptide group showed higher levels of proliferation rate restimulated with its corresponding antigen(P<0.05),but lower than the ConA-stimulated wells(P<0.05). The percentage of area of GFAP positive cells in cortex and hippocampus was as follows:empty vector group>Aβ1-42peptide group>Ad-Aβ(3-10)10-CpG group. A very few CD5-positive and CD3-positive lymphocytes were occasionally observed within the blood vessels or in the parachyma in all three groups of mice. There were no significant different in all three groups. Ad-Aβ(3-10)10-CpG and Aβ1-42peptide group exhibited significantly greater IL-4 and IFN-γ levels in the cultures of spleen T cells restimulated with its corresponding antigen. Mice immunized with Aβ1-42peptide exhibited the greater IFN-γ levels in spleen T cells restimulated with Aβ1-42peptide than mice immunized with Ad-Aβ(3-10)10-CpG(restimulated with Aβ3-10)(P<0.05). IL-4 levels in brain homogenates from mice of Ad-Aβ(3-10)10-CpG group were greater than that of Aβ1-42peptide group,but the diffrence was not significant(P>0.05). IFN-γ levels in brain homogenates of Aβ1-42peptide group was greater than that of Ad-Aβ(3-10)10-CpG group(P<0.05). Conclusion Intranasal inoculation with a recombinant adenovirus vaccine Ad-Aβ(3-10)10-CpG appeared to induce a Th2 type immune response and reduction of astrocytosis without causing neuroinflammation in the brain. Ad-Aβ(3-10)10-CpG had low potential to cause autoimmune response caused by Aβ1-42peptide.
Alzheimer’s disease; β-amyloid; Inflammatory response; Astrocyte
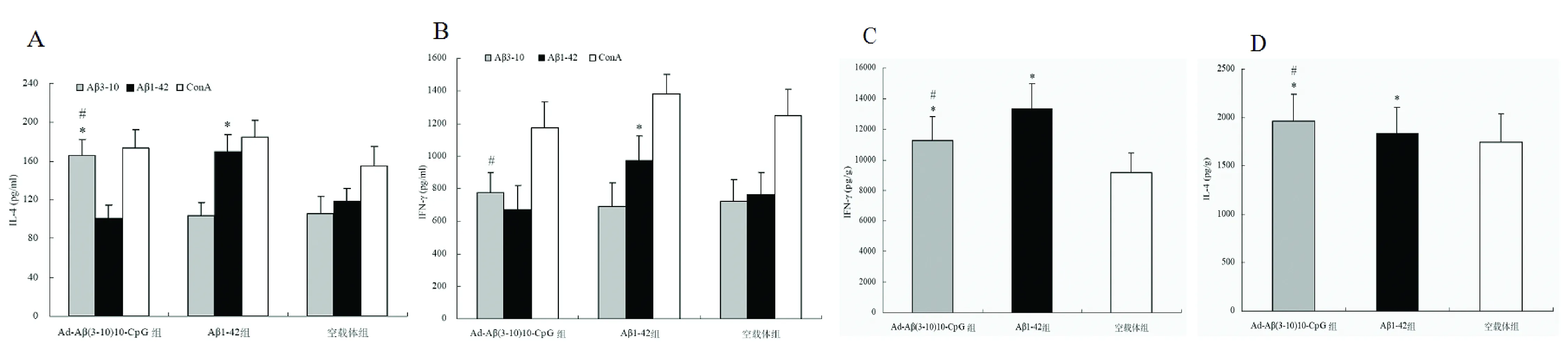
图2 脾淋巴细胞培养上清及脑组织匀浆的IL-4/IFN-γ水平测定。(A)(B)脾细胞培养上清中IL-4/IFN-γ。(C)(D)脑组织匀浆中IL-4/IFN-γ。在相应抗原刺激时脾淋巴细胞培养上清有较高水平的IL-4(A)和 IFN-γ(B)。(A)*和空载体组比较P<0.05,#和Aβ1-42组比较P>0.05。(B)*和Ad-Aβ(3-10)10-CpG组与空载体组比较P<0.05,# 与空腺病毒载体组比较P<0.05。(C)*和空腺病毒载体组比较P<0.05,#和Aβ1-42组比较P>0.05。(D)* 和空腺病毒载体组比较P<0.05,# 和Aβ1-42组比较P<0.05

图3 免疫后各组小鼠GFAP阳性细胞分析。Ad-Aβ(3-10)10-CpG组(B1,B2)和Aβ1-42组(C1,C2)海马和皮质GFAP阳性细胞与空腺病毒载体组(A1,A2)相比明显减少。(D)海马和皮质GFAP阳性细胞所占面积百分比的定量分析,*和空腺病毒载体组相比P<0.05。比例尺代表 50μm
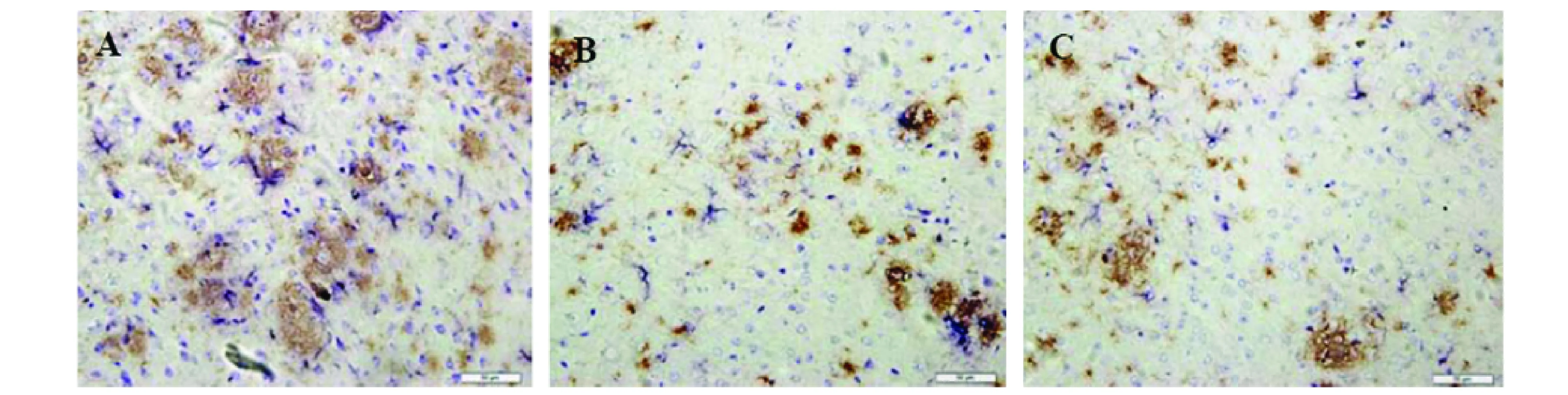
图4 Aβ和GFAP双染。(A)空腺病毒载体组,大量GFAP阳性细胞聚集在Aβ斑块周围和内部。(B)Ad-Aβ(3-10)10-CpG组和(C)Aβ1-42组可见散在的GFAP阳性细胞。比例尺代表50μm

图5 三组小鼠免疫后脑组织淋巴细胞浸润检测。在三组中均未发现广泛的CD3,CD5,CD45阳性细胞。在血管周围和脑实质偶尔可以发现少量CD3阳性和CD5阳性细胞。比例尺代表100μm
2017-03-12;
2017-04-23
国家自然科学基金(No. 81371227) 作者单位:(1.大连医科大学附属第二医院神经内科,辽宁 大连 116027;2.中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
曹云鹏,E-mail:cypcmu@163.com
1003-2754(2017)05-0393-05
R749.1
A
