大肠癌肝转移的相关因素及手术治疗效果的回顾性分析
2017-06-19于淼张洪海贺志坚叶晋生高建新王啸飞梁燕凯路夷平
于淼 张洪海 贺志坚 叶晋生 高建新 王啸飞 梁燕凯 路夷平
•经验交流•
大肠癌肝转移的相关因素及手术治疗效果的回顾性分析
于淼 张洪海 贺志坚 叶晋生 高建新 王啸飞 梁燕凯 路夷平
目的 探讨大肠癌肝转移的相关因素及手术治疗效果。方法 回顾分析北京中医医院2010年1月至2015年12月间30例大肠癌肝转移患者的手术治疗和非手术治疗的效果,并选同期30例大肠癌非肝转移患者为对照,分析影响大肠癌肝转移的危险因素;采用Kaplan-Meier法对大肠癌肝转移患者进行生存分析并绘制生存曲线,采用log rank检验对手术与非手术治疗的生存曲线进行比较。结果 大肠癌肝转移患者中,肿瘤大于5 cm(X2=4.344,P<0.05)及发生脉管癌栓(X2=4.593,P<0.05)的患者数量明显多于非肝转移患者;肝转移患者中,手术组和保守组中位生存时间分别是(37.200±4.857)月和(20.333±4.722)月,另外log rank检验得出:手术组五年累积生存率明显高于保守组(P=0.045)。结论 肿瘤大小、脉管癌栓是大肠癌发生肝转移的危险因素,对大肠癌肝转移患者实施手术治疗可提高患者短期生存率。
结直肠肿瘤; 肿瘤转移; 回顾性分析
近年来随着生活水平的提高及人口老龄化进程,大肠癌的发病率逐年上升,大肠癌发病率在欧洲国家跃居第1~2位,在中国大肠癌已成为高发病率的肿瘤之一,居第4~6位[1]。肝脏是大肠癌转移最常见的器官,20~34%的结直肠癌患者存在同时性肝转移,80~90%的患者为不可切除的肝转移,一半以上的患者死后尸检伴有肝转移[2],2/3的结直肠癌病人因为肝脏转移死亡[3]。肝转移患者若不治疗,其中位生存期仅5~10个月[4],可见肝转移治疗的有效性直接决定结直肠癌病人的生存率。首都医科大学附属北京中医医院肿瘤外科总结了2010年01至2015年12间大肠癌伴肝转移30例患者进行手术治疗和保守治疗的疗效。
资料与方法
一、临床资料
选取2010年01至2015年12间首都医科大学附属北京中医医院肿瘤外科大肠癌伴肝转移患者30例,其中男性20例,女性10例。年龄43~73岁,平均年龄(59.6±4.5)岁。12例为降结肠,6例为横结肠,10例为升结肠,2例为直肠。所有患者均在入院时完善结肠镜、B超、胸部CT、肝脏增强CT和血清癌胚抗原(carcino embryonie antigen,CEA)检查诊断为结肠癌肝转移,并排除其他部位转移灶。其中18例转移至肝右叶,12例转移至肝左叶。病灶直径最大7 cm,最小1 cm。30例患者分为手术组和保守组,手术组15例接受肝转移灶切除术手术治疗。另外,选北京中医医院同期大肠癌非肝转移患者30例为对照组(即非肝转移组)。
二、治疗方法
根据患者肿瘤的情况,手术组15例实施外科手术治疗,针对患者不同的情况选择一期或者二期手术治疗。肝转移灶数目少于4个,或多于4个,但是瘤体小且基本位于周边或局限于半肝附近,肝切除量<50%,实施一期手术治疗。原发灶根治性切除后,确保残留肝脏可以有效代偿。对于肝脏多发转移灶,则行二期治疗。初始不能进行肝转移灶切除的患者,则进行积极的转化性化疗,将无法切除的肝转移病灶进行转化可切除手术治疗。保守手术组15例转移灶无法切除的患者进行保守治疗,治疗手段包括全身化疗,肝动脉栓塞或化疗栓塞和支持治疗,因患者的情况采取不同的方法。
三、统计学分析
采用统计学处理软件SPSS 13.0进行分析,对大肠癌患者治疗前的临床病理特征(如肿瘤大小、肿瘤分化程度、有无脉管癌栓等)进行单因素分析。由于样本量不大,对肝转移组患者生存率采用Kaplan-Meier法对患者进行生存分析,绘制生存曲线,采用log rank检验对两组生存曲线进行比较,以P<0.05为差异有统计学意义。
结 果
一、结肠癌患者发生肝转移的因素分析
采用卡方检验比较肝转移组与非肝转移组患者的临床病理特征,结果显示:肿瘤大小(X2=4.344,P<0.05)、脉管癌栓均是大肠癌发生肝转移的危险因素(X2=4.593,P<0.05),见表1。

表1 结肠癌患者发生肝转移的单因素分析[例(%)]
二、大肠癌肝转移患者治疗后五年累积生存率比较
经过手术治疗后,手术组15例患者住院天数在7~25天,平均天数是(14.5±3.2)天,无患者死亡,但是术后2例患者有腹水,对患者采取了综合治疗,症状得到了明显改善并临床治愈。随访截止至2015年12月,手术组和保守组共计30例,随访的30例大结肠癌肝转移患者中,手术组3例删失,对照组1例删失。采用Kaplan-Meier法对患者进行生存分析,结果表明:手术组和保守组中位生存时间分别是(37.200±4.857)月和(20.333±4.722)月。另外,根据患者的存活时间(以月计算)绘制生存曲线,见图1。采用log rank检验对两组生存曲线进行比较,差异具有统计学意义(P=0.045)。
讨 论
肝脏的状态是具有丰富的血流、高糖且低氧,且狄氏间隙内存在富含营养的滤过液,这些都为转移癌的生长提供了绝佳的环境。且肝脏与多个脏器毗邻,接纳丰富的淋巴引流,都决定了全身许多恶性肿瘤都最易侵犯和转移至肝脏,其中尤以大肠癌多见[5]。有研究证明癌细胞进入肝脏后将不再参与血循环,形成肿瘤屏障,不易再发生肝外转移,除非肿瘤屏障被破坏时,才可能发生肝外转移,如肺转移[6]。由此可见,手术完全切除肝转移灶仍是目前能治愈结直肠癌肝转移的最佳方法,故符合条件的病人均应在适当的时候接受手术治疗[7]。近年来很多研究都表明,根治性手术治疗可以使患者获得较长的生存。复旦大学附属中山医院总结2000~2010年收治的1 613例结直肠癌肝转移患者,发现其中530例肝转移灶行手术切除的病人平均总生存时间达49.8月,5年存活率达到47%,远高于其他未行手术切除的病人[8]。Bolton等[9]研究证实成功切除大肠癌肝转移灶后5年生存率可达30~40%。Lochan等[10]研究表明积极手术切除后,患者的5年生存率接近60%。
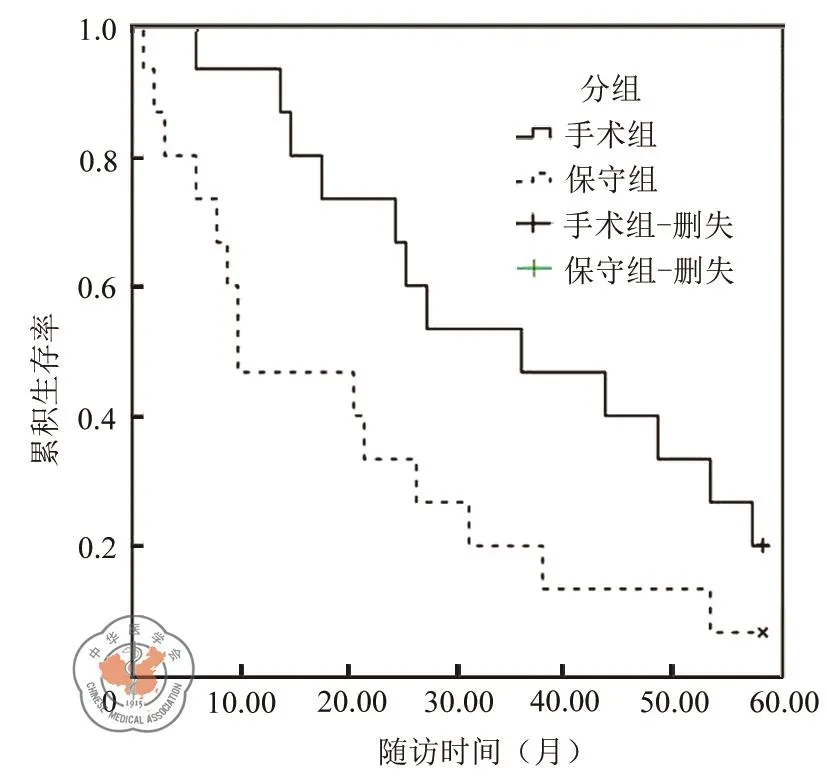
图1 大结肠癌肝转移手术治疗与非手术治疗患者的累积生存曲线
医学的进步日新月异,随着外科手术及多学科综合治疗水平的提高,肝转移癌可切除的概念也在不断更新着,以往对于肝转移癌可切除的概念认识为:(1)异时性的肝转移;(2)转移灶位于肝脏一侧叶,未侵袭重要血管;(3)转移灶的数目<4个;(4)最大肿瘤直径<5 cm;(5)肿瘤的切缘>1 cm;(6)CEA的水平<100,因此只有小于10%的肝转移病人是可以切除的[11-12]。现今我们可切除的概念已更新为:(1)肝脏所有转移灶能够切除;(2)切除后残余肝体积大于原体积的30%;(3)肝外的转移性病灶可以获得切除,目前专家共识为,只要保证残留肝脏能代偿,应尽可能扩大切除范围,使20%的病人获得了手术机会[13]。
结直肠癌确诊时发现的或结直肠癌原发灶根治性切除术后6个月内发生的肝转移为同时性肝转移。结直肠癌根治术6个月后发生的肝转移为异时性肝转移。约10.25~25%的患者初诊时已有同时性肝转移,此后20~25%的患者发生异时性肝转移[14-15]。对同时性肝转移患者,外科医生往往面临下面的选择:同期切除,还是分期切除?2015年卫计委及中华医学会肿瘤学分会出版的《结直肠癌诊疗规范》中写明:如果肝转移灶小、且多位于周边或局限于半肝,肝切除量<50%,肝门部淋巴结、腹腔或其他远处转移均可手术切除,则建议结直肠癌原发灶和肝转移灶同步切除[16]。有研究表明,同期手术切除是安全的,且与分期手术切除转移灶比较,同期手术组3、5年生存率明显高于分期手术组(均P<0.05),可延长患者生存时间[17]。考虑这主要是因为同期切除免除了二次手术的痛苦,相应的减少了术后并发症的发生几率。而分期切除的生存益处取决于肿瘤的生物学行为,但手术并发症和死亡率较高,但其可使隐匿性的肝转移病灶更加明显,减少了同期切除的术后复发率[7]。但是也有报道认为,对于肝转移癌数目3个以上及最大径>5 cm的患者,一期手术组的并发症明显高于分期手术组,1、3年生存率也低于分期手术组,所以对于肝转移癌数目3个以上及最大径>5 cm的患者,一期手术仍应慎重[18]。另外关于手术切缘状态与患者生存之间的关系仍有争议。有研究纳入经过术前化疗后接受肝切除术的患者378例,对比阴性与阳性切缘,阴性切缘生存获益更显著[19]。Angelsen等[20]人的研究也证实了,阴性切缘其3年及5年生存率明显优于阳性切缘。因此我们可以认为阴性切缘仍为患者生存的重要决定性因素并应视为手术治疗的首要目标。但Yoshihiro等[21]则研究了对于大肠癌同时伴有肝及肺转移时,肝病灶切除肺病灶未行切除组的三年生存率明显优于肝病灶未切除而肺病灶切除组,这个研究则很好的证明了对于同时性的肺转移,非R0的切除也是有意义的,并不是所有的非R0切除都不能生存获益。另外对于术后复发的再切除问题,数据显示60~70%的切除术后患者出现复发,复发的脏器仍然是肝脏多见。随着早期探测技术的发展、新的化疗药物的应用和肝切除技术的进步,重复的肝切除术病例数在不断地增加。有学者对64例肝复发患者进行了83次数的重复肝切除证实没有手术的并发症、死亡率和手术出血的增加,5年总生存率和无瘤生存率分别为41%和26%[22]。另外随着外科手术技术不断进步,联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partitioning and portal vein occlusion for staged hepatectomy,ALPPS)这种全新的手术方式应运而生,为过去因余肝体积不足无根治性手术切除机会的患者带来了曙光。ALPPS的优势在于短时期内可使肝脏迅速增生,平均9~14天增生61~93%,使95~100%的患者获得二期切除的机会,RO手术根治率达86~100%[23],目前全球已有超过300例的正式病例报道,但ALPPS作为一种全新的手术方式,由于实施时间较短,早期因技术不成熟,其围手术期并发症发生率和死亡率较高,但随着认识及技术的不断提高,该手术在技术成熟的肝外科中心是完全可以安全实施的[24]。对于大肠癌肝转移病例,尚缺乏长期预后的数据,但我们可以看到医学的不断进步为患者带来治愈疾病的希望。
综上所述,对于大肠癌肝转移患者,只要条件允许,就应积极地设法切除,这对提高大肠癌患者的生存率及改善预后有极其重要的意义。
[ 1 ] 汤钊猷.现代肿瘤学 [M]. 第2版.上海:上海医科大学出版社, 2000: 775-818.
[ 2 ] NCCN. Clinical practice guidelines in Oncology: colon cancer(2016. V2)[EB/OL]. NCCN, 2015[2015-11-24]. https://www.nccn.org/ professionals/physician_gls/f_guidelines.asp.
[ 3 ] Zalinski S, Mariette C, Farges O, et al. Management of patients with synchronous liver metastases of colorectal cancer. Clinical practice guidelines. Guidelines of the French society of gastrointestinal surgery (SFCD) and of the association of hepatobiliary surgery and liver transplantation (ACHBT). Short version [J]. J Visc Surg, 2011, 148(3):e171-182.
[ 4 ] Ruers T, Bleichrodt RP. Treatment of liver metastases, an update on the possibilities and results [J]. Eur J Cancer, 2002, 38(7):1023-1033.
[ 5 ] 施东华, 王小林. 大肠癌肝转移机制及诊治进展 [J]. 中国医学计算机成像杂志, 2010, 16(1):81-86.
[ 6 ] 郁宝铭.结直肠癌肝转移的外科防治 [J]. 腹部外科, 2000, 13(1): 22-24.
[ 7 ] Dexiang Z, Li R, Ye W, et al. Outcome of patients with colorectal liver metastasis: analysis of 1, 613 consecutive cases [J]. Ann Surg Oncol, 2012, 19(9):2860-2868.
[ 8 ] 朱德祥, 任黎, 许剑民.不可切除结直肠癌肝转移的转化性治疗策略 [J]. 中国实用外科杂志, 2013, 33(8):635-644.
[ 9 ] Bolton JS, Fuhman GM.Survival after resection of multiple bilobar hepatic metastases from colorectal carcinoma [J]. Ann Sury, 2000, 231 (5):743-751.
[ 10 ] Lochan R, White SA, Manas DM. Liver resection for colorectal liver metastasis [J]. Surg Oncol, 2007, 16 (1):33-45.
[ 11 ] 邱云峰, 许海民, 陈虹, 等.大肠癌肝转移的诊断及外科治疗(附32例报告) [J]. 中国医师进修杂志, 2006, 29(11):40-41, 43.
[ 12 ] 谭桂兴.大肠癌肝转移的诊断与治疗 [J]. 中华现代医学与临床, 2007, 6(6):20-21.
[ 13 ] Adam R, Hoti E, Folprecht G, et al. Accomplishments in 2008 in the management of curable metastatic colorectal cancer [J]. Gastrointest Cancer Res, 2009, 3(5 Supplement 2):S15-22.
[ 14 ] Zalinski S, Mariette C, Farges O, et al. Management of patients with synchronous liver metastases of colorectal cancer. Clinical practice guidelines. Guidelines of the French society of gastrointestinal surgery (SFCD) and of the association of hepatobiliary surgery and liver transplantation (ACHBT). Short version [J]. J Visc Surg, 2011, 148(3):e171-182.
[ 15 ] Kopetz S, Chang GJ, Overman MJ, et al. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy [J]. J Clin Oncol, 2009, 27(22):3677-3683.
[ 16 ] 中华人民共和国卫生和计划生育委员会医政医管局, 中华医学会肿瘤学分会. 结直肠癌诊疗规范(2015年版) [J]. 中华外科杂志, 2015, 53(12):881-894.
[ 17 ] 罗威等. 结肠癌同时性肝转移同期手术与分期手术的疗效比较 [J].中国普通外科杂志, 2013, 22(4):434-437.
[ 18 ] 王庆新, 徐斌, 晏建军, 等.同时性结直肠癌肝转移患者治疗策略探讨 [J]. 癌症, 2008, 27 (7):748-751.
[ 19 ] Andreou A, Aloia TA, Brouquet A, et al. Margin status remains an important determinant of survival after surgical resection of colorectal liver metastasesin the era of modern chemotherapy [J]. Ann Surg,2013, 257(6):1079-1088.
[ 20 ] Angelsen JH, Horn A, Eide GE, et al. Surgery for colorectal liver metastases: the impact of resection margins on recurrence and overall survival [J]. World J Surg Oncol, 2014, 12:127.
[ 21 ] Mise Y, Kopetz S, Mehran RJ, et al. Is complete liver resection without resection of synchronous lung metastases justif i ed? [J]. Ann Surg Oncol, 2015, 22(5):1585-1592.
[ 22 ] Adam R, Del Gaudio M. Evolution of liver transplantation for hepatocellular carcinoma [J]. J Hepatol, 2003, 39(6):888-895.
[ 23 ] Schadde E, Ardiles V, Robles-Campos R, et al. Early survival and safety of ALPPS: fi rst report of the International ALPPS Registry [J]. Ann Surg, 2014, 260(5):829-836.
[ 24 ] 王征, 樊嘉, 周俭.ALPPS在肝脏外科的应用前景 [J]. 肝胆外科杂志, 2015, 23(1):1-2.
A retrospective analysis of the related factors and effect of surgical treatment for colorectal cancer patients with liver metastasis
Yu Miao, Zhang Honghai, He Zhijian, Ye Jinsheng, Gao Jianxin, Xiao Xiaofei, Liang Yankai, Lu Yiping. Department of Surgical Oncology, Beijing Traditional Chinese Medicine Hospital Aff i liated to Capital Medical University, Beijing 100010, China
Lu Yiping, Email: 15210712026@163.com
Objective To explore the related factors and the effect of surgical treatment for colorectal cancer patients with liver metastasis. Methods Retrospective analysis the surgical and non-surgical treatment for 30 cases of patients with colorectal liver metastases from January 2010 to December 2015, and chose the colorectal cancer patients without liver metastases at the same period as the control group, and then, analysis the risk factors of colorectal liver metastases. To use the Kaplan-Meier method to analyze the accumulation survival rate for colorectal cancer patients with liver metastasis and to draw the cumulative survival curve, thus, to compare the cumulative survival curve of surgical and non-surgical treatment through the log rank test. Results The number of patients whose tumor size were greater than 5 cm and suffered with vascular tumor emboli among colorectal cancer patients with liver metastasis were more than colorectal cancer patients without liver metastasis (X2=4.344, X2=4.593, all P<0.05). Among these patients with liver metastasis, the median survival time of surgical group and conservative group were (7.200±4.857) months and (20.333±4.722) months respectively. And the log rank test showed that the 5-year cumulative survival rate of the surgical groups was signif i cantly higher than that of the conservative group (P=0.045). Conclusion Tumor size and vascular tumor emboli are the risk factors for colorectal cancer patients with liver metastases, and the therapy of surgical treatment can improve the short-term survival rate for them.
Colorectal neoplasms; Neoplasm metastasis; Retrospective analysis
2016-05-09)
(本文编辑:杨明)
10.3877/cma.j.issn.2095-3224.2017.03.016
100010 北京,首都医科大学附属北京中医医院肿瘤外科
路夷平,Email:15210712026@163.com
于淼, 张洪海, 贺志坚, 等.大肠癌肝转移手术治疗与非手术治疗的回顾性分析[J/CD].中华结直肠疾病电子杂志, 2017, 6(3): 249-252.
