剖析高中常见晶体结构
2017-06-15内蒙古赤峰市巴林左旗林东一中025450
内蒙古赤峰市巴林左旗林东一中(025450)
王晓波●
剖析高中常见晶体结构
内蒙古赤峰市巴林左旗林东一中(025450)
王晓波●
有关晶体结构的推断和计算是高中化学中的一个难点,这些题目能很好地考察学生的观察能力和三维想象能力,而且又很容易与数学、物理特别是立体几何知识相结合,自然也就成为近年高考的热点之一.此类题目的解答,要求学生在熟练掌握NaCl、CsCl、CaF2、CO2、SiO2、金刚石、石墨等晶体结构的基础上,进一步理解和掌握一些重要的分析方法与原则.
通常采用均摊法来分析这些晶体的结构特点.均摊法的根本原则是:晶胞任意位置上的原子如果是被n个晶胞所共有,则每个晶胞只能分得这个原子的1/n.
1. 氯化钠晶体
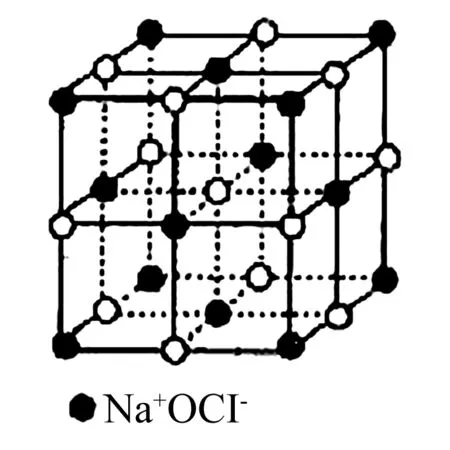
图1
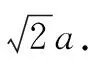
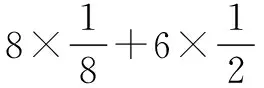
2. 氯化铯晶体
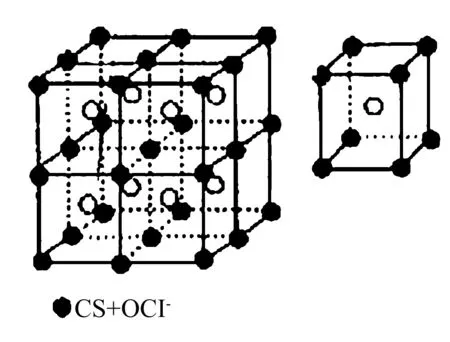
图2
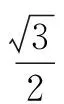
3. 硫化锌晶体
ZnS晶体结构有两种型式,即立方ZnS和六方ZnS.立方ZnS晶胞中,有4个S原子,4个Zn原子,如图3所示立方晶系,每个S2-离子周围与4个相反电荷的Zn2+联成四面体,同样每个Zn2+离子也与周围的4个S2-离子联成四面体,即该晶体的配位数之比为4∶4=1∶1.
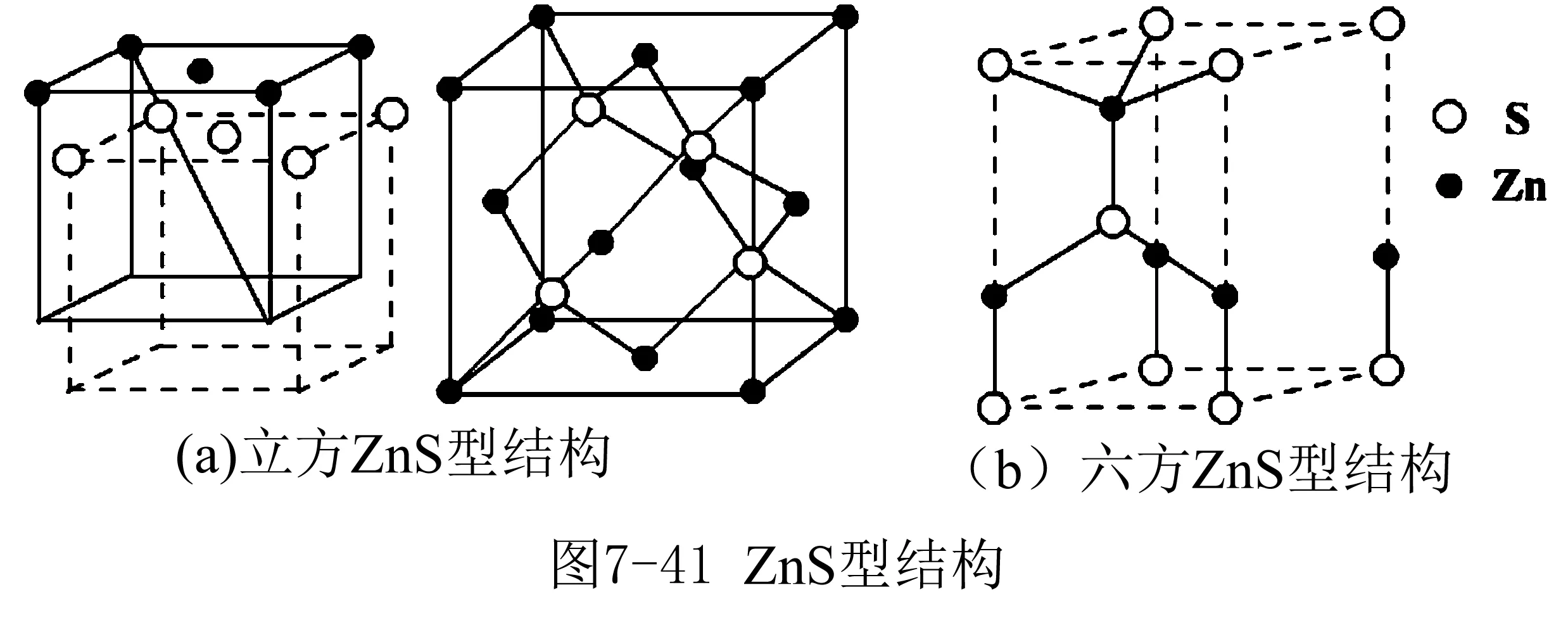
图3
4. 氟化钙晶体
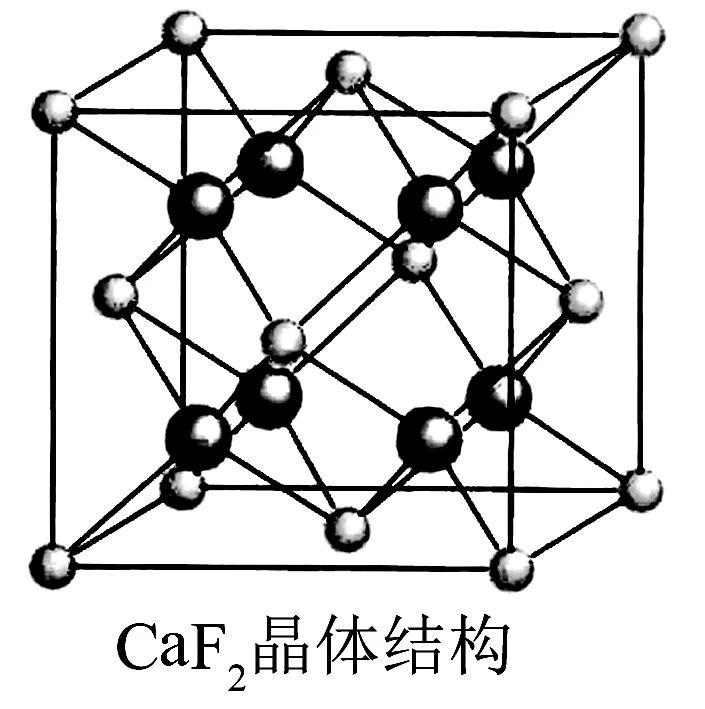
图4
在氟化钙晶胞中,Ca2+位于立方体的8个顶点和6个面上,8个F-位于立方体的内部,根据图4中晶胞结构计算:每个Ca2 +周围最邻近的F-有8个,表明Ca2 +的配位数为8.每个F-周围最邻近的Ca2 +有4个,表明F-的配位数是4.由此可见,在CaF2晶体中,Ca2 +和F-个数比为1:2,刚好与Ca2 +和F-的电荷数之比相等.
整个晶体的结构与前面两例的结构完全不相同.
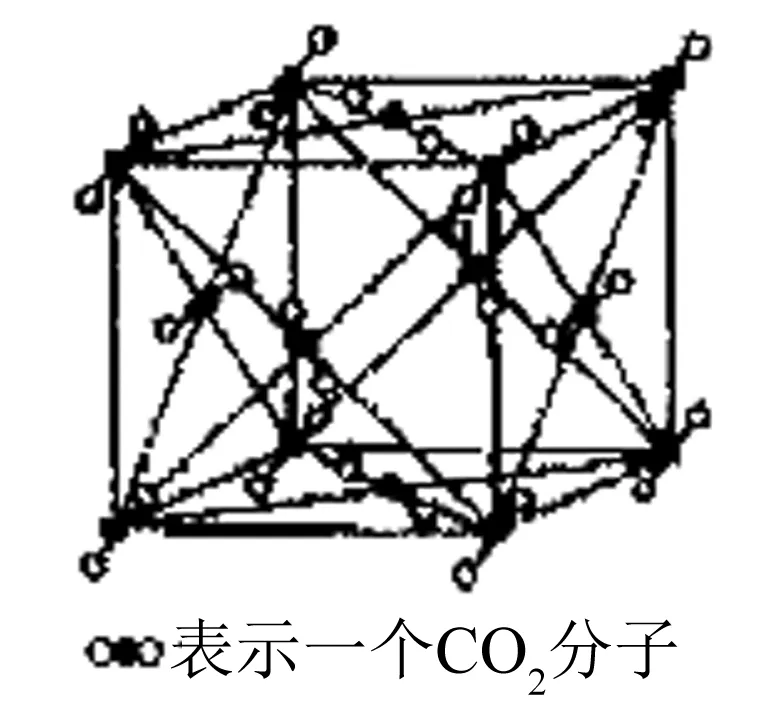
图5
5. 干冰
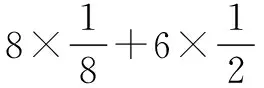
6. C60分子
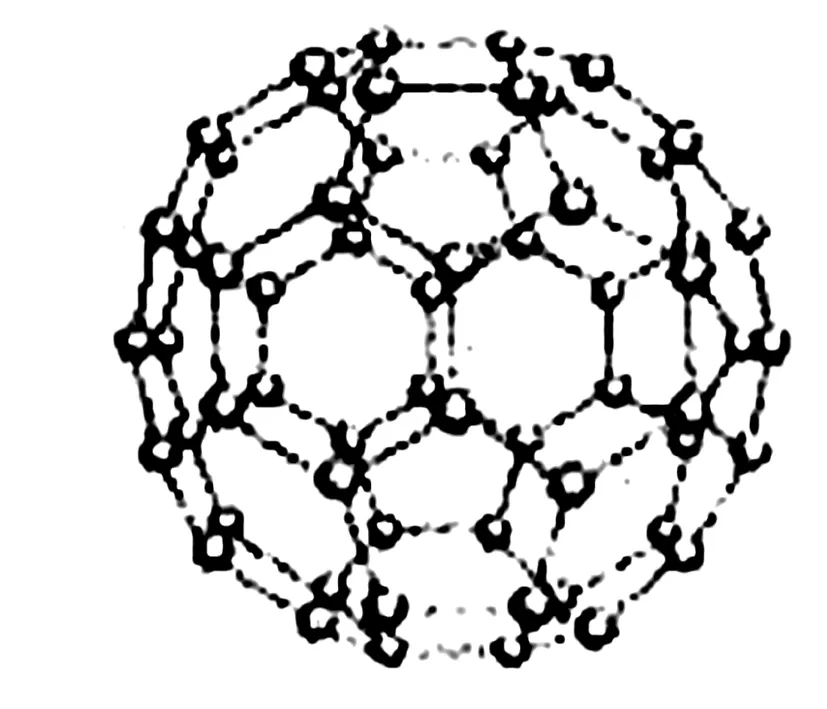
图6

7. 二氧化硅晶体
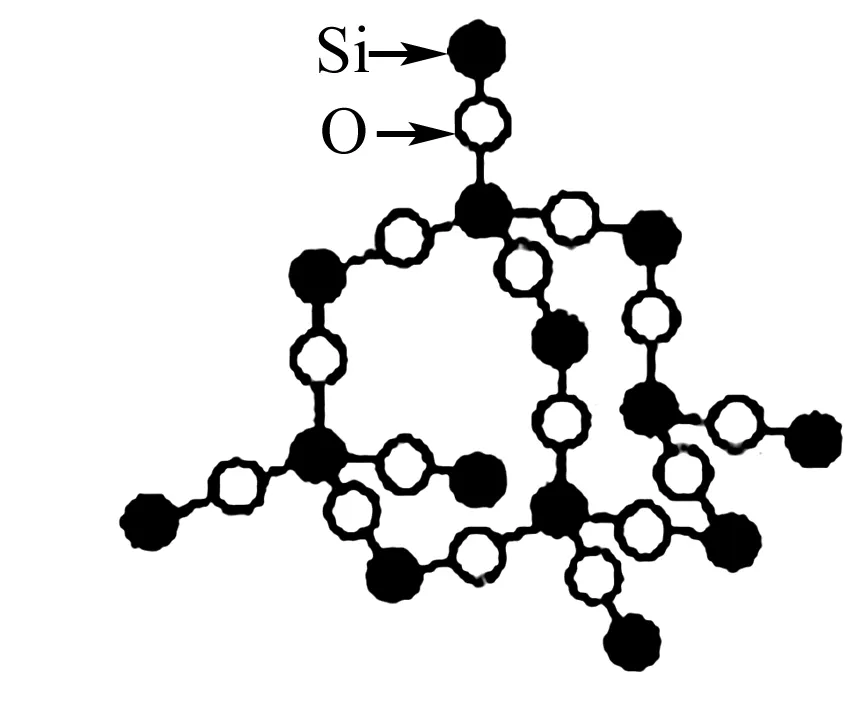
图7
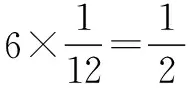
8. 金刚石晶体(晶体硅同)
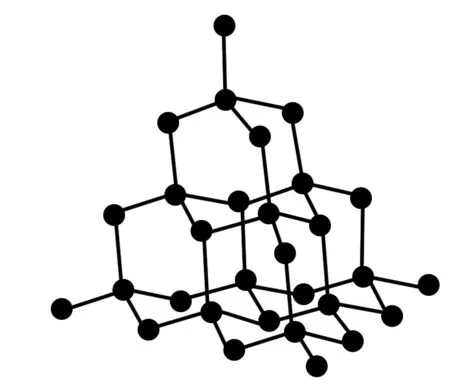
图8
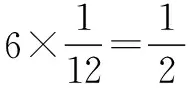
9.石墨晶体
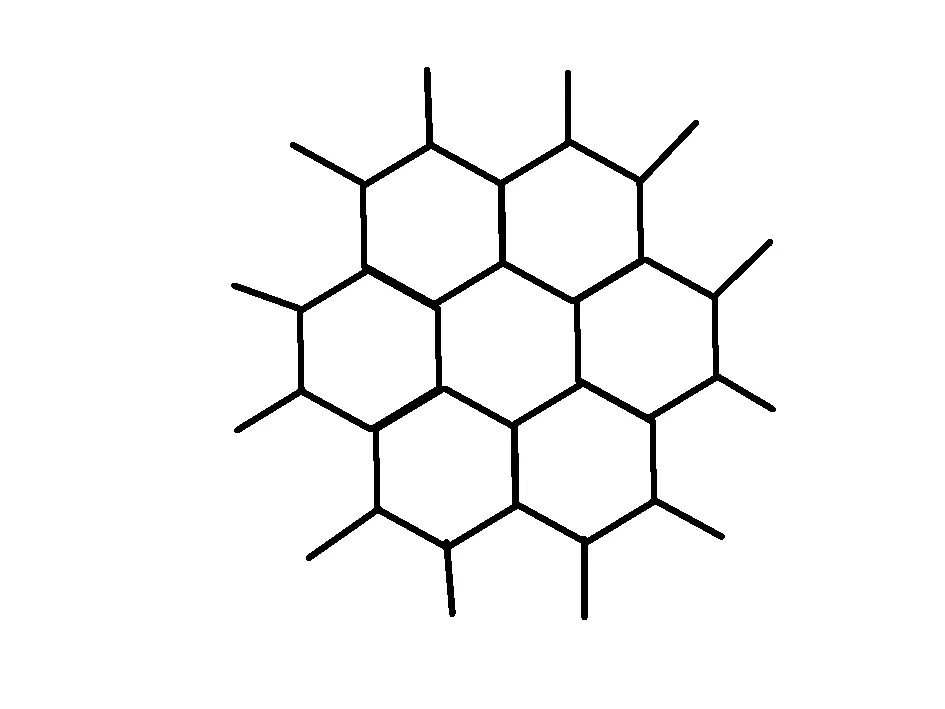
图9
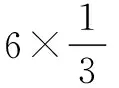
立方晶系的晶胞中, 原子个数比的计算:
(1)处于体心的原子: 完全属于该晶胞;


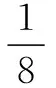
(5)晶胞中微粒个数= 晶胞中可视的微粒个数×晶胞占有值;
非立方结构单元中包含粒子数的确定:
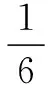


(4)处于结构单元内部的粒子,完全属于该结构单元.
例 (2013·山东卷,节选)卤族元素包括F、Cl、Br、I等.
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,图10为其晶胞结构示意图,则每个晶胞中含有B原子的个数为____,该功能陶瓷的化学式为____.
答案:(2)2,BN
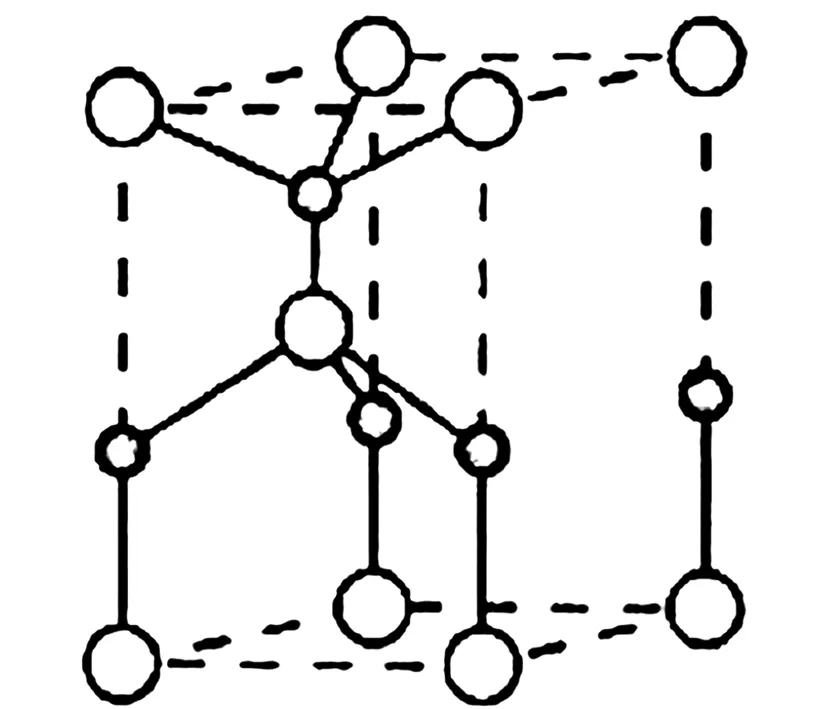
图10
解析 (2)同周期元素原子半径随核电荷数的递增逐渐减小,故B原子的半径大于N原子,也就是B原子位于晶胞的8个顶点和中间,其每个晶胞中含有8×1/8+1=2个;N原子位于晶胞中和棱上,故每个晶胞中含有4×1/4+1=2个,化学式可写为:BN.
G632
B
1008-0333(2017)01-0093-02
