PCOS患者血清AMH水平与胰岛素抵抗及雄激素的相关性研究
2017-06-15王小霞
王小霞,邓 翠
广州市第一人民医院妇产科(广东 广州 510180)
PCOS患者血清AMH水平与胰岛素抵抗及雄激素的相关性研究
王小霞,邓 翠
广州市第一人民医院妇产科(广东 广州 510180)
目的 探讨多囊卵巢综合征(PCOS)患者血清抗苗勒氏管激素(AMH)水平变化与患者胰岛素抵抗(IR)和雄激素的相关性。方法 选取2015年1月-2016年6月在治疗的80例PCOS患者设为研究组,选取80例正常女性设为对照组,观察研究对象的体质量指数(BMI)、血清AMH、空腹血糖、空腹胰岛素、促黄体生成素(LH)、促卵泡生成素(FSH)、雄激素、稳态模型胰岛素抵抗指数(HOMA-IR)之间的相关性。结果 研究组血清AMH、LH、LH/FSH、雄激素、HOMA-IR值均明显高于对照组(P<0.05)。根据Pearson相关性分析,PCOS患者血清AMH水平与雄激素、LH、LH/FSH呈正相关,与HOMA-IR、BMI、年龄相关性无统计学意义(P>0.05)。多元线性回归分析得出,PCOS患者血清AMH水平与雄激素呈正相关。结论 患有PCOS的人群中血清AMH相比于正常女性高,且PCOS患者血清AMH水平与体内雄激素水平相关,而与IR无相关。
多囊卵巢综合征;抗苗勒氏管激素;胰岛素抵抗;雄激素
多囊卵巢综合征(polycystic ovay syndrome,PCOS)是妇科最常见的内分泌疾病之一,影响着5%~10%的育龄妇女[1-2],主要表现为下丘脑-垂体-卵巢轴平衡的失调及全身的代谢紊乱。其典型临床特征为月经不规则、慢性不排卵、肥胖、多毛、高雄激素血症,部分伴随糖脂代谢异常胰岛素抵抗(insulin resistance,IR)和高胰岛素血症(hyperinsulinemia,HI)。据文献报道[3],有超过30%的PCOS患者伴有IR,她们早在30岁就可能发展为糖耐量损害或2型糖尿病。近年来研究显示,PCOS患者血清和卵泡液的抗苗勒氏管激素(anti-Mullerain hormone,AMH)水平均高于正常人群[4]。AMH是由卵巢小卵泡分泌的一种糖蛋白,卵巢小卵泡数目越多,血清中AMH的浓度越高。而IR使得HI促进卵巢颗粒小泡的分化降低血清中AMH水平。由此表明IR可能与颗粒细胞AMH分泌异常存在相关性。此外雄激素可以在卵巢小泡早期促使其成长发育,由此推测AMH与雄激素存在一定联系。本研究分析PCOS患者血清AMH水平与IR和雄激素间的相关性,旨在为PCOS的诊断和治疗提供指导性意见。
1 资料与方法
1.1 一般资料 选取2015年1月-2016年6月在广州市第一人民医院妇科门诊治疗的80例PCOS患者作为研究组,年龄20~35岁,平均(27.50±2.25)岁。选取同时期进行健康检查的80例正常女性作为对照组,年龄22~38岁,平均(30.00±3.32)岁。纳入标准:PCOS诊断采用国际通用的“2003年鹿特丹标准”。①稀发排卵或无排卵;②高雄激素的临床表现和(或)高雄激素血症;③卵巢多囊改变:超声提示一侧或双侧卵巢直径2~9 mm的卵泡≥12个,和(或)卵巢体积≥10 mL,3项中符合2项并排除其他高雄激素的病因。排除标准:其它引发HA的疾病及非PCOS因素导致的内分泌疾病,如:先天性肾上腺增生、皮质醇增多症、分泌雄激素的肿瘤、高催乳素血症、甲状腺疾病等。对照组女性内分泌正常,临床诊断不具HA症状。两组研究对象均征得知情同意,在近3个月内未使用过激素类药物,一般资料具有可比性。
1.2 研究方法
1.2.1 人体测量及体质量指数 将两组女性在空腹条件下测量身高、体质量,并计算体质量指数(BMI),BMI=体质量(kg)/身高(m2)。
1.2.2 血清标本收集和测定 于月经期第2~4 d(闭经者服用黄体酮撤退出血)采集两组女性的空腹静脉血,采用ELISA法检测血清AMH,葡萄糖氧化酶法检测空腹血糖(FPG),化学发光法检测促卵泡生成素(FSH),放射免疫法检测促黄体生成素(LH)和胰岛素(FIns),酶联免疫法检测雄激素水平。IR采用胰岛素抵抗指数(HOMA-IR)计算,HOMA-IR=空腹血糖×空腹胰岛素/22.5,用它评价机体的胰岛素敏感性[5]。

2 结果
2.1 两组一般情况及临床检测指标比较 PCOS患者除FSH值外,血清AMH、LH、LH/FSH、HOMA-IR、雄激素水平均明显高于对照组(P<0.05)。见表1。
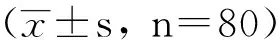
表1 两组相关临床指标的比较
2.2 PCOS患者血清AMH水平与其它变量的关系 患者AMH水平与雄激素、LH、LH/FSH水平呈正相关;与年龄、HOMA-IR、BMI相关性无统计学意义;进一步分析,以AMH为应变量,以年龄、BMI、雄激素、HOMA-IR为自变量进行多元线性回归分析,得出雄激素是AMH水平的影响因素,见表2。

表2 血清AMH与其它变量的关系
3 讨论
PCOS是一种临床表现多态性、异质性的综合征,目前认为优势卵泡选择受阻导致的无排卵或稀发排卵是最后的共同通路。AMH也称为苗勒抑制物质(Mullerian inhibiting substance,MIS),属转化因子β超家族成员。近年来研究发现AMH除了抑制苗勒氏管分化以外,还参与调节卵泡的发育,能抑制卵巢始基卵泡的起始募集和卵泡刺激素(FSH)诱导的卵泡生长,在优势卵泡选择中发挥重要作用[6-7],与PCOS发病密切相关。PCOS患者卵巢内窦状卵泡数目(antral follicle count,AFC)明显增多,其血清AMH水平较正常女性明显增高[8-9]。Du等[10]提出降低PCOS患者血清AMH水平可能成为治疗PCOS的靶点。我们研究表明,研究组血清AMH水平明显高于对照组,与以上结果一致。
HA为PCOS另一重要内分泌特征,它在PCOS发病中起着非常重要的作用。PCOS患者由于垂体对促性性腺激素释放激素敏感性增加,分泌过量LH,刺激卵巢间质、卵泡膜细胞产生过量雄激素。高LH和高雄激素抑制卵巢颗粒细胞增殖,卵泡优势化异常而导致闭锁,影响卵泡发育与成熟,此类机制与AMH类似。是否与雄激素促进卵泡聚焦从而分泌大量的AMH有关,目前尚不清楚。Piltonen等[11]认为PCOS患者升高的血AMH水平和体内血雄激素水平(雄烯二酮和睾酮)、窦卵泡数目有显著的正相关,而经二甲双胍治疗6个月后血AMH、窦卵泡数和卵巢体积则明显下降。本研究得到类似结果,PCOS患者血清AMH水平与血清雄激素、LH、LH/FSH呈正相关。且多元线性回归分析得出PCOS组中雄激素是血清AMH的影响因素,但谁是因谁是果,有待进一步研究。
在本次研究中,PCOS患者血清AMH水平不受BMI影响,由此可知PCOS患者血清AMH与肥胖无关系,但受年龄因素影响,这与女性体内AMH的分泌规律吻合。AMH在女性青春期生育年龄时形成,18~29岁是AMH的分泌高峰期,30岁之后分泌开始逐年降低。育龄期女性血清AMH水平比促卵泡生成素 (FSH)、类固醇激素和抑制素评估卵巢储备能力更特异、更敏感, 因为AMH 起旁分泌作用, 并不参与下丘脑- 垂体- 性腺轴反馈机制。AMH 可以更准确地评估卵巢的储备功能[12]。AMH的正常值界于2~6.8 ng/mL之间,AMH数值越高,代表卵子存量越多,适合受孕的周期越长,AMH值越低则卵巢功能越弱,35岁以后AMH值会开始急剧下降,当AMH值低于0.7 ng/mL时,表示卵子存量降低至难以怀孕。当AMH值大于6.8时,可能患有PCOS[13]。Sahmay等[14]认为血清AMH 水平可以作为诊断PCOS严重性的指标。
AMH与IR的关系目前报道不一。Chen 等[15]研究显示,PCOS 患者AMH 水平与HORMA-IR 呈负相关。而Fonseca 等[16]研究发现PCOS有IR 的患者AMH 水平显著高于无IR者,可能为胰岛素对颗粒细胞分泌AMH 产生直接的作用。Skaba 等[17]发现HOMA-IR 与AMH 水平呈正相关。本研究结果提示PCOS患者血清AMH水平与IR不相关,推测PCOS患者高胰岛水平及IR与肥胖、高雄激素水平及局部胰岛素受体多方面因素相关,而不是单一因素影响,要判断两者的关系,需要大样本、分层等系统研究才能得出。综上所述,PCOS患者血清AMH水平比正常女性高,但其中原因与雄激素密切相关,而与IR无关。此结果提示检测AMH水平可作为诊断PCOS的1个重要指标,AMH水平与雄激素的关系也为我们临床治疗PCOS起到重要的指导作用。
[1] Tucci S,Futterweit W,Concepcion ES,et al.Evidencefor association of polycystic ovary syndrome in Caucassian women with a marker atthe insulin receptor gene lous[J].J Clin Endocrinol Metab,2001,86(1):1 760-1 766;
[2] Rociy A,Chen X,Roberts VJ,et al.Expression of the genes encoding the insulin-like growth factors(IGF-1 and II),the IGF and insulin receptors,and IGF-binding proteins-1-6 and the localization of their gene products in normal and polycystic ovary syndrome ovaries[J].J Clin Endocrinol Metab,1994,78(6):1 488-1 496.
[3] 吴效科,周珊英.多囊卵巢综合征患者的胰岛素抵抗[J].中华妇产科杂志,1999,34(11):698-701.
[4] Pigny P,Merlen E,Robert Y,et al.Elevated serum level of anti-Mullerian hormone in patients with polycystic ovary syndrome;relationship to the ovarian follicle excess and to the follicular arrest[J].J Clin Endocrinol Metab,2003,88(12):5 957-5 962.
[5] Haffner SM,Miettinen H, Stern MP.The homeostasis model in the San Antonio heart study[J].Diatetes Care,1997,20(7):1 087-1 092.
[6] Weenen C,Laven JS,Von Bergh AR,et al. Anti-Mullerian hormone expression pattern in the human ovary:potential implications for initial and cyclic follicle recruitment[J].Human Reproduction,2004,10(2):77.
[7] Pareo S,Novelli C,Vascotto F,et al.Serum anti-Miillerian hormone as a predictive marker of polyeystie ovarian syndrome[J]. Int J Gen Med,2011(4):759-763.
[8] Pigny P,Jonard S,Robert Y,et al.Serum anti-Mullerian hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome[J].J Clin Endocrinol Metab,2006,91(3):941-945.
[9] Laven JS,Mulders AG,Visser JA, et al.Anti-Mullerian hormone serum concentrations in normoovulatory and anovulatory women of reproductive age[J].J.of Clinical Endocrinology and Metabolism.2004,89(1):318.
[10] Du DF,Li XL,Fang F,et al.Expression of anti-Mullerian hormone in letrozole rat model of polycystic ovary syndrome[J].Gynecol Endocrinol,2014,29(1):1-5.
[11] Piltonen T,Morin-Papunen L,Koivunen R,et al.Serum anti-mullerian hormone levels remain high until late reproductive age and decrease during metformin therapy in women with polycystic ovary syndrome[J].Hum Reprod,2005,20(7):1 820-1 826.
[12] Hampl R,Snajderova M,Mardesic T.Anti-Müllerian hormone (AMH) not only a marker for prediction of ovarian reserve[J].Physiol Res,2011,60(2):217-223.
[13] 张欣, 邓琳琳. 雄激素抑制剂对PCOS患者血清AMH等指标的影响初探[J]. 现代妇产科进展, 2012, 21(6):482-483.
[14] Sahmay S,Atakul N,Oncul M,et al.Serum anti-Mullerian hormone levels in the main phenotypes of polycystic ovary syndrome[J].Eur J Obstet Gynecol Report Biol,2013,170 (1):157-161.
[15] Chen MJ,Yang WS,Chen CL, et al.The relationship between anti-Mullerian hormone,androgen and insulin resistance on the number of antral follicles in women with polycystic ovary syndrome [J].Hum Reprod,2008,23(4):952- 957.
[16] Fonseca HP,Brondi RS,Piovesan FX,et al.Anti- Mullerian hormone and insulin resistance in polycystic ovary syndrome[J].Gynecol Endocrinol,2014,30 (9):667- 670.
[17] Skaba P,Cygal A,Madej P,et al.Is the plasma anti-Mullerian hormone(AMH) level associated with body weight and metabolic,and hormonal disturbances in women with and without polycystic ovary syndrome?[J].Eur J Obstet Gynecol Reprod Biol,2011,158(2):254-259.
责任编辑:牟冬生
The Correlation Studies of Serum AMH Level, Insulin Resistance and Androgen in Patients with PCOS
Wang Xiaoxia, Deng Cui
(TheDepartmentofObstetricsandGynecology,GuangzhouFirstPeople'sHospital,Guangzhou510180,China)
Objective To study the correlation of serum anti-Mullerian hormone (AMH),insulin resistance (IR) and androgen in patients with polycystic ovary syndrome (PCOS).Methods 80 patients with PCOS in our hospital (from January 2015 to June 2016) were selected as research group and 80 cases of normal women were control group.The correlation of BMI, serum AMH,blood glucose,insulin,LH,LH/FSH, androgen and HOMA-IR were observed.Results The serum AMH,LH,LH/FSH,androgen and HOMA-IR in the research group was significantly higher than those in the control group(P<0.05).According to the Pearson correlation analysis,the AMH level was positively correlated with androgen, LH and LH/FSH,while the correlation with HOMA-IR、BMI and age was not statistically significant for the PCOS patients.The multiple linear regression analysis showed that the serum AMH level of patients with PCOS was positively correlated with androgen.Conclusion The serum AMH level in the patients with PCOS was significantly higher than that in the normal women and had positive correlation with androgen, but was not correlated with insulin resistance.
PCOS;AMH;IR;androgen
广州市医药卫生科技项目(20141A011009)。
王小霞,女,硕士,副主任医师,研究方向:妇科内分泌、妇科肿瘤。
R711.75
A
1008-8164(2017)02-0008-03
2017-02-16
