依非韦伦合成方法综述
2017-06-15盛智超金灿
盛智超,金灿
(浙江工业大学药学院长三角绿色制药协同创新中心,浙江杭州310014)
医药化工
依非韦伦合成方法综述
盛智超,金灿*
(浙江工业大学药学院长三角绿色制药协同创新中心,浙江杭州310014)
依非韦伦一种非核苷类逆转录酶抑制剂,临床上用于HIV的治疗。介绍了依非韦伦的合成方案并做了初步的评价,并展望了今后合成的发展方向。
依非韦伦;合成方法;化学拆分法;不对称合成
依非韦伦(E favirenz,1)是由默沙东公司开发的非核苷类逆转录酶抑制剂[1],1998年9月获FDA批准用于抗HIV感染。其化学名称为(S)-6-氯-4-(环丙基乙炔基)-1,4-氢-4-(三氟甲基)-2H-3,1-氧氮杂萘-2-酮。
依非韦伦具有半衰期长、耐受性好、选择性高[2]、不良反应少等优点,使其得到越来越多的关注[3],是治疗HIV的关键药物[4],是最有效的HIV一线治疗联合用药的药物之一[5]。然而该药物价格十分昂贵,对世界上大多数人来说依然不易得[6],所以优化工艺条件合成依非韦伦具有巨大的商业价值和社会意义。
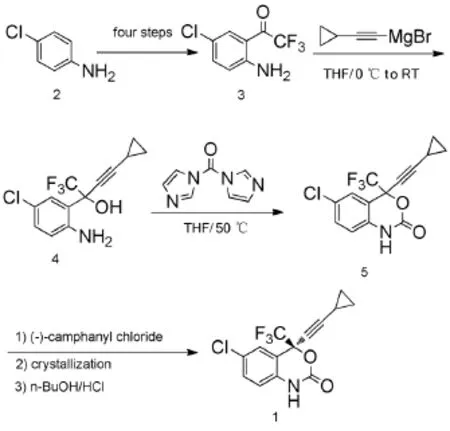
图1
1 化学拆分法
默沙东公司[7](图1)申请了依非韦伦的化合物专利,首次对合成路线进行了报道。该路线以对氯苯胺为原料,先经4步反应得到了重要的中间体2-三氟乙酰基对氯苯胺,再经环丙乙炔格式试剂加成得到氨基醇4,然后经羰基二咪唑闭环得到消旋的依非韦伦1,最后通过化学拆分法得到依非韦伦。该路线的总收率为25%。
Radesca等[8](图2)以对氯苯基异腈酸酯为原料,先与叔丁醇加成得到Boc保护的对氯苯胺,再经仲丁基锂处理后与三氟乙酸乙酯反应得到化合物8,然后与环丙乙炔基锂加成得到Boc保护的氨基醇,再经正丁基锂处理得到消旋的依非韦伦,最后经化学拆分得到依非韦伦。但是该路线的总收率只有15%。

图2
Nicolaou等[9](图3)以Boc保护的对氯苯胺为原料,经叔丁基锂处理后与7-氯-1,1,1-三氟庚-3-炔-2-酮反应得到化合物10,再经LDA处理后得到Boc保护的氨基醇,最后又经LDA处理得到消旋的依非韦伦。该路线总收率为68%。它主要的优点在于7-氯-1,1,1-三氟庚-3-炔-2-酮避免了之前路线中使用的环丙乙炔的挥发。

图3
Correia等[10](图4)以1,4-二氯苯为原料,先经正丁基锂处理后再与N-三氟乙酰基吗啉反应得到化合物12,再与环丙乙炔基锂反应得到化合物13,最后环合得到消旋的依非韦伦。反应的总收率为45%。该路线最大的优点是只需三步反应。
2 不对称合成
Thompson等[11](图5)以2-三氟乙酰基对氯苯胺为原料,先经对甲氧基苄基(PMB)保护后,在(1R,2S)-1-苯基-2-(1-吡咯烷基)-丙醇配体诱导下,与环丙乙炔基锂加成得到化合物16,再由光气闭环得到化合物16,最后经硝酸铈铵得到依非韦伦。相比于化学拆分法,该路线在收率和立体选择性上都有了很大的提高。但该路线的缺点在于:(1)脱去PMB保护时会产生与依非韦伦等量的对甲氧基苯甲醛,不能有效除去;(2)会产生对环境有害的废物铈盐。

图4
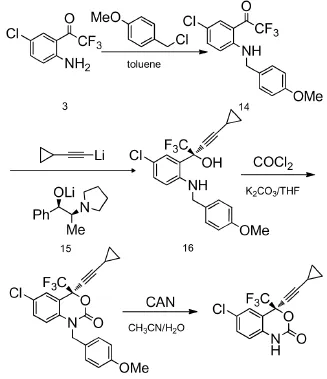
图5
Pierce等[12](图6)同样以2-三氟乙酰基对氯苯胺为原料,进行对甲氧基苄基(PMB)保护以及不对称加成,再经DDQ环化、NaOH-MeOH体系处理脱去PMB保护得到氨基醇,最后由光气闭环得到依非韦伦。该路线是对硝酸铈铵法脱PMB保护的改进,但其存在两个问题:(1)DDQ价格昂贵;(2)DDQ转化得到的DDQH2同样不易于处理。

图6
Tan[13]等(图7)以2-三氟乙酰基对氯苯胺为原料,与(1R,2S)-1-苯基-2-(1-吡咯烷基)-丙醇、三氟乙醇、二乙基锌及环丙乙炔所形成的体系反应直接得到氨基醇,反应收率为95%、ee值为99.3%。该路线省去了对氨基的保护与脱保护,简化了反应流程。但二乙基锌价格昂贵,且易燃易爆不易控制,存在很大的安全隐患。
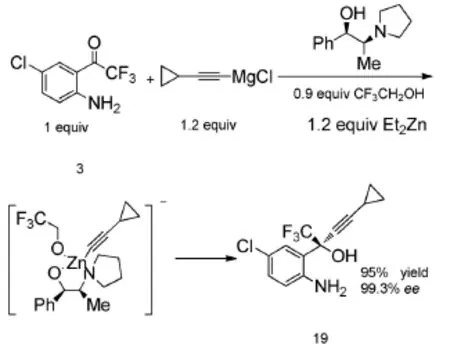
图7
Chinkov等[14](图8)发现中间体19即氨基醇对上述反应具有催化作用,在(1R,2S)-1-苯基-2-(1-吡咯烷基)-丙醇、三氟乙醇、二乙基锌及环丙乙炔所形成的配体体系加入0.18 equiv的氨基醇可以有效地降低(1R,2S)-1-苯基-2-(1-吡咯烷基)-丙醇及二乙基锌的用量。该路线收率为79%、ee值为99.6%。

图8
姜标等[15](图9)以2-三氟乙酰基对氯苯胺盐酸盐为原料,经氯甲酸某酯保护后,通过一锅法在环丙乙炔铜或锌试剂反应以后,直接在碱性条件下回流闭环得到依非韦伦。该路线条件温和,操作简便且步骤少,配体廉价且易于回收。但是氯甲酸某酯价格昂贵,剧毒且有刺激性气味。

图9
Kawai等[15](图10)以2-硝基-5-氯苯甲醛为原料,先与环丙乙炔基锌反应得到化合物21,再通过Dess–Martin氧化剂氧化得到化合物22,然后与Ruppert-Prakash试剂在辛可尼丁衍生物的催化下完成不对称加成得到化合物23,再用铁粉还原得到氨基醇,最后通过对硝基苯氯甲酸酯闭环得到依非韦伦。这是首次通过先引入环丙乙炔基再引入三氟乙酰基的方法进行不对称三氟乙酰基化加成得到依非韦伦。但是这类催化技术还不成熟,用于工业生产还有待进一步的拓展。

图10
3 合成路线方案的评价与展望
总体来说,化学拆分法操作繁琐,收率和ee值较低,原子经济性不高。现在主流使用的是不对称合成的方法,但通常都需要使用大量的金属有机试剂以及化学计量数的手性助剂,对社会环境和经济成本的压力都比较大。未来的合成方向是致力于使用催化量的手性试剂进行大规模的工业合成。
[1]Young S D,Britcher S F,Tran L O.L-743,726(DMP-266):a novel,highly potent nonnucleoside inhibitor of the human immunodeficiency virus type 1 reverse transcriptase [J].Antimicrob.Agents Chemother,1995,39:2602.
[2]Clercq E D.The history of antiretrovirals:key discoveries over the past25 years[J].Rev.Med.Virol,2009,19:287-299.
[3]王珍燕,卢洪洲.HIV-1非核苷类反转录酶仰制剂依非韦伦[J].世界临床药物.2007,28(11):680-683.
[4]Liu P.Asymmetric alkynylzinc additions to aldehydes and ketones[J].Tetrahedron,2003,59:9873-9886.
[5]Rizzo R C,Blagovic M U,Wang D P.Prediction of activity for nonnucleoside inhibitors with HIV-1 reverse transcriptase based on Monte Carlo Simulations[J].J.Med.Chem,2002,45:2970.
[6]Okusu S,Hirano K,Yasuda Y.Alkynyl cinchona catalysts affect enantioselective trifluoromethylation for Efavirenz under metal-Free conditions[J].Org.Lett,2016,18:5568-5571.
[7]Young S,Britcher S F,Payne N S.Benzoxazinones as inhibitors of HIV reverse transcriptase:US,005519021A[P]. 1996-05-21.
[8]Radesca L A,Lo Y S,Moore J R.Synthesis of HIV-1 reverse transcriptase inhibitor DMP 266[J].Synthetic.Com mun,1997,27(24):4373-4384.
[9]Nicolaou K C,Krasovskiy A,Majumder U.New synthetic technologies for the construction of heterocycles and tryptamines[J].J.Am.Chem.Soc,2009,131:3690-3699.
[10]Correia C A,Gilmore K,McQuade D T.A concise flow synthesis of Efavirenz[J].Angew.Chem.Int.Ed,2015,54:4945-4948.
[11]ThompsonA S,Corley E G,Huntington M F.Use of an ephedrine alkoxide to mediate enantioselective addition of an acetylide to a prochiral ketone:asymmetric synthesis of the reverse transcriptase inhibitor L-743,726[J].Tetrahedron Lett,1995,36(49):8937-8940.
[12]Pierce M E,Parsons R L,Radesca L A.Practical asymmetric synthesis of Efavirenz(DMP 266),an HIV-1 reverse transcriptase inhibitor[J].J.Org.Chem.,1998,63:8536-8543.
[13]Tan L,Chen C Y,Tillyer R D.A novel,highly enantioselective ketone alkynylation reaction mediated by chiral zinc aminoalkoxides[J].Angew.Chem.Int.Ed,1999,38(5):711-713.
[14]Chinkov N,Warm A,Carreira E M.Asymmetric autocatalysis enables an improved synthesis of Efavirenz[J].Angew. Chem.Int.Ed,2011,50:2957-2961.
[15]姜标,李金华.HIV-1逆转录酶抑制剂依法韦仑类化合物的一锅法不对称合成工艺:CN,102584801A[P]. 2012-07-18.
[16]Kawai H,Kitayama T,Tokunaga E.A new synthetic approach to Efavirenz through enantioselective trifluoromethylation by using the Ruppert-Prakash Reagent[J]. Eur.J.Org.Chem,2011:5959-5961.
A Review of the Synthesis of Efavirenz
SHENG Zhi-chao JIN Can*
(Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
Efavirenz is a nonnucleoside reverse transcriptase inhibitor for the treatment of HIV infection.The characters and synthesis of Efavirenz and the tendency for synthesis of this medicine were briefly introduced.
Efavirenz;synthesis;chemical resolution;asymmetric synthesis
1006-4184(2017)5-0006-05
2016-12-13
盛智超(1992-),男,浙江衢州人,硕士研究生,主要从事药物及中间体的合成。
*通讯作者:金灿,E-mail:jincan@zjut.edu.cn。
